基于软骨细胞外基质的取向支架的制备及评价
2017-02-23李坤赵艳红徐晨王连永杨强李洪发滕彬宏
李坤赵艳红徐晨王连永杨强李洪发滕彬宏
1.天津医科大学口腔医院正畸科,天津 300070;2.烟台市口腔医院正畸科,烟台 264000;3.南开大学生命科学学院生物活性材料教育部重点实验室,天津 300071;4.天津市天津医院脊柱外科,天津 300211
基于软骨细胞外基质的取向支架的制备及评价
李坤1,2赵艳红1徐晨1王连永3杨强4李洪发1滕彬宏1
1.天津医科大学口腔医院正畸科,天津 300070;2.烟台市口腔医院正畸科,烟台 264000;3.南开大学生命科学学院生物活性材料教育部重点实验室,天津 300071;4.天津市天津医院脊柱外科,天津 300211
目的 制备软骨细胞外基质(CECM)取向多孔支架,评价其理化特性及对脂肪干细胞(ADSCs)的相容性。方法 切取新鲜猪关节软骨片,匀浆后离心筛选出直径50~500 nm左右的软骨纤维,经Triton X-100脱细胞后制备成浓度6%的CECM浆料,通过定向结晶和冷冻干燥后交联即得CECM取向支架。对CECM取向支架的理化性能和细胞相容性进行评价。结果 CECM取向支架横断面为均匀的多孔网状结构,孔壁上密布软骨纤维,纵断面为垂直管状结构;支架呈苏木精-伊红红染,甲苯胺蓝、番红O、天狼星红染色均呈阳性;支架孔隙率、吸水率和纵向压缩弹性模量分别为95.455%±0.910%、95.889%±1.071%和(40.208±5.097)kPa;ADSCs在支架上黏附和增殖,并均匀长入支架孔隙内。结论 CECM取向支架的成分与天然软骨相似,生物相容性良好,孔隙结构、孔径大小适于种子细胞黏附、增殖和长入,是一种比较理想的软骨组织工程支架。
软骨; 细胞外基质; 取向支架; 组织工程; 定向结晶; 冷冻干燥
由创伤、炎症、肿瘤等引起的颞下颌关节软骨组织缺损是临床较常见的疾患。由于软骨组织退变呈渐进性发展且自身修复能力极为有限,目前应用于临床的多种治疗方法如手术、软骨移植等均不能达到令人满意的治疗效果。随着组织工程技术的发展,组织工程化软骨修复展现了其良好的临床应用前景[1]。
软骨组织工程主要包括支架材料、种子细胞和信号因子三要素[2],其中,支架材料是组织工程构建的关键环节[3]。理想的组织工程软骨支架材料应具有以下特征[4-6]:良好的生物相容性;促进细胞黏附与增殖;适当的可降解性;接近于正常关节软骨的组织结构等。然而,目前尚未有一种支架材料能满足以上全部特征。支架作为种子细胞的载体,不仅影响种子细胞的增殖与分化,而且还决定移植后能否与组织有效的结合,从而发挥其修复病变软骨组织的作用。因此,开发性能优异的支架材料是软骨组织工程的突破点。本实验以猪关节软骨细胞外基质(cartilage extracellular matrix,CECM)为材料,采用定向结晶及冷冻干燥技术,成功制备出取向性的仿生软骨支架,并对其理化特性及与脂肪干细胞(adipose-derived stem cells,ADSCs)的相容性进行了系列评价。
1 材料和方法
1.1 实验主要材料、试剂及设备
新鲜猪关节软骨购于天津市屠宰场;Triton X-100、三羟甲基氨基甲烷(Tris)、DNase I、RNase A、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、碳二亚胺[1-ethyl-3-(3-dimethyllaminopropyl) carbodiimide,EDAC]、N-羟基琥珀酰亚胺(N-hydroxy-succinamide,NHS)(Sigma-Aldrich公司,美国),胶原检测试剂盒、糖胺聚糖(glycosaminoglycan,GAG)检测试剂盒(Biocolor公司,英国),胰蛋白酶、Ⅰ型胶原酶、DMEM低糖培养基、胎牛血清(fetal bovine serum,FBS)(Gibco公司,美国),Cell Counting Kit-8(CCK-8)试剂盒(Dojinko公司,日本),Live/Dead染料(Life Technologies公司,美国),5810R型低温高速离心机(Eppendorf公司,德国),FP40-HE型加热制冷恒温循环器(Julabo公司,德国),FD-1型冷冻干燥机(北京博医康实验仪器有限公司)。
1.2 猪CECM取向支架的制备
1.2.1 CECM冻干海绵的制备 切取新鲜猪关节软骨片,采用pH7.5、0.01 mol·L-1Tris-HCl缓冲液(含0.035 mmol·L-1PMSF)浸泡软骨片并以组织粉碎机粉碎为匀浆后,3 500 r·min-1离心15 min,提取上清液,沉淀继续于Tris-HCl缓冲液中粉碎匀浆,反复匀浆、离心数次,直至离心后无沉淀或仅有少量沉淀。将提取的上清液9 000 r·min-1离心15 min后弃去上清,所剩沉淀即为直径50~500 nm的软骨纤维。加入pH7.5的含1%TritonX-100的Tris-HCl缓冲液(含0.035 mmol·L-1PMSF)混匀,在4 ℃下振荡脱细胞12 h,9 000 r·min-1离心15 min后蒸馏水反复冲洗。加入含50 U·mL-1DNase Ⅰ与1 U·mL-1RNase A的酶消化缓冲液混匀,37 ℃下振荡消化12 h,9 000 r·min-1离心15 min后超纯水反复冲洗,冷冻干燥后即得到CECM冻干海绵,4 ℃保存备用。
1.2.2 CECM取向支架的制备及交联 用超纯水溶解CECM冻干海绵并配制为浓度6%的浆料后加入圆柱型聚丙烯模具(直径15 mm,高30 mm,厚度1 mm),离心去气泡,模具周围以聚苯乙烯保温材料包裹,底部暴露。将装有CECM浆料的模具与保温材料置于预冷至-20 ℃的循环冷却液表面,使模具底部与循环冷却液接触,从而形成由模具顶部到底部的温度梯度差,使CECM浆料由模具底部至顶部定向结晶,12 h后将模具及CECM转移至冷冻干燥机中冰相升华干燥24 h定型支架,取出模具内支架浸泡于含50 mmol·L-1EDAC和20 mmol·L-1NHS的无水乙醇中37 ℃下交联24 h,用超纯水洗3 d,每天换水10次,然后50 ℃真空干燥箱内干燥12 h,将支架切成直径5 mm、高2.5 mm的圆柱状(图1),辐照灭菌备用。
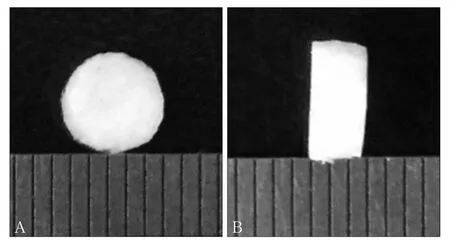
图 1 CECM取向支架大体观察Fig 1 The general observation of CECM oriented scaffold
1.3 CECM取向支架与兔ADSCs的复合
灭菌后的CECM取向支架置于12孔板中,每孔一个支架。将第三代兔ADSCs调节细胞密度至5× 106个·mL-1,吹匀。用1 mL注射器将细胞悬液注入支架内部至支架饱和,接种后将支架-细胞复合体移至37 ℃细胞培养箱中孵育1 h,翻转支架后继续孵育1 h,每孔加入2 mL含10%FBS的低糖DMEM培养基后于细胞培养箱中培养,每3天更换一次培养基,构建细胞-支架复合体。
1.4 CECM取向支架理化性能评价
扫描电镜(scanning electron microscope,SEM)观察:分别切取厚度为0.5 mm的CECM取向支架横断面和纵断面,表面喷金处理后SEM观察。
支架组织学染色:将支架于二甲苯中透明30 min后常规石蜡包埋,厚度10 μm横断切片,进行苏木精-伊红(hematoxylin-eosin,HE)、甲苯胺蓝、番红O和天狼星红染色观察。
支架生化成分定量分析:将支架以胰蛋白酶完全消化后,分别以胶原检测试剂盒和糖胺聚糖检测试剂盒定量分析支架中总胶原含量和总糖胺聚糖含量(以牛硫酸软骨素作为标准品)。
支架孔隙率测定:利用无水乙醇法测试支架的孔隙率。测试3次,取平均值。
支架吸水率测定:取支架5个浸于超纯水中,接真空泵抽吸脱气至无气泡逸出,取出后擦净支架表面水分,称得质量m,然后将支架在50 ℃的真空干燥箱内干燥12 h,取出后称得质量m0,吸水率X=(m-m0)/m。测试3次,取平均值。
支架力学性能测定:利用微材料力学测试系统检测支架的纵向压缩弹性模量,绘制支架应力—应变曲线。测试3个支架,取平均值。
1.5 CECM取向支架细胞相容性评价
支架浸提液毒性检测:以含有10%FBS的低糖DMEM培养基浸泡支架48 h制备支架浸提液,取第一代兔ADSCs进行实验,将200 μL细胞密度为1.0× 104个·mL-1的细胞悬液接种到96孔细胞培养板上,待细胞贴壁后加入支架浸提液培养(支架浸提液组),以含10%FBS的低糖DMEM培养基作为对照组,连续培养7 d,分别在培养1、3、5、7 d后采用CCK-8试剂盒检测其对细胞增殖的影响。
细胞-支架复合体活-死(Live/Dead)细胞染色:细胞-支架复合体培养7 d后取出,加入Live/Dead染液,在激光共聚焦显微镜下观察细胞活性。
细胞-支架复合体SEM观察:细胞-支架复合体培养48 h后取出,固定、脱水,干燥后切为厚度0.5 mm的薄片,表面喷金处理后SEM观察。
细胞-支架复合体组织学染色:细胞-支架复合体培养7 d后取出,固定、脱水、二甲苯透明,常规石蜡包埋,厚度10 μm切片,HE染色观察。
1.6 统计学方法
采用SPSS 19.0软件包进行分析,所有数据以均数±标准差的形式表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 CECM取向支架的SEM观察
SEM下可见,支架横断面呈均匀的多孔网状结构,孔径100~200 μm(图2A),孔壁上密布软骨纤维(图2C、D,箭头所示);支架纵断面呈垂直取向的管状结构,管径100~200 μm,孔隙之间连通性好(图2B)。
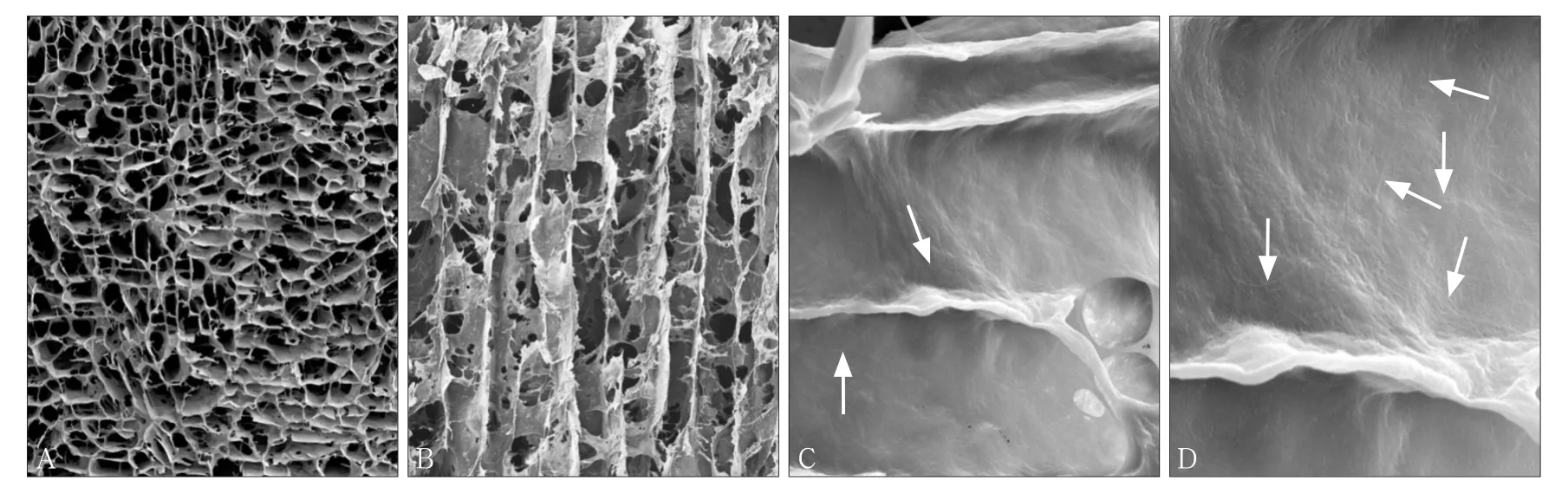
图 2 CECM取向支架 SEMFig 2 CECM oriented scaffold SEM
2.2 CECM取向支架的组织学染色观察
组织学染色可见,支架HE单纯红染,无蓝染(图3A),表明CECM材料中已无完整的细胞及细胞核;甲苯胺蓝、番红O、天狼星红染色均呈阳性(图3B、C、D),表明CECM取向支架含有蛋白多糖、胶原成分,与天然软骨成分相似。
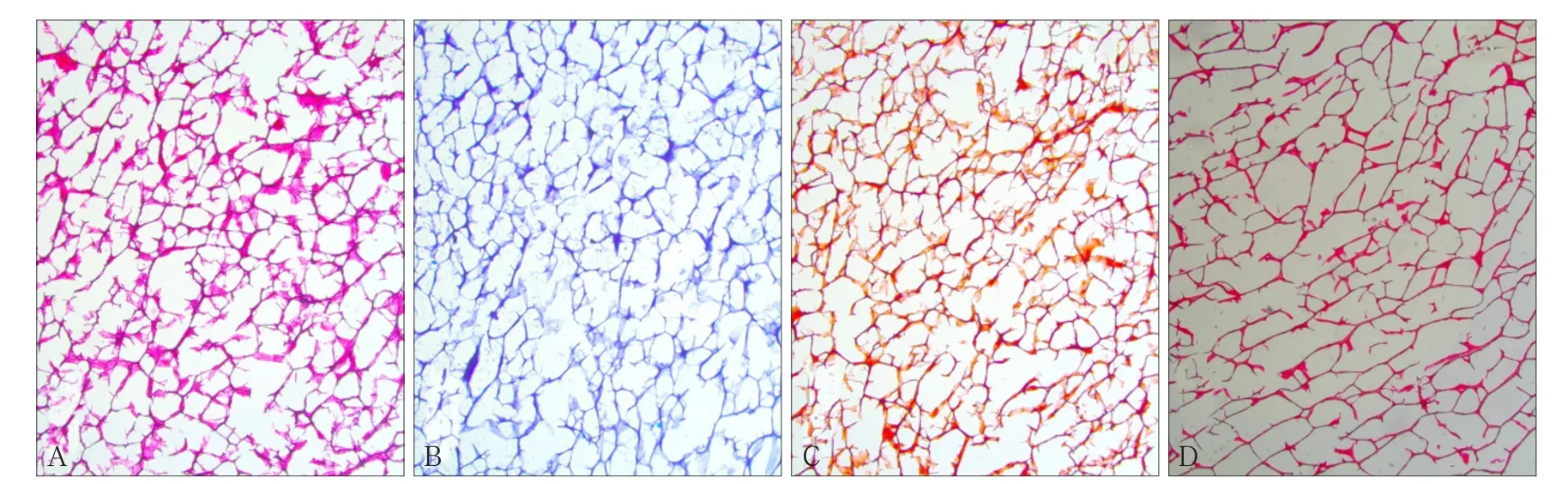
图 3 CECM取向支架组织学染色观察 × 50Fig 3 The histological staining observation of CECM oriented scaffold × 50
2.3 CECM取向支架的生化成分定量分析
生化成分定量分析结果显示,空支架本身含有胶原和糖胺聚糖成分,其含量(样品湿重)分别为(8.73±0.26)μg·mg-1和(1.66±0.14)μg·mg-1,表明关节软骨组织中的天然胶原和糖胺聚糖成分被保留下来。
2.4 CECM取向支架的孔隙率、吸水率及力学特性
CECM取向支架的孔隙率为95.455%±0.910%,吸水率为95.889%±1.071%;湿润状态下支架纵向压缩弹性模量为(40.208±5.097) kPa(图4)。
2.5 CECM取向支架的细胞相容性相关检测
支架浸提液CCK-8检测结果(图5A)显示:不同时间点支架浸提液对兔ADSCs的增殖与对照组相比无明显差异(P>0.05),表明支架浸提液无细胞毒性。Live/Dead细胞染色结果(图5B)显示:复合体培养7 d后,支架上的细胞均显绿色荧光(活细胞),无红色荧光(死细胞);SEM观察细胞-支架复合体(图5C),可见细胞贴附支架孔壁生长并分泌细胞外基质;细胞-支架复合体HE染色(图5D)可见,复合培养7 d后,细胞在支架孔隙内分布均匀,表明支架孔隙结构适于细胞的黏附、长入。
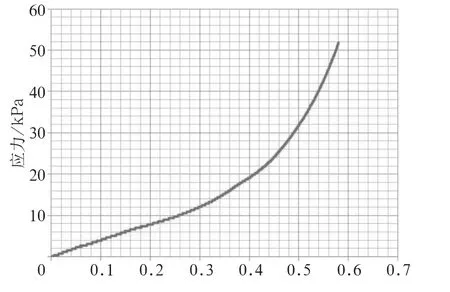
图 4 CECM取向支架的应力—应变曲线Fig 4 The stress strain curve of CECM oriented scaffold

图 5 CECM取向支架的细胞相容性相关检测Fig 5 The biocompatibility detection of CECM oriented scaffold
3 讨论
可用于软骨组织工程支架构建的材料主要有合成材料、天然生物材料、复合材料等[7]。早期应用于软骨组织工程的支架材料主要为合成材料,如聚羟基乙酸[8]、聚乳酸[9]、聚乳酸聚羟基乙酸共聚物[10-11]等。由于合成材料生物相容性较差,容易引起机体免疫排斥反应以及体内降解产物偏酸性可能引起炎症等缺点,临床应用价值有限。天然生物材料最突出的优点是抗原性低,与正常组织细胞外基质成分相似,能够参与组织愈合过程,有效地克服了合成材料的不足之处;因而天然生物材料是软骨组织工程中极具发展前景和临床应用价值的一类支架材料。
因为猪在解剖学、生理学特性、发病机理、营养代谢等方面与人极其相似而备受组织工程界的青睐,并且猪关节软骨来源广泛、成本低廉、生物安全性高[12],因此,本实验选用猪关节软骨作为支架的材料来源。未经处理的猪关节软骨含有细胞成分,具有抗原性,体内移植可能引起免疫排斥反应,对此,本实验采用作用柔和的去垢剂Triton X-100[13-14]对其进行脱细胞处理后,去除了大部分抗原性并保留了关节软骨的天然成分如胶原、蛋白多糖、生长因子等[15-16],这些天然成分能够为种子细胞提供高度仿生的生化环境并对干细胞产生定向诱导分化作用[17-18]。既往国内外有对整块软骨组织脱细胞后应用于组织工程的相关报道[19-20],但块状的脱细胞软骨存在脱细胞不彻底、孔隙过小和孔隙连通性差不利于种子细胞长入和迁徙等缺陷,而本实验中超微匀浆、定向结晶和冷冻干燥再成型技术的结合,有效地弥补了上述缺陷。
超微匀浆技术彻底破坏关节软骨原有的物理结构,形成软骨纤维脱细胞更加彻底,经进一步冷冻干燥而成CECM冻干海绵,方便保存和配制。超微匀浆过程为单纯物理变化过程,能够在极大限度上保留关节软骨的天然成分,这是在Jia等[21]的物理粉碎与化学消化结合法基础上的优化。对于软骨细胞外基质冻干海绵的重溶过程,姚军等[22]采用了稀盐酸重溶法,而由于本实验所制备的CECM冻干海绵结构更加微细,超纯水即可完全重溶,从而进一步避免了酸对天然软骨成分的破坏;定向结晶技术即在体系中建立一定的温度梯度差,使CECM浆料中水分能逆着温度梯度差的方向结晶生长,从而控制冰晶在体系中的形成方向;冷冻干燥后,冰晶升华,留下的空隙即为支架的孔隙结构。为了控制支架的孔隙率和吸水率,将CECM浆料浓度调节为6%,定向结晶温度梯度最低值控制在-20 ℃,经过此流程制备而成的取向性CECM支架孔隙率和吸水率均在95%以上,孔隙连通性好,满足软骨组织工程对支架结构的要求。
软骨支架作为种子细胞再生组织的模板,具有搭载种子细胞并引导种子细胞及其分泌的新生细胞外基质的积累排列,最终决定新生组织的形态、结构及功能的作用[23],因此,在结构上高度仿生也是软骨组织工程对软骨支架的另一要求。早期国内外对软骨组织工程支架的研究多局限于制备成无规则的、随机排列的孔隙结构,而本实验方法所制备的软骨支架具备类似于正常关节软骨垂直于关节面的柱状组织排列结构,在结构上达到了高度仿生的要求。此外,由于解剖部位的特殊性,颞下颌关节软骨组织通常需承受相当的载荷来支持关节的活动,因而软骨支架的力学特性也应尽量接近于正常关节软骨组织,具有足够的载荷能力,而垂直取向的结构同时也大大提高了软骨支架本身的纵向抗压缩性能,这对于在新生软骨组织形成、成熟前支架能够为种子细胞提供足够的修复空间以及保护种子细胞有重要意义。
种子细胞是缺损组织修复再生的细胞来源,种子细胞的持续增殖、分化以及其细胞外基质的积累使得缺损组织能够修复、再生。早期应用于软骨组织工程研究的种子细胞多为终末分化的组织细胞,然而这类细胞在分离培养、增殖潜能等方面均存在着一定的困难和缺陷,因而对干细胞诱导分化已经成为当今软骨组织工程研究的热点和重点。ADSCs是一种以极小的手术创伤即可大量获得的自体干细胞,且其定向成软骨诱导潜能已被国内外研究所证实。本研究结果表明CECM取向支架对ADSCs具有良好的相容性,为进一步探讨以CECM取向支架搭载自体ADSCs构建组织工程化软骨的可行性奠定了基础。
综上,本实验成功制备了猪关节软骨细胞外基质来源的取向性软骨支架,结构上具有一定仿生性,理化性能优良,生物相容性好,是一种比较理想的软骨组织工程支架。在后续研究中,我们将进一步结合动物实验,探索其构建组织工程软骨及体内再生修复软骨损伤的生物可行性。
[1] Getgood A, Bhullar T, Rushton N. Current concepts in articular cartilage repair[J]. Orthop Trauma, 2009, 23(3):189-200.
[2] Haleem AM, Chu CR. Advances in tissue engineering techniques for articular cartilage repair[J]. Oper Tech Orthop, 2010, 20(2):76-89.
[3] Danisovic L, Varga I, Zamborsky R, et al. The tissue engineering of articular cartilage: cells, scaffolds and stimulating factors[J]. Exp Biol Med (Maywood), 2012, 237(1):10-17.
[4] Tortelli F, Cancedda R. Three-dimensional cultures of osteogenic and chondrogenic cells: a tissue engineering approach to mimic bone and cartilage in vitro[J]. Eur Cell Mater, 2009, 17:1-14.
[5] Cheng CW, Solorio LD, Alsberg E. Decellularized tissue and cell-derived extracellular matrices as scaffolds for orthopaedic tissue engineering[J]. Biotechnol Adv, 2014, 32(2): 462-484.
[6] Luo Z, Jiang L, Xu Y, et al. Mechano growth factor (MGF) and transforming growth factor (TGF)-β3 functionalized silk scaffolds enhance articular hyaline cartilage regeneration in rabbit model[J]. Biomaterials, 2015, 52:463-475.
[7] Hollister SJ, Murphy WL. Scaffold translation: barriers between concept and clinic[J]. Tissue Eng Part B Rev, 2011, 17(6):459-474.
[8] Cui L, Wu Y, Cen L, et al. Repair of articular cartilage defect in non-weight bearing areas using adipose derived stem cells loaded polyglycolic acid mesh[J]. Biomaterials, 2009, 30 (14):2683-2693.
[9] Morelli S, Salerno S, Holopainen J, et al. Osteogenic and osteoclastogenic differentiation of co-cultured cells in polylactic acid-nanohydroxyapatite fi ber scaffolds[J]. J Biotechnol, 2015, 204:53-62.
[10] Zhang K, Zhang Y, Yan S, et al. Repair of an articular cartilage defect using adipose-derived stem cells loaded on a polyelectrolyte complex scaffold based on poly(l-glutamic acid) and chitosan[J]. Acta Biomater, 2013, 9(7):7276-7288.
[11] Chang NJ, Lin CC, Shie MY, et al. Positive effects of cellfree porous PLGA implants and early loading exercise on hyaline cartilage regeneration in rabbits[J]. Acta Biomater, 2015, 28:128-137.
[12] 鹿亮, 郭全义, 杨启友, 等. 猪来源关节软骨脱细胞支架的生物安全性研究[J]. 中国医药生物技术, 2010, 5(1):19-23.
Lu L, Guo QY, Yang QY, et al. Study on the biological safety of acellular scaffold derived from porcine articular cartilage [J]. Chin Med Biotechnol, 2010, 5(1):19-23.
[13] Gilbert TW, Sellaro TL, Badylak SF. Decellularization of tissues and organs[J]. Biomaterials, 2006, 27(19):3675-3683.
[14] 马浩, 王奇, 石海燕, 等. 不同方法制备脱细胞猪主动脉瓣膜支架的组织结构[J]. 中国组织工程研究, 2012, 16(29): 5355-5360.
Ma H, Wang Q, Shi HY, et al. Histological structure of porcine aortic valve scaffolds decellularized by using different methods[J]. Chin J Tiss Eng Res, 2012, 16(29):5355-5360.
[15] Brody LT. Knee osteoarthritis: clinical connections to articular cartilage structure and function[J]. Phys Ther Sport, 2015, 16(4):301-316.
[16] Almeida HV, Liu Y, Cunniffe GM, et al. Controlled release of transforming growth factor-β3 from cartilage-extra-cellularmatrix-derived scaffolds to promote chondrogenesis of humanjoint-tissue-derived stem cells[J]. Acta Biomater, 2014, 10 (10):4400-4409.
[17] 陈富林, 毛天球, 丁桂聪, 等. 转化生长因子-β诱导骨髓基质细胞团体外形成软骨的观察[J]. 华西口腔医学杂志, 2003, 21(2):92-94.
Chen FL, Mao TQ , Ding GC, et al. Experimental study on the chondrogenesis potentiality of marrow stromal cell under the induction of transforming growth factor-β[J]. West Chin J Stomatol, 2003, 21(2):92-94.
[18] Matsiko A, Levingstone TJ, Gleeson JP, et al. Incorporation of TGF-beta 3 within collagen-hyaluronic acid scaffolds improves their chondrogenic potential[J]. Adv Healthc Mater, 2015, 4(8):1175-1179.
[19] 孙良, 李丕宝, 栾保华. 脱细胞基质软骨支架的制备[J].中国组织工程研究, 2015, 19(16):2494-2499.
Sun L, Li PB, Luan BH. Preparation of an acellular cartilage matrix scaffold[J]. Chin J Tiss Eng Res, 2015, 19(16):2494-2499.
[20] Luo L, Eswaramoorthy R, Mulhall KJ, et al. Decellularization of porcine articular cartilage explants and their subsequent repopulation with human chondroprogenitor cells[J]. J Mech Behav Biomed Mater, 2015, 55:21-31.
[21] Jia S, Liu L, Pan W, et al. Oriented cartilage extracellular matrix-derived scaffold for cartilage tissue engineering[J]. J Biosci Bioeng, 2012, 113(5):647-653.
[22] 姚军, 卢世壁, 彭江, 等. 关节软骨细胞外基质源性软骨组织工程取向支架的制备[J]. 中国组织工程研究与临床康复, 2009, 13(3):432-436.
Yao J, Lu SB, Peng J, et al. Preparation of articular cartilage extracellular matrix derived oriented scaffold for cartilage tissue engineering[J]. J Clin Rehabil Tiss Eng Res, 2009, 13(3):432-436.
[23] Chung C, Burdick JA. Engineering cartilage tissue[J]. Adv Drug Deliv Rev, 2008, 60(2):243-262.
(本文编辑 李彩)
Development and characterization of oriented scaffolds derived from cartilage extracellular matrix
Li Kun1,2, Zhao Yanhong1, Xu Chen1, Wang Lianyong3, Yang Qiang4, Li Hongfa1, Teng Binhong1. (1. Dept. of Orthodontics, Stomatological Hospital of Tianjin Medical University, Tianjin 300070, China; 2. Dept. of Orthodontics, Yantai Stomatological Hospital, Yantai 264000, China; 3. The Key Laboratory of Bioactive Materials, Ministry of Education, College of Life Sciences, Nankai University, Tianjin 300071, China; 4. Dept. of Spine Surgery, Tianjin Hospital, Tianjin 300211, China)
Supported by: The National Natural Science Foundation of China (31300798, 31470937, 81572154); The Key Project of Science and Technology Research of Tianjin Health Bureau (15KG125, 16KG114).
Objective This study aimed to prepare oriented scaffolds derived from a cartilage extracellular matrix (CECM) and to investigate their physicochemical property and compatibility with adipose-derived stem cells (ADSCs). Methods A fresh porcine articular cartilage was cut into pieces. Cartilage nanofi bers with diameters of 50–500 nm were collected through homogenization and centrifugation. These nanofi bers were then decellularized by using Triton X-100 to produce 6% CECM. The oriented scaffolds derived from the nanoscale CECM were fabricated through unidirectional solidifi cation and lyophilization. Afterward, these scaffolds were crosslinked. The physical and chemical performances and cell compatibility of CECM-oriented scaffolds were evaluated. Results The cross-sections of the scaffolds contained homogeneous reticular porous structures with nanofi bers on the walls of the pores, and the longitudinal sections revealed vertical tubular structures. Hematoxylin–eosin staining revealed that the scaffolds were red without blue. Toluidine blue, safranin O, and Sirius red staining showed positive results. The porosity, water absorption rate, and vertical compressive elastic modulus of the scaffolds were 95.455%± 0.910%, 95.889%±1.071%, and (40.208±5.097) kPa, respectively. Conclusion The components of the oriented scaffolds derived from CECM are similar to those of native cartilage with favorable biocompatibility. The porous structures and sizes of the scaffolds are suitable for the adhesion, proliferation, and infiltration of ADSCs. The oriented scaffolds derived from CECM are relatively optimal for cartilagetissue engineering.
cartilage; extracellular matrix; oriented scaffolds; tissue engineering; unidirectional solidifi cation; lyophilization
Q 81
A
10.7518/hxkq.2017.01.007
2016-06-20;
2016-08-10
国家自然科学基金(31300798,31470937,81572154);天津市卫生局科技攻关重点项目(15KG125,16KG114)
李坤,住院医师,硕士,E-mail:likun_630216@163.com
赵艳红,副主任医师,博士,E-mail:leafzh@126.com
Correspondence: Zhao Yanhong, E-mail:leafzh@126.com.
