微振动对成骨细胞成骨效应的瞬时影响
2017-02-23朱卓立张玲马瑞阳甘雪琦
朱卓立 张玲 马瑞阳 甘雪琦
口腔疾病研究国家重点实验室 华西口腔医院修复科(四川大学),成都 610041
微振动对成骨细胞成骨效应的瞬时影响
朱卓立 张玲 马瑞阳 甘雪琦
口腔疾病研究国家重点实验室 华西口腔医院修复科(四川大学),成都 610041
目的 在不考虑间歇期的介入所带来的延时效应下,研究高频率低振幅微振动(LMHFV)刺激对成骨细胞成骨效应的瞬时影响。方法 培养小鼠成骨前体细胞系(MC3T3-E1),实验组在施加高频率(40 Hz)、低振幅(0.49 g)微振动30 min后,立即通过实时荧光定量聚合酶链反应检测早期成骨分化标志物Runt相关转录因子2(Runx2)、Ⅰ型胶原蛋白(Col-Ⅰ)、碱性磷酸酶(ALP)的表达,并检测活性氧(ROS)浓度变化及线粒体形态变化,后加入抗氧化剂后继续观察上述指标的变化。结果 LMHFV刺激后Runx2、Col-Ⅰ、ALP的mRNA表达明显下调(P<0.01),线粒体ROS浓度升高(P<0.01),线粒体长度缩短(P<0.01);抗氧化剂的使用则使上述变化得到显著缓解(P<0.01)。结论 排除间歇期的干扰后,LMHFV(40 Hz,0.49 g)可降低成骨细胞内早期成骨分化标志物的表达,促进线粒体ROS的产生与积累并导致线粒体的过度分裂。
微振动; 成骨分化; 活性氧; 线粒体形态
骨组织是人体内一种典型的力学敏感器官,可以通过骨改建来适应多种不同的力学刺激信号,如拉力、压力、流体静压力、剪切力、微振动等[1-3]。其中,既往研究[4-6]表明高频率低振幅微振动(lowmagnitude high-frequency vibration,LMHFV)可促进成骨分化,抑制破骨分化,使骨改建更倾向于骨生成方向。但在这些相关研究的实验设计中,每一个微动刺激周期被固定的间隙期所阻隔,这使最终检测的成骨效应并非单纯来自于微动刺激本身,还掺入了间隙期的影响。有学者[7-9]已证实,间歇期插入所致的延时效应可增强成骨细胞对固有微振动刺激的敏感性,促进成骨。然而,在研究微振动对成骨细胞的成骨变化的瞬时影响方面却鲜有报道。此外,近年来线粒体活性氧(reactive oxygen species,ROS)作为一种胞内信号传递分子已成为细胞分化方面的研究热点,有学者[10-13]认为ROS可作为成骨分化的一个新兴指标。因此,本实验拟在排除间隙期的干扰下,研究LMHFV刺激对小鼠成骨前体细胞(MC3T3-E1)所造成的瞬时成骨效应,并观察线粒体内ROS是否与此瞬时效应相关。
1 材料和方法
1.1 主要材料和仪器
小鼠MC3T3-E1细胞系由四川大学口腔疾病研究国家重点实验室提供。改良α-MEM 培养基(Hyclone公司,美国),胎牛血清(fetal calf serum,FBS)、胰蛋白酶、双抗(Millipore公司,美国),Mitotracker™ Red CMXRos染料、Mitosox™ Red染料、Mitotracker™ Green染料、Trizol(Invitrogen公司,美国)。GJX-5型振动传感器校准仪(北京森德格科技有限公司),ABI 7300荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪(ABI公司,美国)。
1.2 细胞培养与传代
将MC3T3-E1细胞接种于含10%FBS的改良α-MEM培养基中,并置于37 ℃、5%CO2的饱和湿度孵箱中培养。当贴壁细胞达90%时,以0.25%胰蛋白酶进行消化传代培养。复苏后细胞传代培养至2~3代用于实验。
1.3 微振动刺激
将MC3T3-E1细胞接种于6孔板(接种浓度为6× 104个·mL-1,用于检测mRNA变化)或24孔板(接种浓度为2×104个·mL-1,用于检测ROS和线粒体形态变化)中培养至贴壁细胞达90%时,进行微振动刺激,振动参数设为40 Hz、0.49 g、30 min。所有检测在振动结束后立即进行。
1.4 抗氧化剂N-乙酰半胱氨酸(N-acetyl cysteine,NAC)的处理
MC3T3-E1细胞在含1.0 mmol·L-1NAC的培养基中培养24 h后,施加微振动刺激,并进行相关检测。
1.5 检测方法
1.5.1 实时荧光定量PCR 在微振动刺激结束后,立即采用Trizol收集6孔板内的细胞,加入氯仿(每管200 mL),剧烈振荡15 s至乳胶状,冰上静置至其自然分层。4 ℃,12 850 r·min-1离心15 min,后取上清约每管500 μL并加入等体积的异丙醇,混合均匀后,冰上静置10 min。4 ℃,12 850 r·min-1离心15 min。缓慢弃掉上清,加入预冷的75%乙醇,振荡离心管使沉淀悬浮。4 ℃,11 130 r·min-1离心5 min。缓慢弃掉上清,室温干燥RNA沉淀约5 min,加入焦碳酸二乙酯(diethy pyrocarbonate,DEPC)水30 μL(每管)溶解RNA。采用分光光度法检测RNA的浓度和纯度。然后依次使用PrimeScript™ RT reagent Kit with gDNA Eraser(大连TAKARA公司)和SYBR®Premix Ex Taq™ Ⅱ(TliRNaseH Plus)(大连TAKARA公司)进行逆转录和扩增。最后于ABI 7300荧光定量PCR仪中进行反应,反应条件为:95 ℃ 3 min;95 ℃5 s,63 ℃ 31 s,40个循环。各检测基因实验引物如下。Runt相关转录因子2(Runt-related transcription factor 2,Runx2)正向引物序列:CCCAGCCACCTTTACCTACA,反向引物序列:TATGGAGTGCTGCTGGTCTG;Ⅰ型胶原蛋白(collagen typeⅠ,Col-Ⅰ)正向引物序列:CCCAAGGAAAAGAAGCACGTC,反向引物序列:AGGTCAGCTGGATAGCGACATC;碱性磷酸酶(alkaline phosphatase,ALP)正向引物序列:CCAACTCTTTTGTGCCAGAGA,反向引物序列:GGCTACATTGGTGTTGAGCTTTT;磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)正向引物序列:ACTTTGTCAAGCTCATTTCC,反向引物序列:TGCAGCGAACTTTATTGATG。
1.5.2 ALP活性检测 振动加载结束后,立即弃掉旧培养基,1%PBS轻轻漂洗2次后,用细胞刮刮下孔底细胞,经超声裂解后,4 ℃,10 000 r·min-1离心5 min,取上清液进行检测,上述操作均在冰上进行。后根据ALP活性检测试剂盒(南京建成生物工程研究所)的说明书进行ALP活性检测,并利用BCA蛋白试剂盒(上海碧云天生物技术有限公司)测定细胞内总蛋白浓度。
1.5.3 线粒体内ROS浓度检测 采用微振动处理后,立即弃掉细胞培养基,并在孔板内加入Mitosox™Red染料(2.5 μmol·L-1)和Mitotracker™ Green染料(100 nmol·L-1),37 ℃孵育30 min后,用缓冲液温和冲洗2次,并在荧光显微镜下观察,利用NIH Image J软件进行图片分析。
1.5.4 线粒体形态检测 在24孔板中放置圆形的载玻片,并在其上培养细胞。微振动处理后,立即弃掉细胞培养基,并在孔板内加入Mitotracker™ Red CMXRos染料(200 nmol·L-1),37 ℃孵育30 min后,用缓冲液温和冲洗2次。加入4%多聚甲醛后,于37 ℃固定30 min,后弃掉固定液,用缓冲液温和冲洗2次。将载玻片取出,放在长方形载玻片之上,盖上盖玻片,并用含抗荧光淬灭的封片剂(KPL公司,美国)进行封片。最后置于荧光显微镜下观察线粒体形态,并利用NIH Image J软件进行图片分析。
1.5.5 动力相关蛋白(dynamin-like protein 1,Drp1)检测 振动加载结束后,立即进行细胞裂解,过程为:4 ℃、1 2 000 r·min-1离心15 min,取上清液,后用裂解液裂解细胞,并收集裂解液至离心管中,在振荡器上混匀4~15 min,4 ℃、14 000 r·min-1离心15 min,取上清液备用。然后,取15 μL上清液至10 cm×10 cm胶上电泳,转至聚偏二氟乙烯膜,5%脱脂牛奶室温封闭1 h,1∶1 000加入血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体,再加入羊抗兔二抗,37 ℃孵育45 min,缓冲液洗涤30 min,每10 min换液1次。在暗室中压片,显影、定影后进行图像分析。
1.6 统计分析
所有检测均重复至少3次。数据形式表示为平均值±标准差。利用统计分析软件GraphPad Prism 6.0(Graph-pad Software公司,美国)对所得数据进行两独立样本t检验或方差分析。P<0.01被视为有统计学差异。
2 结果
2.1 微振动对早期成骨分化标志物基因表达的影响
Runx2、Col-Ⅰ、ALP三者作为早期成骨分化的标志物,在受到LMHFV瞬时刺激后,其mRNA表达水平及ALP活性显著降低(P<0.01)(图1)。
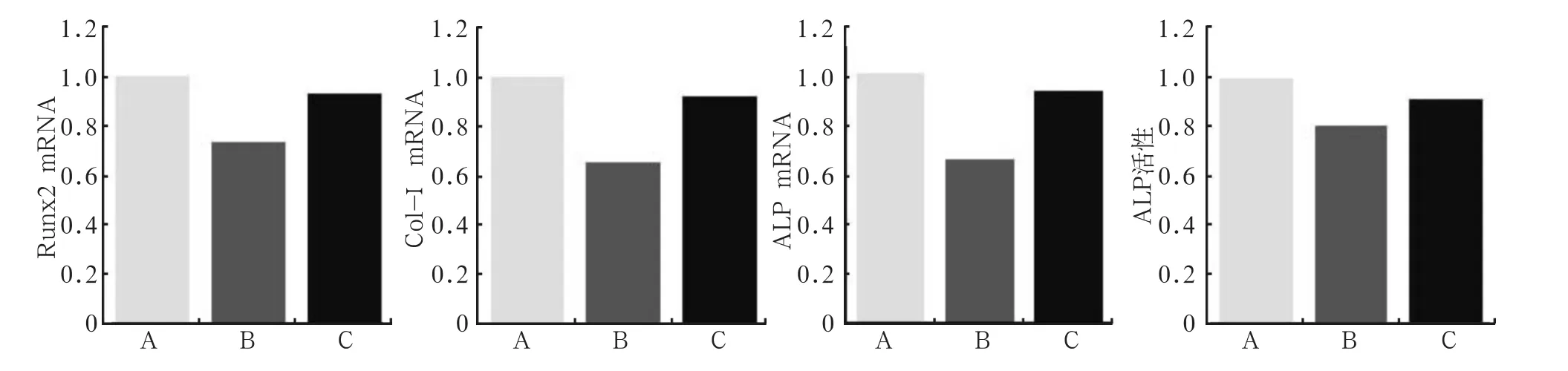
图 1 LMHFV和NAC对早期成骨标志物表达的影响Fig 1 Infl uence of LMHFV and NAC on early osteogenic markers levels
2.2 微振动对线粒体形态及ROS产生的影响
LMHFV刺激下ROS水平的变化及线粒体平均长度的变化见图2。施加0.49 g、40 Hz的微振动刺激30 min后,线粒体内ROS的含量明显高于对照组(P<0.01),且与静态培养的成骨细胞内的线粒体相比,振动组内的线粒体平均长度缩短(P<0.01),表现为线粒体碎片化增加。

图 2 LMHFV和NAC对ROS水平及线粒体平均长度变化的影响Fig 2 Infl uence of LMHFV and NAC on ROS level and average mitochondrial length
2.3 NAC对线粒体形态及ROS产生的影响
抗氧化剂NAC的使用,显著降低了振动组线粒体内ROS的含量(P<0.01),与对照组的差异无统计学意义(图2)。NAC的加入明显逆转了由微振动所造成的Drp1表达升高(P<0.01)以及线粒体过度分裂(P<0.01),使线粒体的平均长度与对照组无显著性区别(图2~4)。
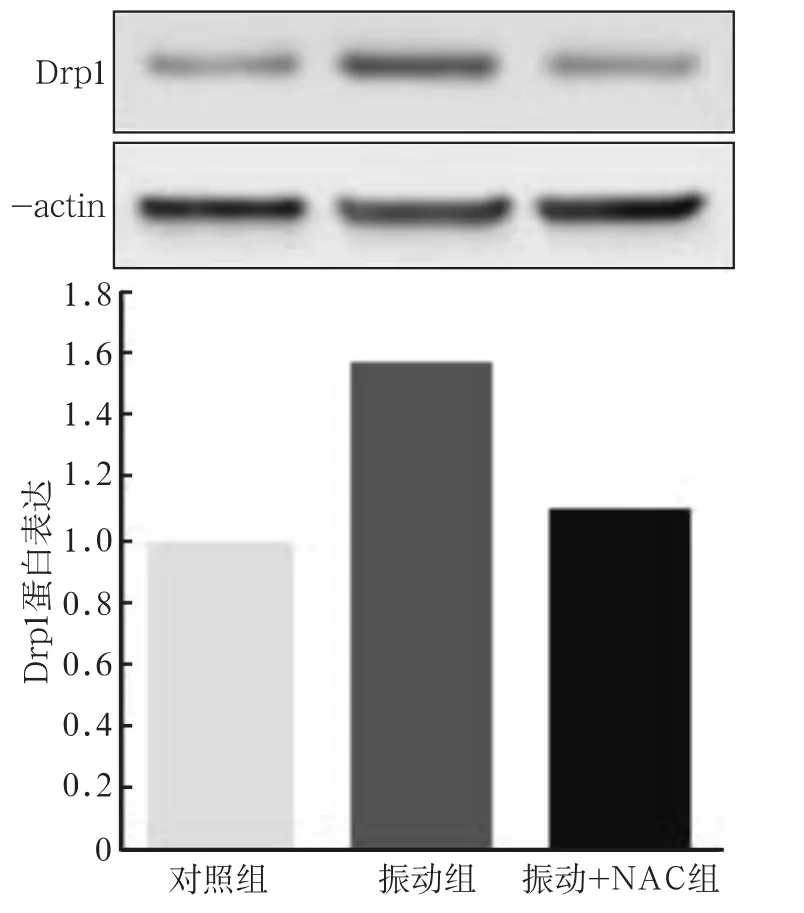
图 3 Drp1蛋白表达水平Fig 3 Expression of Drp1
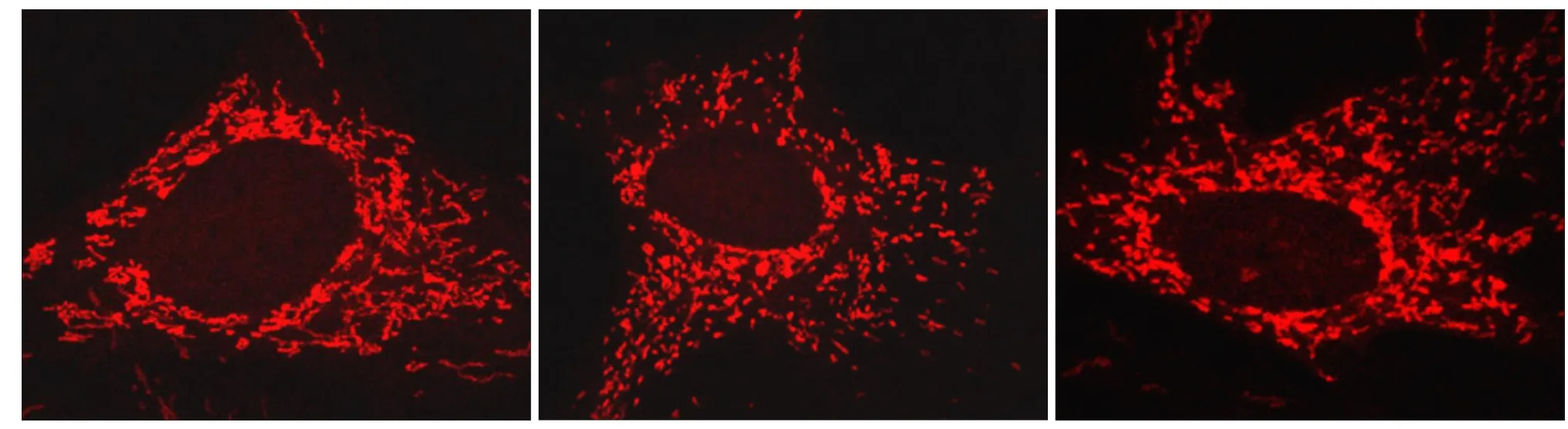
图 4 NAC对线粒体形态的影响Fig 4 Infl uence of NAC on mitochondrial morphology
2.4 NAC对微振动瞬时成骨效应的影响
NAC对微振动瞬时成骨效应的影响见图1。抗氧化剂NAC的使用,显著缓解了微振动所导致的瞬时成骨效应,表现为NAC预处理后微振动组内的Runx2、Col-Ⅰ、ALP mRNA水平及ALP活性程度较微振动组均发生不同程度的上调(P<0.01),并且与对照组比较差异无统计学意义。
3 讨论
近年来,高频率(f=20~90 Hz)、低振幅(a<1 g,1 g=9.81 m·s-2)微振动常作为一种促进骨改建的力学刺激而被广泛研究[3-6,14-15]。虽然既往研究[16-18]已证实在微振动刺激中插入间歇期可促进成骨分化,有利于骨生成和骨质愈合,但是关于微振动的瞬时成骨效应却鲜有报道。此外,有学者[10,19-20]称线粒体ROS在成骨细胞分化过程中可发挥一定作用,但在微振动诱导下成骨细胞分化过程ROS的表达水平及线粒体形态的变化却未被研究过。因此,LMHFV对成骨细胞瞬时成骨变化的影响及线粒体ROS在此过程中的变化,成为了本研究的亮点和突破点。
在本研究中,微振动组的Runx2、Col-Ⅰ、ALP这三个早期成骨分化标志物的基因表达水平及ALP活性程度均显著低于对照组,表明单纯的、瞬时的微振动刺激可以抑制成骨分化。结合前人对间隙期的研究结果,笔者猜测间歇期所致的延时效应可以缓解甚至逆转由单纯微动刺激所导致的瞬时成骨效应,使长期微动刺激的综合成骨效应表现为促进成骨分化,抑制破骨分化,促进骨生成,这一猜想与其他研究[6,8-9]结果一致。
在正常情况下,线粒体的形态常在融合与分裂之间维持着平衡,并且这种平衡与线粒体内ROS的含量相关[21-23]。当线粒体内ROS水平过低时,线粒体融合大于分裂,其平均长度增加;反之,当线粒体内ROS水平过高时,线粒体分裂大于融合,其平均长度缩短。本实验对线粒体ROS的含量及线粒体形态的检测结果表明,微振动在下调成骨分化标志物基因表达水平的同时,明显提高了线粒体内ROS的水平,氧化应激增强,进而促进了线粒体结构的动态变化趋向于线粒体分裂,表现为线粒体平均长度缩短。当使用抗氧化剂NAC后,线粒体ROS的含量显著下调,线粒体的动态结构变化也趋于平衡。由于Drp1在调控线粒体分裂的过程中起着非常关键的作用[19-20],因此在本实验中随着NAC的加入,由微振动造成的Drp1过度表达现象也得到显著改善。与此同时,NAC减弱了ROS来源的氧化应激对成骨细胞的损伤程度,使Runx2、Col-Ⅰ、ALP mRNA水平及ALP活性程度上调,并与对照组无显著性差异。
Arakaki等[10]的研究结果表明,成骨诱导液的使用可促进基质矿化、ALP mRNA的表达,同时还伴随ROS水平的上调及线粒体结构的异常变化;当抑制ROS的产生后,成骨细胞分化同样也受到抑制。这一研究结果与本实验结果之所以不同,其原因可能是由于不同的刺激因素造成的ROS水平的升高程度不同所致。
综上所述,本研究阐述了微振动对小鼠成骨细胞成骨变化的瞬时影响,并探讨了线粒体ROS以及线粒体分裂活动在此过程中的变化,对微振动这一传统的力学刺激有了更加全面和深入的认识。此外,线粒体ROS是如何调控微振动刺激下的成骨分化过程,则有待进一步的研究。
[1] Sumanasinghe RD, Bernacki SH, Loboa EG. Osteogenic differentiation of human mesenchymal stem cells in collagenmatrices: effect of uniaxial cyclic tensile strain on bone morphogenetic protein (BMP-2) mRNA expression[J]. Tissue Eng, 2006, 12(12):3459-3465.
[2] Arnsdorf EJ, Tummala P, Kwon RY, et al. Mechanically induced osteogenic differentiation-the role of RhoA, ROCKⅡ and cytoskeletal dynamics[J]. J Cell Sci, 2009, 122(Pt 4):546-553.
[3] Zhou Y, Guan X, Zhu Z, et al. Osteogenic differentiation of bone marrow-derived mesenchymal stromal cells on bonederived scaffolds: effect of microvibration and role of ERK1/2 activation[J]. Eur Cell Mater, 2011, 22:12-25.
[4] Xie L, Jacobson JM, Choi ES, et al. Low-level mechanical vibrations can infl uence bone resorption and bone formation in the growing skeleton[J]. Bone, 2006, 39(5):1059-1066.
[5] Rubin C, Recker R, Cullen D, et al. Prevention of postmenopausal bone loss by a low-magnitude, high-frequency mechanical stimuli: a clinical trial assessing compliance, effi cacy, and safety[J]. J Bone Miner Res, 2004, 19(3):343-351.
[6] Kim IS, Song YM, Lee B, et al. Human mesenchymal stromal cells are mechanosensitive to vibration stimuli[J]. J Dent Res, 2012, 91(12):1135-1140.
[7] Sen B, Xie Z, Case N, et al. Mechanical signal infl uence on mesenchymal stem cell fate is enhanced by incorporation of refractory periods into the loading regimen[J]. J Biomech, 2011, 44(4):593-599.
[8] Ponik SM, Pavalko FM. Formation of focal adhesions on fi bronectin promotes fl uid shear stress induction of COX-2 and PGE2 release in MC3T3-E1 osteoblasts[J]. J Appl Physiol, 2004, 97(1):135-142.
[9] Bacabac RG, Smit TH, Van Loon JJ, et al. Bone cell responses to high-frequency vibration stress: does the nucleus oscillate within the cytoplasm[J]. FASEB J, 2006, 20(7): 858-864.
[10] Arakaki N, Yamashita A, Niimi S, et al. Involvement of reactive oxygen species in osteoblastic differentiation of MC3T3-E1 cells accompanied by mitochondrial morphological dynamics[J]. Biomed Res, 2013, 34(3):161-166.
[11] Lee NK, Choi YG, Baik JY, et al. A crucial role for reactive oxygen species in RANKL-induced osteoclast differentiation[J]. Blood, 2005, 106(3):852-859.
[12] Chen CT, Shih YR, Kuo TK, et al. Coordinated changes of mitochondrial biogenesis and antioxidant enzymes during osteogenic differentiation of human mesenchymal stem cells [J]. Stem Cells, 2008, 26(4):960-968.
[13] Rehman J. Empowering self-renewal and differentiation: the role of mitochondria in stem cells[J]. J Mol Med, 2010, 88(10):981-986.
[14] Wang S, Liu Y, Tang Y, et al. Direct radial LMHF microvibration induced bone formation and promoted implant osseointegration[J]. Clin Implant Dent Relat Res, 2016, 18 (2):401-409.
[15] 朱卓立, 马瑞阳, 杨扬, 等. 不同频率微振动对血管内皮细胞生长因子表达及通透性的影响[J]. 华西口腔医学杂志, 2016, 34(2):136-139.
Zhu ZL, Ma RY, Yang Y, et al. Effects of different frequency microvibrations in the vascular endothelial growth factor expression and permeability of vascular endothelial cell[J]. West Chin J Stomatol, 2016, 34(2):136-139.
[16] Chan ME, Uzer G, Rubin CT. The potential benefi ts and inherent risks of vibration as a non-drug therapy for the prevention and treatment of osteoporosis[J]. Curr Osteoporos Rep, 2013, 11(1):36-44.
[17] Uzer G, Manske SL, Chan ME, et al. Separating fl uid shear stress from acceleration during vibrations in vitro: identifi cation of mechanical signals modulating the cellular response[J]. Cell Mol Bioeng, 2012, 5(3):266-276.
[18] Zhang Y, Hou W, Liu Y, et al. Microvibration stimulates β-catenin expression and promotes osteogenic differentiation in osteoblasts[J]. Arch Oral Biol, 2016, 70:47-54.
[19] Gan X, Wu L, Huang S, et al. Oxidative stress-mediated activation of extracellular signal-regulated kinase contributes to mild cognitive impairment-related mitochondrial dysfunction[J]. Free Radic Biol Med, 2014, 75:230-240.
[20] Gan X, Huang S, Yu Q, et al. Blockade of Drp1 rescues oxidative stress-induced osteoblast dysfunction[J]. Biochem Biophys Res Commun, 2015, 468(4):719-725.
[21] Qu J, Chen W, Hu R, et al. The injury and therapy of reactive oxygen species in intracerebral hemorrhage looking at mitochondria[J]. Oxid Med Cell Longev, 2016, 2016:1-9.
[22] Kashatus JA, Nascimento A, Myers LJ, et al. Erk2 phosphorylation of Drp1 promotes mitochondrial fission and MAPK-driven tumor growth[J]. Mol Cell, 2015, 57(3):537-551.
[23] Wang X, Su B, Lee HG, et al. Impaired balance of mitochondrial fi ssion and fusion in Alzheimer’s disease[J]. J Neurosci, 2009, 29(28):9090-9103.
(本文编辑 杜冰)
Infl uences of vibration on rapid osteogenic response of osteoblasts
Zhu Zhuoli, Zhang Ling, Ma Ruiyang, Gan Xueqi. (State Key Laboratory of Oral Diseases, Dept. of Prosthodontics, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
Supported by: Specialized Research Fund for The Doctoral Program of Higher Education (20120181120007).
Objective This study investigated the rapid response of osteoblasts, which were derived from low-magnitude high-frequency vibration (LMHFV). Refractory period-derived memory response was also observed. Methods MC3T3-E1 cells were incubated and received LMHFV stimulation (0.49 g, 40 Hz) for 30 min. After application of LMHFV, mRNA levels of earlier osteogenic differentiation markers Runt-related transcription factor 2 (Runx2), collagen typeⅠ(Col-Ⅰ), and alkaline phosphatase (ALP) were immediately detected by real-time fl uorescence quantitative polymerase chain reaction in the absence or presence of antioxidant. Simultaneously, concentrations of mitochondrial reactive oxygen species (ROS) and average mitochondrial length were also measured. Results Osteoblasts in the vibration group showed decreased gene expressions of Runx2, Col-Ⅰ, and ALP (P<0.01) and increased levels of mitochondrial ROS (P<0.01) and shortened mitochondria (P<0.01), whereas antioxidant treatment resulted in recovery from changes in the above indicators (P<0.01). Conclusion LMHFV can downregulate mRNA levels of early osteogenic differentiation markers, promote ROS generation, and mitochondrial fi ssion.
vibration; osteogenic differentiation; reactive oxygen species; mitochondrial morphology
Q 68
A
10.7518/hxkq.2017.01.010
2016-04-17;
2016-11-10
高等学校博士学科点专项科研基金(20120181120007)
朱卓立,讲师,博士,E-mail:494218289@qq.com
甘雪琦,副教授,博士,E-mail:522707976@qq.com
Correspondence: Gan Xueqi, E-mail: 522707976@qq.com.
