腹腔镜胃癌根治性全胃切除术后外科并发症的Clavien-Dindo分级及危险因素分析*
2017-02-22陈秋贤蔡丽生方顺勇沈俊涛连明桥蔡铭智洪建明
陈秋贤 蔡丽生 方顺勇 沈俊涛 连明桥 蔡铭智 洪建明
(福建医科大学附属漳州市医院普外二科,漳州 363000)
·临床论著·
腹腔镜胃癌根治性全胃切除术后外科并发症的Clavien-Dindo分级及危险因素分析*
陈秋贤 蔡丽生**方顺勇 沈俊涛 连明桥 蔡铭智 洪建明
(福建医科大学附属漳州市医院普外二科,漳州 363000)
目的 探讨腹腔镜胃癌根治性全胃切除术后外科并发症的Clavien-Dindo分级情况及危险因素。 方法 回顾性分析2008年1月~2015年12月我院281例胃中上部癌行腹腔镜根治性全胃切除术的临床资料,根据Clavien-Dindo分级系统分析术后外科并发症的发生情况,并采用logistic回归分析术后外科并发症发生的危险因素。 结果 发生外科并发症29例,发生率10.3%(29/281),其中严重外科并发症9例,发生率3.2%(9/281)。术后外科并发症的Clavien-Dindo分级情况:Ⅰ级3例 (1.1%),Ⅱ级17例(6.0%),Ⅲa级4例(1.4%),Ⅲb级2例(0.7%),Ⅳ级2例(0.7%),Ⅴ级1例(0.4%)。单因素分析结果显示患者年龄、BMI、手术时间、术中出血量、肿瘤分化、肿瘤大小、浸润深度有统计学差异(P<0.05)。logistic多因素分析表明年龄(OR=2.671,95%CI:1.138~6.269,P=0.024)、BMI(OR=4.970,95%CI:1.597~15.465,P=0.006)、肿瘤大小(OR=3.311,95%CI: 1.068~10.260,P=0.038)、浸润深度(OR=4.472,95%CI:1.120~17.862,P=0.034)和术中出血量(OR=3.835,95%CI: 1.481~9.928,P=0.006)是腹腔镜胃癌根治性全胃切除术后外科并发症发生的独立危险因素。多因素logistic回归模型预测患者术后外科并发症发生的受试者工作特征(reciever operating characteristic,ROC)曲线下面积是0.784(0.695~0.873)。 结论 腹腔镜胃癌根治性全胃切除术后外科并发症的Clavien-Dindo分级以Ⅱ级较多见;患者年龄≥65岁、BMI≥25、肿瘤大小≥50 mm、浸润深度≥T3及术中出血量≥100 ml应警惕外科并发症的发生。
胃癌; 腹腔镜; 全胃切除术; 外科并发症; 危险因素
近年来,腹腔镜技术由于创伤小、术后疼痛轻、术后恢复快及并发症少等优点,在胃癌中的应用越来越多[1,2]。在关注腹腔镜胃癌根治术手术远期疗效的同时,应非常重视手术的安全性[3]。尽管外科技术的进步和手术器械的发展提高了手术安全性,但术后外科并发症仍是人们关注的重要问题。腹腔镜胃癌根治性全胃切除术由于手术难度较大,相关报道较少,术后外科并发症发生率为7.0%~38.9%[4~6]。如果能了解外科并发症发生的危险因素,采取相适应的围术期干预措施,将有助于减少术后外科并发症的发生。但由于对术后外科并发症的分级方法不尽相同,导致对腹腔镜胃癌根治性全胃切除术后外科并发症影响因素的研究存在一定的差异。本研究采用回顾性分析,通过应用Clavien-Dindo分级系统[7]探讨281例腹腔镜胃癌根治性全胃切除术后外科并发症的发生情况及相关危险因素。
1 临床资料与方法
1.1 一般资料
本组281例,男227例,女54例。年龄(62.2±10.7)岁。BMI 22.1±2.7。肿瘤位于胃上部153例,中部128例。肿瘤大小≥50 mm 146例,<50 mm 135例。血红蛋白(123±24)g/L;白蛋白(38.3±5.1)g/L。术前合并症80例,其中1~2种合并症59例,2种以上合并症21例。有腹腔手术史42例。
我科对胃上部癌常规实施全胃切除术,以减少术后食管反流,提高生活质量[8],病例选择标准:①术前胃镜证实为胃中上部腺癌;②术前检查无肿瘤直接侵犯胰周围脏器;③未发现远处转移;④术中施行根治性全胃切除和规范的胃周淋巴结清扫;⑤术后病理学诊断为R0切除。剔除标准:①T4b期肿瘤、术中见肿瘤腹腔播散或远处转移;②腹腔镜手术中转开腹手术者;③病理学诊断资料不全者。
1.2 方法
气管插管全身麻醉,分腿仰卧位。术者站于患者左侧,助手站于患者右侧,扶镜者站于患者两腿之间。采用五孔法。气腹建立后,维持腹内压12~15 mm Hg(1 mm Hg=0.133 kPa)。根据日本第14版《胃癌处理规约》进行全胃切除术联合胃周淋巴结清扫,其中进展期患者常规行D2淋巴结清扫,早期、术前存在手术高风险指征的胃癌患者行D1+淋巴结清扫术[9]。消化道重建方式采用食管空肠Roux-en-Y吻合术。
1.3 变量和定义
术后外科并发症主要指术后出现的外科系统相关并发症,主要包括术后出血、吻合口漏、术后梗阻及腹腔感染等[10](术后出血:术后出现1 d内血红蛋白下降超过10 g/L,并具有呕血、黑便、腹腔引流管或胃管引出血性液体等表现中的任何一项或多项;吻合口漏:腹腔内容物通过引流管或手术部位流出,或者影像学发现[10];术后梗阻:影像资料显示机械梗阻部位及气液平面)。并发症分级根据Clavien-Dindo分级系统[7]。Ⅰ级:任何偏离正常的术后恢复过程,没有生命危险,不需要药物、介入治疗,但允许对症处理,如解热、镇痛、止吐、利尿、调节电解质、物理治疗;Ⅱ级:需要药物治疗,包括输血和全肠外营养;Ⅲ级:需要手术、内镜、影像学介入治疗,并根据是否需要全身麻醉分为Ⅲa级(不需要)和Ⅲb级(需要);Ⅳ级:威胁生命的并发症需要ICU管理,并根据单个或多个器官衰竭分为Ⅳa级(单个)和Ⅳb(多个)级;Ⅴ级:并发症死亡。当并发症不止一个时,以最严重的并发症分级。严重并发症指分级≥Ⅲa级。
Charlson合并症指数[11]是一项对基础疾病的积分性评分系统,评分为1的疾病包括脑血管疾病、慢性肺部疾病、心肌梗死、周围血管疾病、糖尿病等疾病;评分为2的疾病包括中重度肾病、糖尿病伴器官损害、肿瘤、白血病等疾病;评分为3的疾病有中重度肝脏疾病;评分为6的疾病包括艾滋病、转移性肿瘤。
本研究收集术后外科并发症潜在相关危险因素的数据,包括年龄、性别、BMI、腹部手术史、Charlson合并症指数[11]、术前血红蛋白水平、术前白蛋白水平、肿瘤部位、肿瘤大小、浸润深度、N分期、肿瘤分期、手术时间、术中出血量、D1+/D2清扫、淋巴结清扫数目、手术时期(以40例为腹腔镜根治性全胃切除术的学习曲线)[12]。
1.4 统计学处理
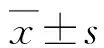
2 结果
2.1 术中及病理分期情况
手术时间(182.8±48.7)min,术中出血量中位数70.0ml(25~2520ml)。D1+淋巴结清扫56例,D2淋巴结清扫225例,淋巴结清扫数(29.4±14.7)枚。根据2010年第7版UICC分期标准进行TNM分期[13],Ⅰ期 66例,Ⅱ期 99例,Ⅲ期116例。
2.2 术后外科并发症发生情况
术后总并发症(外科和内科并发症)发生率15.7%(44/281),其中术后外科并发症29例,发生率10.3%(29/281)。Clavien-Dindo分级情况见表1。感染和吻合口有关并发症是最常见的外科并发症,严重外科并发症9例,发生率为3.2%,其中术后出血3例(1.1%)是最常见的严重外科并发症。3例(1.1%)进行了二次手术治疗,包括1例吻合口漏、1例粘连性肠梗阻、1例脾梗死。术后30d内死亡1例(0.4%),为脾梗死。

表1 术后外科并发症Clavien-Dindo分级
2.3 术后外科并发症影响因素的单因素分析
单因素分析显示7个因素有统计学差异,分别为年龄、BMI、肿瘤分化、肿瘤大小、浸润深度、手术时间和术中出血量,见表2。

表2 并发症影响因素的单因素分析
2.4 术后外科并发症影响因素的多因素分析
对有统计学差异的7个变量进行多因素分析,结果显示年龄(OR=2.671,P=0.024)、BMI (OR=4.970,P=0.006) 、肿瘤大小(OR=3.311,P=0.038)、浸润深度(OR=4.472,P=0.034)和术中出血量(OR=3.835,P=0.006)是外科并发症发生的独立危险因素,见表3。

表3 术后外科并发症的多因素分析
2.5 多因素模型预测术后外科并发症发生的受试者工作特征(reciever operating characteristic,ROC)曲线验证
多因素模型[Logit(P)=-7.687-0.983×年龄(≥65岁)-1.603×BMI(≥25)-1.498×浸润深度(≥T3)-1.197×肿瘤大小(≥50 mm)-1.344×术中出血量(≥100 ml)]预测术后外科并发症发生的ROC曲线下面积为0.784(0.695~0.873),见图 1。

图1 多因素模型预测术后外科并发症发生的ROC曲线
3 讨论
一些前瞻性的随机临床试验结果已经证实腹腔镜技术在治疗早期远端胃癌的重要价值[1,3]。随着腹腔镜胃癌根治手术经验的不断积累以及外科器械的进步,腹腔镜技术在中上部胃癌和进展期胃癌中的应用也越来越广泛。腹腔镜胃癌全胃切除术能够达到与传统开腹手术相当的根治性程度和淋巴结清扫范围,其在技术上的可行性已经得到证实[14,15]。由于胃周血供丰富、 解剖层次复杂、 脾门淋巴结清扫及消化道重建困难,因此,腹腔镜根治性全胃切除术技术难度较大,如何有效地提高腹腔镜手术的安全性, 一直是国内外学者所关注的热点问题。外科并发症的发生率是常用于衡量手术安全性的指标,但由于不同研究外科并发症的定义和分级标准不尽相同,不同学者报道的外科并发症发生率存在一定差异。有学者提出采用Clavien-Dindo分级系统来规范并发症的定义和分级[7]。该系统已成为目前评估并发症的严重程度和衡量手术安全性较为客观、可靠的工具[16]。因此,本研究采用Clavien-Dindo分级系统分析腹腔镜胃癌根治性全胃切除术后外科并发症的发生情况。腹腔镜胃癌根治性全胃切除术后外科并发症和严重外科并发症的发生率分别为7.0%~28.9%和2.4%~10.8%[4~6,17]。本研究术后外科并发症和严重并发症的发生率分别为10.3%(29/281)、3.2%(9/281)。韩国的一项大样本回顾性分析显示,胃癌术后外科并发症主要为:肠梗阻、腹腔出血、十二指肠残端漏、吻合口漏、腹腔感染等[18]。本研究中术后外科并发症以吻合口相关并发症及术后感染为主。
影响腹腔镜胃癌根治术后并发症发生的危险因素报道不一。Lin等[4]报道年龄、术前合并症和手术时间是影响腹腔镜根治性全胃切除术后并发症发生的独立危险因素。Jiang等[19]研究显示高BMI和术者经验不足会使术后并发症发生率显著增高。Kawamura等[20]认为ASA分级、术前化疗和术中出血量等因素是术后易发生并发症的重要因素。然而关于影响腹腔镜根治性全胃切除术后外科并发症发生的独立危险因素鲜有报道。本研究多因素分析结果显示,术后外科并发症发生的独立危险因素包括年龄(β=0.983)、BMI(β=1.603)、肿瘤大小(β=1.197)、浸润深度(β=1.498)和术中出血量(β=1.344)。应用ROC曲线分析logistic回归模型预测术后外科并发症发生的概率,以预测概率0.5为判别分界点,判对率为78.4%(ROC曲线下面积达到0.784)。中国胃肠外科研究组(CLASS)的研究表明腹腔镜手术对于老年(年龄>65岁)进展期胃癌患者是安全可行的[21],老年胃癌患者不应该作为腹腔镜手术的禁忌[22],但是老年患者身体重要脏器的生理功能及代偿储备功能都有所下降,且常伴有不同程度的基础疾病,耐受手术和麻醉的能力差,容易出现术后并发症甚至术后死亡[23],尤其是同时存在其他危险因素时,因此,对于这一特殊人群仍需高度重视。另外,BMI对腹腔镜根治性全胃切除术后外科并发症的发生具有重要影响。BMI通过对手术时间、术中出血量的影响直接或间接影响患者术后并发症发生率[24]。我们认为肥胖患者对腹腔镜手术视野和手术操作可造成一定影响,增加淋巴结清扫难度和手术时间,手术时间延长能间接增加术后轻微并发症的发生[25]。当肿瘤较大、浸润程度较深时,手术难度加大,手术时间延长,手术对患者的创伤增加,可导致术后外科并发症发生的增加。此外,由于术中出血需要额外的结扎、压迫止血,严重出血甚至导致血容量下降,这些均可导致组织供氧不足,增加感染风险[26,27]。
总之,对于存在术后外科并发症发生的危险因素,如年龄≥65岁、BMI≥25、肿瘤大小≥50 mm、浸润深度达固有肌层以上和术中出血量≥100 ml的患者,应加强围术期干预措施,以提高手术安全性。由于本研究为单中心回顾性研究,样本量较少,更可靠的结果有赖于多中心大样本的前瞻性试验的验证。
1 Kim YW, Baik YH, Yun YH, et al. Improved quality of life outcomes after laparoscopy-assisted distal gastrectomy for early gastric cancer: results of a prospective randomized clinical trial. Ann Surg,2008,248(5):721-727.
2 景化忠,刘宏斌.腹腔镜在进展期胃癌的应用现状.中国微创外科杂志,2014,14(7):662-663.
3 Kim HH, Hyung WJ, Cho GS, et al. Morbidity and mortality of laparoscopic gastrectomy versus open gastrectomy for gastric cancer: an interim report-a phase Ⅲ multicenter, prospective, randomized trial (KLASS Trial). Ann Surg,2010,251(3):417-420.
4 Lin JX, Huang CM, Zheng CH, et al. Evaluation of laparoscopic total gastrectomy for advanced gastric cancer: results of a comparison with laparoscopic distal gastrectomy. Surg Endosc,2016,30(5):1988-1998.
5 Lee JH, Ahn SH, Park DJ,et al. Laparoscopic total gastrectomy with D2 lymphadenectomy for advanced gastric cancer. World J Surg,2012,36(10):2394-2399.
6 Topal B, Leys E, Ectors N,et al. Determinants of complications and adequacy of surgical resection in laparoscopic versus open total gastrectomy for adenocarcinoma. Surg Endosc,2008,22(4):980-984.
7 Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg,2004,240(2):205-213.
8 卢 昕,孟庆彬,邵永胜.进展期近端胃癌近端胃与全胃切除的对比研究.中华普通外科杂志,2016,31(2):97-99.
9 Japanese Gastric Cancer, Association. Japanese gastric cancer treatment guidelines 2010 (ver. 3). Gastric Cancer,2011,14(2):113-123.
10 Jung MR, Park YK, Seon JW, et al. Definition and classification of complications of gastrectomy for gastric cancer based on the accordion severity grading system. World J Surg,2012,36(10):2400-2411.
11 Birim O, Kappetein AP, Bogers AJ. Charlson comorbidity index as a predictor of long-term outcome after surgery for non small cell lung cancer. Eur J Cardiothorac Surg,2005,28(5):759-762.
12 Lu J, Huang CM, Zheng CH, et al. Learning curve of laparoscopy spleen-preserving splenic hilar lymph node dissection for advanced upper gastric cancer. Hepatogastroenterology,2013,60(122):296-300.
13 Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol, 2010,17(6):1471-1474.
14 Nakata K, Nagai E, Ohuchida K, et al. Technical feasibility of laparoscopic total gastrectomy with splenectomy for gastric cancer: clinical short-term and long-term outcomes. Surg Endosc,2015,29(7): 1817-1822.
15 Jeong O, Jung MR, Kim GY, et al. Comparison of short-term surgical outcomes between laparoscopic and open total gastrectomy for gastric carcinoma: case-control study using propensity score matching method. J Am Coll Surg,2013,216(2):184-191.
16 Mazeh H, Samet Y, Abu-Wasel B, et al. Application of a novel severity grading system for surgical complications after colorectal resection. J Am Coll Surg,2009,208(3):355-361.
17 Lee JH, Nam BH, Ryu KW, et al. Comparison of outcomes after laparoscopy-assisted and open total gastrectomy for early gastric cancer. Br J Surg,2015,102(12):1500-1505.
18 Oh SJ, Choi WB, Song J, et al. Complications requiring reoperation after gastrectomy for gastric cancer: 17 years experience in a single institute. J Gastrointest Surg,2009,13(2):239-245.
19 Jiang X, Hiki N, Nunobe S, et al. Postoperative outcomes and complications after laparoscopy-assisted pylorus-preserving gastrectomy for early gastric cancer. Ann Surg,2011,253(5): 928-933.
20 Kawamura Y, Satoh S, Suda K, et al. Critical factors that influence the early outcome of laparoscopic total gastrectomy. Gastric Cancer,2015,18(3):662-668.
21 Yu J, Hu J, Huang C, et al. The impact of age and comorbidity on postoperative complications in patients with advanced gastric cancer after laparoscopic D2 gastrectomy: results from the Chinese laparoscropic gastrointestinal surgery study (CLASS) group. Eur J Surg Oncol,2013,39(5):1144-1149.
22 Hwang SH, Park DJ, Jee YS, et al. Risk factors for operative complications in elderly patients during laparoscopy-assisted gastrectomy. J Am Coll Surg,2009,208(2):186-192.
23 Takeshita H, Ichikawa D, Komatsu S, et al. Surgical outcomes of gastrectomy for elderly patients with gastric cancer. World J Surg,2013,37(12):2891-2898.
24 Makino H, Kunisaki C, Izumisawa Y, et al. Effect of obesity on laparoscopy-assisted distal gastrectomy compared with open distal gastrectomy for gastric cancer. J Surg Oncol,2010,102(2):141-147.
25 Kunisaki C, Makino H, Takagawa R, et al. Predictive factors for surgical complications of laparoscopy-assisted distal gastrectomy for gastric cancer. Surg Endosc,2009,23(9):2085-2093.
26 Hartmann M, Jonsson K, Zederfeldt B. Effect of tissue perfusion and oxygenation on accumulation of collagen in healing wounds. Randomized study in patients after major abdominal operations. Eur J Surg, 1992,158(10):521-526.
27 Esrig BC, Frazee L, Stephenson SF, et al. The predisposition to infection following hemorrhagic shock. Surg Gynecol Obstet,1977,144(6): 915-917.
(修回日期:2016-12-11)
(责任编辑:李贺琼)
Risk Factors Analysis and Clavien-Dindo Classification of Surgical Complications After Laparoscopic Total Gastrectomy for Gastric Cancer
ChenQiuxian,CaiLisheng,FangShunyong,etal.
DepartmentofGeneralSurgery,ZhangzhouAffiliatedHospitalofFujianMedicalUniversity,Zhangzhou363000,China
CaiLisheng,E-mail:cailisheng@medmail.com.cn
Objective To investigate risk factors and Clavien-Dindo classification of surgical complications after laparoscopic total gastrectomy (LTG). Methods Clinical data of 281 patients who underwent LTG for middle or upper gastric cancer in our hospital from January 2008 to December 2015 were collected. The surgical complications after LAG were analyzed according to the Clavien-Dindo classification, and risk factors of the postoperative surgical complications were evaluated by using the logistic regression model. Results Of the 281 patients, 29 (10.3%) had postoperative surgical complications, and 9 (3.2%) developed major surgical complications. According to the Clavien-Dindo classification of postoperative surgical complications, 3 patients (1.1%) were detected in grade Ⅰ, 17 (6.0%) in grade Ⅱ, 4 (1.4%) in grade Ⅲa, 2 (0.7%) in grade Ⅲb, 2 (0.7%) in grade Ⅳ and 1 (0.4%) in grade Ⅴ. The univariable analysis showed that age, BMI, operative time, intraoperative blood loss, tumor size, tumor grade and depth of tumor invasion were associated with an increased risk of surgical complications after LTG. A multivariate analysis showed that age (OR=2.671, 95%CI: 1.138-6.269,P=0.024), BMI (OR=4.970, 95%CI: 1.597-15.465,P=0.006), tumor size (OR=3.311, 95%CI: 1.068-10.260,P=0.038), depth of tumor invasion (OR=4.472, 95%CI: 1.120-17.862,P=0.034) and intraoperative blood loss (OR=3.835, 95%CI: 1.481-9.928,P=0.006) were identified as independent risk factors for postoperative surgical complications. The area under the ROC curve was 0.784 (0.695-0.873) for the logistic regression model for postoperative surgical complications. Conclusions Surgical complications after LTG are mainly in grade Ⅱ of Clavien-Dindo classification. Age ≥65 years, BMI ≥25, tumor size ≥50 mm, depth of tumor invasion ≥T3and intraoperative blood loss ≥100 ml are independent risk factors for postoperative surgical complications.
Gastric neoplasm; Laparoscopy; Total gastrectomy; Surgical complication; Risk factor
福建省医学创新课题(项目编号:2014-CXB-29)
A
1009-6604(2017)02-0120-06
10.3969/j.issn.1009-6604.2017.02.007
2016-06-27)
**通讯作者,E-mail:cailisheng@medmail.com.cn
