体外膜肺氧合在重症爆发性心肌炎患者中的应用
2017-02-22郑慧萍冯海波傅元豪宫一辰
郑慧萍 徐 敏 张 喆 冯海波 吴 松 傅元豪 宫一辰
(北京大学第三医院心外科,北京 100083)
·临床研究·
体外膜肺氧合在重症爆发性心肌炎患者中的应用
郑慧萍 徐 敏*张 喆 冯海波 吴 松 傅元豪 宫一辰
(北京大学第三医院心外科,北京 100083)
目的 探讨体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)在重症爆发性心肌炎(fulminant myocarditis,FM)中的应用价值。 方法 回顾性分析2014年2月~2015年7月使用ECMO支持治疗的FM 6例的临床资料。男3例,女3例,年龄(35.7±9.3)岁。均采用股动静脉插管置入静脉-动脉ECMO (veno-arterial ECMO, V-A ECMO)的方式。结果 ECMO辅助(213.0±83.8)h。5例成功脱离ECMO,其中4例生存出院,1例虽脱离ECMO,但死于多脏器功能衰竭;1例死于严重脓毒症。4例出院患者随访6、18、20、5个月,均存活,左心室射血分数(left ventricular ejection fraction,LVEF)分别为65%、66%、55%、71%。 结论 ECMO可应用于因重症爆发性心肌炎引起难治心源性休克和致命性心律失常患者。
体外膜肺氧合; 重症爆发性心肌炎
重症爆发性心肌炎(fulminant myocarditis,FM)虽然发生率低,仅占急性病毒性心肌炎的4.6%,但病情进展迅速,常在较短时间内出现严重心律失常、心源性休克和(或)心力衰竭,病死率高达50%~75%[1,2]。体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是一种有效的心肺支持手段,可为FM患者提供足够的氧供和有效的循环支持,心肺得到充分休息,为心肺功能恢复赢得时间[3,4]。2014年2月~2015年7月,对6例常规药物治疗不能有效逆转循环恶化的FM,我们应用ECMO作为首选的机械辅助治疗手段治疗,现将ECMO支持下治疗FM的结果和应用ECMO的初步经验报道如下。
1 临床资料与方法
1.1 一般资料
本组6例,男3例,女3例,年龄20~49岁,(35.7±9.3)岁。
例1,女,35岁,以低热、背痛、乏力3天,呼吸困难2天入院。查体:体温(T)36.7 ℃,呼吸(R)23次/min,血压(BP)98/70 mm Hg,右下肺可闻及散在湿性啰音,心率113次/min,心音低钝,可闻及奔马律。心电图示广泛导联ST段抬高(Ⅰ、Ⅱ、Ⅲ、AVF、AVL及V1~V6),心肌损伤标志物肌钙蛋白I(TnI)、肌酸激酶同工酶(CK-MB)明显升高[TnI 9.0 μg/L(正常值0.01~0.02 μg/L),CK-MB 97 U/L(正常值≤24 U/L)],超声心动图提示左室壁运动弥漫减低,左心室射血分数(left ventricular ejection fraction,LVEF)下降(40%),出现心衰症状,诊断FM,给予大剂量激素、丙种球蛋白、抗病毒、营养心肌细胞及抗心衰治疗。入院后反复出现窦性心动过速,心房纤颤,室性心动过速,Ⅲ度房室传导阻滞,内科抗心律失常药物如胺碘酮、利多卡因、艾司洛尔等控制不佳,应用大剂量血管活性药物[多巴胺5.0 μg/(kg·min),去甲肾上腺素0.3 μg/(kg·min)],血压不易维持在90/60 mm Hg以上,复查超声心动图提示左、右室壁运动弥漫减低,运动不协调,室壁回声增强,LVEF 30%,入院15小时出现逸搏心律,植入心内临时起搏器,可见起搏信号,无心室除极波(考虑心肌细胞水肿严重无法除极),心脏无机械活动,在持续胸外按压下行ECMO植入术。
例2,女,49岁,主因“背痛伴头晕3天”入院。查体:T 37.8 ℃,P 90次/min,R 18次/min,BP 95/60 mm Hg,心、肺、腹查体未见异常。血TnI 4.2 μg/L,CK-MB 108 U/L。心电图提示Ⅱ、Ⅲ、AVF、V1~V3及V3R~V5R导联ST抬高。超声心动图提示室壁节段性运动异常(左室下壁基底段-中段),右室壁运动减低,右房略大(右房面积15 cm2),右室略大(前后径22 mm),二尖瓣轻度反流,三尖瓣轻度反流,LVEF 30%。冠状动脉造影提示:左主干(LM)、前降支(LAD)、回旋支(LCX)及右冠状动脉(RCA)均大致正常。入院后13小时先后出现Ⅲ度房室传导阻滞,心室颤动和室性自主心律,给予胺碘酮、利多卡因、多巴胺、去甲肾上腺素等血管活性药物持续静脉泵入,持续为室性自主心律,血压仍难以维持,FM诊断明确,在大剂量激素、丙种球蛋白、抗病毒、营养心肌细胞、补液、升压、镇静治疗及临时起搏治疗同时行ECMO植入术。
例3,男,20岁,主因“胸闷,心慌7天”入院。入院前2周有“上呼吸道感染”病史。咳粉红色泡沫痰。查体:T 37.7 ℃,R 28次/min,BP 86/52 mm Hg,双中下肺可闻及多量湿性啰音,心率120次/min,心音低钝,可闻及奔马律。气管插管接呼吸机辅助呼吸,持续泵入大剂量血管活性药物[多巴胺10.0 μg/(kg·min),多巴酚丁胺10 μg/(kg·min),去甲肾上腺素0.5 μg/(kg·min),肾上腺素0.3 μg/(kg·min)],血压持续低于90/60 mm Hg。血TnI 1.8 μg/L,CK-MB 49 U/L。心电图示窦性心动过速。超声心动图提示左室壁弥漫性运动减低,二尖瓣中度反流,三尖瓣轻度反流,LVEF 18%。入院诊断:FM,低心排血量综合征。紧急安置ECMO。
例4,男,35岁,主因“心前区不适1天”入院。入院前2周有“上呼吸道感染”病史。查体:T 36.5 ℃,R 23次/min,BP 124/62 mm Hg。血TnI 8 μg/L,CK-MB 79 U/L。心电图示Ⅱ、Ⅲ、AVF、V1~V3及V7~V9导联ST抬高。超声心动图示左室壁弥漫性运动减低,二尖瓣中度反流,LVEF 20%。冠状动脉造影示LM、LAD、LCX及RCA均大致正常。入院后频繁发作室性心动过速,给予胺碘酮、利多卡因等药物抗心律失常及多次电复律,多次出现低血压,间段给予多巴胺、肾上腺素静脉冲入,诊断FM,在内科治疗基础上行ECMO辅助治疗。
例5,女,38岁,主因“呼吸困难1天”入院。查体:端坐呼吸,T 38.8 ℃,P 112次/min,R 32次/min,BP 95/58 mm Hg,脉搏氧饱和度88%,双下肺可闻及较多干湿啰音。入院前1个月有“上呼吸道感染”病史,外院给予“头孢类抗生素”治疗。血TnI 6 μg/L,CK-MB 47 U/L。心电图示Ⅱ、Ⅲ、AVF导联ST抬高。初步诊断重症肺炎。给予气管插管、抗感染治疗。入院后频繁发作室性心动过速,给予胺碘酮、利多卡因等药物抗心律失常及多次电复律,考虑FM,行ECMO辅助治疗。
例6,男,37岁,主因“间断胸痛、胸闷18小时”入院。查体:T 36.5 ℃,R 26次/min,BP 96/62 mm Hg,心、肺、腹查体未见异常。血TnI 7.8 μg/L,CK-MB 49 U/L。心电图示窦性心动过速,完全性右束支传导阻滞。超声心动图示左室壁弥漫性运动减低,二尖瓣轻度反流,LVEF 22%。冠状动脉造影示LM、LAD、LCX及RCA均大致正常。入院后出现意识淡漠,窦性心动过速,血压低至70/30 mm Hg,存在早期心源性休克,TnI、CK-MB进行性升高,心电图QRS波迅速增宽,考虑心肌水肿、室内传导阻滞进行性加重,诊断FM,低心排血量综合征。紧急安置ECMO。
6例ECMO治疗前一般资料及主要化验见表1、2。
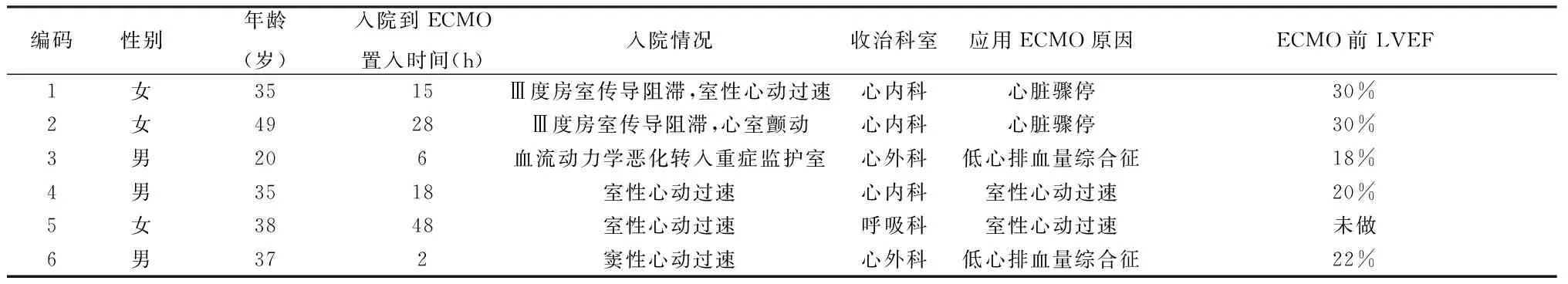
表1 ECMO治疗前一般资料
LVEF:左室射血分数

表2 ECMO治疗前血液化验结果
WBC:白细胞,正常值(3.5~9.5)×109/L;BUN:血尿素氮,正常值2.5~5.5 mmol/L;Cr:肌酐,正常值53~130 mmol/L;ALT:丙氨酸氨基转移酶,正常值5~40 U/L;AST:天冬氨酸氨基转移酶,正常值8~40 U/L;T-Bil:总胆红素,正常值3.4~23.3 μmol/L;NT-proBNP:N末端B型利钠肽前体,正常值0~125 ng/L;TnI:肌钙蛋白I,正常值0.01~0.02 μg/L;CK-MB:肌酸激酶同工酶,正常值≤24 U/L
FM的临床诊断标准[1,2,5]:(1)30天内呼吸道感染或胃肠道感染的证据。(2)心电图改变:①窦性心动过速、房室传导阻滞、窦房阻滞或束支阻滞;②多源的成对室性早搏,自主性房性和交界性心动过速,阵发性或非阵发性室性心动过速,心房或心室扑动或颤动;③两个以上导联ST段呈水平型或下斜型下移大于0.05 mV,或ST段异常抬高,或出现异常Q波。(3)病程中血清肌钙蛋白I或肌钙蛋白T、CK-MB明显升高。(4)感染证据,如体温>38 ℃,白细胞和C反应蛋白水平升高。(5)冠脉CT成像或冠脉造影排除冠脉病变。(6)心源性休克。(7)严重血流动力动力学异常需要大剂量升压药或机械辅助装置。参考以上7个方面综合考虑。
ECMO应用指征:①药物、主动脉内球囊反搏(intra-aortic balloon pump,IABP)不能控制的心源性休克;②心脏骤停;③低心排血量综合征;④严重心律失常。
低心排血量综合征诊断标准[6]:①收缩压下降超过术前基础血压20%,持续2小时或以上;②尿量<0.5 ml/(kg·h),持续2小时或以上;③中心静脉压>13 mm Hg,持续2小时或以上;④中心体温与体表体温之差>5 ℃,持续2小时或以上,导致四肢发凉;⑤心脏指数(CI)<2.5 L/(m2·min)。发生上述2项或2项以上事件时诊断为低心排血量综合征。
1.2 方法
1.2.1 ECMO安置 均在床旁经皮穿刺经股动静脉插管行静脉-动脉ECMO(veno-arterial ECMO,V-A ECMO)。V-A ECMO装置包括一个离心泵,一个中空纤维膜式氧合器和一套肝素涂层管道(德国Jostra Medizintechnik AG公司,Maquet,BE-PLS 2050)。ECMO放置技术:切开右腹股沟部,暴露股静脉和股动脉,使用5-0 Prolene线预置荷包缝线,使用直视穿刺技术,行肝素涂层动静脉管道皮下置入,充分止血后逐层缝合。股动脉和股静脉插管根据患者体重和术中全流量要求进行选择,股动脉采用15Fr、长度18 cm插管(美国Medtronic公司,CB96570),股静脉采用17~19Fr、长度50 cm插管(美国Medtronic公司,CB96670)。股动脉插管深度为插管侧孔后5~8 cm,股静脉插管深度为插管侧孔后30~40 cm。ECMO管道预充液采用生理盐水1000 ml,重力排气后再使用离心泵排气,然后将管道和置管进行连接。
1.2.2 ECMO管理 参照体外膜肺氧合循环支持专家共识[7]。
1.2.2.1 ECMO转速和流量 动、静脉插管与动、静脉管道连接完成后,台上、台下分别检查核对管道,确保无误后,先打开静脉管道钳,启动ECMO泵至转数在1500 r/min以上,再打开动脉管道钳(以防止血液逆流),ECMO开始运转。ECMO早期流量2.5~3.0 L/min,氧流量按通气血流比值0.8~1.0调整,并根据血气结果适当微调,偿还氧债后,流量调整为1.8~2.3 L/(min·m2)。
1.2.2.2 血流动力学管理 ECMO期间血压可偏低,特别是在ECMO初期,成人平均动脉压维持在60~80 mm Hg,中心静脉压6~10 mm Hg,混合静脉血氧饱和度>60%,脉搏氧饱和度>95%。乳酸<2 mmol/L或呈下降趋势提示组织灌注良好。每日复查超声心动图结合血流动力学指标判断心功能及液体负荷情况。机体液体负荷过高可用利尿剂增加尿量,也可用肾替代治疗加速液体排出。对于严重左心功能不全,经左房放置引流管,可有效降低左室前负荷,使左室得到充分休息。
1.2.2.3 药物调整 保留少量正性肌力药物(如多巴胺、多巴酚丁胺、肾上腺素、米力农)以避免心源性肺水肿。
1.2.2.4 抗凝管理 ECMO需全身肝素化,在股动静脉插管前给予50 U/kg肝素,ECMO安置术后,鱼精蛋白常规全量中和肝素。视有无活动性出血决定ECMO运转期间抗凝程度:有出血倾向者24小时内可不给肝素,无活动性出血者肝素持续静脉泵入,维持活化凝血时间(activated coagulation time,ACT)150~200 s。进入脱机状态时,随ECMO流速降低,适当增加肝素用量。
1.2.2.5 呼吸管理 保证呼吸通畅,避免肺泡萎陷,减少肺泡渗出,避免氧中毒。持续机械通气采用同步间歇指令通气模式,呼吸机参数在ECMO辅助后进行调整,降低呼吸频率(6~10次/min),将吸入氧浓度调整在30%~60%,呼气末正压(positive end expiratory pressure,PEEP)5~10 cm H2O,维持一定程度肺膨胀。
1.2.3 ECMO并发症的预防和处理
1.2.3.1 出血 出血应积极止血。渗血可通过检查各项凝血指标[ACT、APTT、血栓弹力图(TEG)、凝血因子等]发现问题,根据结果补充相应的凝血物质,适当应用止血药物可明显减轻渗血。ECMO转流中维持血球压积(hematocrit,HCT)在30%~33%,血红蛋白(hemoglobin,HGB)>100 g/L,血小板需维持在(50~70)×109/L以上,低于此水平应补充新鲜的血小板。
1.2.3.2 血液破坏 一般情况下ECMO期间溶血较轻,如果溶血严重,出现血红蛋白尿,应适当碱化尿液,促进游离血红蛋白的排除,保护肾功能,严重者应更换ECMO系统。
1.2.3.3 肢体并发症 对于股动脉插管患者,插管部位远端肢体缺血是常见的并发症。为了避免发生,可采用以下方法:①比较观察双侧肢体情况,如温度、颜色、周径等;②用适当的灌注管建立远端灌注;③从肢体远端的灌注管泵入肝素,减少血栓发生。
1.2.3.4 预防感染 严格执行无菌操作,防止血行性感染。常规给广谱抗生素预防感染,每日复查血常规、胸片及痰培养,必要时留取其他体液培养,并根据结果及时调整抗感染方案。
1.2.4 ECMO撤除指征 根据动脉血气、混合静脉血氧、胸片、超声心动等检查及临床评估情况决定ECMO撤离时机。撤机策略:逐步减低ECMO流量,当流量降至1.0 L/min,不用或仅用小剂量血管活性药物能维持血流动力学稳定,平均动脉压>60 mm Hg,LVEF>35%,肺毛细血管楔压10~15 mm Hg,混合静脉血氧饱和度>70%,可考虑撤离ECMO。
1.3 观察和随访指标
1.3.1 住院期间 院内死亡,ECMO使用时间,留置气管插管时间,ECMO并发症(出血、溶血、血栓栓塞、下肢缺血、神经系统并发症、急性肾损伤及感染等)。
出血的诊断标准:穿刺部位、腹膜后或胃肠道等部位出血且需要额外输血。
血栓栓塞:血液循环中任何一处心腔、动脉或静脉血栓形成和栓塞。
下肢缺血:麻木,酸胀,疼痛,肢体皮温低,脉搏减退或消失,肢端发黑,溃烂等。
神经系统并发症:脑出血,脑栓塞,癫痫及其他神经系统并发症。
急性肾损伤(acute kidney injury,AKI)的诊断根据改善全球肾脏病预后组织(KDIGO)发布的《KDIGO急性肾损伤临床实践指南》[8],符合下列情形之一者即可定义为AKI:①在48 h内血清肌酐(SCr)上升≥26.5 mmol/L;②已知或假定肾功能损害发生在7 d之内,SCr上升至≥基础值的1.5倍;③尿量<0.5 ml/(kg·h),持续6 h。
1.3.2 随访 出院病人采取门诊随访方式,第1年每3个月随访一次,以后每半年随访一次,复查超声心动图。随访截止日期2015年8月。
2 结果
6例ECMO辅助时间(213.0±83.8)h。5例顺利撤除ECMO,其中4例撤除ECMO后心功能恢复正常,LVEF 57%、66%、55%、71%。输入红细胞(29.2±12.9)U,新鲜冰冻血浆(20.2±14.8)U,血小板(10.0±6.6)U。ECMO同时置入IABP 1例(例5)。具体见表3。
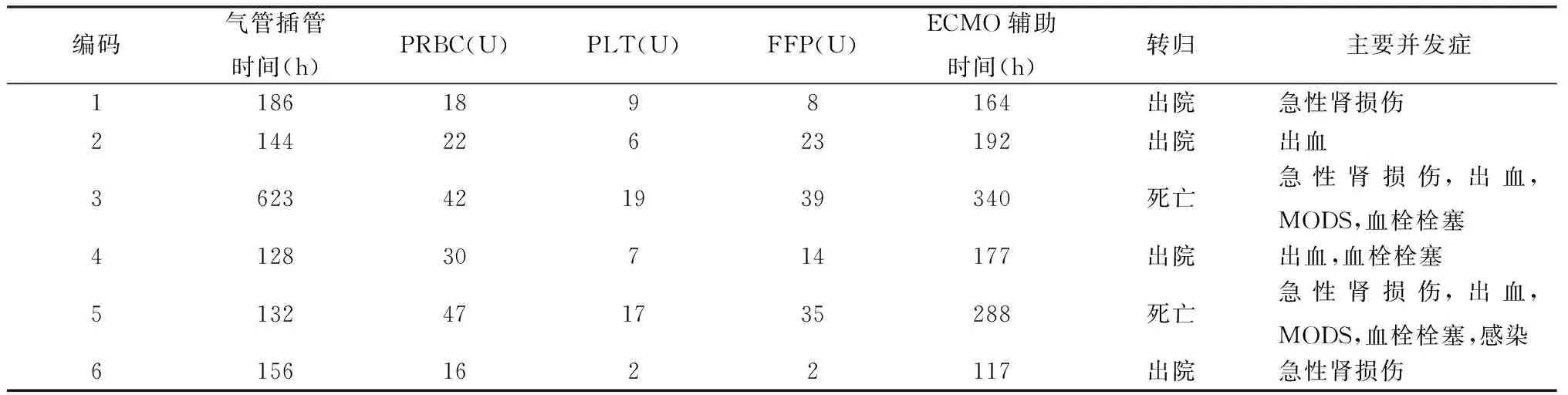
表3 ECMO辅助期间各项指标
PRBC:红细胞悬液(packed red blood cell);PLT:血小板(blood platelet);FFP:新鲜冰冻血浆(fresh frozen plasma);MODS:多器官功能障碍综合征(multiple organ dysfunction syndrome)
4例抢救成功:例1入院后心电图显示心室内传导阻滞进行性加重,出现持续性室性心动过速,给予胺碘酮、利多卡因等药物抗心律失常及多次电复律无效,出现意识丧失,心源性休克,床旁持续胸外按压过程中,股动静脉切开直视下置入ECMO,其后血流动力学逐渐趋于稳定,ECMO术后第2天恢复自主意识,第3天恢复自主循环,ECMO运行164 h后撤除。例2入院后多次心室颤动,房室传导阻滞,床旁置入ECMO后心律失常明显减少,ECMO运行192 h后撤除;例4入院后频繁发作室性心动过速,给予胺碘酮、利多卡因等药物抗心律失常及多次电复律控制不良,置入ECMO后心律失常明显减少,ECMO运行177 h后成功撤除;例6入院即表现为心源性休克,多巴胺12 μg/(kg·min),肾上腺素0.2 μg/(kg·min),去甲肾上腺素0.2 μg/(kg·min),血压持续低于90/60 mm Hg,置入ECMO后血压上升,正性肌力药物逐渐减停,ECMO运行117 h后撤除。
2例死亡:例5在成功撤除ECMO后37天死于脓毒血症;例3在ECMO辅助情况下,血流动力学趋于稳定,多巴胺减至6 μg/(kg·min),ECMO辅助173 h后撤除,但因持续低心排血量综合征,在撤除ECMO 1周后再次置入,后因多器官功能衰竭,家属放弃治疗死亡。
ECMO主要并发症:出血4例(例2、3、4、5),其中例2消化系统、手术伤口多处出血;急性肾损伤4例(例1、3、5、6),其中2例(例3、6)需要床边连续血液滤过维持内环境稳定,例1、例6存活出院,肾功能均恢复;ECMO插管部位感染1例(例5),撤除ECMO后给予清创缝合,持续血源性感染,死于脓毒血症;ECMO置入侧肢体静脉血栓2例(例3、5),动脉血栓1例(例4),均手术切开取栓。
4例出院患者门诊随访6、18、20、5个月,均恢复正常的工作生活,LVEF分别为65%、66%、55%、71%。
3 讨论
FM诊断早期及时给予有效的维持血流动力学手段(如机械循环辅助),心功能有完全恢复的可能[5,6,8,9]。ECMO适用于心肺功能在短期内有恢复可能的患者,其原理是将血液从体内引流到体外,经膜式氧合器(膜肺)氧合后再经泵将血液注入体内,可以暂时代替心脏的泵功能和肺的氧合功能,保证机体有充分的循环灌注与氧供,从而使心肺获得休息而得到功能恢复,为心源性休克患者短期内提供心肺功能支持。本组6例FM采取ECMO辅助循环,4例存活出院,并且心功能完全恢复,取得较好的效果。
本组6例因为存在心源性休克和严重心律失常,均在床旁安置V-A ECMO。V-A ECMO可以减轻心脏的前负荷,但同时增加心脏的后负荷,导致室壁张力增加,从而使冠脉灌注降低,增加了心肌氧耗[10,11]。IABP正好可以弥补这方面的不足。IABP的工作原理是通过主动脉内球囊与心动周期同步地充放气,提高心肌氧供,减少心肌氧耗,即舒张期球囊充气,增加冠脉灌注,进而增加心肌氧的供应,收缩期球囊放气,减少了心脏的后负荷,心脏做功减少,从而减少心肌对氧的需求,增加冠脉灌注[12,13]。但是目前关于FM合并心源性休克病人IABP和ECMO联用的效果研究较少。本组仅有1例死亡患者(例5)应用IABP,IABP在ECMO患者中的应用效果还需要进一步数据证实。
FM患者一旦出现循环衰竭,很快就可进展合并肺、肝、肾功能衰竭,即使应用ECMO挽救了心肺功能,这些并发症仍极有可能导致最终治疗失败,患者死亡或残留严重后遗症。因此掌握适当的时机及时开始ECMO辅助是提高治疗成功率的关键[2]。目前ECMO置入的最佳时机和最佳辅助时间还没有定论,国内外还没有针对ECMO的应用指南。本组6例从入院到ECMO置入的时间间隔为(19.5±16.7)h,ECMO辅助时间(213.0±83.8)h。根据我们应用ECMO的经验,ECMO应用时间限定在7~10天合适。
ECMO的并发症中出血和栓塞最常见,以脑出血和缺血最为严重[14,15]。本组6例中4例发生出血和栓塞,但没有严重的颅内出血和栓塞。出血是机械辅助循环早期最常见的并发症,ECMO采用全身肝素化,出血不可避免,严重出血将危及患者生命。出血与手术或插管部位止血不彻底,全身肝素抗凝,体内凝血物质持续激活及消耗,血小板减少和功能降低以及插管或吸痰时损伤等因素有关[16,17]。ECMO应用期间应严密监测出血部位及出血量,及时处理:插管及手术切口部位小面积渗血,采取局部压迫,调整肝素用量或间断停止肝素输注,降低ACT,促进凝血,维持血小板计数,补充新鲜血小板、血浆和新鲜血,必要时输注凝血酶原复合物、纤维蛋白原等;胃肠道出血用冷生理盐水洗胃和用抗酸剂等。
本组2例ECMO置入侧肢体产生静脉血栓,1例动脉血栓,最终手术切开取栓。ECMO应用过程中,由于长时间辅助循环,导致大量血液成分破坏,或抗凝不充分,均可导致大量血栓形成,造成栓塞;同时,ECMO期间机体凝血功能发生很大变化,尽管ECMO期间有足够的ACT,循环管道中光镜检查仍可发现栓子,肾、肺、脑、冠状动脉内均可能有血栓。故ECMO应用过程中,栓塞并发症亦很常见。
以往的研究显示,ECMO患者AKI的发生率>70%[18,19]。本组4例发生AKI,其中2例需要连续血液滤过治疗,4例肾功能均恢复正常。Meyer等[20]认为ECMO应用过程中出现的AKI大部分是可逆的,93%的患者不需要连续血液滤过治疗。ECMO期间肾功能不全的原因目前尚不明了,可能与ECMO之前的低灌注、非搏动灌注、低血压、儿茶酚胺分泌增加、输入过多库血、溶血及全身炎症反应等因素有关。对于发生肾功能不全者,在积极进行肾替代治疗的同时,应快速查找病因并处理。对于接受ECMO辅助者,如果液体负荷过重、对利尿治疗反应差,及早进行肾脏替代治疗对改善预后有益。同时,ECMO辅助期间应尽可能减小正性肌力药物的剂量,以降低心肌氧耗并改善肾脏灌注。
随着ECMO设备的改进及ECMO管理技术的提高,ECMO应用期间的并发症可明显降低。由有经验的专家置入ECMO插管,充分的手术准备和细致的围手术期管理可以使ECMO辅助治疗获得满意治疗效果,可以最大程度减少并发症。FM出院后患者的生存率和生活质量比较乐观[21,22]。本组4例出院患者随访5~20个月,超声心动提示LVEF 55%~71%,均恢复正常生活。
综上,ECMO可应用于因FM引起的难治性心源性休克和致命性心律失常患者。
1 Lieberman EB,Hutchins GM,Herskowitz A,et al.Clinicopathologic description of myocarditis.J Am Coll Cardiol,1991,18(7):1617-1626.
2 Baughman KL.Diagnosis of myocarditis: death of Dallas criteria.Circulation,2006,113(4):593-595.
3 Abrams D,Brodie D.Novel uses of extracorporeal membrane oxygenation in adults.Clin Chest Med,2015,36(3):373-384.
4 Rihal CS,Naidu SS,Givertz MM,et al.2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care (Endorsed by the American Heart Association,the Cardiological Society of India,and Sociedad Latino Americana de Cardiologia Intervencion;Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention).J Card Fail,2015,21(6):499-518.
5 Lorusso R,Centofanti P,Gelsomino S,et al.Venoarterial extracorporeal membrane oxygenation for acute fulminant myocarditis in adult patients:a 5-year multi-institutional experience. Ann Thorac Surg,2016,101(3):919-926.
6 Algarni KD,Maganti M,Yau TM.Predictors of low cardiac output syndrome after isolated coronary artery bypass surgery:trends over 20 years.Ann Thorac Surg,2011,92(5):1678-1684.
7 龙 村.体外膜肺氧合循环支持专家共识.中国体外循环杂志,2014,12(2):65-67.
8 Khwaja A.KDIGO clinical practice guidelines for acute kidney injury.Nephron Clin Pract,2012,120(4):c179-c184.
9 Narain S,Paparcuri G,Fuhrman TM,et al.Novel combination of impella and extra corporeal membrane oxygenation as a bridge to full recovery in fulminant myocarditis.Case Rep Crit Care,2012,2012:459296.
10 Tsuji Y,Heijman J,Nattel S,et al.Electrical storm:recent pathophysiological insights and therapeutic consequences.Basic Res Cardiol,2013,108(2):336.
11 Cheng A,Swartz MF,Massey HT,et al.Impella to unload the left ventricle during peripheral extracorporeal membrane oxygenation.ASAIO J,2013,59 (5):533-536.
12 郑慧萍,徐 敏,万 峰,等.主动脉内球囊反搏在高危冠状动脉旁路移植术患者中的应用.中国微创外科杂志,2015,15(10):868-871,875.
13 Hu W,Liu C,Chen L,et al.Combined intraaortic balloon counterpulsation and extracorporeal membrane oxygenation in 2 patients with fulminant myocarditis.Am J Emerg Med,2015,33(5):736.
14 Aubron C,Cheng AC,Pilcher D,et al.Factors associated with outcomes of patients on extracorporeal membrane oxygenation support:a 5-year cohort study.Crit Care,2013,17(2):R73.
15 Nakamura T,Ishida K,Taniguchi Y,et al.Prognosis of patients with fulminant myocarditis managed by peripheral venoarterial extracorporeal membranous oxygenation support:a retrospective single-center study.J Intensive Care,2015,3(1):5.
16 Schmid C,Philipp A,Hilker M,et al.Venovenous extracorporeal membrane oxygenation for acute lung failure in adults.J Heart Lung Transplant,2012,31(1):9-15.
17 Brodie D,Bacchetta M.Extracorporeal membrane oxygenation for ARDS in adults.N Engl J Med,2011,365(20):1905-1914.
18 Gadepalli SK,Selewski DT,Drongowski RA,et al.Acute kidney injury in congenital diaphragmatic hernia requiring extracorporeal life support:an insidious problem.J Pediatr Surg,2011,46(4):630-635.
19 Yan X,Jia S,Meng X,et al.Acute kidney injury in adult postcardiotomy patients with extracorporeal membrane oxygenation:evaluation of the RIFLE classification and the Acute Kidney Injury Network criteria.Eur J Cardiothorac Surg,2010,37(2):334-338.
20 Meyer RJ,Brophy PD,Bunchman TE,et al.Survival and renal function in pediatric patients following extracorporeal life support with hemofiltration.Pediatr Crit Care Med,2001,2(3):238-242.
21 Combes A,Leprince P,Luyt CE,et al.Outcomes and long-term quality-of-life of patients supported by extracorporeal membrane oxygenation for refractory cardiogenic shock.Crit Care Med,2008,36(5):1404-1411.
22 Cheng R,Hachamovitch R,Kittleson M,et al.Clinical outcomes in fulminant myocarditis requiring extracorporeal membrane oxygenation:a weighted meta-analysis of 170 patients.J Card Fail,2014,20(6):400-406.
(修回日期:2016-11-23)
(责任编辑:王惠群)
Extracorporeal Membranous Oxygenation for Fulminant Myocarditis
ZhengHuiping,XuMin,ZhangZhe,etal.
DepartmentofCardiacSurgery,PekingUniversityThirdHospital,Beijing100083,China
XuMin,E-mail:xxugr@sohu.com
Objective To evaluate effects and functional outcomes of extracorporeal membrane oxygenation (ECMO) for the treatment of fulminant myocarditis. Methods From February 2014 to July 2015, 6 patients (3 male and 3 female; mean age: 35.7±9.3 years old) with fulminant myocarditis were treated with femoral veno-arterial ECMO for refractory cardiogenic shock and life-threatening arrhythmia. Results The mean duration of ECMO was 213.0±83.8 hours. Five patients were successfully weaned from ECMO,include one patient died due to multi-organ failure. The other patient died due to severe sepsis. Four patients were discharged from the hospital, and survival at follow-up for 6, 18, 20, and 5 months, respectively. The left ventricular ejection fractions (LVEF) were 65%, 66%, 55%, and 71%, respectively. Conclusion We recommend ECMO in patients with fulminant myocarditis and refractory cardiogenic shock and life-threatening arrhythmia to facilitate myocardial recovery.
Extracorporeal membrane oxygenation; Fulminant myocarditis
,E-mail:xxugr@sohu.com
A
1009-6604(2017)02-0141-07
10.3969/j.issn.1009-6604.2017.02.011
2016-05-18)
