伴未破裂颅内动脉瘤的急性脑梗死患者静脉溶栓治疗安全性评价研究
2017-02-17耿玉荣柳英杰张云霞刘春红张惠丽
耿玉荣,柳英杰,张云霞,刘春红,王 宏,张惠丽*
·论著·
伴未破裂颅内动脉瘤的急性脑梗死患者静脉溶栓治疗安全性评价研究
耿玉荣1,柳英杰2,张云霞1,刘春红1,王 宏1,张惠丽1*
目的 评价在溶栓时间窗内,对伴未破裂颅内动脉瘤(UIAs)的急性脑梗死(ACI)患者行静脉溶栓治疗的安全性。方法 选取2010年1月—2015年12月在石河子大学医学院第一附属医院神经内科卒中单元接受静脉溶栓治疗的ACI患者245例,均接受重组组织型纤溶酶原激活剂阿替普酶(rt-PA)静脉溶栓治疗。溶栓后36 h内复查颅脑CT,36 h~7 d完成颅内血管评估。根据血管评估结果,将纳入患者分为无UIAs组(n=224)和UIAs组(n=21)。记录并比较两组患者溶栓前和溶栓7 d后的美国国立卫生研究院卒中量表(NIHSS)评分、溶栓90 d后的改良Rankin量表(mRS)分级,以及溶栓后的出血情况。 结果 共检出伴UIAs患者21例(8.6%),UIAs 25个,直径为2.0~8.0 mm,平均直径为(4.1±1.7)mm。两组患者性别、平均年龄、吸烟率、饮酒率、合并糖尿病发生率、合并高血压发生率、合并高脂血症发生率、合并心房颤动发生率、发病至溶栓时间,溶栓前BMI、收缩压、舒张压,溶栓次日空腹血糖(FPG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、三酰甘油(TG)、血小板计数、尿酸比较,差异均无统计学意义(P>0.05);UIAs组患者溶栓次日低密度脂蛋白(LDL)、同型半胱氨酸低于无UIAs组,差异有统计学意义(P<0.05)。溶栓前和溶栓7 d后,两组患者NIHSS评分比较,差异均无统计学意义(P>0.05);溶栓7 d后两组患者NIHSS评分均低于溶栓前,差异有统计学意义(P<0.05)。溶栓90 d后,两组患者mRS为0~2级发生率比较,差异无统计学意义(P>0.05)。两组患者溶栓后非症状性颅内出血(N-sICH)、症状性颅内出血(sICH)、蛛网膜下腔出血(SHA)发生率比较,差异均无统计学意义(P>0.05)。结论 对伴≤8.0 mm UIAs的ACI患者行静脉溶栓治疗可能不会增加患者的动脉瘤破裂出血风险,这为静脉溶栓患者的选择和判断提供了依据,但结果仍需大样本研究的证实。
脑梗死;颅内动脉瘤;血栓溶解疗法;安全性
耿玉荣,柳英杰,张云霞,等.伴未破裂颅内动脉瘤的急性脑梗死患者静脉溶栓治疗安全性评价研究[J].中国全科医学,2017,20(1):56-61.[www.chinagp.net]
GENG Y R,LIU Y J,ZHANG Y X,et al.Safety of intravenous thrombolysis in treating acute cerebral infarction patients combined with unruptured intracranial aneurysms[J].Chinese General Practice,2017,20(1):56-61.
急性脑梗死(ACI)患者采用重组组织型纤溶酶原激活剂阿替普酶(rt-PA)静脉溶栓治疗是较为有效的治疗方法之一,最为严重的并发症是症状性颅内出血(sICH),可明显增加溶栓患者的死亡率和病残率[1]。rt-PA可以改变血管的通透性和血管基膜的完整性[2],因此从理论上讲对伴未破裂颅内动脉瘤(UIAs)ACI患者进行溶栓治疗,可能会增加患者的sICH风险。2013年美国卒中协会(ASA)/美国心脏协会(AHA)的缺血性卒中管理指南中,明确将动脉瘤列为溶栓治疗的禁忌证[3];rt-PA说明书也将其纳入溶栓禁忌证。但受治疗时间窗和医院影像学检查条件的限制,大多数患者在使用rt-PA溶栓前仅接受颅脑CT平扫,而颅脑CT平扫的UIAs检出率并不高,故大多数患者在溶栓后行血管评估〔如数字减影血管造影技术(DSA)、非创伤性血管成像技术(CTA)、磁共振血管造影(MRA)〕时才会发现存在UIAs。临床实践发现,该类患者并未出现较高的出血风险和较差的预后,因此目前对伴UIAs的ACI患者行静脉溶栓治疗的安全性评价尚不统一[4-5]。本研究采用病例回顾的形式,对伴UIAs的ACI患者行静脉溶栓治疗的安全性进行分析,从而为临床上更好地积累经验、选择和判断溶栓治疗患者提供依据。
1 对象与方法
1.1 研究对象 选取2010年1月—2015年12月在石河子大学医学院第一附属医院神经内科卒中单元接受静脉溶栓治疗的ACI患者245例,均符合第四届全国脑血管病学术会议制订的脑梗死诊断标准[6]。纳入标准:(1)年龄>18岁;(2)卒中发病时间<4.5 h;(3)有明确神经功能缺损症状;(4)接受rt-PA静脉溶栓治
本文要点:
本文回顾性分析了245例行静脉溶栓治疗后急性脑梗死(ACI)患者的临床资料,其中伴未破裂颅内动脉瘤(UIAs)患者21例。对伴UIAs ACI患者的动脉瘤大小、形态及部位等进行了详细记录,未发现溶栓治疗后症状性动脉瘤性蛛网膜下腔出血病例,并得出对伴直径≤8.0 mm UIAs ACI患者行静脉溶栓治疗不会增加患者动脉瘤破裂出血风险的结论。该研究对伴UIAs ACI患者在治疗时间窗内行静脉溶栓治疗的安全性提供了理论依据,但缺乏长期随访情况。
疗(0.9 mg/kg),最大剂量不超过90 mg,年龄≥80岁者剂量为60 mg;(5)溶栓后36 h内复查颅脑CT,36 h~7 d完成颅内血管评估[3]。排除标准:既往有脑出血或蛛网膜下腔出血史。本研究通过了石河子大学医学院第一附属医院伦理委员会的批准,纳入患者均知情同意。
1.2 研究方法 根据溶栓后的血管评估结果,将纳入患者分为无UIAs组(n=224)和UIAs组(n=21)。
1.2.1 血管评估 采用DSA、CTA对纳入患者进行血管评估。(1)DSA:经股动脉采用Seldinger法穿刺插管;先行常规DSA检查,进行颈内动脉和椎动脉常规正、侧位造影,注射对比剂碘海醇,总量为8 ml,注射速度为4 ml/s;再行旋转3D-DSA检查,将C臂围绕人体头部纵轴旋转采集数据,并连续传输至三维工作站进行重建,影像采集频率为30 FPS,速度为40°/s,采集时间为5 s,注射对比剂总量为18 ml,注射速度为4 ml/s。(2)CTA:采用GE公司Light speed volume 64排多层螺旋CTA(MSCTA),以高压注射器经肘静脉注入非离子型对比剂60 ml,注射流率为3.0~3.5 ml/s,颈内动脉触发扫描;将扫描数据自动传输至后处理工作站(ADW 4.5版);原始图像三维后处理技术采用最大密度投影(MIP)和容积再现(VR)进行血管三维重建。
1.2.2 基本情况收集 通过查阅住院病历、影像学资料、门诊复诊资料等,收集患者的一般资料,包括性别、年龄、吸烟情况(以平均吸烟≥1支/d,持续1年以上为吸烟)、饮酒情况(以平均饮白酒≥50 g/次,≥3次/周,持续1年以上为饮酒)、合并症(糖尿病、高血压、高脂血症、心房颤动)、发病到溶栓时间;采用标准测量法,测量患者溶栓前的身高、体质量、血压,并计算BMI。
1.2.3 实验室指标检测 采集患者溶栓次日空腹8 h后的静脉血4 ml,采用日本OLYMPUS AU-2700全自动生化仪测定空腹血糖(FPG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL)、尿酸及同型半胱氨酸水平;采用希森美康XE-5000血液学自动分析仪测定血小板计数。
1.2.4 神经功能评价 (1)美国国立卫生研究院卒中量表(NIHSS):分别于入院溶栓前及溶栓7 d后,采用NIHSS对患者的神经功能进行评价。NIHSS包括意识水平、意识水平提问、意识水平指令、凝视、视野、面瘫、上肢运动、下肢运动、共济失调、感觉、语言、构音障碍、忽视症共13个条目,总分为0~42分,以<1分为趋于正常或正常、1~4分为轻度神经功能缺损、5~15 分为中度神经功能缺损、>15分为重度神经功能缺损[7]。(2)改良版Rankin量表(mRS)[8]:于溶栓90 d后,采用mRS对患者神经功能恢复状况进行评价。mRS分为0~5级及死亡,以0~2级为预后好、3级为预后一般,4~5级及死亡为预后差。
1.2.5 溶栓后出血情况判断 分别记录两组患者静脉溶栓后的非症状性颅内出血(N-sICH)、sICH(存在影像学ICH证据,且NIHSS评分增加≥4分)及蛛网膜下腔出血(SHA)情况。根据欧洲合作组急性脑卒中研究(ESASSⅡ)对溶栓后出血的定义,将其分为4类:(1)HI1,无空间占位效应,小的点状缺血;(2)HI2,无空间占位效应,融合的点状出血;(3)PH1,伴有轻度空间占位效应,出血≤30%的梗死面积;(4)PH2,伴轻度空间占位效应,出血>30%的梗死面积[9]。

2 结果
2.1 两组患者临床资料比较 两组患者性别、平均年龄、吸烟率、饮酒率、合并糖尿病发生率、合并高血压发生率、合并高脂血症发生率、合并心房颤动发生率、发病至溶栓时间,溶栓前BMI、收缩压、舒张压,溶栓次日FPG、HbA1c、TC、TG、血小板计数、尿酸比较,差异无统计学意义(P>0.05);溶栓次日LDL、同型半胱氨酸比较,差异有统计学意义(P<0.05,见表1、2)。
2.2UIAs组患者UIAs检出及预后情况 21例(8.6%)UIAs患者,共检出UIAs25个。其中,15个(60.0%)为囊状动脉瘤,6个(24.0%)为梭形动脉瘤,2个(8.0%)为舟状动脉瘤,2个(8.0%)为不规则动脉瘤,3例患者存在2种UIAs。UIAs的直径为2.0~8.0mm,平均直径为(4.1±1.7)mm,7个(28.0%)UIAs的直径≥5.0mm(见表3)。
2.3 两组患者溶栓前后NIHSS评分及溶栓后mRS分级比较 溶栓前和溶栓7d后,两组患者NIHSS评分比较,差异均无统计学意义(P>0.05);溶栓7d后两组患者NIHSS评分与溶栓前比较,差异均有统计学意义(P<0.05)。溶栓90d后,两组患者mRS为0~2级发生率比较,差异无统计学意义(P>0.05,见表4)。
2.4 两组患者溶栓后出血情况比较 两组患者溶栓后N-sICH、sICH、SHA发生率比较,差异均无统计学意义(P>0.05,见表5)。
3 讨论
UIAs在全球成年人群(平均年龄为50岁)中的患病率约为3.2%,但其中仅0.25%~0.50%会发生破裂[10]。静脉溶栓是否会增加动脉瘤破裂风险尚不明确,但将伴UIAs的ACI患者全部列入溶栓禁忌人群,可能会导致该部分患者得不到充分治疗。本研究回顾性分析了245例接受溶栓治疗ACI患者的临床资料,共检出伴UIAs患者21例,检出率为8.6%。OH等[11]的研究结果显示,ACI患者的UIAs检出率为6.6%,而一般人群的检出率为2.0%,两者的检出率均较高。也有研究结果显示,ACI和UIAs的发生可能有共同危险因素,如高血压、高脂血症、吸烟[12]。
本研究中,溶栓前和溶栓后7d,UIAs组和无UIAs组患者的NIHSS评分间无差异;溶栓后90d两组患者的mRS分级为0~2级的患者比例间无差异,提示对伴UIAs的ACI患者行静脉rt-pA溶栓治疗同样获益。MITTAL等[13]对105例于2002年3月—2011年6月在梅奥诊所行静脉溶栓治疗的ACI患者的临床资料进行回顾性分析,共发现10例患者共12个囊状UIAs,而该10例将患者在住院期间并未发生SHA,且sICH发生率和90d预后情况与未伴UIAs组患者无差异。
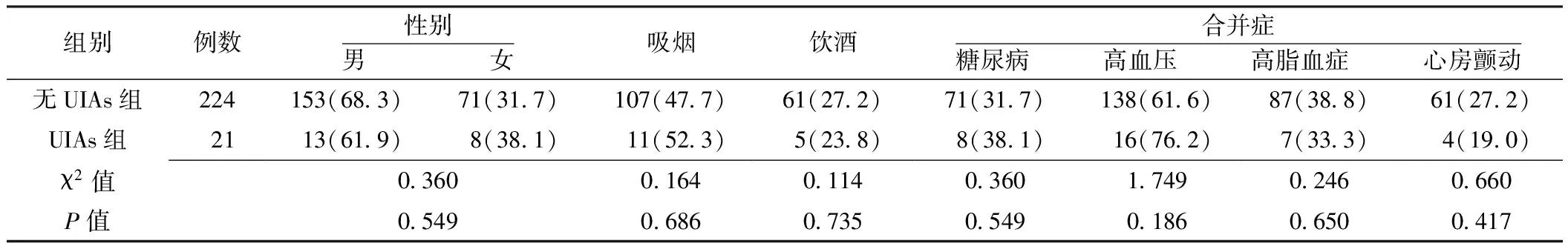
表1 两组患者临床资料比较〔计数资料,n(%)〕
注:UIAs=未破裂颅内动脉瘤
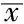
表2 两组患者临床资料比较(计量资料,±s)
注:FPG=空腹血糖,HbA1c=糖化血红蛋白,TC=总胆固醇,TG=三酰甘油,LDL=低密度脂蛋白;1 mm Hg=0.133 kPa
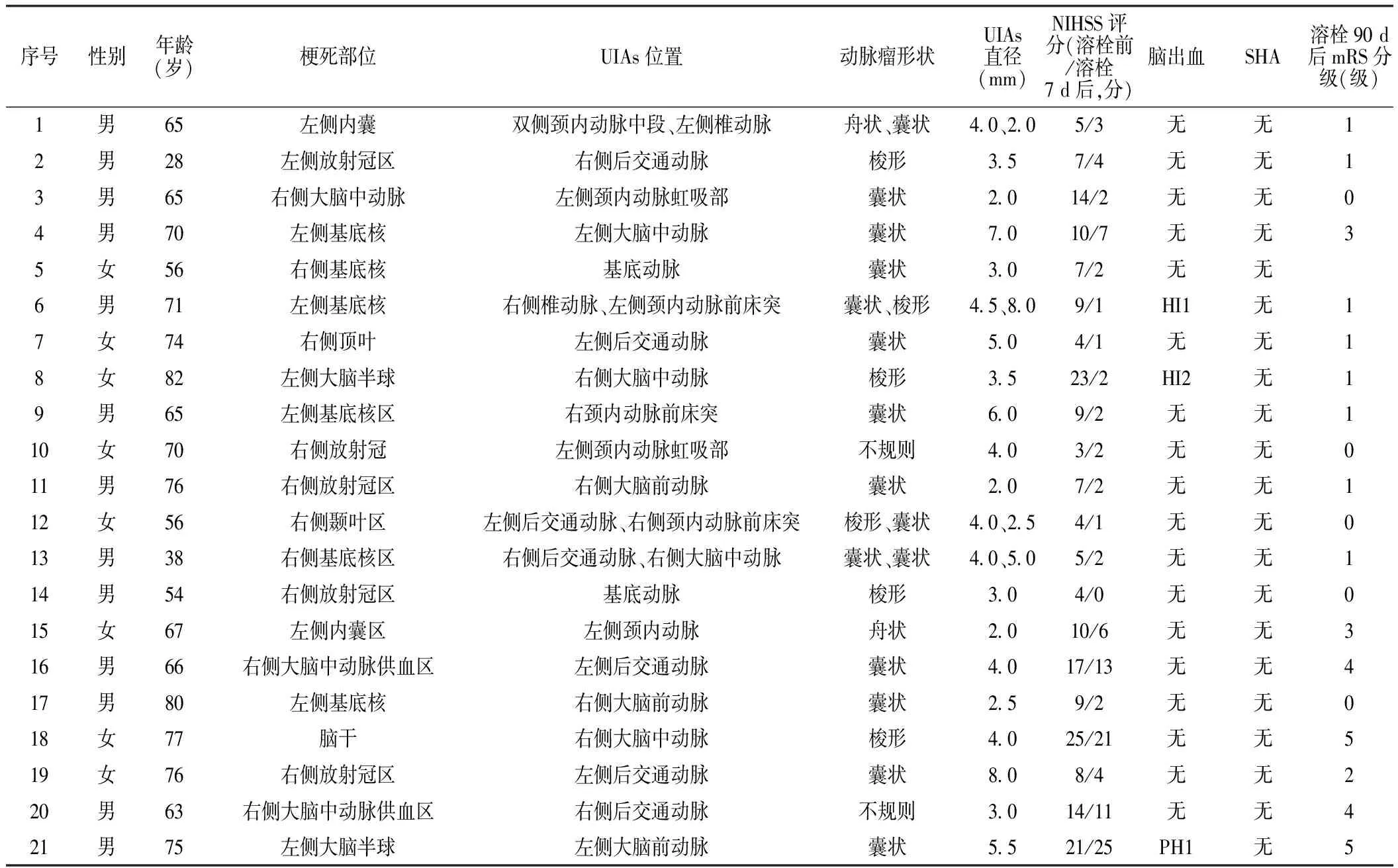
表3 UIAs组患者UIAs检出及预后情况
注:NIHSS=美国国立卫生研究院卒中量表,SHA=蛛网膜下腔出血,mRS=改良版Rankin量表
表4 两组患者溶栓前后NIHSS评分及溶栓后mRS分级比较
Table 4 Comparison of NIHSS score and mRS grading of patients between two groups before and after thrombolysis
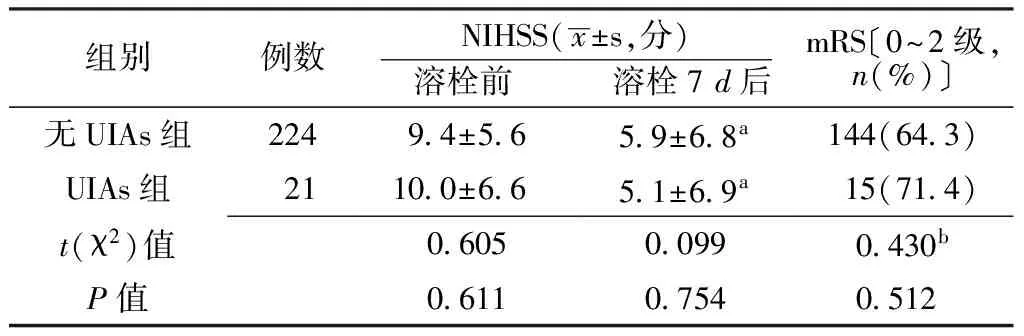
组别例数NIHSS(x±s,分) 溶栓前 溶栓7d后mRS〔0~2级,n(%)〕无UIAs组22494±5659±68a144(643)UIAs组21100±6651±69a15(714)t(χ2)值060500990430bP值061107540512
注:与溶栓前比较,aP<0.05;b为χ2值
表5 两组患者溶栓后出血情况比较〔n(%)〕
Table 5 Comparison of intracranial hemorrhage of patients between two groups

组别例数N⁃sICHsICHSHA无UIAs组22417(76)7(31)3(13)UIAs组212(95)1(48)0χ2值0012--P值091305171000
注:N-sICH=非症状性颅内出血,sICH=症状性颅内出血;-代表采用Fisher确切概率法
本研究纳入患者所携带UIAs的直径为2.0~8.0 mm。既往研究结果显示,约92.0%伴UIAs患者的UIAs直径<10.0 mm[14]。国际未破颅内动脉瘤研究(internation study of unruptured intracanial aneurysms,ISUIA)是关于UIAs自然病史、破裂风险及管理策略的一项大规模多中心临床研究,其前瞻性研究共纳入1 692例伴UIAs患者,结果显示为7.0~12.0 mm UIAs的破裂风险为1.2%,>25.0 mm的为8.6%,而<7.0 mm的则非常低[10]。目前,UIAs直径的易破裂临界值尚无定论,被广泛接受的阈值为7.0 mm。ZHANG等[15]的研究结果也显示,对伴直径≤3.0 mm UIAs的急性缺血性中风患者行静脉溶栓治疗可能是安全有效的。
另外,两组患者溶栓后的N-sICH、sICH、SHA发生率间均无差异,表明伴≤8.0 mm UIAs的ACI患者行静脉溶栓治疗可能不会增加患者的动脉瘤破裂出血风险。KIM等[16]对194例行静脉溶栓治疗的ACI患者进行分析,发现溶栓后,伴UIAs的8例患者未出现SHA、发生sICH 3例,而186例未检出UIAs者发生SHA 2例,这与本研究结果相似。EDWARDS等[17]共纳入236例行静脉溶栓治疗的ACI患者,分为伴UIAs组22例和无UIAs组214例。溶栓后,UIAs组未发生sICH,1例发生SHA,但预后良好;无UIAs组10例发生ICH,5例发生sICH。二者SHA和sICH发生率无差异。HAJI等[18]报道了1例ACI患者的临床诊治经过,患者行rt-PA治疗后5 h发生严重SHA,但该患者有严重动脉粥样硬化史和肺癌手术史。近期的部分小样本研究结果显示,对伴UIAs的患者行溶栓治疗并不会增加患者的sICH风险[19-20]。NITIN等[21]在Neurolgy上发表的研究成果,收集了4个卒中中心4年间行静脉溶栓治疗ACI患者的前瞻性数据,样本量为1 398例,共检出伴UIAs患者42例,UIAs 48个,患者溶栓后的sICH发生率为2.4%,ICH发生率为7.1%。将该数据与其他5个研究的数据进行汇总分析,共包含伴UIAs的ACI患者120例,行静脉溶栓治疗后其sICH发生率为6.7%,与无UIAs患者的sICH发生率间无差异。
综上所述,对伴直径≤8.0 mm UIAs的ACI患者行静脉溶栓治疗,同样获益,且可能并不会增加患者的出血风险。但UIAs直径>13.0 mm,处于后交通动脉、基底动脉尖、前交通动脉,外形不规则,随诊逐渐增大,绝经期女性,既往血压控制不佳等患者,均属于破裂出血高危人群[22],故在选择静脉溶栓治疗时应尤为慎重。目前,对伴UIAs的ACI患者行静脉溶栓治疗安全性进行探讨的研究多为回顾性分析或个案报道。且本研究也存在一定的局限性,如:(1)部分患者行CTA或MRA进行血管评估,可能有直径<3.0 mm的UIAs未被检出;(2)仅回顾性分析了溶栓前未知伴UIAs患者的临床资料,未纳入经脑血管造影即检测到的巨大UIAs患者,这可能会造成潜在的资料偏倚。故研究结果尚有待进一步研究的证实。
作者贡献:耿玉荣进行文章的构思与设计,数据收集,统计学处理,撰写论文,对文章整体负责,监督管理;柳英杰进行研究的实施与可行性分析;张云霞进行结果的分析与解释;刘春红进行数据整理;王宏进行英文的修订;张惠丽进行论文的修订,负责文章的质量控制及审校。
本文无利益冲突。
[1]EMBERSON J,LEES K R,LYDEN P,et al.Effect of treatment delay,age,and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke:a meta-analysis of individual patient data from randomised trials[J].Lancet,2014,384(9958):1929-1935.
[2]DEL ZOPPO G J,VON KUMMER R,HAMANN G F.Ischaemic damage of brain microvessels:inherent risks for thrombolytic treatment in stroke[J].J Neurol Neurosurg Psychiatry,1998,65(1):1-9.
[3]JAUCH E C,SAVER J L,ADAMS H P J R,et al.Guidelines for the early management of patients with acute ischemic stroke:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2013,44(3):870-947.
[4]陈胡萍,曾宪荣.伴无症状颅内动脉瘤的急性脑梗死溶栓治疗概况分析[J].中华神经医学杂志,2015,14(5):535-537. CHEN H P,ZENG X R.Thrombolysis treatment in patients with acute cerebral infarction patients combined with asymptomatic aneurysm[J].Chinese Journal of Neuromedicine,2015,14(5):535-537.
[5]陈胡萍,曾宪荣,高椿,等.无症状颅内动脉瘤的急性脑梗死患者静脉溶栓治疗安全性的系统评价[J].中华神经科杂志,2014,47(9):643-647. CHEN H P,ZENG X R,GAO C,et al.The safety among acute ischemic stroke pafients with asymptomatic intracranial aneurysm after the administration of intravenous thrombolysis[J].Chin J Neurol,2014,47(9):643-647.
[6]王新德.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379-380. WANG X D.Points of diagnosis of cerebral vascular diseases[J].Chin J Neurol,1996,29(6):379-380.
[7]NAESS H,KURTZ M,THOMASSEN L,et al.Serial NIHSS scores in patients with acute cerebral infarction[J].Acta Neurologica Scandinavica,2016,133(6):415-420.
[8]MUIR K W,WEIR C J,MURRAY G D,et al.Comparison of neurolgical scales and scoring systems for acute stroke prognosis[J].Stroke,1996,27(10):1817-1820.
[9]SHADI Y,ANDREW E,JOSHUA Z,et al.Symptomatic intracerebral hemorrhage in acute ischemic stroke after thrombolysis with intravenous recombinant tissue plasminogen activator a review of natural history and treatment[J].JAMA Neurol,2014,71(9):1181-1185.
[10]GO A S,MOZAFFARIAN D,ROGER V L,et al.Executive summary:heart disease and stroke statistics——2014 update:a report from the American Heart Association[J].Circulation,2014,129(3):399-410.
[11]OH Y S,LEE S J,SHON Y M,et al.Incidental unruptured intracranial aneurysms in patients with acute ischemic stroke[J].Cerebrovasc Dis,2008,26(6):650-653.
[12]KOBAYASHI H,TSUJI T,ISHII H,et al.Diagnosis of unruptured asymptomatic cerebral aneurysms by magnetic resonance angiography[J].Clin Neurosei,1997,4(2):197-200.
[13]MITTAL M K,SECT R C,ZHANG Y,et al.Safety of intravenous thrombolysis in acute ischemic stroke patients with saccular intracranial aneurysms[J].Journal of Stroke and Cerebrovascular Diseases,2013,22(5):639-643.
[14]ISHIKAWA Y,HIRAYAMA T,NAKAMURA Y,et al.Incidental cerebral aneurysms in acute stroke patients:comparison of asymptomatic healthy controls[J].J Neurol Sci,2010,298(1/2):42-45.
[15]ZHANG C H,LI C,WANG Y X,et al.Efficacy and safety of intravenous thrombolysis for the treatment of acute ischemic stroke patients with saccular intracranial aneurysms of ≤3 mm[J].Cell Biochem Biophys,2015,72(3):889-893.
[16]KIM J T,PARK M S,YOON W,et al.The detection and management of incidental unruptured cerebral aneurysms in patients undergoing intravenous thrombolysis for acute ischemicstroke[J].Neuroimaging,2012,22(2):197-200.
[17]EDWARDS N J,KAMEL H,JOSEPHSON S A.The safety of intravenous thrombolysis for ischemic stroke in patients with pre-existing cerebral aneurysms:a case series and review of the literature[J].Stroke,2012,43(2):412-416.
[18]HAJI F,VAILADEL B,AVERY M,et al.Intracranial aneurysm rupture following intravenous for stroke[J].Can J Neurol Sci,2014,41(1):95-98.
[19]MOWLA A,SINGH K,MEHLA S,et al.Is acute reperfusion therapy safe in acute ischemic stroke patients who harbor unruptured intracranial aneurysm[J].International Journal of Stroke,2015,9:113-118.
[20]SHETH K N,SHAH N,MOROVATI T,et al.Intravenous rt-PA is not associated with increased risk of hemorrhage in patients with intracranial aneurysms[J].Neurocrit Care,2012,17(2):199-203.
[21]NITIN G,GEORGIOS T,RAMIN Z,et al.Systemic thrombolysis in acute ischemic stroke patients with unruptured intracranial aneurysms[J].Neurology,2015,85(17):1452-1458.
[22]张鑫,刘丽萍.颅内未破裂动脉瘤破裂危险因素及管理策略[J].中华医学杂志,2016,102(96):69-71. ZHANG X,LIU L P.Rupture risk and management strategies of unruptured intracranial aneurysms[J].National Medical Journal of China,2016,102(96):69-71.DOI:10.3760/cma.j.issn.1006-7876.2014.09.009.
(本文编辑:王凤微)
Safety of Intravenous Thrombolysis in Treating Acute Cerebral Infarction Patients Combined with Unruptured Intracranial Aneurysms
GENGYu-rong1,LIUYing-jie2,ZHANGYun-xia1,LIUChun-hong1,WANGHong1,ZHANGHui-li1*
1.DepartmentofNeurology,theFirstAffiliatedHospitaloftheMedicalCollege,ShiheziUniversity,Shihezi832000,China2.DepartmentofNeurologicalSurgery,CentralHospitalofChinaRailwayFirstGroupinHuaxian,Weinan714101,China
*Correspondingauthor:ZHANGHui-li,Professor,Mastersupervisor;E-mail:1428977685@qq.com
Objective To evaluate the safety of intravenous thrombolytic therapy in patients with acute cerebral infarction(ACI) combined with unruptured intracranial aneurysms(UIAs) in the thrombolysis time window.Methods A total of 245 patients with ACI who received intravenous thrombolysis therapy in the Stroke Unit of Department of Neurology of the First Affiliated Hospital of the Medical College,Shihezi University from January 2010 to December 2015 were enrolled.All subjects received intravenous thrombolytic therapy of recombinant tissue-type plasminogen activator alteplase(rt-PA).After thrombolysis,patients were reexamined with brain CT scan within 36 hours,and intracranial vascular assessment was completed between 36 hours and 7 days.All patients were divided into group without UIAs(n=224) and group with UIAs(n=21) according to their vascular assessment results.The National Institute of Health Stroke Scale(NIHSS) score of patients in two groups before thrombolysis and seven-day after thrombolysis,their modified Rankin Scale(mRS) grading after 90-day thrombolysis and bleeding condition after thrombolysis were recorded and compared.Results A total of 21 patients combined with UIAs(8.6%) were detected,and 25 UIAs,a diameter between 2.0 to 8.0 mm and an average diameter of(4.1±1.7) mm.There was no significant difference in gender,average age,smoking proportion,drinking proportion,and proportion of combining with diabetes,hypertension,hyperlipemia and atrial fibrillation,time from onset to thrombolysis,and BMI,systolic blood pressure and diastolic blood pressure before intravenous thrombolysis,the fasting blood glucose(FPG),glycosylated hemoglobin(HbA1c),total cholesterol(TC),triglyceride(TG),platelet count and serum uric acid in the day after thrombolysis of patients between two groups(P>0.05);the levels of low density lipoprotein(LDL) and homocysteine in the day after thrombolysis in group with UIAs were significantly lower than those in group without UIAs(P<0.05).Before and seven-day after thrombolysis,the NIHSS scores of the two groups were not significantly different(P>0.05);seven-day after thrombolysis,the NIHSS score of patients in the two groups was significantly lower than that before thrombolysis(P<0.05).After 90-day thrombolytic therapy,the proportion of patients with the mRS from 0 to 2 grade in the two groups was not significantly different(P>0.05).There was no significant difference in the incidence of non-symptomatic intracranial hemorrhage(N-sICH),symptomatic intracranial hemorrhage(sICH) and subarachnoid hemorrhage(SHA) of patients in the two groups after thrombolysis(P>0.05).Conclusion For ACI patients combined with UIAs that not larger than 8.0 mm,the intravenous thrombolysis therapy might not increase the rupture hemorrhage risk of aneurysms.This provides basis for the selection and judgment of patients with intravenous thrombolysis,but the results still need to be confirmed with studies on large samples.
Brain infarction;Intracranial aneurysm;Thrombolytic therapy;Security
国家自然科学基金资助项目(81160368)
R 743.33
A
10.3969/j.issn.1007-9572.2017.01.012
2016-07-04;
2016-12-02)
1.832000 新疆维吾尔自治区石河子市,石河子大学医学院第一附属医院神经内科
2.714101 陕西省渭南市华县中铁一局集团中心医院神经外科
*通信作者:张惠丽,教授,硕士生导师;E-mail:1428977685@qq.com
