代谢正常肥胖患者的代谢异常发生风险及影响因素研究
2017-02-17刘丹,万沁
刘 丹,万 沁
·论著·
代谢正常肥胖患者的代谢异常发生风险及影响因素研究
刘 丹,万 沁*
目的 了解代谢正常肥胖(MHO)患者的代谢异常发生风险,并探讨其影响因素。方法 于2011年4—8月,采用简单随机抽样法在泸州市抽取3个社区,在该3个社区的社区卫生服务中心中采用发放宣传册的方式招募自愿参加本研究的代谢正常居民1 374例。根据腹围,将纳入居民分为MHO组(n=286)和代谢正常非肥胖(MHNO)组(n=1 088)。采用标准化问卷收集居民的基本情况,并进行体格检查和实验室检测,随访3年,记录两组的代谢异常发生情况。结果 MHO组和MHNO组的代谢异常发病率分别为38.8%(111/286)、25.1%(273/1 088),MHO组高于MHNO组,差异有统计学意义〔OR(95%CI)=1.891(1.437,2.489),P<0.05〕。按性别分层,MHO组男性、女性代谢异常发病率均高于MHNO组,差异有统计学意义(P<0.05)。按年龄分层,MHO组40~55岁、56~70岁代谢异常发病率高于MHNO组,差异有统计学意义(P<0.05);而两组71~93岁代谢异常发病率比较,差异无统计学意义(P>0.05)。MHO组是否发生代谢异常患者性别、平均年龄、职业、吸烟、饮酒、腰围、臀围、收缩压、舒张压、谷氨酰转肽酶(GGT)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)比较,差异无统计学意义(P>0.05);MHO组发生代谢异常患者BMI、空腹血糖(FPG)、葡萄糖耐量试验(OGTT)2 h血糖、三酰甘油(TG)高于未发生者,高密度脂蛋白胆固醇(HDL-C)低于未发生者(P<0.05)。多因素Logistic回归分析结果显示,TG、HDL-C是MHO患者发生代谢异常的影响因素(P<0.05)。结论 MHO并非一种持续良好状态,其代谢异常发生风险高于MHNO,高TG和低HDL-C水平是MHO转归代谢异常的危险因素。
肥胖症;代谢障碍;影响因素分析
刘丹,万沁.代谢正常肥胖患者的代谢异常发生风险及影响因素研究[J].中国全科医学,2017,20(1):51-55,61.[www.chinagp.net]
LIU D,WAN Q.Incidence and influencing factors of metabolic disorders in obese patients with normal metabolism[J].Chinese General Practice,2017,20(1):51-55,61.
随着人类生活方式和饮食结构的改变,代谢综合征(metabolic syndrome,MS)已经逐渐成为世界范围内临床和公共卫生领域共同面临的危机[1]。MS是指肥胖、糖尿病、血脂异常、高血压等多种心血管危险因素在个体内集聚,可导致心脑血管事件发生,增加患者的全因死亡率[1],在严重影响患者生活质量的同时也加重了社会的经济负担。肥胖(尤其是中心性肥胖)是MS的重要组分之一,但肥胖不等同于代谢异常。肥胖人群中存在代谢组分正常亚群,即代谢正常肥胖(metabolically healthy obesity,MHO);正常体质量人群中也存在代谢组分异常亚群,即代谢异常非肥胖(metabolically unhealthy non-obesity,MUHNO)。既往研究结果表明,MHO患者的糖尿病发病风险低于代谢异常肥胖(metabolically unhealthy obesity,MUHO)患者和MUHNO患者;与体质量异常人群相比,代谢异常人群的糖尿病发病风险更高[2-3]。但也有研究结果表明,MHO患者的良好状态并非持续存在,其发生代谢异常的风险是逐渐升高的[4-5],而其病因和影响因素却尚不十分清楚。因此,本研究对MHO和代谢正常非肥胖(metabolically healthy non-obese,MHNO)患者的临床资料进行了分析,旨在探讨MHO患者的代谢异常发生风险和影响因素,从而为代谢异常的临床防治提供依据。
1 对象与方法
1.1 研究对象 于2011年4—8月,采用简单随机抽样法在泸州市抽取3个社区,在该3个社区的社区卫生服务中心中采用发放宣传册的方式招募自愿参加本研究的居民,最终以代谢正常的1 374例为研究对象。纳入标准:(1)年龄>40岁;(2)自愿参加本研究,且完成了问卷调查、体格检查及实验室检测。排除标准:问卷调查、体格检查及实验室检测资料不完善。本研究通过了西南医科大学附属医院伦理委员会的批准,纳入者均签署知情同意书。
1.2 诊断标准 参照2007年《中国成人血脂异常防治指南》[6]中的MS诊断标准,(1)肥胖:腹围,男>90.0 cm,女>85.0 cm。(2)代谢异常指标包括:①三酰甘油(TG)≥1.70 mmol/L;②高密度脂蛋白胆固醇(HDL-C)<1.04 mmol/L;③血压异常:收缩压≥130 mm Hg(1 mm Hg=0.133 kPa)、舒张压≥85 mm Hg,或已经诊断为高血压并接受相应治疗;④血糖异常:空腹血糖(FPG)≥6.1 mmol/L和/或葡萄糖耐量试验(OGTT)2 h血糖≥7.8 mmol/L,或已经诊断为2型糖尿病并接受相应治疗。以代谢异常指标个数≤1个为代谢正常,以代谢异常指标个数≥2个为代谢异常。
1.3 研究方法 根据腹围,将纳入居民分为MHO组(n=286)和MHNO组(n=1 088)。
1.3.1 基本情况收集 由经过统一培训的医学生,采用标准化问卷收集居民的基本情况,主要内容包括姓名、性别、年龄、职业、吸烟及饮酒情况、所在社区、既往高血压和糖尿病病史等。共发放问卷4 000份,回收有效问卷3 900份,问卷有效回收率为97.5%。
1.3.2 体格检查 包括测量腰围、臀围、身高、体质量、静息时血压等,并计算BMI。腰围测量要求:紧贴被测者皮肤,以脐水平为测量部位;臀围测量要求:被测者穿单衣,以髋部左右大转子骨的尖端为测量部位;体质量测量要求:被测者脱去鞋帽,取出衣服口袋中较重物品,只穿薄内衣进行测量,待体质量计读数稳定后,由测量人员记录读数。腰围、臀围、身高精确到0.1 cm,体质量精确到0.1 kg。血压的测量采用经校正的欧姆龙电子血压计(型号HEM752),被测者静坐5 min后,取其非优势臂测量3次,每次间隔至少1 min,取3次测量的平均值。
1.3.3 实验室检测 分别抽取居民空腹8 h以上及接受口服75 g OGTT(无糖尿病病史的居民予以82.5 g一水葡萄糖,有糖尿病病史的居民予以100 g无糖馒头)2 h后的静脉血,检测指标包括谷氨酰转肽酶(GGT)、FPG、OGTT 2 h血糖、糖化血红蛋白(HbA1c)、总胆固醇(TC)、TG、低密度脂蛋白胆固醇(LDL-C)、HDL-C。其中,FPG、OGTT 2 h血糖由西南医科大学检验科在抽样后2 h内,采用德国SIMENS公司生产的全自动生化免疫分析仪ADVIA2400检测,检测方法为葡萄糖氧化酶法;HbA1c由上海市内分泌代谢病研究所采用美国伯乐公司生产的Variant Ⅱ检测,检测方法为高效液相色谱法;GGT和血脂指标由上海市内分泌代谢病研究所采用雅培公司生产的全自动生化免疫分析仪architect ci16200检测,GGT的检测方法为左旋-γ -谷氨酰-3-羧基-4-硝基苯胺底物法和速率法、TC的检测方法为酶法、TG的检测方法为磷酸甘油氧化酶法、LDL-C和HDL-C的检测方法为均相测定法。
1.3.4 随访 于2014年6—10月完成3年随访,问卷调查、体格检查及实验室检测方法同基线调查,以记录两组的代谢异常发生情况。

2 结果

2.2 两组代谢异常发病情况比较 随访3年后,MHO组和MHNO组的代谢异常发病率分别为38.8%(111/286)、25.1%(273/1 088),两组代谢异常发病率比较,差异有统计学意义〔χ2=21.083,OR(95%CI)=1.891(1.437,2.489),P<0.05〕。其中,MHO组代谢异常指标个数=2个76例(68.5%),代谢异常指标个数≥3个35例(31.5%);MHNO组代谢异常指标个数=2个219例(80.2%),代谢异常指标个数≥3个54例(19.8%)。两组发生代谢异常者代谢异常指标个数分布比较,差异有统计学意义(χ2=38.851,P<0.05)。
按性别分层,两组男性、女性代谢异常发病率比较,差异有统计学意义(P<0.05)。按年龄分层,两组40~55岁、56~70岁代谢异常发病率比较,差异有统计学意义(P<0.05);而71~93岁代谢异常发病率比较,差异无统计学意义(P>0.05,见表1)。
2.3 是否发生代谢异常MHO组患者临床资料比较MHO组是否发生代谢异常患者性别、平均年龄、职业、吸烟、饮酒、腰围、臀围、收缩压、舒张压、GGT、HbA1c、TC、LDL-C比较,差异无统计学意义(P>0.05);BMI、FPG、OGTT2h血糖、TG、HDL-C比较,差异有统计学意义(P<0.05,见表2、3)。
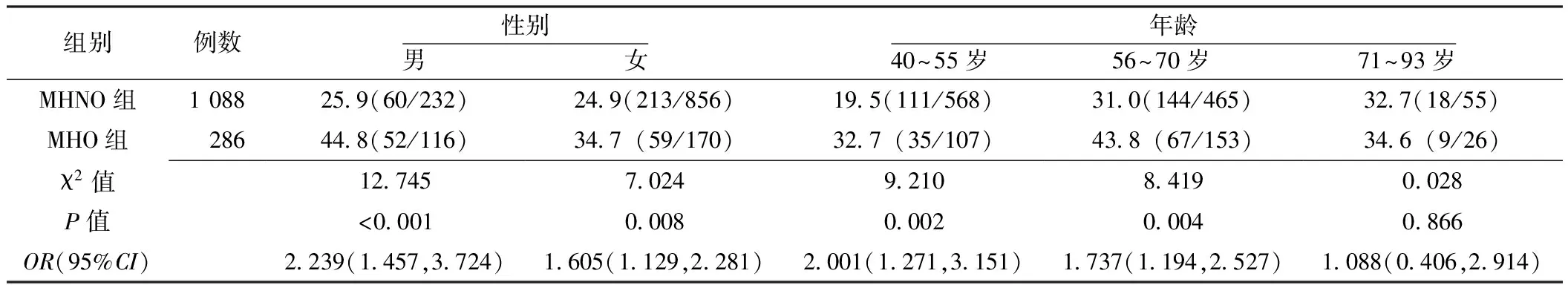
表1 两组代谢异常发病率比较〔%(n/N)〕
注:MHNO=代谢正常非肥胖,MHO=代谢正常肥胖

表2 MHO组是否发生代谢异常患者临床资料比较〔计数资料,n(%)〕
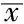
表3 MHO组是否发生代谢异常患者临床资料比较(计量资料,±s)
注:GGT=谷氨酰转肽酶,FPG=空腹血糖,OGTT 2 h血糖=葡萄糖耐量试验2 h血糖,HbA1c=糖化血红蛋白, TC=总胆固醇,TG=三酰甘油,LDL-C=低密度脂蛋白胆固醇,HDL-C=高密度脂蛋白胆固醇;1 mm Hg=0.133 kPa
2.4 MHO患者发生代谢异常影响因素的多因素Logistic回归分析 以是否发生代谢异常为因变量(赋值:是=1,否=0),以性别、年龄、职业、吸烟及饮酒情况、BMI、FPG、OGTT 2 h血糖、TG及HDL-C为自变量(赋值:性别,男=1,女=2;年龄,40~55岁=1,56~70岁=2,71~93岁=3;职业,农民工人=1,退休/其他=2,办公室干事/干部=3;吸烟,不吸烟=0,已戒烟=1,偶尔吸烟=2,吸烟=3;饮酒,不饮酒=0,已戒酒=1,偶尔饮酒=2,饮酒=3;其他指标以实际值纳入),进行多因素Logistic回归分析。结果显示,TG、HDL-C是MHO患者发生代谢异常的影响因素(P<0.05,见表4)。
表4 MHO患者发生代谢异常影响因素的多因素Logistic回归分析
Table 4 Multivariate Logistic regression analysis of the influencing factors for metabolic disorders occurred in the MHO group
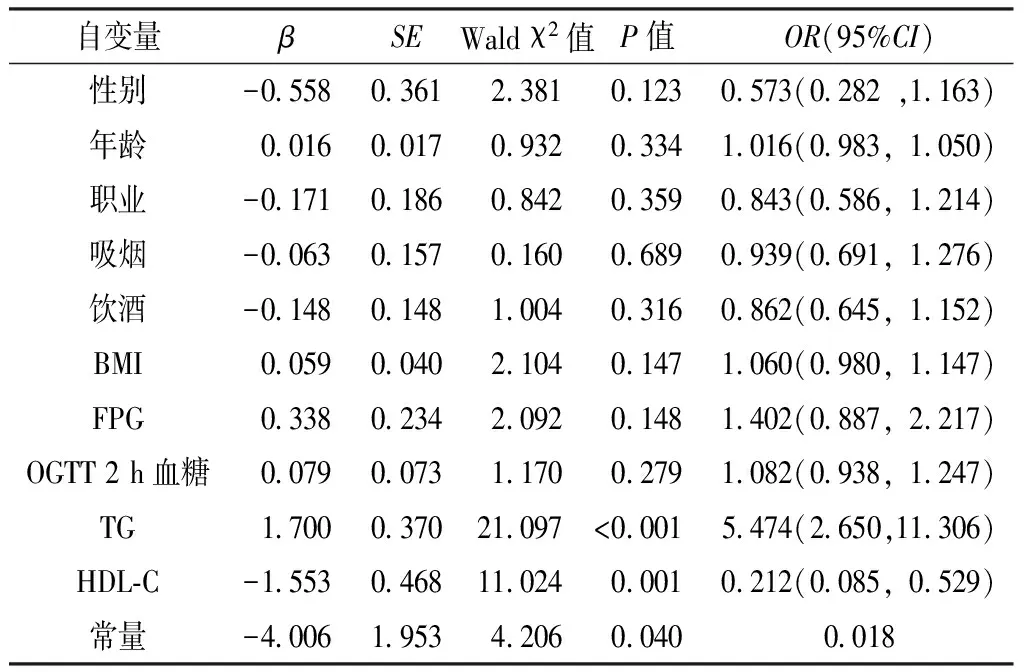
自变量βSEWaldχ2值P值OR(95%CI)性别-05580361238101230573(0282,1163)年龄00160017093203341016(0983,1050)职业-01710186084203590843(0586,1214)吸烟-00630157016006890939(0691,1276)饮酒-01480148100403160862(0645,1152)BMI00590040210401471060(0980,1147)FPG03380234209201481402(0887,2217)OGTT2h血糖00790073117002791082(0938,1247)TG1700037021097<00015474(2650,11306)HDL⁃C-155304681102400010212(0085,0529)常量-40061953420600400018
3 讨论
3.1 MHO并非一种持续良好状态,其代谢异常发生风险高于MHNO 本研究结果显示,随访3年后MHO和MHNO组的代谢异常发病率分别为38.8%、25.1%,MHO组代谢异常发病风险是MHNO组的1.891倍〔95%CI(1.437,2.489)〕。按性别分层分析,男性MHO组的代谢异常发生风险是MHNO组的2.239倍,女性为1.605倍。按年龄分层分析,40~55、56~70岁MHO组的代谢异常发生率分别为MHNO组的2.001、1.737倍,但两组71~93岁居民的代谢异常发生风险无差异。APPLETON等[4]对4 056例受试者进行调查,随访5.5~10.3年后发现,与MHNO组相比,MHO组的代谢异常发生风险更大,MHNO、MHO组的代谢异常发生率分别为15.5%和33.1%。张弛等[5]以BMI≥25 kg/m2定义肥胖,以不含高血压、高脂血症、糖尿病定义代谢正常,随访1~3年后发现,MHO组的代谢异常发生率明显高于对照组〔46.79%比17.60%,OR(95%CI)=4.117(2.503,6.770),P<0.05〕,与本研究结果类似,但该研究未对其影响因素进行分析。
3.2 TG、HDL-C是MHO转归代谢异常的影响因素 本研究中,发生代谢异常MHO组居民BMI、FPG、OGTT 2 h血糖、TG高于未发生者,HDL-C低于未发生者,推测MHO的持续代谢正常状态可能与基线血糖、血脂水平等有关。多因素Logistic回归分析结果显示,TG、HDL-C是MHO转归代谢异常的影响因素,这与ACHILIKE等[7]认为TG、HDL-C可作为预测MHO发展指标的研究结果一致。我国ZHENG等[8]的研究结果表明,腹型肥胖、久坐是代谢异常的危险因素;APPLETON等[4]的研究结果表明,持续代谢正常状态的存在与年龄≤40岁、相对较小的腰围及脂肪分布外周化有关,这与CALORI等[9]和RHEE等[2]的研究结果相同,均证明了腹型肥胖、高龄对转归代谢异常中的影响。JO等[10]的一项前瞻性研究结果表明,GGT与MS各组分相关,GGT可预测MS的发生,其价值甚至高于血压、空腹血糖损害(IFP)及HDL-C,其机制可能与GGT参与胰岛素抵抗(insulin resistance,IR)有关;THAMER等[11]通过研究发现,GGT与胰岛素敏感性有明显相关性,认为GGT升高可以预测糖耐量异常与IR。但本研究中,未发现GGT、腰围对MHO转归代谢异常的影响。
IR是MS发生的中心环节,是指组织(包括脂肪、肝脏、肌肉)对胰岛素的敏感性下降,导致对葡萄糖摄取和利用减弱的一种病理状态[1]。IR的发生是遗传和环境多因素共同作用的结果,肥胖、吸烟、高能膳食、缺乏运动等均是其病因。近年来的研究结果表明,IR的发生机制与高糖毒性、高脂毒性、氧化应激、机体炎性反应等有关[12]。大多数糖尿病患者伴血脂代谢障碍,主要表现为高TG、低HDL-C水平[13];TIROSH等[14]通过研究发现,高TG水平可以增加糖尿病发病风险;WILSON等[15]的研究结果表明,低HDL-C水平是发生糖尿病的危险因素;另外,也有研究结果显示,血脂代谢障碍和IR密切相关[16],高TG、低HDL-C水平不仅是糖代谢紊乱的结果,也是导致糖代谢紊乱的危险因素[17]。流行病学研究结果显示,约50.0%的高血压患者合并高胰岛素血症或糖耐量异常,约高达80.0%的2型糖尿病患者合并高血压[18-19],其潜在病理生理机制可能与胰岛素和血管紧张素Ⅱ受体信号传导通路在多重水平共享一系列下游效应器有关[20]。肥胖(尤其是中心性肥胖)与IR的主要关联机制为TG在肝脏中蓄积,脂肪动员加强,导致游离脂肪酸(FFA)增多,而FFA的增加会减弱胰岛素信号并加剧IR,此外慢性炎性反应也参与其中[12]。可见MS各组分(包括中心性肥胖、高血糖、血脂异常、高血压)之间通过与IR的联系相互影响。
综上所述,MHO并非一种持续良好状态,其发生代谢异常的风险明显高于MHNO,高TG和低HDL-C水平是其转归代谢异常的危险因素。提示人们应建立健康的生活方式,定期体检,及时发现MS各组分,并积极给予生活方式干预及药物治疗,阻止MS发生,从而减少心血管事件的发生、降低死亡率。对于MS发生的病理生理机制还有待更加深入的研究,而深入研究会涉及机体多个组织和器官,影响因素众多,需要将基础医学与临床医学结合在一起,多学科通力合作。
作者贡献:刘丹进行文章的构思与设计,研究的实施与可行性分析,数据收集与整理,统计学处理,结果的分析与解释,撰写论文;万沁进行文章的中英文修订,文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
[1]STRAND M A, HUSETH-ZOSEL A, HE M Z, et al.Menopause and the risk of metabolic syndrome among middle-aged Chinese women[J].Fam Med Community Health,2015,3(1):15-22.
[2]RHEE E J,LEE M K,KIM J D,et al.Metabolic health is a more important determinant for diabetes development than simple obesity:a 4-year retrospective longitudinal study[J].PLoS One,2014,9(5):e98369.DOI:10.1371/journal.pone.0098369.
[3]LUO D,LIU F,LI X,et al.Comparison of the effect of metabolically healthy but obese and metabolically abnormal but not obese′ phenotypes on development of diabetes and cardiovascular disease in Chinese[J].Endocrine,2015,49(1):130-138.
[4]APPLETON S L,SEABORN C J,VISVANATHAN R,et al.Diabetes and cardiovascular disease outcomes in the metabolically healthy obese phenotype:a cohort study[J].Diabetes Care,2013,36(8):2388-2394.
[5]张弛,赵乃蕊,李华珠,等.代谢正常肥胖个体的临床特点及其发生代谢异常性疾病的风险[J].中华糖尿病杂志,2013,5(3):140-144. ZHANG C,ZHAO N R,LI H Z,et al.Clinical characteristics and risk on metabolic abnormal diseases of metabolically healthy obese individuals[J].Chinese Journal of Diabetes Mellitus,2013,5(3):140-144.
[6]中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南[J].中华心血管病杂志,2007,35(5):390-419. Joint Committee for the Prevention and Treatment of Dyslipidemia in Chinese Adults.Guidelines for prevention and treatment of dyslipidemia in Chinese adults[J].Chinese Journal of Cardiology,2007,35(5):390-419.DOI:10.3760/j.issn:0253-3758.2007.05.003.[7]ACHILIKE I,HAZUDA H P,FOWLER S P,et al.Predicting the development of the metabolically healthy obese phenotype[J].Int J Obes(Lond),2015,39(2):228-234.
[8]ZHENG R,YANG M,BAO Y,et al.Prevalence and determinants of metabolic health in subjects with obesity in Chinese population[J].Int J Environ Res Public Health,2015,12(11):13662-13677.
[9]CALORI G,LATTUADA G,PIEMONTI L,et al.Prevalence,metabolic features,and prognosis of metabolically healthy obese Italian individuals:the Cremona Study[J].Diabetes Care,2011,34(1):210-215.
[10]JO S K,LEE W Y,RHEE E J,et al.Serum gamma-glutamyl transferase activity predicts future development of metabolic syndrome defined by 2 different criteria[J].Clin Chim Acta,2009,403(1/2):234-240.
[11]THAMER C,TSCHRITTER O,HAAP M,et al.Elevated serum GGT concentrations predict reduced insulin sensitivity and increased intrahepatic lipids[J].Horm Metab Res,2005,37(4):246-251.
[12]张岩,陈晓亭,宋惠珠,等.肥胖所导致的胰岛素抵抗分子机制的研究进展[J].检验医学,2014,29(7):774-778. ZHANG Y,CHEN X T,SONG H Z,et al.Research progress on molecular pathogenesis of obesity-induced insulin resistance[J].Laboratory Medicine,2014,29(7):774-778.
[13]WU L,PARHOFER K G.Diabetic dyslipidemia[J].Metabolism,2014,63(12):1469-1479.
[14]TIROSH A,SHAI I,BITZUR R,et al.Changes in triglyceride levels over time and risk of type 2 diabetes in young men[J].Diabetes Care,2008,31(10):2032-2037.
[15]WILSON P W,MEIGS J B,SULLIVAN L,et al.Prediction of incident diabetes mellitus in middle-aged adults:the Framingham Offspring Study[J].Archives of Internal Medicine,2007,167(10):1068-1074.
[16]刘红梅,孙传伯.糖尿病患者血脂水平与动脉粥样硬化的相关性分析[J].安徽医学,2015,36(6):646-649. LIU H M, SUN C B.Analysis of correlation between different age diabetes clinical serum lipid levels and atheroma[J].Anhui Medical Journal,2015,36(6):646-649.
[17]徐涛成.中青年缺血性卒中伴2型糖尿病患者的病因分析及预后观察[J].实用心脑肺血管病杂志,2015,23(4):88-90. XU T C.Etiology and prognosis of ischemic stroke complicated with type 2 diabetes mellitus in young and middle-aged people[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2015,23(4):88-90.
[18]ZHOU M S,SCHULMAN I H.Prevention of diabetes in hypertensive patients:results and implications from the VALUE trial[J].Vasc Health Risk Manag,2009,5(1):361-368.
[19]LASTRA G,DHUPER S,JOHNSON M S,et al.Salt,aldosterone,and insulin resistance:impact on the cardiovascular system[J].Nat Rev Cardiol,2010,7(10):577-584.
[20]李凡,薛建红,英明中,等.高血压与胰岛素抵抗相关性机制的研究进展[J].中华老年心脑血管病杂志,2012,14(2):209-210. LI F,XUE J H,YING M Z,et al.Research progress of the correlation mechanism between hypertension and insulin resistance[J].Chinese Journal of Geriatric Heart Brain and Vessel Diseases,2012,14(2):209-210.DOI:10.3969/j.issn.1009-0126.2012.02.032.
(本文编辑:王凤微)
Incidence and Influencing Factors of Metabolic Disorders in Obese Patients with Normal Metabolism
LIUDan,WANQin*
DepartmentofEndocrinology,theAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China
*Correspondingauthor:WANQin,Professor,Mastersupervisor;E-mail:wanqin3@163.com
Objective To study the incidence and risk factors of metabolic disorders in metabolically healthy obese(MHO) patients.Methods From April to August 2011,we selected 3 communities from Luzhou using simple random sampling method.And by issuing recruitment brochures at the community health service centers of the 3 communities,we recruited 1 374 residents who had normal metabolism and volunteered to participate in this study.In accordance with the abdominal circumference,the included residents were divided into MHO group(n=286) and metabolically healthy non-obese(MHNO) group(n=1 088).We used standardized questionnaires to collect the general data of the residents,and gave them physical examination and laboratory tests.The incidences of metabolic disorders of both groups were recorded at 3-year follow-up.Results The incidence of metabolic disorders was higher in the MHO group than that in the MHNO group〔38.8%(111/286) vs. 25.1%(273/1 088),OR(95%CI)=1.891(1.437,2.489),P<0.05〕.As stratified by gender,when compared with MHNO group,higher incidences of metabolic disorders were observed in both males and females in the MHO group(P<0.05).As stratified by age,higher incidences of metabolic disorders were noted in both aged 40 to 55 years and aged 56 to 70 years in MHO group compared with the MHNO group(P<0.05).However,the incidence of metabolic disorders in residents aged 71 to 93 years in the MHO group was not significantly different from that in the MHNO group(P>0.05).There were no statistically significant difference in terms of sex,mean age,occupation,history of smoking,history of drinking,waist circumference,hip circumference,levels of systolic pressure,diastolic pressure,glutamyltranspetidase(GGT),glycosylated hemoglobin(HbA1c),total cholesterol(TC) and low-density lipoprotein cholesterol(LDL-C) between the pateints with metabolic disorders and those without in the MHO group(P>0.05).In the MHO group,the pateints with metabolic disorders had higher BMI,higher levels of fasting plasma glucose(FPG),blood glucose concentration at 2 h of an oral glucose tolerance test(OGTT) and triacylglycerol(TG),but lower level of high-density lipoprotein cholesterol (HDL-C)(P<0.05).Results of multivariate Logistic regression analysis suggested that TG and HDL-C levels were the influencing factors for metabolic disorders occurred in the patients of MHO group(P<0.05).Conclusion The conditions of MHO group were not optimistic with a higher incidence of metabolic disorders compared with the MHNO group.Higher TG and lower HDL-C levels were the risk factors for metabolic disorders occurring in patients in the MHO group.
Obesity;Metabolism disorders;Root cause analysis
国家代谢性疾病临床医学研究中心项目(2013BAI09B13)
R 723.14 R 589
A
10.3969/j.issn.1007-9572.2017.01.011
2016-07-11;
2016-11-29)
646000 四川省泸州市,西南医科大学附属医院内分泌科
*通信作者:万沁,教授,硕士生导师;E-mail:wanqin3@163.com
