ToxoDB#17型弓形虫卵囊对昆明小鼠致病性的研究
2017-02-17冯永杰付晓莹陆瑶瑶梁宏德杨玉荣
王 凯,冯永杰,付晓莹,陆瑶瑶,梁宏德,杨玉荣
ToxoDB#17型弓形虫卵囊对昆明小鼠致病性的研究
王 凯,冯永杰,付晓莹,陆瑶瑶,梁宏德,杨玉荣1
目的 为探究ToxoDB#17型弓形虫对昆明小鼠的致病特点。方法 分别选择<1个,1个,101个,102个,103个,104个,105个,106个ToxoDB#17型弓形虫卵囊灌胃小鼠,观察小鼠的临床症状,采用改良凝集试验、HE和IHC方法研究弓形虫的感染率,小鼠生存率及其大脑内的包囊数量。结果 ≥104个卵囊组小鼠在攻虫后出现一过性的精神沉郁,弓背,被毛逆立现象,其余组精神状态正常;≥102个卵囊可引起小鼠100%感染,感染小鼠的成囊率为2.38%(1/42),感染小鼠生存率为85.71%(36/42),存活时间≥360 DPI。结论 ToxoDB#17型弓形虫对昆明小鼠的致病力弱,包囊形成率低。
ToxoDB#17型弓形虫;昆明小鼠;包囊;致病性
刚地弓形虫(Toxoplasmagondii)是一种呈世界性分布的细胞内寄生原虫,可感染几乎所有恒温动物,引起弓形虫病。不同基因型弓形虫对昆明小鼠的致病性不同[1]。我国目前为止共分离到154株弓形虫,11个基因型,其对昆明小鼠的致病性研究仅有少量报道。本试验首次将分离于河南猫体内ToxoDB#17型弓形虫虫株,采用改良凝集试验(modified agglutination test,MAT),常规病理学方法,HE和IHC染色技术,研究这一虫株对昆明小鼠的致病性特点,丰富中国虫株对小鼠致病特性的认识,为弓形虫卵囊入侵机制及防治提供参考。
1 材料与方法
1.1 弓形虫卵囊及主要试剂 ToxoDB#17型弓形虫虫株分离于河南省郑州市宠物市场猫的组织,猫粪便中卵囊的分离及纯化具体操作方法参照Dubey JP (1987)[2],ToxoDB#17型弓形虫卵囊见图1A。兔抗弓形虫多克隆抗体、弓形虫抗原受赠于美国农业部Dubey实验室,小鼠Specific HRP/DAB(ABC)Detection IHC kit 购自abcam公司(货号:ab64264)。
1.2 试验动物及处理 6~8周龄健康清洁级昆明小鼠,购于郑州大学实验动物中心。小鼠随机分为9组(8个感染组,1个对照组),每组5~8只,分笼饲养,正常采食饮水。对照组小鼠灌胃无菌生理盐水1ml/只,感染组小鼠每只分别灌胃<1个、1个、101个、102个、103个、104个、105个、106个的ToxoDB#17型卵囊溶液。104个、105个、106个每组8只小鼠,其他每组5只小鼠(表1)。感染后60 d(60 DPI),采集小鼠血清,试验组小鼠乙醚麻醉每组处死5只。其他小鼠每日观察临床表现,分别在120 DPI,180 DPI,240 DPI,300 DPI,360 DPI采集小鼠血清。每日观察记录发病和死亡情况。对自然死亡和处死的小鼠检查并记录肺脏、淋巴结中是否感染有弓形虫;取大脑,计数大脑包囊数量,自然死亡小鼠的全部组织固定于10%中性福尔马林溶液中,常规方法制做石蜡切片,进行HE及弓形虫抗原IHC染色,检查其死亡原因。
1.3 试验方法 血清弓形虫IgG抗体检测采用MAT方法[2]。小鼠大脑包囊计数,采用压片显微镜检查方法[3]。
1.4 数据处理 采用Excel 2007收集整理数据,GraphPad Prism 5.0制图。
2 结 果
2.1 小鼠的临床表现 将8个不同数量级浓度的ToxoDB#17弓形虫卵囊溶液灌胃给各组小鼠后,高浓度组(104个、105个、106个)小鼠一周内表现为活动减少、精神沉郁、弓背,被毛逆立的现象,其他各组小鼠未见明显异常。一周过后,各浓度组小鼠逐渐恢复正常饮食和活动,除自然死亡的小鼠外,其它小鼠被毛光滑,食欲旺盛,体重和活动量增加。
2.2 ToxoDB#17型弓形虫的感染与致病情况 60 DPI小鼠血清弓形虫IgG抗体结果显示,1个和101个卵囊组小鼠的弓形虫感染率为80%,≥102个卵囊组小鼠的感染率均为100%(表1)。104个,105个,106个卵囊组的小鼠血清在120 DPI,180 DPI,240 DPI,300 DPI,360 DPI,弓形虫抗体均为阳性(血清阳性率100%)。102个,104个,105个,106个卵囊组分别有小鼠在44 DPI,37 DPI、60 DPI、300 DPI,180 DPI,44 DPI自然死亡,共6只。44 DPI,37 DPI自然死亡的小鼠,肺脏、肠系膜淋巴结切片IHC未见弓形虫,肺脏可见血管内有栓塞(1B)。60 DPI~300 DPI,自然死亡小鼠体内长有恶性肿瘤(1C)。其余小鼠存活超过360 DPI,试验小鼠生存曲线见图2。
2.3 ToxoDB#17型弓形虫感染小鼠后大脑包囊负载量 弓形虫卵囊共接种44只小鼠, 42只小鼠感染弓形虫,人为处死31只小鼠(60 DPI),自然死亡6只小鼠(44 DPI, 180 DPI,37 DPI,60 DPI,330 DPI,44 DPI),在这37只死亡小鼠中仅1只小鼠大脑有包囊(330 DPI,39个包囊)(图1D),目前还有5只小鼠存活,存活时间超过360DPI,感染小鼠的成囊率为2.38%(1/42),感染小鼠生存率为85.71%(36/42)。
表1 ToxoDB#17型弓形虫卵囊灌胃对昆明小鼠的致病特点
Tab.1 Patogenicity of the ToxoDB#17 strain ofT.gondiioocyst onKunmingmice by injection gavage
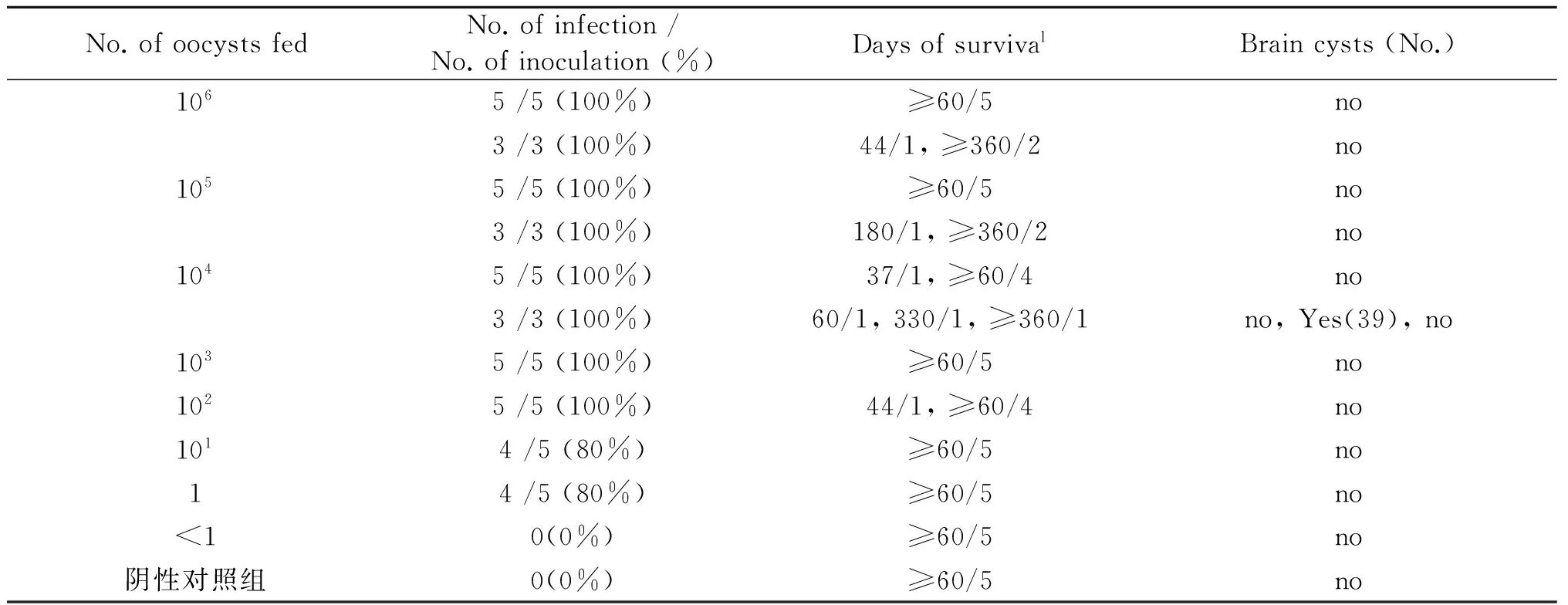
No.ofoocystsfedNo.ofinfection/No.ofinoculation(%)DaysofsurvivalBraincysts(No.)1065/5(100%)≥60/5no3/3(100%)44/1,≥360/2no1055/5(100%)≥60/5no3/3(100%)180/1,≥360/2no1045/5(100%)37/1,≥60/4no3/3(100%)60/1,330/1,≥360/1no,Yes(39),no1035/5(100%)≥60/5no1025/5(100%)44/1,≥60/4no1014/5(80%)≥60/5no14/5(80%)≥60/5no<10(0%)≥60/5no阴性对照组0(0%)≥60/5no
Note:amouse survival days / number of surviving mice
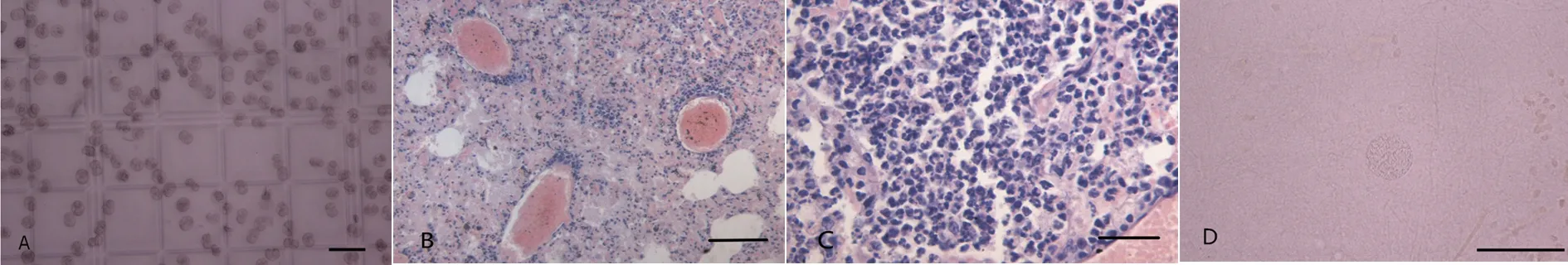
A: T. gondii oocysts, the hemocytometer grid smallest unit, smear, unstained, Bar=50 μm; B: Lung blood vessels containing thrombi, Paraffin sections, HE staining, Bar=100 μm; C: Tumor cells in the lung, Paraffin sections, HE staining, Bar=30 μm; D: T. gondii cysts in mouse brain, squash of the brain, unstained, 330 DPI. Bar=50 μm.图1 ToxoDB#17型弓形虫卵囊及小鼠病理变化Fig.1 ToxoDB#17 strain T. gondii oocysts and pathological change of mice
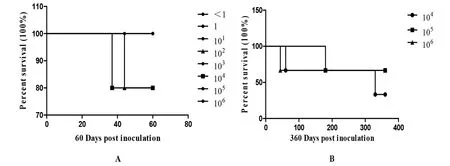
A: Survival curve of mice after fed of different dose of ToxoDB#17 strain T. gondii oocysts (0 DPI-60 DPI); B: Survival curve of chronically infected mice after fed ToxoDB#17 strain of T. gondii oocysts (0 DPI-360 DPI)图2 昆明小鼠感染ToxoDB#17型弓形虫卵囊的生存曲线Fig.2 The survival curve of mice after fed of ToxoDB#17 strain T. gondii oocysts
3 讨 论
近年来,对世界各地人和动物体内分离的弓形虫虫株多采用多位点PCR-RFLP基因分型,分型结果显示,各地刚地弓形虫具有丰富的遗传多态性[4-5]。弓形虫数据库中已记录的基因型有232个(http://toxodb.org/toxo)。但关于我国流行的弓形虫基因型虫株致病性的研究尚不充分。
研究显示,I型弓形虫虫株致病力强,低剂量可引起小鼠急性感染而死亡;II型、III型弓形虫虫株致病力弱,较高剂量才可引起小鼠死亡,脑组织包囊数量高。CT1与GT1弓形虫都是I型强毒株,它们对Swiss小鼠和Balb/c小鼠灌胃卵囊的最低致死量均为1个卵囊/只小鼠,RH株(ToxoDB#10)感染后的死亡率为25%,TgCtxz1(ToxoDB#10)感染后的死亡率为83.3%[6]。ME49为II型弓形虫虫株,它对Swiss小鼠和Balb/c小鼠灌胃卵囊的最低致死量为100-1 000个卵囊/只小鼠,Balb/c小鼠口服100个速殖子才可感染,感染后54 d可在大脑形成约566个组织包囊,Balb/c小鼠皮下注射一个速殖子可感染,54 d后在大脑形成约660个组织包囊。VEG为III型弓形虫虫株,它对Swiss小鼠和Balb/c小鼠灌胃卵囊的最低致死量为100-1000个卵囊/只小鼠,Swiss小鼠口服10个速殖子即可感染,103个可导致小鼠死亡,而皮下注射1个即可感染,104个可导致小鼠死亡[3,7]。VEG对Swiss小鼠的最低致死量为102个卵囊/只,平均死亡时间为11.6d,最早8d在小鼠大脑中可见小的组织包囊[8]。
与Chinese 1(ToxoDB#9)型比较,ToxoDB#17型弓形虫对小鼠的致病力弱,脑包囊形成率低。Chinese 1弓形虫虫株分离数量占中国分离到的活虫虫株的66.67%,为优势基因型[9-10],但Chinese 1型不同虫株存在着明显的毒力差异。在对昆明小鼠的试验中发现[6]:TgCtgy1虫株1个速殖子即可导致小鼠感染,感染后的死亡率为50%;TgCtwh3虫株1个速殖子也可感染小鼠,感染后的死亡率为10%;TgCtwh6虫株1个速殖子即可感染小鼠,但不能导致小鼠死亡,10个速殖子可导致感染后小鼠6.2%的死亡率。对Balb/c小鼠皮下注射速殖子的研究发现[11]:TgCtwh3虫株50个速殖子可导致小鼠在感染后9 d死亡率达100%;TgCtwh6虫株500个速殖子在感染后30d内,未发现小鼠死亡;TgCtwh6虫株5×105个速殖子可导致小鼠在感染后第7 d开始死亡,到第30 d死亡率为80%。Swiss小鼠注射TgCtsd2、 TgCtsd3、TgCtwh6虫株的速殖子后到感染第45 d,可在小鼠大脑内观察到组织包囊[12]。ToxoDB#17已从法国、巴西、阿根廷、秘鲁(http://toxodb.org/toxo)、中国[13]分离出来,关于它的致病性尚未有文献报道,因此本试验研究它对昆明小鼠的致病性。结果显示,灌胃ToxoDB#17弓形虫卵囊后1周内小鼠表现为活动减少、精神状态不佳,1周过后各浓度组小鼠逐渐恢复正常饮食和活动,说明ToxoDB#17弓形虫的致病性很弱。在感染ToxoDB#17弓形虫的42只小鼠,人为处死31只小鼠(60 DPI),自然死亡6只小鼠,尚有5只小鼠存活,自然死亡小鼠病理组织学研究发现其组织未见弓形虫,死亡直接原因是肺栓塞或肿瘤(图1 B,C),这个结果排除了弓形虫引起小鼠自然死亡的可能。王林[14]采用TgCtwh6(Chinese 1型)50个弓形虫包囊灌胃感染昆明小鼠,发现小鼠同样出现一过性的炎症反应,感染第35 d至试验结束,小鼠精神状态恢复正常,且在感染后第21 d首次在存活小鼠脑内发现大量包囊,成囊率为80%,随着感染时间的推移,包囊逐渐增多,至第35 d,小鼠的成囊率为100%。本试验中各浓度梯度的ToxoDB#17型卵囊灌胃小鼠60 d后,在感染的35只小鼠大脑研磨液中均未发现包囊。在小鼠进入慢性感染期后到360 DPI,只在104个浓度组一只小鼠大脑检出包囊。本研究所用昆明小鼠为清洁级,排除了小鼠在接种前存在潜伏感染的可能性。同时根据MAT试验结果,证明1个ToxoDB#17型弓形虫卵囊即可导致昆明小鼠感染,但高浓度的卵囊并没有导致小鼠死亡,说明昆明小鼠对ToxoDB#17 型卵囊易感,但大脑包囊成囊率低。
综上,与我国弓形虫优势基因型Chinese 1比较,ToxoDB#17型弓形虫分离株对小鼠的毒力较低,其致病性和包囊形成明显弱于Chinese 1型弓形虫虫株。关于其毒力差异的原因还需进一步深入研究。
[1] Lehmann T, Marcet PL, Graham DH, et al. Globalization and the population structure ofToxoplasmagondii[J]. Proc Natl Acad Sci, 2006, 103(30): 11423-11428.
[2] Dubey JP, Desmonts G. Serological responses of equids fedToxoplasmagondiioocysts[J]. Equine Vet J, 1987, 19(4): 337-339.
[3] Dubey JP, Ferreira LR, Martins J, et al. Oral oocyst induced mouse model of toxoplasmosis: effect of infection withToxoplasmagondiistrains of different genotypes, dose, and mouse strains (transgenic, out-bred, in-bred) on pathogenesis and mortality[J]. Parasitology, 2012, 139(1): 1-13.
[4] Louis MW, Kami K.Toxoplasmagondii[M]. New Jersey: Esevier ltd. 2014: 62-89.
[5] Hernan L, Asis K, Michael SB, et al. Local admixture of amplified and diversified secreted pathogenesis determinants shapes mosaicToxoplasmagondiigenomes[J]. Nat Commun, 2016, 7(7): 1-13.
[6] Li M, Mo XW, Wang L, et al. Phylogeny and virulence divergency analyses ofToxoplasmagondiiisolates from China[J]. Parasit Vectors, 2014, 7(7): 67-70.
[7] Dubey JP. Bradyzoite induced murine toxoplasmosis: stage conversion, pathogenesis, and tissue-cyst formation in mice fed bradvzoites of different strains ofToxoplasmagondii[J]. J Euk Microbiol, 1997, 44(6): 592-602.
[8] Dubey JP, Speer CA, Shen SK, et al. Oocyst-induced murine toxoplasmosis: life cycle, pathogenicity, and stage conversion in mice fedToxoplasmagondiioocysts[J]. J Parasitol, 1997, 83(5): 870-882.
[9] Fu XY, Feng YJ, Liang HD, et al. Genotypes and pathogenesis ofToxoplasmagondiiisolates in China[J]. Chin J Zoonoses, 2015, 31(7): 669-673. (in Chinese)
付晓莹,冯永杰,梁宏德,等. 中国弓形虫分离株基因型及致病性的研究进展[J]. 中国人兽共患病学报, 2015, 31(7): 669-673.
[10] Meng DD, Wang L, Lou Y, et al. Genotype and virulence ofToxoplasmagondiiisolates from cats in Guiyang, Southwest China[J]. Chin J Zoonoses, 2014, 30(2): 150-154. (in Chinese)
孟德娣,王林,楼研,等. 贵阳猫源弓形虫株基因分型及毒力研究[J]. 中国人兽共患病学报, 2014, 30(2): 150-154.
[11] Zhang AM, Shen Q, Li M, et al. Comparative studies of macrophage-biased responses in mice to infection withToxoplasmagondii, ToxoDB #9 strains of different virulence isolated from China[J]. Parasit Vectors, 2013, 6(1): 386-395.
[12] Wang L, Chen H, Liu DH, et al. Genotypes and mouse virulence ofToxoplasmagondiiisolates from animals and humans in China[J]. PLoS One, 2013, 8(1): 1-11.
[13] Yang Y, Ying Y, Verma SK, et al. Isolation and genetic characterization of viableToxoplasmagondiifrom tissues and feces of cats from the central region of China[J]. Vet Parasitol, 2015, 211(3/4): 283-288.
[14] Wang L. The prevalence ofToxoplasmagondiiisolates genotyping and virulence[D]. Hefei: Anhui Medical University, 2012. (in Chinese)
王林. 流行我国的弓形虫分离株基因分型及其毒力研究[D]. 合肥:安徽医科大学, 2012.
Virulence and pathogenicity ofToxoplasmagondiiToxoDB#17 strain oocysts inKunmingmice
WANG Kai, FENG Yong-jie, FU Xiao-ying, LU Yao-yao, LIANG Hong-de, YANG Yu-rong
(CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou450002,China)
To investigate the pathogenic characteristic of ToxoDB#17ToxoplasmagondiiinKunmingmice, the mice were fed with <1, 1, 101, 102, 103, 104, 105, 106oocysts, and the clinical symptoms of mice were observed. MAT, HE and IHC were used to research the infection rate ofT.gondii, survival rate of mice and the number of cysts in brain. The results showed that the mice fed with ≥104oocysts appeared transient depression, mice were arched, messy hair after infection. The mice fed with ≥102oocysts were all infected,T.gondiicysts formation rate was 2.38% (1/42), the survival rate of infected mice was 85.71% (36/42), the survival time was greater than 360 days. In conclusion, the pathogenicity of ToxoDB#17T.gondiiis weak, and cysts formation rate is also low.
ToxoDB#17;Toxoplasmagondii;Kunmingmice; tissue cysts; pathogenicity
Yang Yu-rong, Email: yangyu7712@sina.com
10.3969/j.issn.1002-2694.2017.01.009
国家自然科学基金(No. 30800812),河南省自然科学基金资助(No.162300410138)
杨玉荣, yangyu7712@sina.com
河南农业大学牧医工程学院, 郑州 450002
R382.5
A
1002-2694(2017)01-0049-04
2016-07-04 编辑:刘岱伟
Supported by the National Natural Science Foundation of China (No. 30800812) and the Natural Science Foundation of Henan Province (No.162300410138)
