4种血清型登革病毒多表位重组抗原的表达及血清学初步评价
2017-02-17易方浩张俊爱黎四平余诗炎代友超庄泽岗郑碧英徐军发
易方浩,张俊爱,黎四平,贾 岩,陈 晨,余诗炎,王 鑫,代友超,庄泽岗,郑碧英,徐军发
4种血清型登革病毒多表位重组抗原的表达及血清学初步评价
易方浩1,张俊爱1,黎四平2,贾 岩1,陈 晨1,余诗炎1,王 鑫1,代友超1,庄泽岗1,郑碧英1,徐军发1
目的 在原核表达系统中对登革病毒包膜蛋白(E蛋白)和非结构蛋白1(NS1)融合的B细胞抗原表位进行表达、纯化及血清学评价。方法 将B细胞抗原表位用形成α螺旋的连接肽(EAAAK)2作为接头,串联合成1条全新的多表位融合重组基因rE,将其克隆到原核表达载体pET-28a(+)中,转化大肠杆菌BL21(DE3)后经IPTG诱导表达融合蛋白,用镍柱对重组蛋白纯化,并用SDS-PAGE 和Western blot方法鉴定表达产物。以融合蛋白为抗原,用间接ELISA检测登革热病人血清IgM抗体。结果 重组表达载体pET28a-rE构建成功,并在大肠杆菌BL21(DE3)中成功表达。融合蛋白主要以包涵体形式存在,用镍柱纯化获得高纯度的目的蛋白,SDS-PAGE和Western blot检测结果显示蛋白分子量大小与预期结果相符,建立的间接ELISA具有较高的准确性。结论 原核表达的登革病毒多表位融合蛋白具有良好的血清学检测价值。
登革病毒;抗原蛋白;原核表达;血清学评价
登革热是由有4种血清型的登革病毒引起,通过伊蚊叮咬而传播的虫媒病毒传染病[1],预计全球有大约一半的人口处于感染的风险,每年有3.9亿登革热感染者[2-3]。登革病毒4种不同血清型(DENV-1~4)分布在全球的热带和亚热带地区,每一种血清型都可引起严重的疾病[4],对于登革热传染病没有特效的治疗[5],目前已有全球获批的首个登革热疫苗Dengvaxia可用于预防登革热[6]。登革病毒基因组编码衣壳蛋白(C蛋白)、膜蛋白(M 蛋白)和包膜蛋白(E 蛋白)3个结构蛋白和7个非结构蛋白(non-structure protein,NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[7-8]。登革病毒的E蛋白和NS1蛋白都是抗体的主要靶点,其中E蛋白作为构成病毒体表面的主要成分,在抗体介导的免疫应答中作为最主要的靶点[9]。E蛋白含有约500个氨基酸,其中N端约400个氨基酸组成的膜外区从结构和功能上分为3个结构域:从氨基端到羧基端分别为结构域I(EDI)、结构域Ⅱ(EDII)和结构域Ⅲ(EDIII)[10]。EDⅢ含有多重构象的中和表位,是E蛋白中最主要的抗原区域[11],多项研究发现EDIII含有登革病毒单一血清型特异性表位和2~3种血清型的亚复合体反应表位以及4种血清型的复合体反应表位[12]。
本研究采用原核表达系统对登革病毒E蛋白和NS1蛋白融合的B细胞抗原表位进行表达,为登革检测试剂的开发提供候选抗原,为进一步开发登革抗体诊断试剂盒和新型登革疫苗奠定基础。
1 材料与方法
1.1 主要材料 大肠杆菌DH5α及表达载体pET-28a (+)购自上海捷瑞生物工程有限公司,PCR反应所用试剂、各种限制性内切酶和DNA Marker购自宝生物工程(大连)有限公司,质粒小提试剂盒购自天根生化科技有限公司,BL21(DE3)感受态细胞购自北京全式金生物技术有限公司,Protein Marker购自Thermo公司,IPTG、Acr、Bis和Tris购自Sigma公司,SDS购自Amresco公司,0.22 μm无菌滤器和透析袋购自Millipore公司,Ni-NTA亲和层析柱购自美国GE公司,抗6×H is 抗体购自Life Technologies公司,HRP标记的鼠抗人IgM购自北京博奥龙免疫技术有限公司,HRP标记的羊抗兔IgG、抗登革病毒E蛋白抗体(兔多抗)和抗登革病毒NS1蛋白抗体(兔多抗)购自北京博奥森生物技术有限公司,其他化学试剂均为国产分析纯。
1.2 方法
1.2.1 B细胞抗原表位的选择 参考文献[13-14],选择通过计算机软件筛选4种血清型登革病毒E蛋白共有的优势B细胞抗原表位和能诱导产生中和抗体的NS1蛋白共有抗原表位,各表位的来源、氨基酸序列及位置见表1。
1.2.2 融合基因的设计及合成 本研究把表1中登革病毒E蛋白和NS1蛋白的B细胞抗原表位序列用连接肽(EAAAK)2串联表达,构思和连接顺序如下:E蛋白序列1(3~14)+连接肽+ NS1蛋白序列(225~245)+连接肽+ E蛋白序列2(67~110)+连接肽+E蛋白序列3(244~276)+连接肽+E蛋白序列4(305~427),其中E蛋白序列4包含EDIII序列(305~394),以上E蛋白序列均为1~4型登革病毒共有的氨基酸序列,见参考文献[13],连接后的氨基酸序列见图1;因在大肠杆菌BL21 (DE3)中表达,所以选用大肠杆菌EscherichiacoliK12的偏嗜密码子对基因进行优化,但不改变编码的氨基酸序列。优化后的多表位基因(命名为rE基因)大小约816 bp,委托上海捷瑞生物工程有限公司合成其基因序列,用DNAStar分析其抗原性。
表1 登革病毒各抗原表位氨基酸序列
Tab.1 Epitope amino acid sequences of dengue virus

表位来源Epitopesources氨基酸序列Aminoacidsequences位置PositionECVGVGNRDFVEG3-14ENTTTDSRCPTQGEA67-80EVDRGWGNGCGLFG98-110EAKKQEVVVLGSQEGA244-258EMHTALTGATEIQTSGGTT259-276EWFKKGSSIGKMF391-402EGDTAWDFGSVGG416-427NS1WPKSHTLWSNGVLESEMIIPK225-245

图1 登革病毒重组抗原蛋白氨基酸序列
Fig.1 Amino acid sequence of dengue virus recombinant antigen protein
1.2.3 rE基因的PCR扩增和原核表达载体的构建与鉴定 根据rE基因序列,设计1对引物,在5′和3′端分别加入NcoI和XhoI酶切位点,按照常规体系,以rE基因克隆质粒为模板进行PCR,将NcoI和XhoI双酶切的PCR产物与表达载体pET-28a(+)用T4DNA连接酶连接,转化大肠杆菌DH5α感受态细胞,抽取质粒进行PCR,用XbaI、XhoI双酶切鉴定阳性克隆,并对序列进行测序分析。正确的重组质粒命名为pET28a-rE。
1.2.4 重组质粒的表达 将经鉴定正确的重组质粒pET28a-rE转化大肠杆菌BL21(DE3)感受态细胞,涂布于含50 mg /L卡那霉素的LB平板,37 ℃培养过夜。挑取生长良好的单菌落,接种于4 mL含50 mg /L卡那霉素的LB培养基,37 ℃振荡培养过夜。取培养过夜的培养基250 μL接种到5 mL含50 mg /L卡那霉素的LB培养基中,220 r/min摇菌,直到OD600为0.5~0.7。
1.2.5 融合蛋白的可溶性分析 诱导前立即取1 mL样本,10 000 g离心2 min,弃上清,用80 μL 1×PBS缓冲液重悬菌体沉淀后加入20 μL的5× loading buffer作为非诱导对照。向剩余的培养物中加入异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度为0.5 mmol/L,分别在37 ℃和15 ℃,220 r/min振摇4 h和16 h,诱导融合蛋白表达,收集第2个1 mL样本,12 000 g离心2 min,弃上清,用80 μL 1×PBS缓冲液重悬菌体沉淀后加入20 μL的5 × loading buffer作为诱导对照。从剩余的培养物中分别取37 ℃和15 ℃诱导后菌液2 mL,10 000 g离心2 min,弃上清,加500 μL的50 mmol/L Tris、300 mmol/L NaCl、pH 8.0缓冲液到离心后的沉淀混匀,超声波破碎,分别收集上清溶液和菌体沉淀,SDS-PAGE电泳检测融合蛋白在菌体沉淀和上清溶液中的表达情况。
1.2.6 纯化包涵体蛋白 5 L表达菌液,加入0.5 mmol/L IPTG在37 ℃振荡培养4 h后,离心收集菌体,加50 mmol/L Tris、300 mmol/L NaCl、pH 8.0裂解液混匀,超声破碎后12 000 r/min离心15 min。离心后的上清制样检测,离心后的沉淀用8 mol/L尿素重新溶解,16 000 r/min离心15 min,上清加入镍柱孵育1 h,用含50 mmol/L Tris、500 mmol/L NaCl、8 mol/L尿素、20 mmol/L咪唑、pH8.0缓冲液进行洗杂,用含50 mmol/L Tris、500 mmol/L NaCl、8 mol/L尿素、500 mmol/L咪唑、pH 8.0缓冲液进行洗脱,透析到含有25 mmol/L Tris、300 mmol/L NaCl、pH 8.0缓冲液过夜,再用超滤浓缩管浓缩透析后的溶液,采用BCA法测定其浓度。
1.2.7 纯化产物的Western blot鉴定 纯化的重组蛋白经10%SDS-PAGE分离后,电转移至PVDF膜上,将其浸在PBST(含5%BSA)中,37 ℃封闭2 h,PBST洗涤3次,将膜分别与His-Tag单抗、兔抗登革病毒E蛋白多克隆抗体和兔抗登革病毒NS1蛋白多克隆抗体温育1 h,洗涤,最后与HRP标记的羊抗兔IgG抗体温育1 h,显色。
1.2.8 自研间接ELISA检测登革热病人血清IgM抗体 收集临床诊断为登革热的血清标本8例和正常人血清标本8例,这8份登革热血清标本通过登革病毒诊断试剂盒检测血清NS1抗原和IgM抗体都是阳性,该试剂盒来自中山生物工程有限公司,应用间接ELISA原理检测人血清或血浆中登革病毒IgM抗体。本研究用5 μg重组蛋白包被ELISA板,用间接ELISA检测以上收集的标本,操作步骤参考上述试剂盒说明书,利用ROC曲线法确定阴阳性血清最佳临界值,取灵敏度和特异性之和最大的点定为临界点(cut off值)。
2 结 果
2.1 表达载体中的rE基因的序列分析 采用DNAStar软件中的protean对rE基因表达的蛋白进行分析,结果显示该重组多表位蛋白有良好的亲水性、柔性、抗原性及表面可及性,分析结果见图2。

图2 rE基因多表位蛋白的生物信息学分析Fig.2 Bioinformatic analysis of multiple epitopes of rE gene

M:DNA marker DL2000;1: PCR product of recombinant plasmid containing target gene; 2: PCR product of the plasmid was extracted after transformation of BL21 (DE3); 3: PCR product of empty plasmid.图3 重组表达质粒pET28a-rE的PCR鉴定Fig.3 Identification of recombinant expression plasmid pET28a-rE by PCR
2.2 重组表达质粒的鉴定 阳性菌经质粒PCR鉴定,可见477 bp的目的条带,见图3。提取的质粒用XbaI和XhoI双酶切,可见约5.1 kb的载体条带和863 bp的目的条带,见图4。测序结果显示其碱基序列与设计的rE基因序列完全一致,并形成完整的开放阅读框,表明rE基因已成功克隆至原核表达载体pET-28a(+)上。
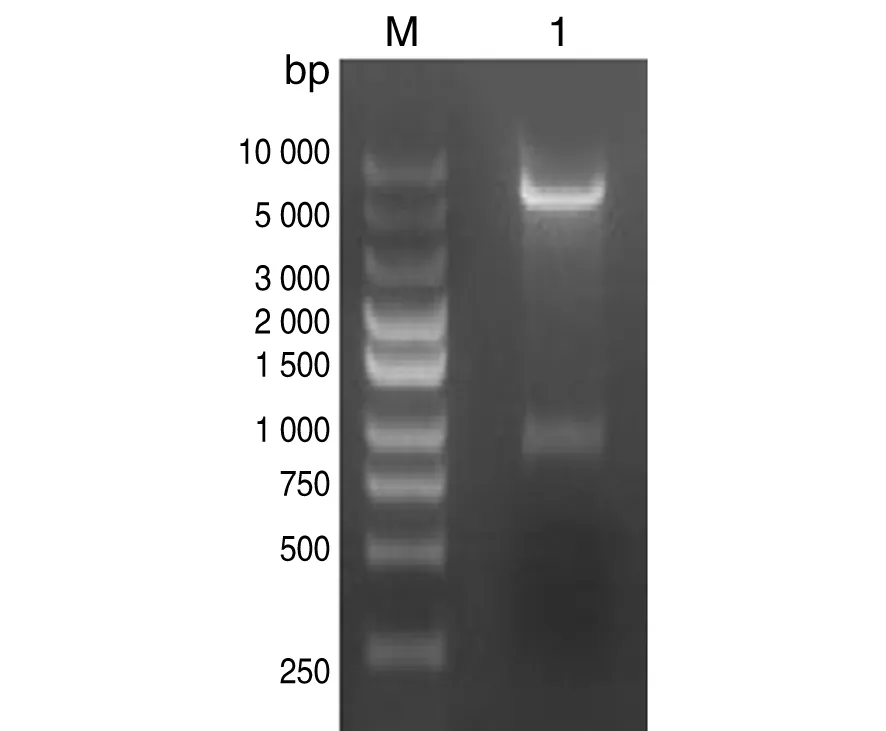
M:DNA marker DLTM10000;1:The recombinant expression plasmids were digested with XbaI and XhoI.图4 重组表达质粒pET28a-rE的酶切鉴定Fig.4 Recombinant expression plasmid pET28a-rE was digested by restriction enzyme digestion
2.3 不同温度诱导的重组蛋白表达结果 表达产物经SDS-PAGE分析,可见相对分子质量约32 kDa的目的蛋白条带,大小与预期相符。重组蛋白在15 ℃表达量很低,在37 ℃条件下的表达量高,主要是以包涵体的形式存在于沉淀中,通过灰度扫描软件分析显示其表达的重组蛋白约占超声破碎后沉淀蛋白量的57%,结果见图5。
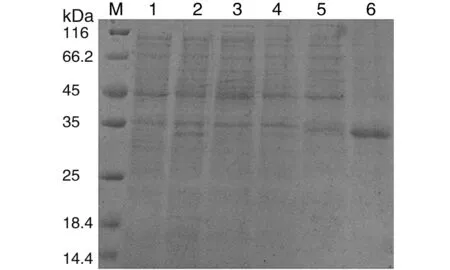
M: Protein marker; 1: Pre-induction samples; 2: Samples after induction at 37℃; 3: Supernatant of BL21(DE3)/ pET28a-rE after induction at 15℃; 4: Precipitate of BL21(DE3)/ pET28a-rE after induction at 15 ℃; 5: Supernatant of BL21(DE3)/ pET28a-rE after induction at 37 ℃; 6: Precipitate of BL21(DE3)/ pET28a-rE after induction at 37 ℃.图5 不同温度诱导的重组蛋白表达形式的SDS-PAGE结果分析Fig.5 SDS-PAGE analyses of recombinant proteins induced at different temperature
2.4 融合蛋白的包涵体破碎及纯化 纯化的重组蛋白经SDS-PAGE分析,可见相对分子质量约32 kDa的目的蛋白条带,通过灰度扫描软件分析,纯化前重组蛋白约占变性重溶离心后上清蛋白量的48%,纯化后重组蛋白纯度可达95%以上,浓度约0.5 mg/mL,结果见图6。
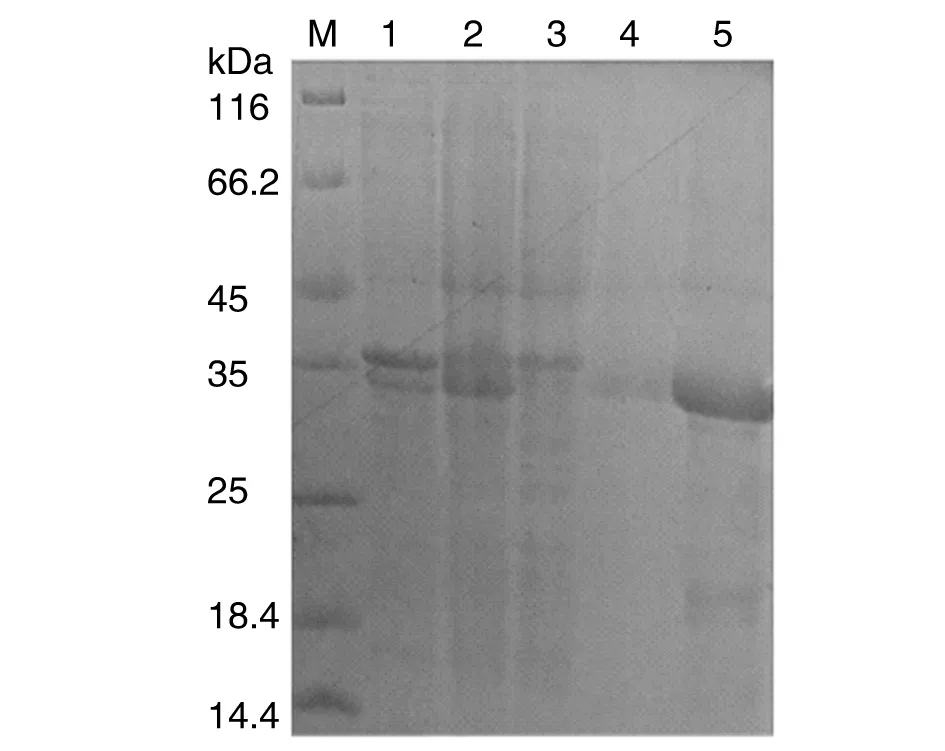
M:Protein marker;1:Re-dissolved after degeneration and then the precipitate was analyzed after centrifugation;2:Re-dissolved after degeneration and then the supernatant was analyzed after centrifugation;3:Collected liquid of inclusion body protein after column;4: The non-target protein was eluted with 20 mmol/L imidazole;5: The target protein was eluted with 500 mmol/L imidazole. 图6 重组蛋白纯化产物的SDS-PAGE分析Fig.6 SDS-PAGE analysis of purified recombinant protein products
2.5 Western blot鉴定 Western blot结果分析显示,纯化的重组蛋白分别与His-Tag单抗、兔抗E蛋白和兔抗NS1蛋白多克隆抗体特异性结合,在相对分子质量约32 kDa附近可见特异性反应条带,见图7。此外,图7C显示,重组蛋白在预期分子量附近还有其它反应条带,其原因可能是兔抗NS1蛋白多克隆抗体特异性不强。
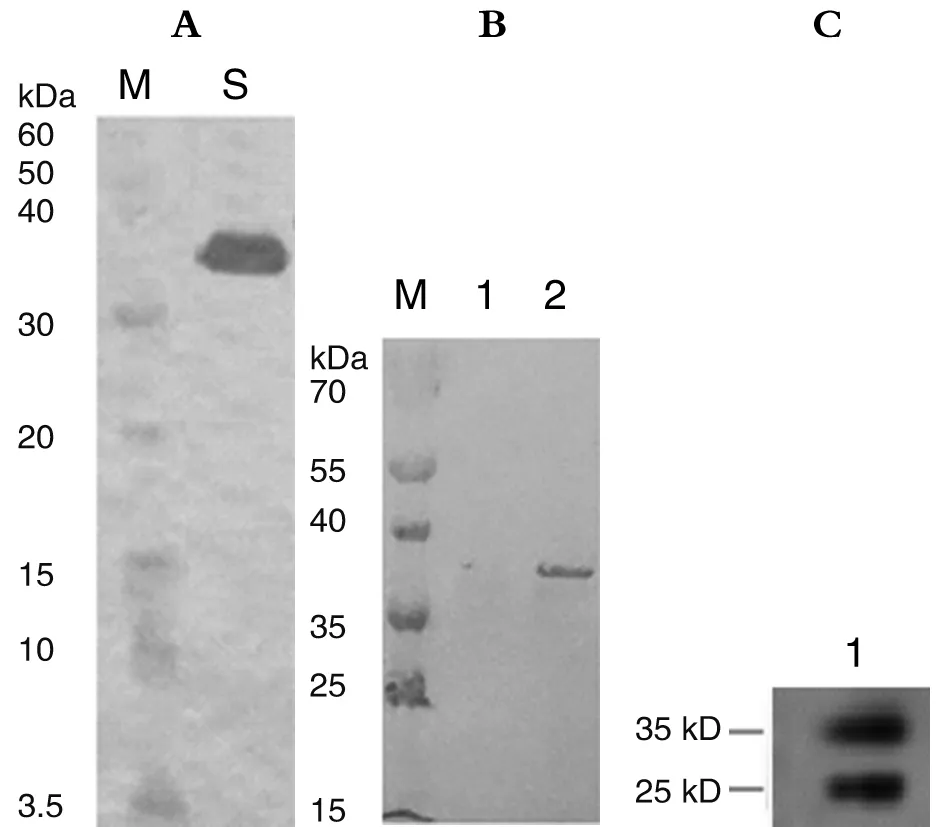
A: Recombinant protein was detected by immunoblotting with His-Tag monoclonal antibody;M: Protein marker;S: Purified recombinant protein.B: Western blotting was used to detect the expression of recombinant protein by rabbit anti-E protein polyclonal antibody; M: Protein marker;1: Negative control;2: Rabbit anti-E protein polyclonal antibody.C: Western blotting was used to detect the expression of recombinant protein by rabbit anti-NS1 protein polyclonal antibody;1: Rabbit anti-NS1 protein polyclonal antibody.图7 纯化产物的Western blot分析Fig.7 Western blot of purified recombinant protein
2.6 重组蛋白应用于间接ELISA的血清学评价 以自研间接ELISA检测后读取OD值,检测结果见表2。利用ROC曲线得到cut off值,当cut off值为0.377 5时,该诊断方法的灵敏度和特异性均为100%,ROC曲线如图8所示,曲线下面积为1,差异有统计学意义(P<0.05),说明这种诊断方法的准确性较高。

图8 间接ELISA检测登革病人血清ROC曲线图Fig.8 ROC of indirect ELISA in detecting sera from dengue patients
表2 自研间接ELISA检测结果
Tab.2 Self-study indirect ELISA test results
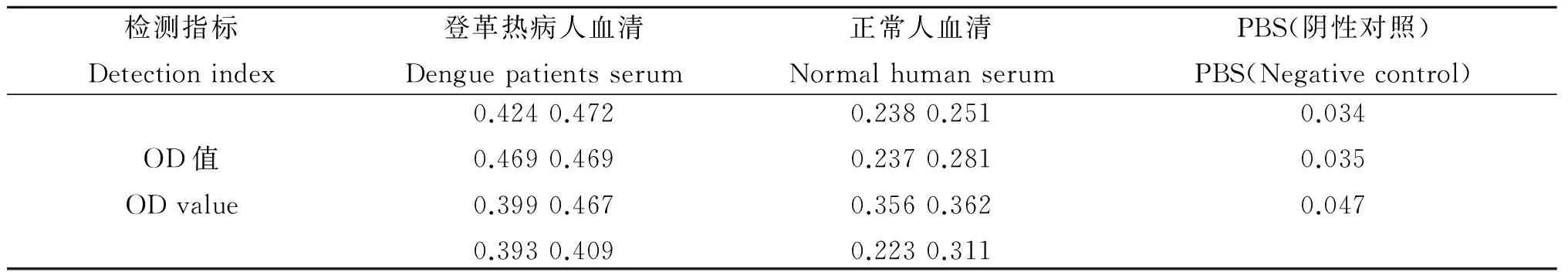
检测指标Detectionindex登革热病人血清Denguepatientsserum正常人血清NormalhumanserumPBS(阴性对照)PBS(Negativecontrol)OD值ODvalue0.4240.4720.4690.4690.3990.4670.3930.4090.2380.2510.2370.2810.3560.3620.2230.3110.0340.0350.047
3 讨 论
目前,登革病毒感染的实验室诊断主要有病毒分离培养、抗原检测、核酸检测和血清学检测。跟病毒分离培养和核酸检测相比,血清学检测由于价钱相对便宜和快速简便,因而在登革病毒感染的诊断中最常用,特别是对于抗登革病毒IgM抗体的检测[1,15]。国际公认研制较为成功的是澳大利亚PanBio公司生产的登革病毒IgM捕获ELSIA试剂盒,它采用登革病毒1-4型E基因N端80%的重组蛋白,4种重组抗原混和后应用于检测登革病毒感染者血清,具有高灵敏度和特异性[16]。从理论上来说四种型别登革病毒混合抗原具有更多的IgM抗体结合位点,但更多的IgM抗体结合位点往往会存在更大的空间位阻,有可能降低了抗原抗体结合的有效性。Panbio公司生产的登革病毒IgM捕获ELSIA试剂盒采用C6/36细胞培养登革病毒制备的混合抗原,不仅成本高,而且具有病毒污染的风险。本研究采用基因工程技术制备单一重组蛋白,更易于标准化、表达量高、不易污染且价格低廉。
一种有效的登革热疫苗应能够同时对4种血清型的登革病毒具有持久的抗病毒保护作用[17],登革病毒E蛋白结构域Ⅲ已成为重组亚单位疫苗发展的焦点[18-19]。研究表明能够同时针对4种血清型登革病毒,具有均衡且持久的抗病毒保护性免疫的登革热疫苗组分除了结构蛋白成分外还可能需要登革病毒NS1蛋白组分[20-22]。基于以上的研究报道,本研究构建的重组蛋白成分里包含4种血清型登革病毒共有的EDIII和NS1蛋白抗原表位。
为了更好地保持登革病毒各个B细胞表位的功能活性,本研究采用连接肽介入技术,连接肽的选择对构建有功能活性的融合蛋白很重要。考虑到功能域分离的空间与融合蛋白的稳定性和生物活性密切相关,刚性α螺旋连接肽在重组融合蛋白中最常使用的是(EAAAK)n (n≤6)[23],所以选用刚性连接肽(EAAAK)2。与柔性连接肽相比,刚性连接肽优势在于能提供相对稳定和可控的隔离效果,并且使融合蛋白较为稳定,不易被蛋白酶降解[24]。
本研究利用大肠杆菌表达系统成功表达4种血清型登革病毒多表位重组抗原,初步证明重组蛋白具有较好的免疫反应活性,可望用于登革热的临床血清学诊断。
[1] Guzman MG, Harris E. Dengue[J]. Lancet, 2015, 385(9966): 453-465.
[2] Bhatt S, Gething PW, Brady OJ, et al. The global distribution and burden of dengue[J]. Nature, 2013, 496(7446): 504-507.
[3] Shepard DS, Undurraga EA, Betancourt-Cravioto M, et al. Approaches to refining estimates of global burden and economics of dengue[J]. PLoS Negl Trop Dis, 2014, 8(11): e3306.
[4] Diamond MS, Pierson TC. Molecular insight into dengue virus pathogenesis and its implications for disease control[J]. Cell, 2015, 162(3): 488-492.
[5] Capeding MR, Tran NH, Hadinegoro SR, et al. Clinical efficacy and safety of a novel tetravalent dengue vaccine in healthy children in Asia: a phase 3, randomised, observer-masked, placebo-controlled trial[J]. Lancet, 2014, 384(9951): 1358-1365.
[6] Durbin AP. A dengue vaccine[J]. Cell, 2016, 166(1): 1.
[7] McArthur MA, Sztein MB, Edelman R. Dengue vaccines: recent developments, ongoing challenges and current candidates[J]. Expert Rev Vaccines, 2013, 12(8): 933-953.
[8] Lindenbach BD, Rice CM. Molecular biology of flaviviruses[J]. Adv Virus Res, 2003, 59: 23-61.
[9] Li M, Jin X. Current progress and future perspectives of dengue vaccine development[J]. Chem Life, 2014(1): 29-38. (in Chinese)
李敏, 金侠. 登革病毒疫苗研究现状与展望[J]. 生命的化学, 2014(1):29-38.
[10] Kuhn RJ, Zhang W, Rossmann MG, et al. Structure of dengue virus: implications for flavivirus organization, maturation, and fusion[J]. Cell, 2002, 108(5): 717-725.
[11] Kou TT, Ding TB. Recent advances on the structure and function of E protein of Flaviviruses[J]. Prog in Microbiol Immunol, 2014(3): 49-53. (in Chinese)
寇甜甜, 丁天兵. 黄病毒属病毒E蛋白结构和功能研究进展[J]. 微生物学免疫学进展, 2014(3):49-53.
[12] Li XQ. Neutralizing epitopes and functional study of antibodies against envelope protein domain III of dengue virus[D]. Guangzhou: Southern Medical University, 2013. (in Chinese)
李孝权. 登革病毒包膜E蛋白Ⅲ区抗体中和表位与功能研究[D]. 广州:南方医科大学, 2013.
[13] Hussain M, Idrees M, Afzal S. Development of global consensus of dengue virus envelope glycoprotein for epitopes based vaccine design[J]. Curr Comput Aided Drug Des, 2015, 11(1): 84-97.
[14] Omokoko MD, Pambudi S, Phanthanawiboon S, et al. A highly conserved region between amino acids 221 and 266 of dengue virus non-structural protein 1 is a major epitope region in infected patients[J]. Am J Trop Med Hyg, 2014, 91(1): 146-155.
[15] Guzman MG, Halstead SB, Artsob H, et al. Dengue: a continuing global threat[J]. Nat Rev Microbiol, 2010, 8(12 Suppl): S7-S16.
[16] Niu G, Pang Z, Guan C, et al. Dengue virus envelope domain III protein based on a tetravalent antigen secreted from insect cells: Potential use for serological diagnosis[J]. Virus Res, 2015, 201: 73-78.
[17] Fahimi H, Sadeghizadeh M, Mohammadipour M. In silico analysis of an envelope domain III-based multivalent fusion protein as a potential dengue vaccine candidate[J]. Clin Exp Vaccine Res, 2016, 5(1): 41-49.
[18] Gottschamel J, Lossl A, Ruf S, et al. Production of dengue virus envelope protein domain III-based antigens in tobacco chloroplasts using inducible and constitutive expression systems[J]. Plant Mol Biol, 2016, 91(4/5): 497-512.
[19] Ren SF, Cao GM, Tan F, et al. Construction of fusion immunoadjuvants Lipo peptides and envelope protein EDIII dengue virus tetravalent vaccine and its immune effect[J]. Chin J Zoonoses, 2016, (2): 119-123. (in Chinese)
任守凤, 曹国梅, 谭峰, 等. 融合免疫佐剂Lipo多肽与包膜蛋白EDⅢ区的登革病毒四价疫苗的构建及免疫效应研究[J]. 中国人兽共患病学报, 2016, (2):119-123.
[20] Chokephaibulkit K, Perng GC. Challenges for the formulation of a universal vaccine against dengue[J]. Exp Biol Med (Maywood), 2013, 238(5): 566-578.
[21] Halstead SB. Identifying protective dengue vaccines: guide to mastering an empirical process[J]. Vaccine, 2013, 31(41): 4501-4507.
[22] Swaminathan S, Batra G, Khanna N. Dengue vaccines: state of the art[J]. Expert Opin Ther Pat, 2010, 20(6): 819-835.
[23] Li JF, Wang CJ, Wu MC. Design of linker peptides and its application in fusion protein[J]. J Food Sci Biotechnol, 2015, (11): 1121-1127. (in Chinese)
李剑芳, 王春娟, 邬敏辰. 连接肽的设计及在融合蛋白中的应用[J]. 食品与生物技术学报, 2015(11):1121-1127.
[24] Huang ZL, Zhang C, Wu X, et al. Recent progress in fusion enzyme design and applications[J]. Chin J Biotech, 2012, (4): 393-409. (in Chinese)
黄子亮, 张翀, 吴希, 等. 融合酶的设计和应用研究进展[J]. 生物工程学报, 2012(4):393-409.
Expression and its serological preliminary evaluation on multi-epitope recombinant antigens of 4 serotypes of dengue virus
YI Fang-hao1,ZHANG Jun-ai1,LI Si-ping2,JIA Yan1,CHEN Chen1,YU Shi-yan1,WANG Xin1,DAI You-chao1,ZHUANG Ze-gang1,ZHENG Bi-ying1,XU Jun-fa1
(1.InstituteofLaboratoryMedicine,GuangdongMedicalUniversity,Dongguan523808,China;2.No.8HospitalofDongguanCity,Dongguan523808,China)
We expressed B cell epitopes of dengue virus envelope protein and NS1 protein in prokaryotic cells, and purified and evaluated for its serological activities. A recombinant multi-epitope chimeric gene named rE including eight B cell epitopes was connected by linker peptide (EAAAK)2and cloned into prokaryotic expression vector pET-28a(+), and transformed intoE.coliBL21(DE3) cells for expression under induction of IPTG. The expressed recombinant protein was purified with 6×His purification media, and identified by SDS-PAGE and Western blot, and its antigenicity was analyzed by using an indirect ELISA assay. The recombinant expression vector pET28a-rE was constructed and expressed in BL21(DE3) successfully,but the recombinant proteins mainly appeared as inclusion bodies.The target protein was obtained with high purity through the purification of affinity chromatography. SDS-PAGE and Western blot analysis showed that the molecular weight of fusion protein was in the expected line. The established indirect ELISA has high accuracy. This recombinant peptide antigen expressed inE.colihas good potential for serum testing.
dengue virus; antigen protein; prokaryotic expression; serological evaluation
Xu Jun-fa, Email:imxujunfa@163.com
10.3969/j.issn.1002-2694.2017.01.006
徐军发,Email:imxujunfa@163.com
1. 广东医科大学检验医学研究所,东莞 523808; 2.东莞市第八人民医院, 东莞 523808
R373.3
A
1002-2694(2017)01-0032-06
2016-10-24 编辑:刘岱伟
