铂类抗癌药物纳米递送系统的研究进展
2017-02-16王晓葳刘雪王丹姬海红夏桂民
王晓葳,刘雪,王丹,姬海红,夏桂民
铂类抗癌药物纳米递送系统的研究进展
王晓葳,刘雪,王丹,姬海红,夏桂民
1965 年,美国科学家 Rosenberg 偶然发现铂电极在通电状态下的分解产物可以有效抑制细菌的分裂,这些分解产物中最有效的是顺铂(cisplatin)。1969 年,Rosenberg 等[1]报告顺铂具有抗癌活性;1972 年,美国国家癌症研究所正式将顺铂列为抗癌研究课题,从此拉开了铂类抗癌药物研究的序幕。
目前全球已批准上市的铂类抗癌药物有顺铂、卡铂(carboplatin)、奥沙利铂(oxaliplatin)、奈达铂(nedaplatin)、庚铂(heptaplatin)、洛铂(lobaplatin)[2]及米铂(miriplatin)等,其广泛用作卵巢癌、睾丸癌、头颈部癌、非小细胞肺癌以及其他恶性肿瘤化疗的首选药物。据统计,以铂类抗癌药为主的或有其参与的化疗方案占所有临床化疗方案的 70% ~ 80%。铂类药物从 1978 年顺铂应用于临床开始,到二代的卡铂、三代的奥沙利铂及米铂经历了近 40 年的发展,这期间,铂类药物在肿瘤化疗方面做出了卓越贡献,展现了广阔的前景。
铂类抗癌药也像绝大多数化疗药物一样具有体内分布缺乏选择性、易产生剂量依赖性毒副反应等问题。这不仅造成铂类药物临床使用剂量受限,还使得铂类药物在杀伤肿瘤细胞的同时也严重损伤了正常细胞、组织,导致患者因不能耐受肾毒、胃肠道毒、耳毒及神经毒性等副反应而被迫终止化疗,严重影响肿瘤化疗成功率。因此,药物学家一直在积极探索新的方法力争突破现有局限,尤其在发展增效减毒的新型铂类药物纳米递送系统方面开展了诸多探索与研究。药物学家期望借助纳米递送系统改变药物的体内分布,实现药物至肿瘤的靶向递送,以提高药物在病灶的浓度并减少药物在正常组织、细胞中的积累,减轻、减少毒副作用。目前国内外对铂类药物的纳米递送系统研究依然活跃,现对其综述如下:
1 脂质体纳米递送系统
脂质体是一种粒径在几十纳米至几微米的、具有脂质双分子层结构的球状载体,其脂质双分子层结构决定了药物可根据其自身疏水、亲水性质,或插入疏水的脂质双分子层或包封于脂质体内水相[3]。脂质体具有良好的生物相容性、高载药率和良好的药代动力学特征,适合作为铂类药物的递送系统[4]。
1.1 顺铂脂质体
顺铂脂质体是铂类药物递送系统中研究最多的一类,这类脂质体进入临床试验的有 SPI-77(SPI-77 B103)、Lipoplatin、LiPlaCis 和 L-NDDP 等[5]。
SPI-77 是由 Alza 公司研究开发,第一个进入临床试验的顺铂脂质体。其脂质双分子层由氢化大豆卵磷脂(HSPC)、聚乙二醇二硬脂酸磷脂酰乙醇胺(PEG-DSPE)和胆固醇组成[6]。SPI-77 的 I 期临床试验结果表明,以顺铂游离药物作对照,SPI-77 的稳定性更高,更易在肿瘤部位高度累积,且安全性也有提高[7]。但在 II 期临床试验对非小细胞肺癌的治疗中,SPI-77 没有表现出良好的临床疗效,之后的改进型 SPI-77 B103 效果依然不够明显。究其原因主要是这两类脂质体均不能促进药物跨膜转运,必须借助磷脂酶降解脂质双分子层后才能释放药物,而相对双分子层的脂质而言,内源性磷脂酶的量明显不足,这使得两者在肿瘤组织中的积蓄量虽然很大,但其发挥抗肿瘤活性的铂-DNA(Pt-DNA)复合物的形成量却仅为顺铂游离药物的 30%,故两者的临床试验均宣告终止[7-8]。从 SPI-77 的研发过程不难发现,良好的抗癌药物载体不仅需要将药物准确、安全地运送到肿瘤部位,还应该能使药物有效地从载体中释放并发挥疗效。
Lipoplatin 是 Regulon 公司研发的顺铂脂质体,其阴离子双分子层由二棕榈酰磷脂酰甘油(DPPG)、大豆卵磷脂(SPC-3)、胆固醇和甲氧聚乙二醇二硬脂酸磷脂酰乙醇胺(mPEG2000-DSPE)组成[9],其中阴离子脂质 DPPG 通过静电引力作用促使带正电的顺铂被包裹于脂质体中,提高了顺铂的包封率[10]。临床试验中,Lipoplatin 能够延长药物在肿瘤部位的驻留时间,且仅表现出轻微的血液和胃肠道毒性,而未见其他特征性不良反应[11]。Lipoplatin 单独用药以及与吉西他滨等联合用药治疗包括非小细胞肺癌在内的多种癌症的临床试验表明,与顺铂相比,Lipoplatin 具有更好的治疗效果[12-13]。有报道显示,该剂型已于 2009 年进入 III期临床研究[14]。
LiPlaCis 是一种新颖的顺铂脂质体,它利用肿瘤部位具有丰富的磷脂酶 A2的特点,通过磷脂酶对脂质体的水解实现在肿瘤部位释放药物[4]。但由于 LiPlaCis 在 I 期临床试验中表现出明显的肾毒性和急性输液反应,故其临床试验终止[15]。尽管如此,LiPlaCis 还是为我们提供了一个实现靶向后快速释放药物的新思路。
L-NDDP 是由 Antigenie 公司开发的一种顺铂前体[顺式-二新癸酸根-反式-(1R, 2R-环己二胺)合铂 II,NDDP]的脂质体。L-NDDP 是由磷脂材料二肉豆蔻酰磷脂酰胆碱(DMPC)和二肉豆蔻酰磷脂酰甘油(DMPG)组成的多室脂质体,利用该脂质体与氯化物进行反应的方法可以将顺铂前体转化为顺铂同时显著增加顺铂的包封率[16]。但 NDDP体外无活性,需降解活化才能发挥效果。研究结果显示,NDDP 在 L-NDDP 中的降解活化严重依赖于其处方中的酸性脂质材料 DMPG,且这种活化不具有严格意义上的量效关系,导致无法精准控制 NDDP 的降解活化率;加之在NDDP 脂质体存放过程中,NDDP 不断被降解、活化、渗漏等,导致其稳定性较差,故其临床试验也终止于 II 期临床[17]。
除了已进入临床试验阶段的顺铂脂质体之外,近年来药学科学家也在积极探索新型顺铂复合物脂质体,以解决顺铂毒性大、载药量低、释药困难等问题。如 Zhou 等[18]将顺铂与十八烯酸的羧基聚合并包载于卵磷脂、十八油酸、胆固醇和 mPEG-DSPE 制备的空白脂质体,提高了顺铂的载药量和释放量,得到粒径为(155.4 ± 16.1)nm、电位为(–50.92 ± 1.19)mV、包封率大于 90% 的顺铂脂质体。体外释放试验中,这种顺铂脂质体在前 8 h 表现出突释效应,在 48 h内释药量达到 45.4%,表现出良好的药物持续释放效果。其原因是在药物释放后期,顺铂的氯离子与十八烯酸的羧基发生了交换反应,使得顺铂可以继续释放。目前这种顺铂脂质体仍处于临床前研究阶段,作为一种有希望的顺铂复合物脂质体,其后续实验结果值得我们期待。
1.2 奥沙利铂脂质体
进入临床试验的奥沙利铂脂质体有 Lipoxal 及MBP-426 等。
Lipoxal 是由 Regulon 公司研发的奥沙利铂脂质体。虽然体外试验表明 Lipoxal 抗肿瘤活性较弱,但是在 I 期临床试验中,Lipoxal 表现出与游离奥沙利铂等效的抗肿瘤活性和更小的毒副作用,其中骨髓抑制、胃肠道毒性的降低尤为明显[19]。其临床价值还需要通过进一步的临床试验进行验证。
MBP-426 是 Mebiopharm 公司研发的一种由转铁蛋白修饰的奥沙利铂脂质体。通过与转铁蛋白受体连接,MBP-426 可以有效介导药物优先与肿瘤细胞结合。在 I 期临床试验中 MBP-426 已经表现出有效的抗肿瘤活性,其II 期临床试验正在进行[17]。
1.3 米铂脂质体
米铂脂质体(lipomiriplatin)由中国医学科学院研究开发[20]。米铂是一种抗癌谱广、疗效确切的新型铂类抗癌药物,但其游离形式给药无效、剂型单一。目前米铂仅有混悬注射液一种上市剂型,使用前须将米铂冻干粉混悬于专用溶媒(碘化罂粟籽油脂肪酸乙酯)中调配成油状混悬液,并在1 h 内经肝动脉栓塞给药,这种剂型仅限于肝癌的介入性化疗[21]。Liu 等[20]发现组成脂质体的磷脂材料二硬脂酰磷脂酰乙醇胺(DSPE)、DMPG 及 DMPC 等分子结构与米铂的分子结构十分相似,根据“相似相溶”原理,推测米铂分子将会排列于 DSPE 等磷脂材料形成的脂质双分子层中,被脂质体稳定包载(图 1)。后经研究证实,利用薄膜分散法米铂被成功包载于脂质体中,且其稳定性和抗肿瘤活性均不依赖于处方中的磷脂材料,这一点不同于以往的某些铂类药物脂质体。制备的米铂脂质体粒度分布均匀[(99.71 ± 0.56)nm],包封率高(> 95%),载药量大(2.2 mg/ml),可显著诱导多种肿瘤细胞的凋亡,且抗癌活性明显优于顺铂注射液、奥沙利铂注射液,米铂脂质体有望进入临床研究。
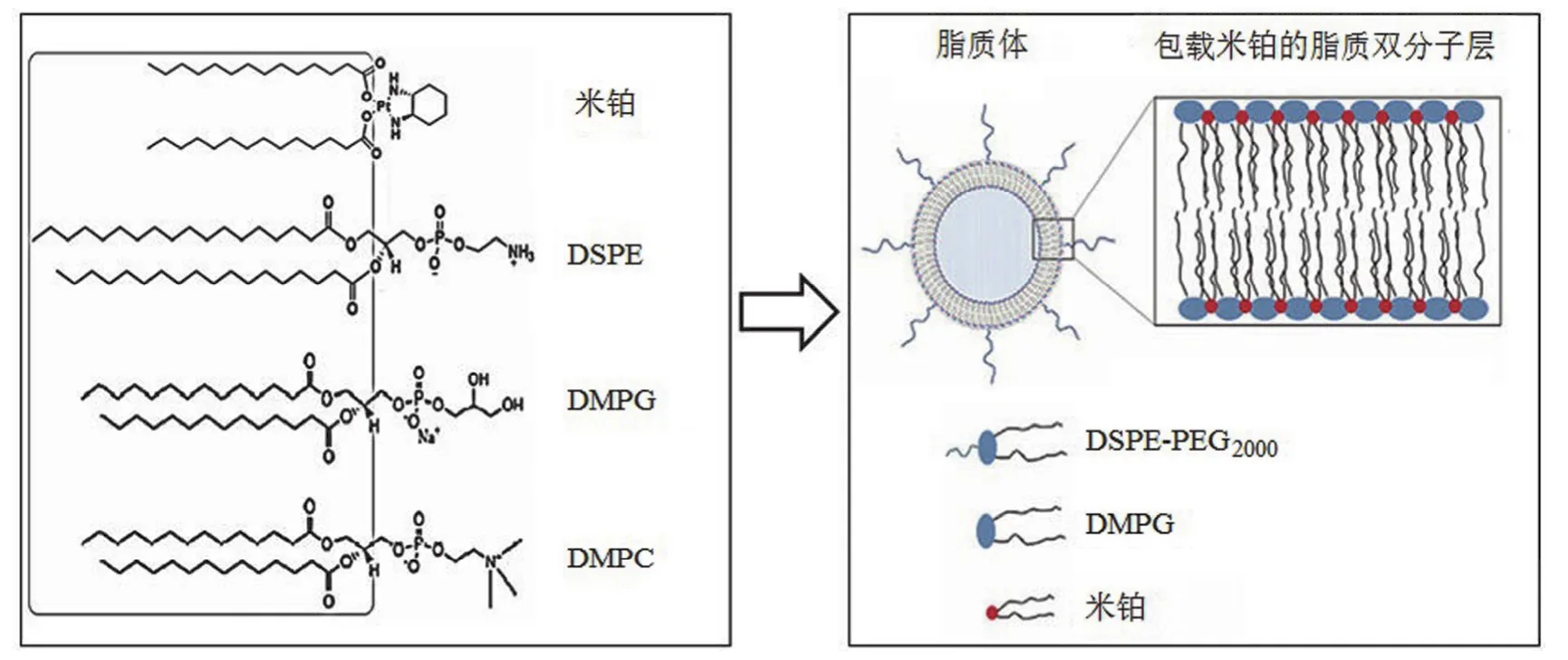
图 1 米铂和磷脂材料(DSPE、DMPG、DMPC)的化学结构[20]
2 纳米囊递送系统
纳米囊是将固体药物或液体药物作为囊心物包裹而形成的药库型球状纳米粒。纳米囊(图 2)由聚合物外壳及壳内的空腔组成,其壳内的空腔可以用来包裹油性或水性药物,是一类亚显微胶状药物载体系统,具有小粒子特征(10 ~ 1000 nm),可穿越生物膜屏障和网状内皮组织系统到达传统药物无法到达的人体特定部位,从而建立新的给药途径[23]。纳米囊的特殊结构使其具有较高的药物包封率并可实现药物的缓释[24]。有研究报道了顺铂纳米囊及顺铂与多柔比星共载的纳米囊[22, 25-26]。
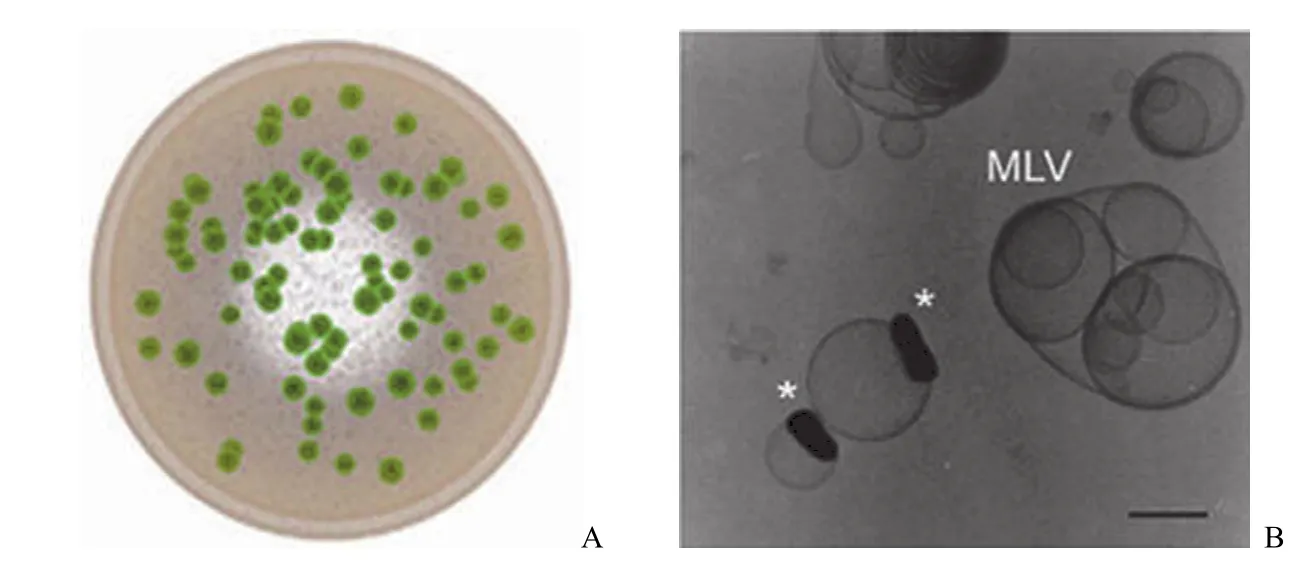
图 2 纳米囊结构示意图(A)[17]与冷冻电镜下顺铂纳米囊实物图(B)[22]
2.1 顺铂纳米囊
Burger 等[22]制备了脂包衣的顺铂纳米囊,这种顺铂纳米囊表面带负电荷,粒径从 50 ~ 250 nm 不等。向处方中加入胆固醇、PEG 修饰的脂质可以增加纳米囊的稳定性。顺铂纳米囊与上述顺铂脂质体相似,但是比脂质体有更高的载药量,药脂比可以超过 10∶1(w/w)。但是顺铂纳米囊并没有在小鼠的卵巢癌模型中表现出比顺铂脂质体更强的抗肿瘤活性。一种观点认为出现这种情况的原因是顺铂纳米囊的高载药量使其给药剂量偏小,这样在给药初始没有足够的药物粒子使网状内皮系统达到饱和状态,使得顺铂的纳米囊更容易被运送至肝脏、脾脏等部位而使肿瘤部位的药物累积量不足[25]。尽管如此,这种制备纳米囊的技术还是为提高药物包封率并包裹其他诸如卡铂类药物提供了参考[17]。
2.2 顺铂-多柔比星共载纳米囊
铂类药物常与传统抗癌药物联合用药,利用纳米囊具有高药物包封率的特点,实现铂类药物与传统抗癌药物的共载,为纳米囊的应用提供了新的思路。Lu 等[24]以带正电的壳聚糖-聚甲基丙烯酸(CM)为材料制备纳米囊,并以它作为载体共载肽修饰的顺铂(PtALy)与多柔比星(doxrobicin)(递送系统简称:CM-Dox-PtALy),用于非肌层浸润性膀胱癌的治疗。临床前试验表明,这种纳米囊系统容易被细胞摄取,在膀胱内腔表面可长时间停留且对组织没有损伤,有希望应用于膀胱内给药以治疗非肌层浸润性膀胱癌。
3 胶束递送系统
胶束通过疏水和亲水的两性片段或接枝共聚物自组装形成,其内核为疏水结构,为加载药物提供空间,其外壳为亲水结构,可以使胶束在水溶液中稳定存在[16]。通过对胶束表面进行 PEG 化修饰还可以延长其在体内的循环时间。用聚氨基酸类物质制备胶束型铂类制剂可以实现药物在肿瘤部位的被动靶向,如聚天冬氨酸(PAsp)和聚谷氨酸(PGlu)[26]。聚氨基酸中的羧基可以与顺铂、奥沙利铂等金属药物结合,当遇到氯离子时,胶束又可以释放出游离药物[16]。
3.1 顺铂胶束 NC-6004
Nishiyama 等[27]以聚乙二醇-聚天冬氨酸(PEG-PAsp)为材料制备了包封率较高的顺铂胶束,与游离药物相比,顺铂胶束可以将更多的顺铂传递至肿瘤部位,而且其肾毒性也较游离药物有所降低。但是以 PEG-PAsp 为材料制备的顺铂胶束稳定性差,在生理盐水浓度下只能稳定保存 10 h,之后出现胶束裂解、药物被释放出来的情况[17]。通过进一步研究,人们发现利用聚乙二醇-聚谷氨酸(PEG-PGlu)制备顺铂胶束可以提高稳定性[27],NC-6004 就是根据这个原理制备的顺铂胶束。临床数据表明,NC-6004 可以有效延长药物在体内的循环时间,提高药物在肿瘤部位的累积并实现抑制肿瘤生长的作用[28]。现在利用 NC-6004 治疗胰腺癌已经进入 III 期临床,另外针对头颈部癌、非小细胞肺癌的临床试验也在进行中[16]。
3.2 顺铂-紫杉醇共载胶束
利用一种新合成的两亲性三嵌段共聚物聚乙二醇-b-聚谷氨酸-b-聚苯丙基氨酸[PEG–PGlu–P(Phe)]制备胶束可以实现紫杉醇与顺铂的共载。在这个体系中,紫杉醇被载于P(Phe) 形成的疏水内核中,顺铂与 PGlu 外壳结合,而PEG 作为胶束外壳的修饰物延长了药物在体内的循环时间[16]。
3.3 米铂胶束
Zhang 等[29]利用一种新合成的含有二硫键的共聚物单芘端基化聚二甲氨基丙烯酸乙酯(pyrene-PDMAEA)成功制备了还原响应型米铂胶束。芘自身的强疏水性质使该胶束体系具有较低的临界胶束浓度(6.09 μg/ml)并可以在血液中稳定存在。同时聚合物中的二硫键使得胶束具有还原响应性质,当胶束被还原性的肿瘤细胞胞吞后可以快速释放米铂,从而达到快速释药的目的。
4 有机-无机杂合型纳米粒递送系统
通过将有机物与金属结合位点的连接得到的金属有机物结构(metal-organic frameworks,MOFs)是一种新兴的杂合材料,利用这种材料制备的药物载体拥有金属无机物和有机物的双重特点。首先它具有金属无机物的多孔结构、高比表面积、结构易变的特点,可以实现药物的高效率包载和吸收;另外这种载体也可以利用接入的有机物实现药物的靶向递送[16]。除上述特点,MOFs 自身的特点更增加了其成为药物递送系统的希望。首先这种材料无毒、可生物降解;另外这种材料具有有序排列的晶体结构,这不但使我们利用多种技术对其进行表征成为可能,还使这种材料形成的药物载体具有合适的粒径以便控制其在体内的药物释放行为[30]。有文献报道,通过将铂类药物包载于 MOFs,同时使小干扰 RNA(siRNA)通过配位作用附着于 MOFs 的表面可以实现铂类药物与 siRNA 的共载,提高体内的抗癌疗效[31]。
5 纳米超分子型递送系统
超分子是由两种或两种以上分子依靠分子间相互作用结合在一起组成的复杂、有组织的聚集体,近年来有报道通过制备纳米超分子系统实现铂类药物的递送。用于递送铂类药物的纳米超分子系统大致可以分为两类,一类是通过修饰磷脂得到脂类超分子,用于包载铂类药物。2011 年,Khiati 等[32]通过将核苷酸分子连接于脂质分子的亲水头部得到了一种新颖的脂类杂化分子“核苷脂”,并利用核苷酸分子的极性头部能够引导聚合物自组装的特点成功制备了载药量高、稳定的顺铂纳米超分子系统。另外一类是直接将待包载的铂类药物整合入磷脂分子中,利用这种方法可以得到较高的药-脂比。2012 年,Aryal 等[33]通过将疏水的酰基链连接于铂分子中心的方法得到了一种两亲性的铂类聚合物。2013 年,Accardo 等[34]通过将铂与两亲性分子amino-EtGly-PEG27-(C18)2连接也得到了一种具有两亲性的铂类聚合物。这两种化合物都可以自组装成超分子纳米粒。Accardo 等合成的两亲性聚合物还可以与另一种含有奥曲肽的两亲性分子单体共聚合。奥曲肽是一种可以识别 II型生长激素抑制素的受体(SSTR2),这种受体在很多肿瘤组织都过表达。但是,目前这些研究还处于初步探索阶段,并没有确切的体内适应证[35]。
6 结语
铂类抗癌药在过去近 40 年的肿瘤化疗中贡献卓越,但由于其在正常组织和肿瘤部位之间选择性较差,该类药物在发挥疗效的同时,也产生了较大的毒副作用。为了克服此不足,科学家们一直在积极探索增效减毒的新型递送系统,尽管借鉴了 20 世纪末已上市且临床疗效显著的阿霉素脂质体、紫杉醇脂质体等成熟剂型,但至今全球范围内一线抗肿瘤铂类药物的纳米递送新制剂仍未见有获准上市的报道[16],进展较快且成功进入 III 期临床的铂类药物纳米粒只有 Lipoplatin 和 NC-6004,其他铂类药物纳米递送系统的临床试验都因各种各样的原因宣告终止。
作者认为铂类纳米递送系统的研究受挫主要原因在于纳米化后的药物与游离药相比体内生物学行为、生物学特性发生了很大的变化,已报道的作用机制几乎都是笼统说明纳米粒被胞吞后发挥疗效,但这种泛泛的解读并未准确阐明纳米粒到底如何在体内发挥作用,不能为后续的纳米粒研究和再优化提供更多的理论指导。所以,清晰阐述铂类纳米递送系统从入胞、胞内转运、降解活化到靶点结合等一系列清晰的、全方位的作用机制显得必要而迫切。作用机制可以帮助我们了解纳米粒在体内的详尽作用过程,从而为科学地设计纳米递送系统,合理地设计、选用智能高分子生物材料提供指导依据,这对推动铂类药物纳米化深入研究直至取得突破性进展至关重要。相信在不久的将来会有理想的铂类新型纳米递送系统应用于临床,惠及肿瘤患者。
[1] Rosenberg B, VanCamp L, Trosko JE, et al. Platinum compounds: a new class of potent antitumour agents. Nature, 1969, 222(5191): 385-386.
[2] Dilruba S, Kalayda GV. Platinum-based drugs: past, present and future. Cancer Chemother Pharmacol, 2016, 77(6):1103-1124.
[3] Jiao J, Jiang GP, Deng YH. Summary on liposomes for drug delivery in 50 years development course. J Shenyang Pharm Unive, 2014, 31(9):738-754. (in Chinese)
焦姣, 蒋宫平, 邓意辉. 脂质体药物传递系统的 50年发展历程概述. 沈阳药科大学学报, 2014, 31(9):738-754.
[4] Liu D, He C, Wang AZ, et al. Application of liposomal technologies for delivery of platinum analogs in oncology. Int J Nanomedicine, 2013, 8:3309-3319.
[5] Babu A, Amreddy N, Ramesh R. Nanoparticle-based cisplatin therapy for cancer. Therapeutic Delivery, 2015, 6(2):115-119.
[6] Meerum Terwogt JM, Groenewegen G, Pluim D, et al. Phase I and pharmacokinetic study of SPI-77, a liposomal encapsulated dosage form of cisplatin. Cancer Chemother Pharmacol, 2002, 49(3):201-210.
[7] Zamboni WC, Gervais AC, Egorin MJ, et al. Systemic and tumor disposition of platinum after administration of cisplatin or STEALTH liposomal-cisplatin formulations (SPI-077 and SPI-077 B103) in a preclinical tumor model of melanoma. Cancer Chemother Pharmacol, 2004, 53(4):329-336.
[8] White SC, Lorigan P, Margison GP, et al. Phase II study of SPI-77 (sterically stabilised liposomal cisplatin) in advanced non-small-cell lung cancer. Br J Cancer, 2006, 95(7):822-828.
[9] Stathopoulos GP, Boulikas T. Lipoplatin formulation review article. J Drug Deliv, 2012, 2012:581363.
[10] Boulikas T. Clinical overview on Lipoplatin: a successful liposomal formulation of cisplatin. Expert Opin Investig Drugs, 2009, 18(8): 1197-1218.
[11] Stathopoulos GP, Boulikas T, Vougiouka M, et al. Pharmacokinetics and adverse reactions of a new liposomal cisplatin (Lipoplatin): phase I study. Oncol Rep, 2005, 13(4):589-595.
[12] Ravaioli A, Papi M, Pasquini E, et al. Lipoplatin monotherapy: A phase II trial of second-line treatment of metastatic non-small-cell lung cancer. J Chemother, 2009, 21(1):86-90.
[13] Mylonakis N, Athanasiou A, Ziras N, et al. Phase II study of liposomal cisplatin (Lipoplatin) plus gemcitabine versus cisplatin plus gemcitabine as first line treatment in inoperable (stage IIIB/IV) non-small cell lung cancer. Lung Cancer, 2010, 68(2):240-247.
[14] Kosmas C, Angel J, Athanasiou A, et al. 9088 Phase III study of Lipoplatin plus Gemcitabine versus Cisplatin plus Gemcitabine in advanced NSCLC; interim analysis. Eur J Cancer Suppl, 2009, 7(2): 531.
[15] de Jonge MJ, Slingerland M, Loos WJ, et al. Early cessation of theclinical development of LiPlaCis, a liposomal cisplatin formulation. Eur J Cancer, 2010, 46(16):3016-3021.
[16] Duan X, He C, Kron SJ, et al. Nanoparticle formulations of cisplatin for cancer therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2016, 8(5):776-791.
[17] Oberoi HS, Nukolova NV, Kabanov AV, et al. Nanocarriers for delivery of platinum anticancer drugs. Adv Drug Deliv Rev, 2013, 65(13-14):1667-1685.
[18] Zhou X, Wang J, Wu J, et al. Preparation and evaluation of a novel liposomal formulation of cisplatin. Eur J Pharm Sci, 2014, 66:90-95.
[19] Stathopoulos GP, Boulikas T, Kourvetaris A, et al. Liposomal oxaliplatin in the treatment of advanced cancer: a phase I study. Anticancer Res, 2006, 26(2B):1489-1493.
[20] Liu S, Li Y, Wang X, et al. Preparation, characterization, and antitumor activities of miriplatin-loaded liposomes. J Pharm Sci, 2016, 105(1):78-87.
[21] Zhao J, Ma JJ. Progress in pharmacological and clinical studies of miriplatin on interventional therapy of hepatocellular carcinoma. Chin J New Drugs, 2012, 21(18):2097-2099. (in Chinese)赵俊, 马俊杰. 肝癌介入治疗新药米铂的药理与临床研究, 中国新药杂志, 2012, 21(18):2097-2099.
[22] Burger KN, Staffhorst RW, de Vijlder HC, et al. Nanocapsules: lipid-coated aggregates of cisplatin with high cytotoxicity. Nat Med, 2002, 8(1):81-84.
[23] Huang HN, Zhang DS, Zhang L, et al. Investigation on nanocapsule and its preparation methods. J Hebei North Univ (Med Ed), 2010, 27(3):59-61. (in Chinese)黄红娜, 张丹参, 张力, 等. 纳米囊及其制备方法的研究. 河北北方学院学报(医学版), 2010, 27(3):59-61.
[24] Lu S, Xu L, Kang ET, et al. Co-delivery of peptide-modified cisplatin and doxorubicin via mucoadhesive nanocapsules for potential synergistic intravesical chemotherapy of non-muscle-invasive bladder cancer. Eur J Pharm Sci, 2016, 84:103-115.
[25] Bryde S, de Kroon AI. Nanocapsules of platinum anticancer drugs: development towards therapeutic use. Future Med Chem, 2009, 1(8): 1467-1480.
[26] Lavasanifar A, Samuel J, Kwon GS. Poly(ethylene oxide)-blockpoly(L-amino acid) micelles for drug delivery. Adv Drug Deliv Rev, 2002, 54(2):169-190.
[27] Nishiyama N, Okazaki S, Cabral H, et al. Novel cisplatin-incorporated polymeric micelles can eradicate solid tumors in mice. Cancer Res, 2003, 63(24):8977-8983.
[28] Plummer R, Wilson RH, Calvert H, et al. A phase I clinical study of cisplatin-incorporated polymeric micelles (NC-6004) in patients with solid tumors. Br J Cancer, 2011, 104(4):593-598.
[29] Zhang Y, Hu D, Han S, et al. Preparation and evaluation of reduction-responsive nano-micelles for miriplatin delivery. Exp Biol Med (Maywood), 2016, 241(11):1169-1176.
[30] Ibrahim M, Sabouni R, Husseini GA. Anti-cancer drug delivery using metal organic frameworks (MOFs). Curr Med Chem, 2016. [Epub ahead of print]
[31] He C, Lu K, Liu D, et al. Nanoscale metal-organic frameworks for the co-delivery of cisplatin and pooled siRNAs to enhance therapeutic efficacy in drug-resistant ovarian cancer cells. J Am Chem Soc, 2014, 136(14):5181-5184.
[32] Khiati S, Luvino D, Oumzil K, et al. Nucleoside-lipid-based nanoparticles for cisplatin delivery. ACS Nano, 2011, 5(11):8649-8655.
[33] Aryal S, Hu CM, Zhang L. Synthesis of ptsome: a platinum-based liposome-like nanostructure. Chem Commun (Camb), 2012, 48(20): 2630-2632.
[34] Accardo A, Mangiapia G, Paduano L, et al. Octreotide labeled aggregates containing platinum complexes as nanovectors for drug delivery. J Pept Sci, 2013, 19(4):190-197.
[35] Ringhieri P, Pannunzio A, Boccarelli A, et al. Effect of cisplatin containing liposomes formulated by unsaturated chain-containing lipids on gynecological tumor cells. J Liposome Res, 2016, 26(4):307-312.
我会上报《2016年度医药生物技术行业国家“十三五”规划进展评估报告》
根据《国家发展改革委办公厅关于请部分行业协会商会开展 2016 年度“十三五”规划实施评估工作的通知》(发改办规划〔2016〕2682 号)文件要求,我会在会员企业和分支机构进行了广泛调研和深入交流,完成了《2016 年度医药生物技术行业国家“十三五”规划进展评估报告》,现已上报国家发展改革委。
10.3969/cmba.j.issn.1673-713X.2017.01.010
国家重点研发计划纳米科技重点专项(2016YFA0201504);国家自然科学基金面上项目(81673383)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所制剂室(王晓葳、刘雪、王丹、夏桂民);266042 青岛科技大学化工学院(刘雪);610106 成都大学研究生处(姬海红)
夏桂民,Email:xiaguimin@126.com
2016-11-09
