胃低分化腺癌中肿瘤易感基因101的表达与细胞增殖的关系
2017-02-13于鹏杰王焕丽张成武马玉滨
于鹏杰 戈 锐 王焕丽 张成武 燕 速 马玉滨
(青海大学附属医院胃肠肿瘤外科,青海 西宁 810000)
胃低分化腺癌中肿瘤易感基因101的表达与细胞增殖的关系
于鹏杰 戈 锐 王焕丽1张成武 燕 速 马玉滨
(青海大学附属医院胃肠肿瘤外科,青海 西宁 810000)
目的 观察胃低分化腺癌中肿瘤易感基因(TSG)101蛋白的表达,关注其与增殖细胞核抗原(PCNA)标记的增殖指数的相关性。方法 57例经病理确诊为胃低分化腺癌的患者术后蜡块组织作为观察组,21例胃高分化腺癌术后组织作为对照组,21例正常胃黏膜组织作为正常对照组。三组中TSG101和PCNA的检测应用免疫组化SP法。结果 观察组中TSG101表达的阳性率明显低于对照组和正常对照组,PCNA表达的阳性率明显高于对照组和正常对照组,观察组中TSG101和PCNA表达的阳性率与肿瘤的脉管累犯、肿瘤最大径密切相关,TSG101表达的阳性率与肿瘤的淋巴结转移密切相关,PCNA表达的阳性率与肿瘤的浸润深度密切相关;相关分析显示TSG101与PCNA呈负相关性。结论 TSG101在胃低分化腺癌中可能起抑癌基因样的作用,TSG101可能通过对肿瘤细胞增殖进行调节发挥作用。
胃腺癌;低分化;肿瘤易感基因(TSG)101;增殖细胞核抗原(PCNA);免疫组化
胃低分化腺癌是胃腺癌最常见的类型,最常见于中老年人,其侵袭和转移的发生率高〔1〕。肿瘤在低分化状态时肿瘤是高增殖性的,其细胞生长活跃〔2〕。肿瘤性病变形成过程是多基因参与、多种信号转导蛋白调控的复杂生物学行为过程〔3〕。肿瘤易感基因(TSG)101于1997年克隆成功,定位于人类染色体11p15.1~p5.2,最近研究显示TSG101可能与肿瘤的形成和进展有关〔4,5〕。本实验关注胃低分化腺癌中TSG101的表达及其与增殖细胞核抗原(PCNA)标记的增殖指数的关系。
1 资料与方法
1.1 一般资料 2011年1月至2013年12月我院确诊为胃低分化腺癌并行手术治疗的患者57例作为观察组,切取术后的肿瘤组织,标本均于取材后立即应用10%甲醛固定、石蜡包埋、切片,烘干后待用。其中男30例,女27例,年龄32~75岁,平均56.5岁。术前均未行放化疗,符合WHO中的诊断标准,并经病理医师确诊。21例胃高分化腺癌术后组织作为对照组,其中男10例,女11例,年龄35~71岁,平均55.0岁。21例正常胃黏膜组织作为正常对照组,其中男11例,女10例,年龄34~72岁,平均57.6岁。三组性别、年龄分组均无明显差异,具有可比性。
1.2 TSG101和PCNA的检测方法 应用免疫组化SP方法检测TSG101和PCNA的表达,行二氨基联苯胺(DAB)染色,严格按说明书进行,做好质量控制工作,努力减少误差。
1.3 TSG101和PCNA的判读 TSG101的阳性部位为细胞质中,PCNA的阳性部位为细胞核,以出现清晰的棕黄色颗粒为阳性。每张切片选择染色密集的上皮细胞分布区进行计数,选择3个400倍视野进行观察,计算阳性率的平均值,TSG101以<5%定为阴性,以≥5%定为阳性,PCNA以<25%定为阴性,以≥25%定为阳性。
1.4 统计学方法 应用SPSS17.0统计软件行χ2检验、线性相关分析。
2 结 果
2.1 TSG101和PCNA在三组中阳性率的比较 TSG101在观察组中的表达明显低于对照组和正常对照组,PCNA在观察组中的阳性率明显高于对照组和正常对照组。见表1。
表1 TSG101和PCNA在三组中表达阳性率比较〔n(%)〕
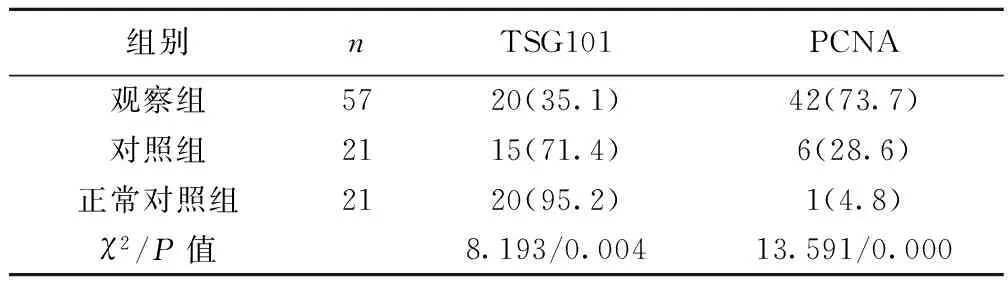
组别nTSG101PCNA观察组5720(35.1)42(73.7)对照组2115(71.4)6(28.6)正常对照组2120(95.2)1(4.8)χ2/P值8.193/0.00413.591/0.000
2.2 观察组中TSG101和PCNA阳性率在不同临床病理特征中的比较 观察组中TSG101和PCNA表达的阳性率与肿瘤的脉管累犯、肿瘤最大径密切相关,TSG101表达的阳性率与肿瘤的淋巴结转移密切相关,PCNA表达的阳性率与肿瘤的浸润深度密切相关。见表2。
2.3 观察组中TSG101和PCNA的相关性 TSG101和PCNA具有负相关性(r=-0.46,P<0.05)。
表2 观察组中TSG101和PCNA阳性率在不同临床病理特征中的比较〔n(%)〕
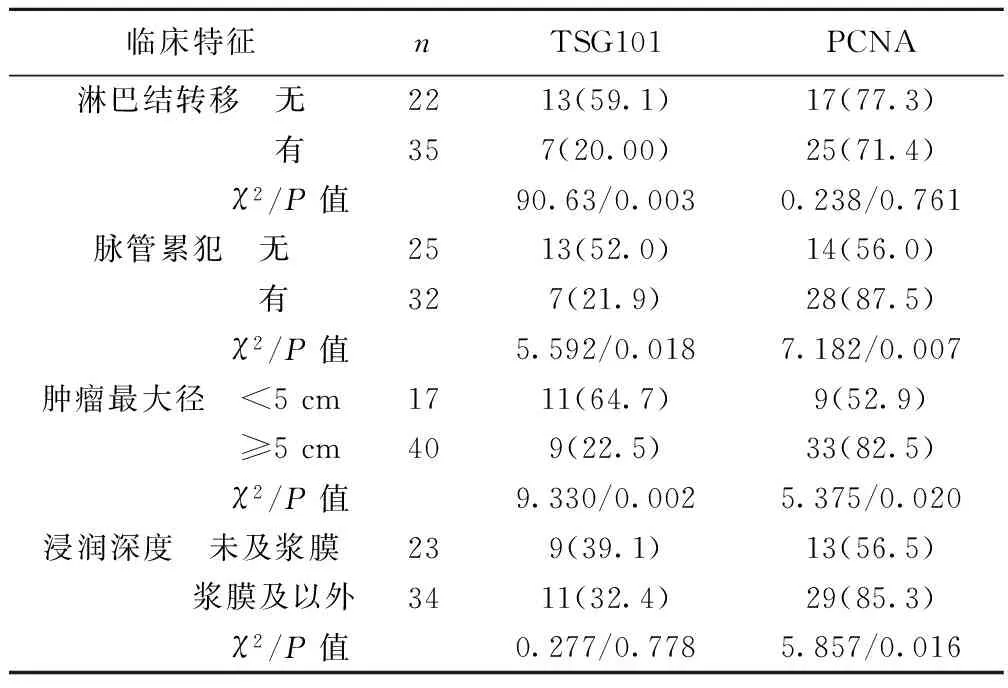
临床特征nTSG101PCNA淋巴结转移 无2213(59.1)17(77.3) 有357(20.00)25(71.4) χ2/P值90.63/0.0030.238/0.761脉管累犯 无2513(52.0)14(56.0) 有327(21.9)28(87.5) χ2/P值5.592/0.0187.182/0.007肿瘤最大径 <5cm1711(64.7)9(52.9) ≥5cm409(22.5)33(82.5) χ2/P值9.330/0.0025.375/0.020浸润深度 未及浆膜239(39.1)13(56.5) 浆膜及以外3411(32.4)29(85.3) χ2/P值0.277/0.7785.857/0.016
3 讨 论
分化在胃腺癌中的意义较大,其预示着不良的预后、侵袭性生长的生物学行为和较高的淋巴结转移率〔6〕。胃低分化腺癌的病因学涉及日常饮食、胆汁反流、幽门螺杆菌感染、肿瘤细胞的过度增生和氧化应激反应等〔7〕。TSG101最初在1996年通过随机纯合子敲除法在小鼠成纤维细胞中发现的,破坏该基因纯合子的功能可导致细胞发生转化,恢复该基因的功能,细胞则恢复正常生长,因此其被认为是一种抑癌基因〔8,9〕。TSG101的结构中含有泛素结合酶E2结构域、脯氨酸富含区及亮氨酸拉链结构等功能结构域,能实现复杂的生物学功能,如细胞内泛素化、蛋白转运、转录调控及细胞增殖等生物学过程〔10,11〕。也有研究认为TSG101可以通过干扰泛素连接酶小鼠双微体(MDM)2催化区以维持MDM2蛋白不被降解〔12〕,进而对P53/MDM2反馈抑制环进行有效的调节〔13,14〕。也有观点认为TSG101可能调控P21的表达,促进肿瘤的恶性进展〔15〕。TSG101在不同肿瘤中的表达可能不完全相同。蔡存伟等〔16〕观察TSG101在肺癌组织和细胞系中的表达,发现TSG101在肺鳞癌和肺腺癌中的表达水平低于相应正常肺组织,认为TSG101是一种候选的肿瘤抑制因子,但是普遍存在的TSG101异常转录产物可能和肺癌类型相关。闫曦等〔17〕观察TSG101在胰腺癌中的表达,发现TSG101在肿瘤中高表达,认为TSG101在肿瘤中的表达与分化程度和转移呈正相关性。TSG101在不同肿瘤或同一肿瘤不同类型中的表达可能不同,其对肿瘤调控的作用也不尽相同。
本实验结果提示TSG101在肿瘤中表达下降,显示TSG10作为肿瘤抑制基因起作用。TSG101可能作为一种显性负调节因子参与泛素系统对细胞周期的调节,可能通过泛素靶蛋白或泛素系统中复合物来实现对肿瘤生长的调控作用〔18,19〕。本研究结果提示TSG101低表达、PCNA高表达可以促进肿瘤脉管侵犯,这使肿瘤侵袭性及转移能力增强,肿瘤细胞恶性程度增加。结果提示二者异常表达可以促进肿瘤的生长及局部周围组织的破坏,使肿瘤的侵袭能力增强。提示TSG101低表达在一定程度上可以促进肿瘤的淋巴道播散。PCNA高表达与肿瘤的侵袭性相关,尤其对周围组织的破坏能力。胃低分化腺癌是高增殖性的肿瘤,即以PCNA标记的增殖指数明显升高,此时肿瘤表现出极强侵袭性的生物学行为,尤其是对胃壁及胃壁以外组织,肿瘤细胞小、散、黏附力差,肿瘤细胞的迁移能力强,对局部破坏能力强,临床手术不易切净。TSG101在正常组织中高表达时可以有抑癌作用,其作用机制可能与对细胞增殖的抑制作用有关。当TSG101表达下降或丢失时,其对肿瘤细胞增殖的抑制作用减弱,对肿瘤的形成和进展起促进作用。
1 Chen HC,Chu RY,Hsu PN,etal.Loss of E-cadherin expression correlates with poor differentiation and invasion into adjacent organs in gastric adenocarcinomas〔J〕.Cancer Lett,2003;201(1):97-106.
2 Liu W,Zhu J,Cao L,etal.Expression of hGC-1 is correlated with differentiation of gastric carcinoma〔J〕.Histopathology,2007;51(2):157-65.
3 陈艳宇,曾子华,郑佩娥,等.TSG101在食管癌、胃癌及结直肠癌中的表达〔J〕.肿瘤防治研究,2006;33(6):433-5.
4 Huang CC,Chen CM.P022:TSG101 expression in head and neck squamous cell carcinomas〔J〕.Otolaryngol Head Neck Surg,2007;137(2):220-1.
5 Ma XR,Edmund Sim UH,Pauline B,etal.Overexpression of WNT2 and TSG101 genes in colorectal carcinoma〔J〕.Trop Biomed,2008;25(1):46-57.
6 艾小顺,刘友富,戎 正,等.TSG101蛋白表达与胃癌转移关系研究〔J〕.现代肿瘤医学,2011;19(7):1386-8.
7 Liu Z,Yang Z,Liu D,etal.TSG101 and PEG10 are prognostic markers in squamous cell/adenosquamous carcinomas and adenocarcinoma of the gallbladder〔J〕.Oncol Lett,2014;7(4):1128-38.
8 Wagner KU,Krempler A,Qi Y,etal.Tsg101 is essential for cell growth,proliferation,and cell survival of embryonic and adult tissues〔J〕.Mol Cell Biol,2003;23(1):150-62.
9 刘 芳,曾子华,周序珑,等.TSG101在宫颈癌、子宫内膜癌与卵巢癌中的表达及意义〔J〕.广东医学,2007;28(3):363-4.
10 靳 雁.TSG101在结肠癌中的表达及意义〔J〕.陕西医学杂志,2009;38(6):691-2.
11 Lo YF,Chen TC,Chen SC,etal.Aberrant expression of TSG101 in Taiwan Chinese breast cancer〔J〕.Breast Cancer Res Treat,2000;60(3):259-66.
12 Masuhara M,Nagao K,Nishikawa M,etal.Enhanced degradation of MDM2 by a nuclear envelope component,mouse germ cell-less〔J〕.Biochem Biophys Res Comm,2003;308(4):927-32.
13 杜红禹,孙翠翠,安 超,等.TSG101与MDM2蛋白在胃腺癌中的表达及意义〔J〕.广东医学,2010;31(22):2936-8.
14 高艳华,张道荣,陆 平,等.TSG101与MDM2在肺鳞癌、腺癌组织中的表达及意义〔J〕.中国肺癌杂志,2007;10(5):433-6.
15 Oh H,Mammucari C,Nenci A,etal.Negative regulation of cell growth and differentiation by TSG101 through association with p21(Cip1/WAF1)〔J〕.Acta Cytol,2002;99(8):5430-5.
16 蔡存伟,张道荣,陆 平,等.TSG101在肺癌组织和细胞系中的表达及意义〔J〕.中国肺癌杂志,2008;11(2):172-5.
17 闫 曦,王 燕,费晋秀.TSG101在胰腺癌组织的表达及临床意义〔J〕.细胞与分子免疫学杂志,2011;27(4):433-5.
18 Krempler A,Henry MD,Triplett AA,etal.Targeted deletion of the Tsg101 gene results in cell cycle arrest at G1/S and p53-independent cell death〔J〕.J Biol Chem,2002;277(45):43216-23.
19 Zhu G,Gilchrist R,Borley N,etal.Reduction of TSG101 protein has a negative impact on tumor cell growth〔J〕.Int J Cancer,2004;109(4):541-7.
〔2015-03-19修回〕
(编辑 苑云杰)
于鹏杰(1980-),男,硕士,主治医师,主要从事胃肠肿瘤研究。
R735.2
A
1005-9202(2017)01-0121-03;
10.3969/j.issn.1005-9202.2017.01.053
1 青海大学附属医院肿瘤内科一病区
