PIAS1调控炎症微环境诱导的胃癌上皮-间质转化的实验研究
2017-02-11王唯一周郁芬章永平吴云林
陈 平 王唯一 周郁芬 谢 玲 章永平 吴云林
上海交通大学医学院附属瑞金医院北院消化内科(201801)
PIAS1调控炎症微环境诱导的胃癌上皮-间质转化的实验研究
陈 平*王唯一 周郁芬 谢 玲 章永平 吴云林#
上海交通大学医学院附属瑞金医院北院消化内科(201801)
背景:作为炎症网络调控的重要介质,STAT活化抑制蛋白1(PIAS1)在胃癌组织中低表达,并与疾病进展相关,但具体机制还有待研究。目的:探讨PIAS1对炎症微环境下胃癌上皮-间质转化(EMT)的影响。方法:构建重组腺病毒Ad5/F35-PIAS1和Ad5/F35-null并转染胃癌细胞株SGC-7901,以RT-PCR法和蛋白质印迹法分别验证PIAS1 mRNA和蛋白表达。随后将SGC-7901细胞分为IL-6治疗组、Ad5/F35-PIAS1+IL-6治疗组、Ad5/F35-null+IL-6治疗组,以MTT法测定细胞增殖率,细胞划痕实验和Transwell侵袭实验测定细胞迁移和侵袭能力,蛋白质印迹法测定E-cadherin、Snail、Twist、Vimentin、P-p38MAPK蛋白表达。结果:转染Ad5/F35-PIAS1可明显上调SGC-7901细胞中PIAS1 mRNA和蛋白表达。与IL-6治疗组和Ad5/F35-null+IL-6治疗组相比,Ad5/F35-PIAS1+IL-6治疗组细胞增殖率、细胞迁移和侵袭能力均显著下降(P<0.01),Snail、Twist、Vimentin、P-p38MAPK蛋白表达显著降低(P<0.01),E-cadherin蛋白表达显著增高(P<0.01)。而IL-6治疗组和Ad5/F35-null+IL-6治疗组上述指标相比差异均无统计学意义(P>0.05)。结论:PIAS1可抑制胃癌细胞在炎症微环境下发生的EMT,进而可能在抑制肿瘤侵袭与转移的过程中发挥重要作用。
胃肿瘤; 上皮-间质转化; 炎症微环境; 活化STAT的蛋白抑制物; 白细胞介素6
胃癌的发生、发展与多种因素有关,包括肿瘤细胞与炎症微环境之间的作用以及上皮-间质转化(epithelial-mesenchymal transition, EMT)改变等。有研究表明胃癌细胞受到炎症因子白细胞介素(interleukin, IL)-6刺激48 h后,呈现上皮细胞形态转变为典型的间质细胞形态特点[1],提示炎症微环境与EMT改变密切相关。STAT活化抑制蛋白1(protein inhibitor of activated STAT 1, PIAS1)作为PIAS家族成员之一,具有较为明显的抗炎作用[2]。既往研究发现PIAS1在胃癌中低表达,上调胃癌细胞PIAS1表达后,肿瘤细胞迁移率下降,其机制可能涉及p38促分裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)信号转导途径的调控[3],说明PIAS1可能是胃癌潜在的治疗靶点,但具体机制仍有待研究。本研究通过检测胃癌细胞株中PIAS1和EMT相关标记分子的表达,旨在揭示PIAS1与EMT的关系及其可能的相关分子机制,从而为靶向调控EMT治疗胃癌提供理论依据。
材料与方法
一、细胞株、主要试剂
胃癌细胞株SGC-7901由上海交通大学医学院附属瑞金医院消化内科实验室提供,Ad5/F35-PIAS1和Ad5/F35-null空载质粒由上海鸿鸣生物科技有限公司构建合成,Transwell侵袭小室(Corning公司),E-cadherin、Snail、Twist、Vimentin抗体(Abcam公司),P-p38MAPK抗体(Cell Signaling Technology公司),PIAS1、GAPDH抗体(Santa Cruz公司),RPMI-1640培养基、胰蛋白酶和TRIzol试剂(Life Technologies公司),胎牛血清(Thermo Fisher公司),IL-6(RD公司),MTT试剂(上海碧云天生物技术有限公司),PIAS1引物、GAPDH引物以及RT-PCR试剂盒由生工生物工程(上海)股份有限公司合成和提供。
二、方法
1. 细胞培养:将胃癌SGC-7901细胞置于含10%胎牛血清的RPMI-1640培养基,培养条件为5% CO2、饱和湿度、温度为37 ℃,收集对数生长期细胞用于后续实验。
2. 细胞分组:先将Ad5/F35-PIAS1(MOI 10)和Ad5/F35-null(MOI 5)转染细胞,并设立空白对照组(加入同体积PBS液),培养24 h后收集细胞检测PIAS1表达。SGC-7901细胞实验分组如下:①Ad5/F35-PIAS1+IL-6治疗组:含10%胎牛血清的RPMI-1640培养基加入IL-6(50 ng/mL)培养48 h后,加入Ad5/F35-PIAS1(MOI 10)。②Ad5/F35-null+IL-6治疗组:含10%胎牛血清的RPMI-1640培养基中加入IL-6(50 ng/mL)培养48 h后,加入Ad5/F35-null (MOI 5)。③IL-6治疗组:含10%胎牛血清的RPMI-1640培养基IL-6(50 ng/mL)培养48 h后,加入PBS液。三组细胞培养24 h后收集细胞行后续实验。
3. MTT法:以每孔5×104/mL个细胞接种于96孔板,每孔终体积为100 μL,待细胞完全贴壁后,另设阴性对照孔。细胞终止培养前4 h每孔加入MTT 20 μL,孵育完毕后吸除孔内上清液,每孔加入150 μL DMSO,微型振荡器振荡10 min,上酶联免疫分析仪测定490 nm波长处每孔吸光的光密度值(A值)并计算细胞增殖率,增殖率(%)=实验孔A值/阴性对照孔A值×100%。
4. 细胞划痕实验:取2×105个细胞接种于6孔培养板,待完全融合时,以200 μL微量枪头在6孔板内单层细胞上垂直划痕,PBS液洗涤2次后加入无血清培养基,倒置显微镜下观察24 h划痕两侧细胞的迁移情况,每组取3个部位拍照并测量划痕两侧细胞间的相对距离,距离差除以2为细胞相对迁移距离,计算细胞相对迁移率,相对迁移率=相对迁移距离/0 h时划痕边缘距划痕中线距离。实验重复3次,取均值。
5. Transwell侵袭实验: 在具有8 μm小孔聚碳酸酯滤膜的培养小室上铺用预冷无血清培养基稀释的Matrigel基质胶,37 ℃孵育30 min后待其凝固,接种不同处理组1×106个/mL SGC-7901细胞,体积100 μL;下室加入600 μL含10%胎牛血清的培养基。每个组别设3个复孔,培养24 h后,取出Transwell小室,弃去培养液,用棉签轻轻擦掉上层未迁移细胞,0.1%结晶紫染色5 min,PBS洗涤,显微镜下采集图像,随机读取3个视野,取平均值作为穿过小室细胞数。
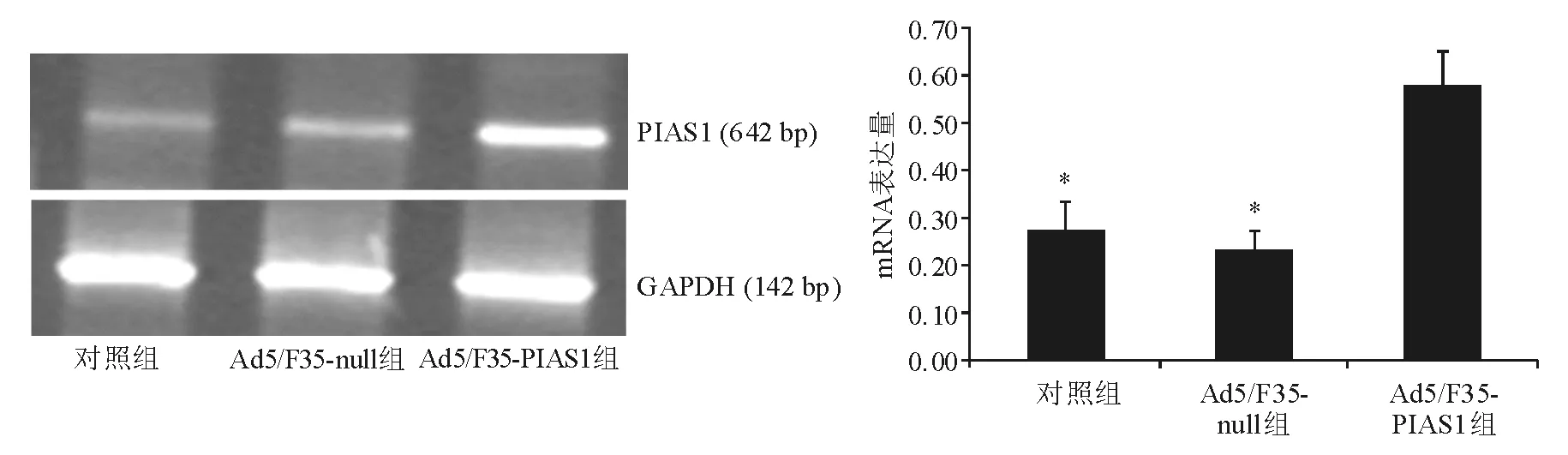
6. RT-PCR法:收集各组细胞,采用TRIzol试剂裂解细胞,提取总RNA,紫外分光光度仪测定RNA浓度,逆转录合成cDNA。PIAS1引物上游:5’-CCA CGC CTT CCT GCT GTA GA-3’,下游:5’-TAT CAC ACA GGC AGT CTT AGA T-3’,片段长度642 bp。内参照GAPDH引物上游:5’-GGC TGA GAA CGG GAA GCT TGT C- 3’,下游:5’-CAG CCT TCT CCA TGG TGG TGA AGA-3’,片段长度142 bp。PCR反应条件:94 ℃预变性4 min;94 ℃变性45 s,58 ℃(PIAS1)或55 ℃(GAPDH)退火45 s,72 ℃延伸1 min,共35个循环;72 ℃终延伸10 min。取PCR产物行1.2%琼脂糖凝胶电泳,Bio-Rad凝胶成像系统摄影,Quantity One软件分析,以GAPDH作为内参照,进行定量分析。
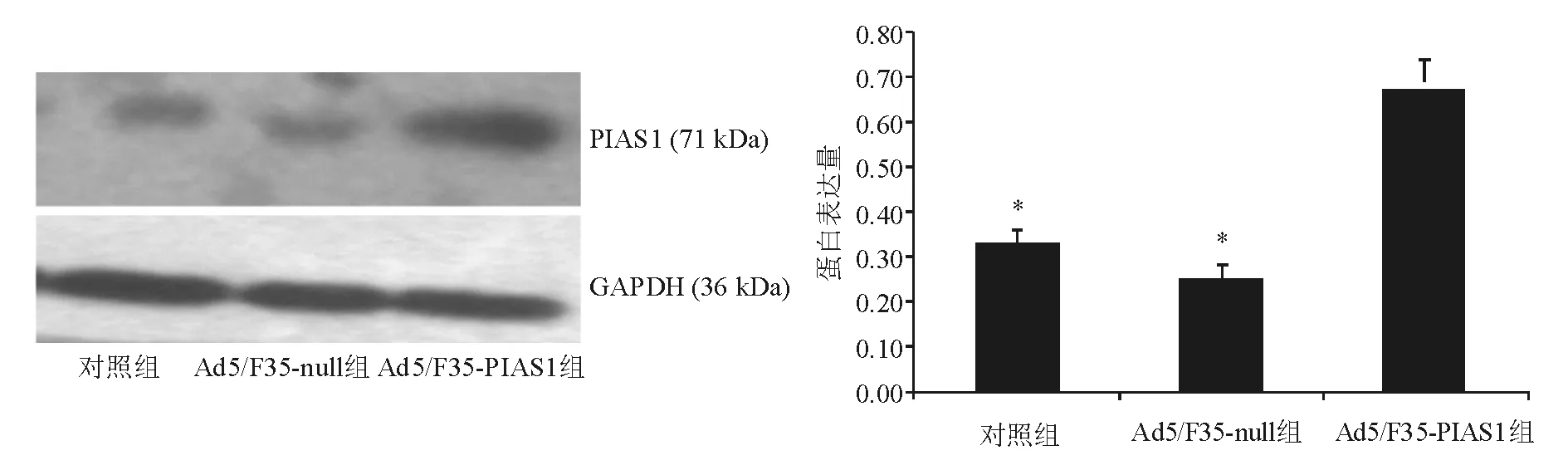
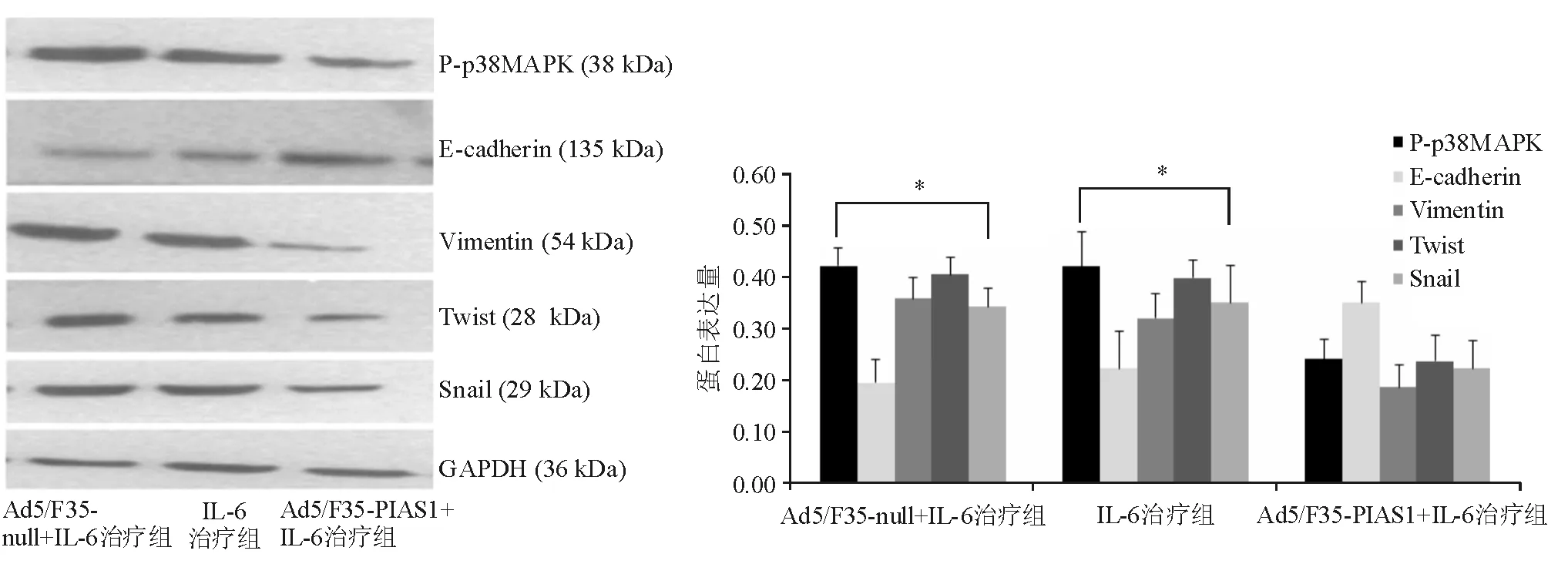
7. 蛋白质印迹法:收集各组细胞,BCA法行蛋白定量。取20 μg蛋白行聚丙烯酰胺凝浆电泳后,将蛋白转移至PVDF膜,经5%脱脂奶粉封闭后,分别加入一抗E-cadherin、Snail、Twist、Vimentin、P-p38MAPK(工作浓度均为1∶500)以及PIAS1、GAPDH(工作浓度均为1∶1 000),4 ℃孵育过夜。TBS/T液洗膜,加入HRP标记的二抗(工作浓度为1∶1 000)室温孵育60 min。TBS/T液洗膜,ECL法显影,胶片曝光。采用Bio-Rad凝胶成像系统摄影,Quantity One软件行灰度分析,以GAPDH作为内参照,进行定量分析。
三、统计学分析
结 果
一、PIAS1表达水平测定
转染24 h后,与对照组或Ad5/F35-null组相比,Ad5/F35-PIAS1组PIAS1 mRNA和蛋白表达显著增高(P<0.01)(图1、图2)。
二、细胞增殖率
IL-6治疗组和Ad5/F35-null+IL-6治疗组细胞增殖率显著高于Ad5/F35-PIAS1+IL-6治疗组(P<0.01),而前两组间相比差异无统计学意义(P>0.01)(表1)。
*与Ad5/F35-PIAS1组比较,P<0.01
*与Ad5/F35-PIAS1组比较,P<0.01
三、细胞迁移和侵袭能力的影响
IL-6治疗组和Ad5/F35-null+IL-6治疗组划痕间距和穿过细胞数显著高于Ad5/F35-PIAS1+IL-6治疗组(P<0.01);而前两组上述指标相比差异无统计学意义(P>0.05)(图3、图4、表1)。
四、各检测蛋白的表达
与IL-6治疗组和Ad5/F35-null+IL-6治疗组相比,Ad5/F35-PIAS1+IL-6治疗组Snail、Twist、Vimentin、P-p38MAPK蛋白表达降低,E-cadherin蛋白表达增高(P<0.01)。而Ad5/F35-null+IL-6治疗组与IL-6治疗组上述蛋白表达相比差异均无统计学意义(P>0.05)(图5)。
讨 论
EMT与胚胎发育、伤口愈合、肿瘤侵袭转移等过程密切相关。有研究证实,EMT与肿瘤浸润转移有关,当肿瘤细胞发生EMT时,易形成局部扩散,细胞侵入淋巴管和血管而发生转移,因此抑制EMT的发生,对调节肿瘤侵袭与转移具有重要意义[4]。EMT过程中伴有多个分子标记物的改变,如上皮细胞标记物E-cadherin表达下调,间质细胞转录因子如Snail、Twist表达上调。E-cadherin属经典的钙黏蛋白家族,主要参与细胞间连接,与肿瘤侵袭、转移关系密切。Snail是一种锌指蛋白转录因子,被认为是EMT的启动者。Twist蛋白是一种碱性螺旋环状结构的转录因子,是介导EMT的关键因子之一。E-cadherin是Snail直接作用的靶基因,Snail表达上调,导致E-cadherin表达下调,减少细胞间的黏附连接,从而使上皮细胞获得间充质细胞的特性[5]。Vimentin作为间质细胞的标记因子,是存在于间质细胞中的一种中间纤维蛋白,在多种恶性肿瘤细胞中过表达,参与肿瘤细胞的迁移、黏附[6]。既往报道发现,激活p38MAPK在EMT过程中起有重要作用,抑制该蛋白的活性可阻止EMT过程[7]。也有研究表明干扰Snail等基因的表达和重新表达E-cadherin等方法可逆转EMT过程,降低肿瘤的侵袭和转移[8]。

图3 各组细胞迁移能力比较(细胞划痕实验,×100)
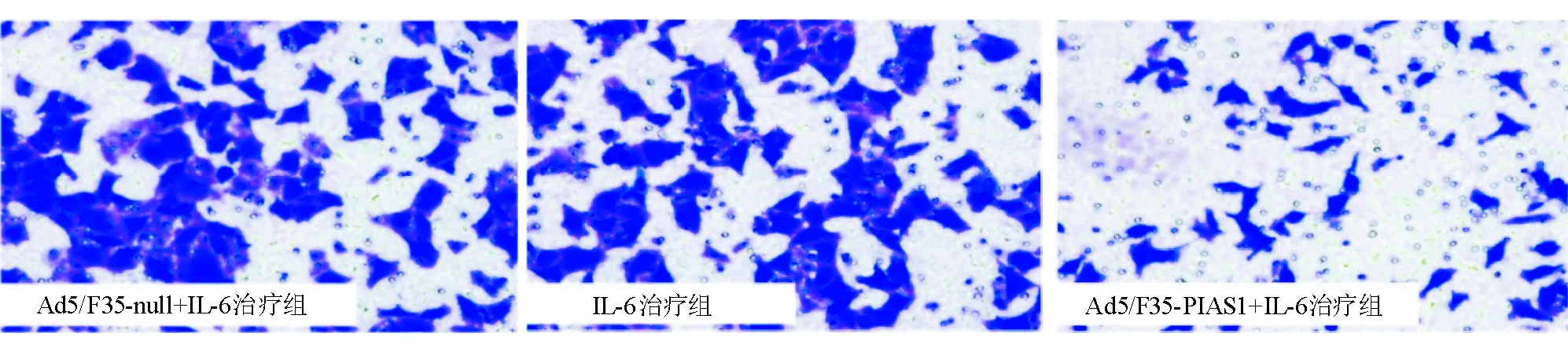
图4 各组细胞侵袭能力比较(Transwell实验,×200)

组 别细胞增殖率(%)划痕间距(%)穿过细胞数IL-6治疗组72.4±11.219.03±2.7054.44±7.74Ad5/F35-null+IL-6治疗组69.7±9.818.42±4.4253.22±11.50Ad5/F35-PIAS1+IL-6治疗组42.2±12.39.80±2.2228.44±3.57
*与Ad5/F35-PIAS1+IL-6治疗组比较,P<0.01
有研究认为,肿瘤细胞EMT的发生除与细胞本身生物学性状改变有关外,更与其所处的微环境密切相关[9]。有研究发现IL-6可通过影响细胞表面蛋白和骨架蛋白的活性,影响细胞形态和结构,是导致肿瘤细胞EMT的关键因子,亦是导致癌症转移、扩散、恶化的重要原因[1]。基于此,本研究通过IL-6处理胃癌细胞模拟肿瘤炎症微环境,发现胃癌细胞中EMT调控蛋白Snail、Twist、Vimentin、P-p38MAPK蛋白表达升高,而E-cadherin表达下调。
多项研究指出PIAS1通过调节NF-κB和p38MAPK等信号转导途径[2,10],参与抑制IL-6等细胞因子的释放,是炎症网路调控的重要调节因子。本研究借助IL-6处理胃癌细胞模拟炎症微环境,通过PIAS1高表达揭示其对EMT的影响,结果发现经PIAS1表达上调的胃癌细胞增殖和侵袭转移力下降,EMT相关标记分子的表达情况显示E-cadherin表达上调而Vimentin表达下调,进一步揭示PIAS1可能抑制胃癌细胞发生EMT的机制涉及降低p38MAPK蛋白的磷酸化、导致Snail和Twist蛋白下调表达。
总之,EMT相关标记分子的变化提示炎症微环境可能诱导胃癌细胞发生EMT,而此环境下PIAS1高表达可能抑制胃癌细胞的EMT,并最终在抑制胃癌细胞侵袭与转移过程中发挥重要作用。
1 Nguyen DP, Li J, Tewari AK. Inflammation and prostate cancer: the role of interleukin 6 (IL-6)[J]. BJU Int, 2014, 113 (6): 986-992.
2 Liu B, Yang Y, Chernishof V, et al. Proinflammatory stimuli induce IKKalpha-mediated phosphorylation of PIAS1 to restrict inflammation and immunity[J]. Cell, 2007, 129 (5): 903-914.
3 Chen P, Zhao D, Sun Y, et al. Protein inhibitor of activated STAT-1 is downregulated in gastric cancer tissue and involved in cell metastasis[J]. Oncol Rep, 2012, 28 (6): 2149-2155.
4 Guarino M, Rubino B, Ballabio G. The role of epithelial-mesenchymal transition in cancer pathology[J]. Pathology, 2007, 39 (3): 305-318.
5 Wang Y, Shi J, Chai K, et al. The role of snail in EMT and tumorigenesis[J]. Curr Cancer Drug Targets, 2013, 13 (9): 963-972.
6 Zhou YF, Xu W, Wang X, et al. Negative methylation status of vimentin predicts improved prognosis in pancreatic carcinoma[J]. World J Gastroenterol, 2014, 20 (36): 13172-13177.
8 Guo HM, Zhang XQ, Xu CH, et al. Inhibition of invasion and metastasis of gastric cancer cells through snail targeting artificial microRNA interference[J]. Asian Pac J Cancer Prev, 2011, 12 (12): 3433-3438.
9 Jung HY, Fattet L, Yang J. Molecular pathways: linking tumor microenvironment to epithelial-mesenchymal transition in metastasis[J]. Clin Cancer Res, 2015, 21 (5): 962-968.
10 Heo KS, Chang E, Takei Y, et al. Phosphorylation of protein inhibitor of activated STAT1 (PIAS1) by MAPK-activated protein kinase-2 inhibits endothelial inflammation via increasing both PIAS1 transrepression and SUMO E3 ligase activity[J]. Arterioscler Thromb Vasc Biol, 2013, 33 (2): 321-329.
(2016-05-12收稿;2016-05-30修回)
Effect of PIAS1 on Epithelial-mesenchymal Transition of Gastric Cancer under Inflammatory Microenvironment
CHENPing,WANGWeiyi,ZHOUYufen,XIELing,ZHANGYongping,WUYunlin.
DepartmentofGastroenterology,RuijinHospitalNorth,ShanghaiJiaotongUniversitySchoolofMedicine,Shanghai(201801)
WU Yunlin, Email: wuyunlin1951@163.com
Stomach Neoplasms; Epithelial-Mesenchymal Transition; Inflammatory Microenvironment; Protein Inhibitors of Activated STAT; Interleukin-6
10.3969/j.issn.1008-7125.2017.01.004
*Email: chenping714@medmail.com.cn
#本文通信作者,Email: wuyunlin1951@163.com
Background: Protein inhibitor of activated STAT 1 (PIAS1) is an important regulator for inflammatory signaling network, which is low expressed in gastric cancer and associated with development of cancer, but its mechanism has not been elucidated. Aims: To investigate the effect of PIAS1 on epithelial-mesenchymal transition (EMT) of gastric cancer under inflammatory microenvironment. Methods: Recombinant adenovirus Ad5/F35-PIAS1 and Ad5/F35-null were constructed and transfected into gastric cancer cell line SGC-7901, mRNA and protein expressions of PIAS1 were detected by RT-PCR and Western blotting, respectively. SGC-7901 cells were divided into IL-6 treatment group, Ad5/F35-PIAS1+IL-6 treatment group and Ad5/F35-null+IL-6 treatment group. Cell proliferation was measured by MTT method, migration and invasion capacities were assessed by wound healing test and Transwell chamber invasion assay. Protein expressions of E-cadherin, Snail, Twist, Vimentin and P-p38MAPK were assessed by Western blotting. Results: The transfection of Ad5/F35-PIAS1 significantly increased the expressions of PIAS1 mRNA and protein in SGC-7901 cells. Compared with IL-6 treatment group and Ad5/F35-null+IL-6 treatment group, capacities of cell proliferation, migration and invasion were significantly decreased (P<0.01); protein expressions of Snail, Twist, Vimentin and P-p38MAPK were significantly decreased while expression of E-cadherin protein was significantly increased in Ad5/F35-PIAS1+IL-6 treatment group (P<0.01). No significant differences in above-mentioned indices were found between IL-6 treatment group and Ad5/F35-null+IL-6 treatment group (P>0.05). Conclusions: PIAS1 could inhibit EMT of gastric cancer cells under inflammatory microenvironment, and may play an important role in inhibition of tumor invasion and metastasis.
