肌球蛋白轻链磷酸化在腹泻型IBS大鼠肠黏膜屏障功能障碍中的作用*
2017-02-11陈超英
张 梦 陈超英 吕 宾#
浙江中医药大学第一临床医学院1(310053) 浙江中医药大学第一附属医院消化科2
肌球蛋白轻链磷酸化在腹泻型IBS大鼠肠黏膜屏障功能障碍中的作用*
张 梦1陈超英2吕 宾2#
浙江中医药大学第一临床医学院1(310053) 浙江中医药大学第一附属医院消化科2
背景:肌球蛋白轻链(MLC)是调控细胞间紧密连接和肠道通透性的启动因子,磷酸化MLC(pMLC)可引起紧密连接相关蛋白重新分布,破坏紧密连接结构和完整性,最终引起肠黏膜屏障功能障碍。目的:探讨MLC磷酸化在腹泻型IBS(IBS-D)大鼠肠黏膜屏障功能障碍中的作用。方法:将8只Sprague-Dawley孕鼠随机分为模型组和对照组,采用母婴分离法构建IBS-D大鼠模型。记录大鼠造模成功后1 h内粪便性状和颗粒数,采用腹壁回撤反射(AWR)评分评估大鼠内脏敏感性,免疫荧光法观察结肠组织纤维状肌动蛋白(F-actin)、细胞紧密连接相关蛋白ZO-1、claudin-1的分布,蛋白质印迹法检测肠黏膜MLC、pMLC、F-actin、ZO-1、claudin-1蛋白的表达,透射电镜观察细胞间紧密连接。结果:与对照组相比,模型组内脏敏感性显著升高;免疫荧光法显示claudin-1荧光强度减弱,结构紊乱,重新分布,F-actin和ZO-1结构模糊;蛋白质印迹结果显示pMLC/MLC比值和pMLC表达明显升高,claudin-1表达明显降低,MLC、F-actin和ZO-1表达无明显差异;透射电镜显示细胞紧密连接破坏,细胞间隙扩大。结论:MLC磷酸化水平升高介导细胞骨架蛋白F-actin重组,引起细胞紧密连接蛋白结构和功能的改变,细胞间隙增加,导致肠黏膜屏障功能障碍,在IBS-D的发病中发挥重要作用。
肌球蛋白轻链; 纤维状肌动蛋白; 紧密连接; 肠易激综合征
肠易激综合征(irritable bowel syndrome, IBS)是一种常见的功能性胃肠病,欧美国家IBS发病率高达10%~20%[1],亚洲国家达6.5%~10.1%[2]。其以腹痛、腹部不适伴随排便习惯和粪便性状改变为主要表现。临床以腹泻型IBS(IBS-D)患者最为常见,因腹泻反复发生,严重影响患者的学习、工作和生活,但具体的发病机制尚未完全阐明。现有研究表明IBS的发病可能与肠道感染、脑-肠轴紊乱、精神心理因素、肠黏膜免疫功能异常、饮食、遗传等因素有一定关系[3-4]。近年研究发现,IBS发病与肠黏膜屏障功能障碍有关,而肠黏膜屏障功能障碍又与细胞收缩、细胞骨架重组、细胞间紧密连接的改变关系密切,肌球蛋白轻链(myosin light chain, MLC)磷酸化是引起细胞收缩、细胞骨架重组的始动因子[5],故推测MLC磷酸化在IBS引起的肠黏膜屏障功能障碍中可能发挥重要作用。本研究通过经典的母婴分离法构建慢性IBS-D大鼠模型,旨在阐明MLC磷酸化介导肌动蛋白重组在IBS-D发病中的作用。
材料与方法
一、实验动物
清洁级Sprague-Dawley (SD)孕鼠(由浙江中医药大学动物实验研究中心提供)8只,体质量320~350 g,由专人饲养于屏障环境中,控制昼夜明暗交替。孕鼠每笼一只,出生后SD大鼠每笼4只,自由摄食、饮水。
二、研究方法
1. 模型的建立:适应性喂养大鼠1周后,采用随机数字表法分为对照组和模型组。采用母幼分离方式建立慢性IBS-D模型[6]。SD孕鼠分娩后,剔除雌幼鼠,以母鼠为单位平均分成2组,模型组自出生后第2天起,每日上午(8:00-11:00)与母鼠分离3 h,持续14 d,对照组不予任何处理,与母鼠同笼。两组大鼠喂养至8周龄,确保大鼠健康以及避开各种伤害性刺激。8周龄后,观察大鼠的一般情况、排便数量、粪便性状。
2. 模型的评估:采用腹壁回撤反射(AWR)评分标准验证大鼠模型[7]。在大鼠清醒状态、不限制活动的情况下将8F带气囊导尿管外涂石蜡油后经肛门插入,气囊末端距肛缘1 cm。导尿管肛门外部分以棉线固定于鼠尾根部。30 min后待大鼠适应环境呈安静状态时,扩张球囊使球囊内压力逐渐升高,观察腹部抬离桌面(AWR=3)时的气囊压力,由非实验者记录,共进行3次实验,每次持续30 s,间隔3 min,取均值。大鼠AWR评分标准:0分:对结肠扩张无行为学反应;1分:结肠扩张时身体静止不动,头部运动减少;2分:结肠扩张时腹肌收缩,但腹部未抬离桌面;3分:结肠扩张时腹肌收缩并抬离桌面;4分:结肠扩张时骨盆抬起,身体呈弓形。
3. 标本采集:AWR评分结束后,大鼠腹腔注射40 mg/kg 3%戊巴比妥钠麻醉,剖腹手术分离近端结肠,取距回盲部5 cm处结肠组织2块,以0.9% NaCl溶液漂洗,置于液氮中保存备用。
4. 免疫荧光法检测大鼠肠道F-actin、ZO-1、claudin-1的分布:取结肠组织,石蜡包埋,8 μm厚连续冰冻组织切片,脱水、固定、透膜、封闭后,加入F-aticn(工作浓度为1∶200,购自Abcam公司)、ZO-1(工作浓度为8 μg/mL,购自Life Technologies公司)、claudin-1(工作浓度为1∶200, 购自Cell Signaling Technology公司)一抗4 ℃孵育过夜,PBS漂洗,滴加二抗(工作浓度均为1∶400,购自Abcam公司),DAPI标记细胞核,室温避光孵育1 h,PBS漂洗,封片,激光共聚焦显微镜下(×400)观察各细胞间紧密连接的分布并拍照。
5. 蛋白质印迹法观察大鼠肠道MLC、pMLC、F-actin、ZO-1、claudin-1表达:取结肠组织,加入RIPA裂解液,混匀,充分裂解后离心,取上清,BCA法测蛋白浓度。SDS-PAGE电泳、转膜、封闭、割膜,分别加入GAPDH、MLC、pMLC(工作浓度均为1∶1 000,均购自美国Cell Signailing Technology公司)、F-actin(工作浓度为1∶500,购自Abcam公司)、ZO-1(工作浓度为8 μL/mL,购自Life Technologies公司)、claudin-1(工作浓度为1∶1 000,购自Cell Signaling Technology公司)4 ℃过夜;TBST洗涤;加入二抗(工作浓度1∶1 000,购自北京中杉金桥生物技术有限公司)孵育1~2 h,TBST洗涤,选用电化学发光成像仪曝光,Quantity One软件对目的条带进行半定量分析。以目的条带灰度值与内参GAPDH条带灰度值的比值作为该目的条带的表达,并计算pMLC与MLC的比值。
6. 透射电镜观察细胞间紧密连接:将组织样本置于2.5%戊二醛PBS冲液固定4 h或更长时间,PBS漂洗,1%锇酸固定液固定1 h,ddH2O漂洗,2%乙酸双氧铀固定30 min,梯度脱水、渗透、包埋、聚合、切片,乙酸双氧铀-柠檬酸铅染色,透射电镜观察细胞间紧密连接。
三、统计学分析
结 果
一、一般情况
模型组大鼠造模后表现为紧张易激惹,反应迟钝,活动减少,粪便质软甚至呈稀水样,体质量降低。对照组一般情况均良好。模型组的粪便颗粒数显著高于对照组(5.70±0.93对2.00±0.64;t=-6.065,P=0.000)。
二、内脏敏感性
AWR评分结果显示,模型组大鼠内脏敏感性明显高于对照组[(36.66±2.09) Pa对(65.33±1.95) Pa;t=-28.383,P=0.000]。
三、免疫荧光法
对照组肠上皮细胞中F-actin主要环绕于细胞
周边,形成周边肌动蛋白丝带,细胞中央偶尔可见不规则纤维丝;claudin-1和ZO-1沿细胞膜分布,呈蜂窝状线性荧光。模型组F-actin沿细胞膜分布,但其结构发生改变,周边肌动蛋白致密带毛糙,细胞质内出现应力纤维;claudin-1荧光强度减弱,结构模糊,胞质内荧光强度增高;ZO-1线性荧光结构紊乱、断裂(图1)。
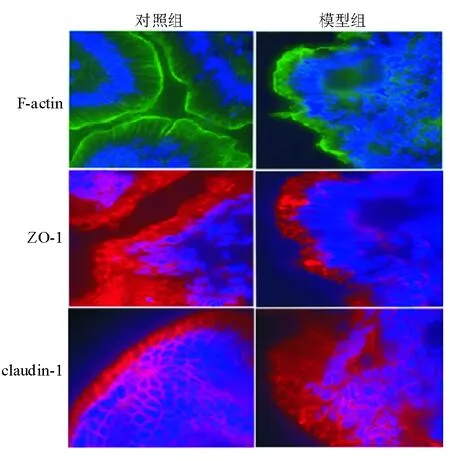
图1 各组F-actin、ZO-1、claudin-1免疫荧光结果(×400)
四、蛋白质印迹法
与对照组相比,模型组pMLC/MLC比值明显升高(2.27±1.09对0.48±0.20;t=-2.243,P=0.018),MLC表达无明显差异,pMLC表达明显升高;claudin-1表达明显降低(0.69±0.21对1.57±0.27;t=5.163,P=0.002);F-actin和ZO-1表达无明显差异(1.10±0.19对0.93±0.11,t=-1.547,P=0.185;1.15±0.19对0.88±0.14;t=-2.233,P=0.058)(图2)。
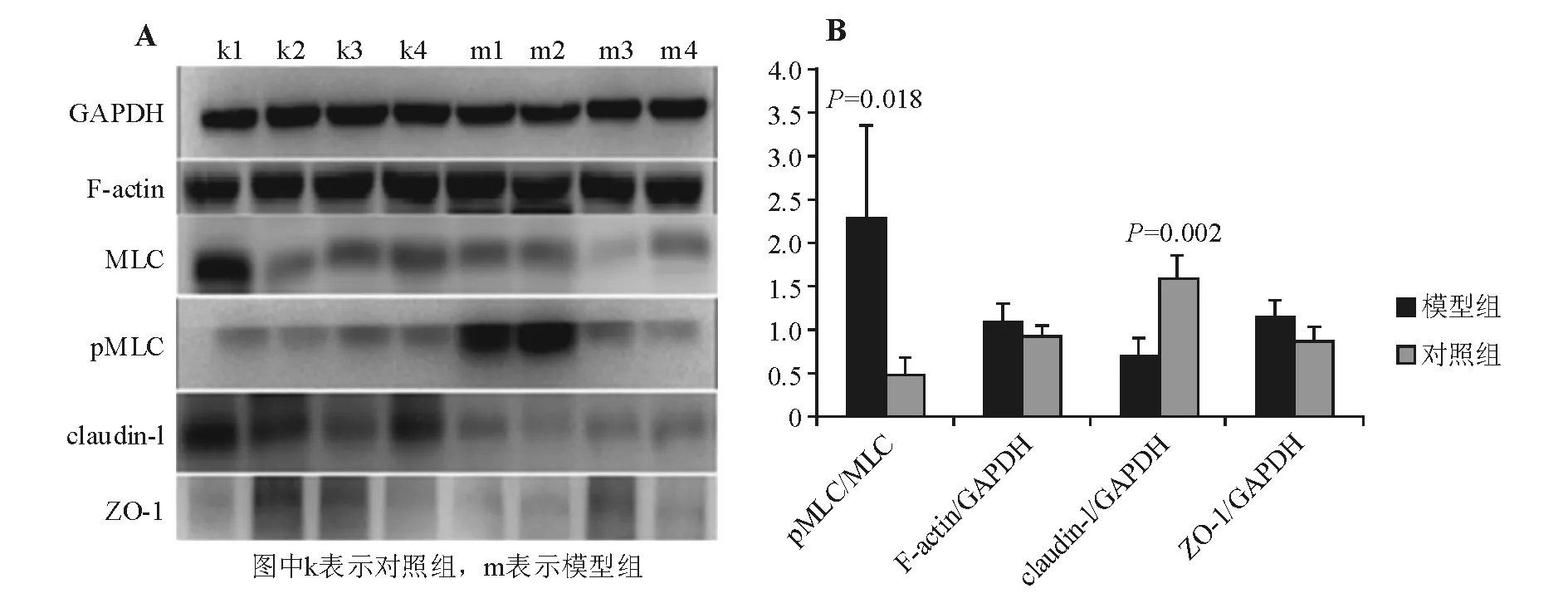
图2 各组MLC、F-actin、claudin-1、ZO-1蛋白表达(蛋白质印迹法)
五、透射电镜结果
与对照组相比,模型组细胞紧密连接破坏,细胞间隙扩大(图3)。
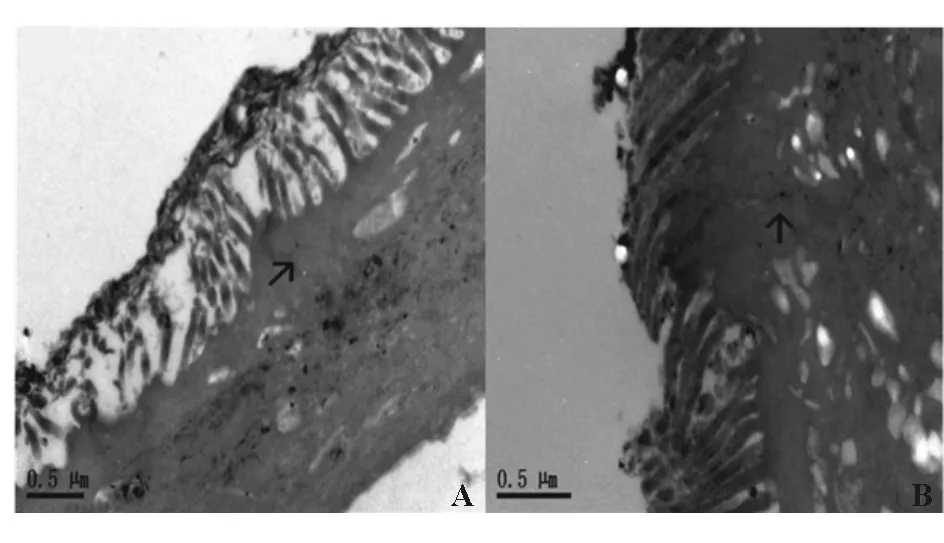
A:对照组;B:模型组
图3 各组细胞透射电镜图(×10 000)(箭头所示处为细胞间紧密连接)
讨 论
肠黏膜屏障是维持肠腔和机体内环境稳定的动能隔离带,肠上皮细胞、细胞间紧密连接结构和细胞骨架蛋白构成了肠道机械屏障,能有效阻止肠道内细菌、毒素和炎性介质经细胞旁途径入侵机体。肠黏膜屏障功能主要与肠黏膜上皮细胞间紧密连接有关[8]。紧密连接是维持肠上皮屏障完整性的重要结构[9],是由咬合蛋白(occludin)、闭合蛋白(claudin)、带状闭合蛋白(ZO)、β-连环蛋白和连接黏附因子等构成的相邻细胞间连接复合体,使相邻两个细胞的缝隙完全闭锁。ZO-1与紧密连接和黏附连接密切相关,其C端区域还可与肌动蛋白和其他骨架相关蛋白直接结合[10],claudin蛋白C端的结合序列可与胞质内其他紧密连接蛋白直接连接,与肌动蛋白发生间接作用[11-13],故肌动蛋白和其他骨架蛋白的改变可引起紧密连接蛋白的改变。
MLC是肌球蛋白重要的调节结构域[14]。肌球蛋白除作为马达分子为细胞内分子运动提供动力外,还参与细胞收缩、分裂、黏附、趋化以及细胞信号转导和细胞骨架结构的调控。MLC激酶(MLCK)是使MLC磷酸化的重要激酶,由Ca2+/钙调复合体(CaM)激活后,引起MLC20位点Ser19、Thr18磷酸化,Ser19磷酸化可激活肌球蛋白头部的Mg2+-ATP酶,Thr18磷酸化可增加Mg2+-ATP酶活性。ATP酶水解产生能量,骨架蛋白活动和细胞收缩,引起紧密连接蛋白结构和功能失调,细胞间隙形成,导致肠黏膜屏障功能障碍[15-17]。
MLC磷酸化通过介导紧密连接蛋白的开放,引起细胞间隙增加,最终导致肠黏膜屏障功能障碍。Shen等[18]通过构建持续激活MLCK的肠道上皮细胞模型发现MLCK表达增加MLC磷酸化,引起结合前肌动蛋白重组,ZO-1和occludin蛋白的再分布和结构改变,细胞旁通透性增加,说明MLC磷酸化可引起紧密连接的变化和肠黏膜屏障功能障碍。Guo等[19]发现MLC磷酸化在烧伤早期肠黏膜屏障损害中发挥重要作用,在采用N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸(fMLP)诱导的单层上皮细胞损伤模型中发现MLC磷酸化水平增高,跨细胞电阻降低,肌动球蛋白环收缩,claudin-1发生重新分布,在胞质内的分布增加。
为阐明IBS-D肠道黏膜屏障功能破坏的机制,本研究采用国际公认的母婴分离法构建IBS-D大鼠模型,分别采用免疫荧光和蛋白质印迹法观察相关蛋白的变化,透射电镜观察细胞间紧密连接。结果显示,与对照组相比,模型组pMLC/MLC比值上调,pMLC表达升高,claudin-1表达下调,免疫荧光示claudin-1荧光强度减弱,结构紊乱,在胞质中的分布增加;虽然F-actin和ZO-1表达下调不明显,但免疫荧光结果表明F-actin束状结构模糊,ZO-1结构紊乱,提示MLC磷酸化水平升高,可通过介导肌动蛋白重组在IBS肠黏膜屏障功能破坏中发挥重要作用。pMLC/MLC比值升高可激活肌球蛋白头部的Mg2+-ATP酶水解产生能量使肌球蛋白与肌动蛋白结合,介导肌动蛋白收缩,胞内细胞骨架F-actin发生改变和重组,而ZO-1与细胞骨架F-actin相连,并且ZO-1又与claudin-1等特异蛋白构成紧密连接,故使胞内细胞骨架与细胞外连接蛋白信号互通,进而引起紧密连接结构和功能的改变,细胞间隙扩大,最终引起肠黏膜屏障功能障碍。上述结果说明MLC磷酸化介导肌动蛋白重组在IBS的发病机制中发挥重要作用,但其上游引起MLC磷酸化的相关信号通路变化仍有待研究,基于细胞间信号通路的复杂性,除MLC磷酸化介导肌动蛋白重组参与肠上皮屏障功能的调控外,可能存在其他信号通路影响细胞间紧密连接蛋白的变化导致IBS肠黏膜屏障功能障碍。
1 Spinelli A. Irritable bowel syndrome[J]. Clin Drug Investig, 2007, 27 (1): 15-33.
2 Chang FY, Lu CL, Chen TS. The current prevalence of irritable bowel syndrome in Asia[J]. J Neurogastroenterol Motil, 2010, 16 (4): 389-400.
3 Gwee KA, Bak YT, Ghoshal UC, et al; Asian Neurogastroenterology and Motility Association. Asian consensus on irritable bowel syndrome[J]. J Gastroenterol Hepatol, 2010, 25 (7): 1189-1205.
4 Ringel Y, Maharshak N. Intestinal microbiota and immune function in the pathogenesis of irritable bowel syndrome[J]. Am J Physiol Gastrointest Liver Physiol, 2013, 305 (8): G529-G541.
5 Turner JR, Rill BK, Carlson SL, et al. Physiological regulation of epithelial tight junctions is associated with myosin light-chain phosphorylation[J]. Am J Physiol, 1997, 273 (4 Pt 1): C1378-C1385.
6 刘雁冰, 袁耀宗, 陶然君, 等. 大鼠肠道高敏性模型的建立及其内脏敏感性评估[J]. 中华消化杂志, 2003, 23 (1): 34-37.
7 Al-Chaer ED, Kawasaki M, Pasricha PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development[J]. Gastroenterology, 2000, 119 (5): 1276-1285.
8 Xiao L, Rao JN, Cao S, et al. Long noncoding RNA SPRY4-IT1 regulates intestinal epithelial barrier function by modulating the expression levels of tight junction proteins[J]. Mol Biol Cell, 2016, 27 (4): 617-626.
9 Cereijido M, Contreras RG, Shoshani L, et al. Tight junction and polarity interaction in the transporting epithelial phenotype[J]. Biochim Biophys Acta, 2008, 1778 (3): 770-793.
10 Yu D, Marchiando AM, Weber CR, et al. MLCK-dependent exchange and actin binding region-dependent anchoring of ZO-1 regulate tight junction barrier function[J]. Proc Natl Acad Sci U S A, 2010, 107 (18): 8237-8241.
11 González-Mariscal L, Quirós M, Díaz-Coránguez M. ZO proteins and redox-dependent processes[J]. Antioxid Redox Signal, 2011, 15 (5): 1235-1253.
12 van Hinsbergh VW, van Nieuw Amerongen GP. Intracellular signalling involved in modulating human endothelial barrier function[J]. J Anat, 2002, 200 (6): 549-560.
13 Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application[J]. Am J Pathol, 2006, 169 (6): 1901-1909.
14 Gerrits L, Overheul GJ, Derks RC, et al. Gene duplication and conversion events shaped three homologous, differentially expressed myosin regulatory light chain (MLC2) genes[J]. Eur J Cell Biol, 2012, 91 (8): 629-639.
15 Xie C, Zhang Y, Wang HH, et al. Calcium regulation of non-kinase and kinase activities of recombinant myosin light-chain kinase and its mutants[J]. IUBMB Life, 2009, 61 (11): 1092-1098.
16 Hong F, Facemyer KC, Carter MS, et al. Kinetics of myosin light chain kinase activation of smooth muscle myosin in aninvitromodel system[J]. Biochemistry, 2013, 52 (47): 8489-8500.
17 Gao N, Huang J, He W, et al. Signaling through myosin light chain kinase in smooth muscles[J]. J Biol Chem, 2013, 288 (11): 7596-7605.
18 Shen L, Black ED, Witkowski ED, et al. Myosin light chain phosphorylation regulates barrier function by remodeling tight junction structure[J]. J Cell Sci, 2006, 119 (Pt 10): 2095-2106.
19 Guo M, Yuan SY, Frederich BJ, et al. Role of non-muscle myosin light chain kinase in neutrophil-mediated intestinal barrier dysfunction during thermal injury[J]. Shock, 2012, 38 (4): 436-443.
(2016-06-12收稿;2016-08-14修回)
Role of Myosin Light Chain Phosphorylation in Intestinal Mucosal Barrier Dysfunction in Diarrhea-predominant IBS Rats
ZHANGMeng1,CHENChaoying2,LÜBin2.
1theFirstClinicalMedicalCollege,ZhejiangChineseMedicalUniversity,Hangzhou(310053);2DepartmentofGastroenterology,theFirstAffiliatedHospitalofZhejiangChineseMedicalUniversity,Hangzhou
LÜ Bin, Email: lvbin@medmail.com.cn
Myosin Light Chains; Fibrous-Actin; Tight Junction; Irritable Bowel Syndrome
10.3969/j.issn.1008-7125.2017.01.005
*本课题由国家自然科学资金资助(编号:81470814)
#本文通信作者,Email: lvbin@medmail.com.cn
Background: Myosin light chain (MLC) is the initiating factor that regulating tight junction and intestinal permeability. Phosphorylated MLC (pMLC) can cause redistribution of tight junction related protein, and break the structure and integrity of tight junction, thus induces the dysfunction of intestinal mucosal barrier. Aims: To explore the role of MLC phosphorylation in intestinal mucosal barrier dysfunction in diarrhea-predominant IBS (IBS-D) rats. Methods: Eight Spague-Dawley pregnant rats were randomly divided into model group and control group, IBS-D rat model was established by maternal separation. The character and particles of feces were record 1 hour after establishing the model. Abdominal withdrawal reflex (AWR) was used to evaluate visceral sensitivity. The distributions of fibrous actin (F-actin), tight junction associated protein ZO-1 and claudin-1 in colon were assessed by immunofluorescence. The expressions of MLC, pMLC, F-actin, ZO-1 and claudin-1 were measured by Western blotting. Tight junction was observed by transmission electron microscope (TEM). Results: Compared with control group, visceral sensitivity was significantly increased. Immunofluorescence showed the decrease in fluorescence intensity, structural distortion and redistribution of claudin-1 and the fussy structure of F-actin and ZO-1 in model group. Western blotting showed that pMLC/MLC ratio and expression of pMLC were significantly increased and expression of claudin-1 was significantly decreased in model group, but no significant differences in expressions of MLC, F-actin and ZO-1 were found between the two groups. TEM showed that tight junction was broken and cell space was enlarged. Conclusions: The increased MLC phosphorylation may induce the redistribution of cell cytoskeletal protein F-actin, cause the change of structure and function of intercellular tight junction proteins and enlargement of intercellular space, thus may induce the dysfunction of intestinal mucosal barrier, and play an important role in the pathogenesis of IBS-D.
