基于石英毛细管载体的血清甲胎蛋白灰度分析免疫检测法
2017-02-06沈海滢王晓倩王云云屈锋
沈海滢+王晓倩+王云云+屈锋
摘 要 以熔融石英毛细管为免疫分析载体材料, 以肿瘤标志物甲胎蛋白(AFP)为模型蛋白, 将AFP捕获抗体固定于毛细管, AFP和AFP的辣根过氧化物酶(HRP)标记抗体分别注入毛细管进行孵育, 形成双抗体夹心结构。注入化学发光底物液后, HRP催化底物液发光, 产生的光信号通过成像仪转化为图片。对图片进行灰度值分析, 建立了血清甲胎蛋白的定量免疫分析检测法。当捕获抗体稀释倍数为100, 酶标抗体稀释倍数为200, 化学发光曝光时间为20 s时, 本方法可在3.1~50 ng/mL浓度范围实现甲胎蛋白测定, 检出限为2.7 ng/mL。对20例人血清临床实际样本进行检测, 结果令人满意, 加标回收率在96.0%~106.7%之间。本方法样本消耗少、材料简单、检测成本低、不依赖大型仪器、 适用性广, 具有较好的临床检验应用前景。
关键词 石英毛细管; 甲胎蛋白; 免疫分析; 灰度分析
1 引 言
随着我国医疗卫生事业的快速发展和人们对健康保健的日益重视, 社会对实用性的检测技术需求越来越多, 体外诊断的新方法、新技术已成为生物分析检测的热点和重点研发方向。目前, 低成本、操作简便、小型化的体外诊断方法和装备的研究正受到科研机构和医疗检测市场的广泛关注。
现有的体外诊断产品中, 免疫检测类产品占比很大, 主要采用酶联免疫吸附法、化学发光法、电化学发光法、放射免疫法以及胶体金免疫层析法[1~3]。前两者以微孔板为检测载体, 技术较成熟, 但检测时间较长, 一般需要2~3 h; 电化学发光法主要基于磁珠捕获抗原进行检测, 检测速度快, 一般可在30 min内完成, 但检测成本较高, 约为酶联免疫吸附法的3~4倍; 放射性免疫检测灵敏度高, 但对操作环境及操作人员要求很高; 胶体金免疫层析检测速度快, 可实现现场检测, 但难以实现定量分析。近年来, 一些学者报道了基于纳米材料及微流控技术的新型体外免疫诊断方法, 但纳米材料的制备较难控制其稳定性, 真正实现临床应用的并不多见[4,5]。本课题组多年从事毛细管电泳生物医药分析研究, 所用的分离载体是熔融石英毛细管, 其性质稳定, 透光性好, 表面易进行物理、化学修饰, 加工工艺成熟, 成本低廉[6~10]。本实验将熔融石英毛细管用于免疫检测的载体材料, 研究基于灰度值分析的血清中甲胎蛋白的免疫检测方法, 目的是实现基于石英毛细管材料和灰度分析的定量免疫检测。传统的化学发光免疫分析检测器大多采用光电倍增管, 检测区域有限, 分析速度慢, 而以电感耦合器件(CCD)为代表的图像传感器则可以提供更加广泛的检测区域, 具有光电转换效率高、动态线性范围宽、多通道同时分析等优点, 成为未来生物传感器的一个发展方向[11,12]。实验中使用的便携式化学发光成像仪采用制冷CCD, 灵敏度高, 体积小, 仅有0.006 m3, 能够高效捕获化学发光信号, 形成图片。灰度是指黑白图像中点的颜色深度, 灰度分析法具有结果直观, 分析快速等优点, 在生物学、医学、图像识别领域有广泛的用途[13], 很多体外诊断试剂的检测应用也采用灰度值分析方法[14]。
本研究以熔融石英毛细管为载体, 建立了基于灰度分析的免疫检测方法。以肿瘤标志物甲胎蛋白(AFP)为模型蛋白, 通过双抗体夹心方式进行检测, 与抗体偶联的辣根过氧化物酶(HRP)催化化学发光底物液发光, 产生的光信号通过成像仪转化为图片[12,15,16], 进行灰度值分析。研究结果表明, 毛细管免疫检测和灰度分析结合, 实际使用的样本量仅为0.8 μL, 而ELISA检测一般需要50 μL, 因此本方法大幅降低了样本使用量。检测过程中仅需石英毛细管、医用注射器等常用耗材, 操作简单, 不依赖大型仪器。所建方法具有普适性, 可用于基于化学发光免疫分析的生物标志物的快速检测。
2 实验部分
2.1 仪器与试剂:
便携式化学发光成像仪(国家纳米科学中心研制); 熔融石英毛细管(北京华阳利民仪器有限公司); 医用注射器(北京科龙生物医学技术有限公司); 表面活化剂(美国Anteo Technologies公司); 磷酸盐缓冲液(PBS)和小牛血清白蛋白(BSA)(德国Merck公司); AFP捕获抗体、AFP的HRP酶标抗体及AFP标准液(北京科跃中楷生物技术有限公司); 癌胚抗原(CEA)标准液、前列腺特异性抗原(PSA)标准液、糖类抗原125(CA125)标准液及糖类抗原199(CA199)标准液(北京沫之东生物技术有限公司); 化学发光底物液(美国Millipore公司); 实验用水由Millipore纯水仪制备。
2.2 分析方法
2.2.1 实验操作步骤 实验步骤如图1所示:(1)活化毛细管 将毛细管裁剪为10 cm长, 使用医用注射器将表面活化剂注入毛细管, 室温静置30 min, 对毛细管内壁进行活化后, 用水冲洗。(2)固定捕获抗体及封闭 将AFP的捕获抗体按照一定比例用PBS稀释, 将稀释液注入毛细管内部, 室温静置1 h后再用PBS清洗, 将含5% BSA的PBS溶液注入毛细管中, 室温静置30 min进行封闭。(3)注入待测蛋白 将待测蛋白AFP溶液注入到毛细管, 室温孵育30 min后用PBS清洗。(4)注入酶标抗体及化学发光底物液 将稀释为一定浓度的HRP酶标抗体注入毛细管, 室温孵育30 min, PBS冲洗后注入化学发光底物液。
2.2.2 成像分析 将化学发光信号转化为图片形式, 进行成像灰度分析。毛细管置于成像仪中, 选择一定的曝光时间, 检测化学发光信号。毛细管中的化学发光底物在酶标抗体上HRP酶的催化作用下产生的光信号转化为图片。图片上的灰度值表示待测蛋白AFP抗原的浓度。通过ImageJ软件分析图片, Origin 8.0软件处理数据。
3 结果与讨论
3.1 毛细管内径对检测的影响
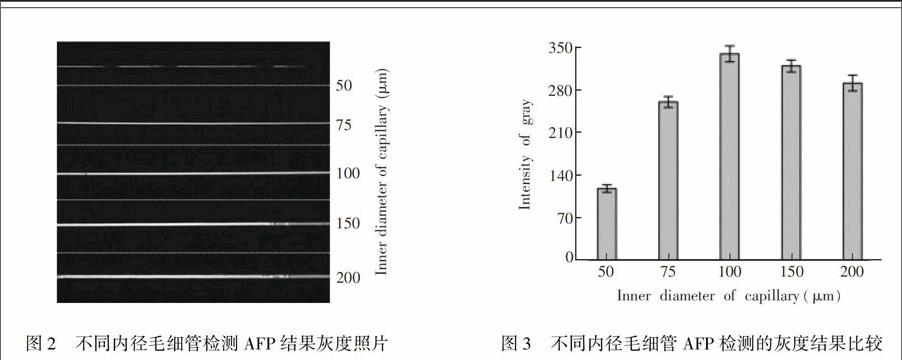
市售毛细管有多种内径, 考察了不同内径毛细管对检测的影响。毛细管内径不同, 可提供抗体结合的位点面积不同。内径较小的毛细管, 可节省样品, 但内壁表面积较小, 可吸附的捕获抗体的量较小, 因而后续可结合的抗原以及酶标抗体也较少, 故化学发光信号较弱, 灰度低, 不利于灵敏检测。较大内径的毛细管所提供的内壁表面积大, 可吸附的捕获抗体量增加, 可结合的抗原及酶标抗体也增加, 化学发光信号增强。考察了50, 75, 100, 150和200 μm内径的毛细管, 分别检测相同浓度的AFP, 比较其灰度强度。结果表明, 灰度强度所指示的化学发光信号与AFP浓度呈正相关(图2和图3)。灰度照片和灰度强度均显示毛细管内径对AFP检测有明显影响。使用50 μm毛细管, 灰度强度较弱; 内径增加到75 μm, 灰度强度增大; 使用100 μm内径毛细管, 灰度较强且均匀; 当内径大于100 μm时, 信号强度降低, 且在横截面方向上信号分布不均。理论上, 大内径的毛细管可提供的内壁表面积大, 可吸附的捕获抗体量多, 可结合的抗原及酶标抗体也多, 可使信号线性增强, 直至趋于饱和。然而由图2可见, 150 μm内径时信号不均。 可能是由于与拍摄方向相切的内壁上下沿区域光程较长, 出现内壁上下沿信号较强, 中部信号偏弱的现象。灰度信号不均匀不利于准确分析, 且增加了各种试剂和样品用量。因此, 实验选择内径100 μm的毛细管。
3.2 免疫分析的条件优化
3.2.1 捕获抗体浓度 捕获抗体在毛细管内的固定效果很大程度上决定了检测的灵敏度。通常捕获抗体在毛细管内壁的密度越高, 检测灵敏度越高, 但过高浓度的捕获抗体, 会造成过饱和, 浪费抗体试剂。本实验中, 固定AFP浓度和酶标抗体浓度, 对捕获抗体浓度进行优化, 将所购的捕获抗体稀释, 稀释倍数为25, 50, 100, 150, 200, 250和300倍, 比较检测的灰度值。当捕获抗体的稀释倍数为150, 200, 250和300倍时, 随稀释倍数增大, 溶液浓度降低, 灰度值即化学发光信号逐渐减小, 说明溶液中的捕获抗体浓度偏低, 固定到毛细管内壁的捕获抗体量较少, 不能充分结合抗原, 故化学发光值随稀释倍数增大而降低, 灰度值减小; 当稀释倍数为50和25倍时, 捕获抗体的浓度因稀释比例小而保持较高的水平, 但其化学发光信号却与捕获抗体稀释100倍时相当, 并未增强, 说明当捕获抗体稀释倍数为100时, 灰度值即化学发光信号趋于饱和, 增加浓度不再使抗体在毛细管内壁的分布密度增加, 且当稀释倍数为100时, 结合到毛细管内壁上的捕获抗体能够完全结合抗原。因此, 选择稀释100倍为捕获抗体最佳的稀释比例(图4)。
3.2.2 酶标抗体溶度
酶标抗体的浓度也直接影响检测结果。如果酶标抗体浓度偏低, 不能与抗原充分结合, 就会造成实际检测信号值偏低。如果酶标抗体浓度偏高, 虽然反应充分, 但是可能浪费试剂。实验中, 固定捕获抗体稀释倍数和AFP抗原浓度, 对检测抗体浓度进行优化。将所购的酶标抗体稀释, 稀释倍数为100, 150, 200, 250, 300和350倍, 比较不同稀释浓度的灰度值。结果表明, 酶标抗体稀释倍数为250, 300, 350倍时, 随稀释比例增大, 酶标抗体浓度降低, 灰度值即化学发光信号逐渐减小, 说明酶标抗体浓度偏低, 反应不充分; 稀释倍数为150和100倍时, 酶标抗体浓度随稀释比例减小而增大, 但灰度值与稀释倍数200时相比未见增加。说明稀释倍数为200时, 灰度值趋于饱和, 抗原抗体结合较为充分。因此, 酶标抗体最佳的稀释倍数为200倍。
3.2.3 孵育时间
孵育时间是免疫检测的重要参数。如孵育时间过短, 反应进行不充分, 影响检测的灵敏度。若孵育时间过长, 则耗时过长。本实验对孵育时间进行优化。室温下, 将AFP抗原及AFP酶标抗体的孵育时间分别设定为5, 15, 30, 60和90 min, 比较灰度值变化。结果表明, 孵育15 min 的灰度值即化学发光信号比孵育5 min时明显升高, 说明5和15 min的孵育时间偏短, 反应尚不充分; 孵育时间设为30, 60和90 min时, 灰度值没有增加。说明孵育时间为30 min时, 灰度值趋于饱和, 免疫反应较为充分。因此, 选择最佳孵育时间30 min(图5)。
3.2.4 曝光时间优化 曝光时间是化学发光免疫检测的重要参数。曝光时间过长, 会造成高浓度AFP检测信号过饱和; 曝光时间过短, 会造成低浓度AFP检测信号微弱, 都不利于图像分析, 因此有必要对曝光时间进行优化。固定捕获抗体及酶标抗体浓度, 对高浓度(100 ng/mL)和低浓度(3 ng/mL)的AFP分别进行检测, 曝光时间为5, 10, 15, 20 和25 s, 选择同时满足高浓度和低浓度AFP抗原检测的合适曝光时间。当曝光时间为15 s时, 3 ng/mL AFP抗原灰度值较弱, 无法进行图像分析, 增加曝光时间, 灰度值增加。当曝光时间为25 s时, 100 ng/mL AFP抗原灰度值出现过饱和, 不利于分析。因此, 20 s为最佳曝光时间, 能够满足检测需求。
3.3 灰度分析的标准曲线
选择3.1~50 ng/mL浓度范围的AFP样品溶液, 测定其灰度值。 灰度值Y与AFP浓度X的关系为:
Y=
42.9328+53.8242log(X1.5625 ng/mL)2
式中, X的单位为ng/mL。Y与X二者呈现较好的线性关系(图6), R=0.992。稀释AFP样品, 通过灰度分析, 测定方法的检出限为2.7 ng/mL。
在目前的临床检验中, 只有当AFP浓度超过20 ng/mL时, 该结果才具有一定的临床诊断意义[17,18]。本方法对AFP的检测范围在3.1~50 ng/mL之间, 为进一步临床应用奠定了基础。
3.4 检测特异性
特异性是评价免疫检测的重要指标之一, 通常用交叉反应率表示。实验中, 分别在血清加入中可能存在的干扰物CEA、 PSA、 CA125和CA199, 在最佳条件下测定。结果表明, 交叉反应率均小于0.5%, 说明上述潜在的干扰组分对检测结果影响小, 方法的检测特异性好[19], 抗干扰能力强。
3.5 检测准确性
评估体外诊断试剂准确性的方法主要有方法学比对和回收实验两种。方法学比对是将两种不同的检测体系所得结果进行比较, 在临床化学文献报道中较为常见[20~22]。将本方法与目前大型医院广泛使用的Roche电化学发光方法进行方法学比对。实际临床样本来源于解放军总医院, 使用采血管收集人全血, 在室温中沉降30 min后, 3000 r/min离心5 min, 收集上层血清, 4℃储存备用。获取的20例血清样本分别采用两种方法进行分析检测, 结果见图7。两种方法的线性回归方程为y=0.148+11095x, R=0.980, 说明两种方法的相关性良好, 本方法具有较高准确性, 能够满足临床检测要求。通过回收实验评价本方法的准确性。选用3份人血清, 在最佳实验条件下测定其AFP浓度, 然后分别向血清中加入AFP标准液, 再次测定其AFP浓度。重复5次, 计算得回收率在96.0%~106.7%之间(表1), 说明本检测方法的准确性较好[20]。
4 结 论
以熔融石英毛细管为免疫分析载体材料, 通过化学发光成像和灰度分析, 建立了血清甲胎蛋白的定量免疫分析检测方法。本方法可在3.1~50 ng/mL 浓度范围实现甲胎蛋白检测, 覆盖了临床应用的关键浓度, 为本方法的进一步临床应用奠定了基础。基于毛细管为载体的灰度分析免疫检测方法的样本消耗少、载体材料简单、检测成本低廉, 且不依赖大型仪器, 适用化学发光免疫分析, 具有普适性和较好的临床检验应用前景。
References
1 Castiello F R, Heileman K, Tabrizian M. Lab Chip, 2016, 16(3): 409-431
2 Nahavandi S, Baratchi S, Soffe R, Tang S Y, Nahavandi S, Mitchellc A, Khoshmanesh K. Lab Chip, 2014, 14(9): 1496-1514
3 ZHANG Jun.Rui, CHEN Jian, LIU Zhong.Ming. Chinese J. Anal. Chem., 2010, 38(8): 1219-1226
张军瑞, 陈 健, 刘仲明. 分析化学, 2010, 38(8): 1219-1226
4 Chin C D, Linder V, Sia S K. Lab Chip, 2012, 12(12): 2118-2134
5 Jung W, Han J, Choi J W, Ahn C H. Microelectron. Eng., 2015, 132: 46-57
6 Meng C, Zhao X, Qu F, Mei F, Gu L. J.Chromatogr. A, 2014, 1358: 269-276
7 Hernández.Borges J, Neusü C, Cifuentes A, Pelzing M. Electrophoresis, 2004, 25(14): 2257-2281
8 Simpson S L, Quirino J P, Terabe S. J. Chromatogr. A, 2008, 1184(1.2): 504-541
9 Breadmore M C. Electrophoresis, 2007, 28(1.2): 254-281
10 Vandaveer W R, Pasas.Farmer S A, Fischer D J, Frankenfeld C N, Lunteet S M. Electrophoresis, 2004, 25(21.22): 3528-3549
11 Zong C, Wu J, Wang C, Ju H, Yan F. Anal. Chem., 2012, 84(5): 2410-2415
12 Liu A, Zhao F, Zhao Y, Shangguan L, Liu S. Biosens.Bioelectron., 2016, 81: 97-102
13 Macphee D J. J. Pharmacol Toxicol Methods, 2010, 61(2): 171-177
14 CHEN Li, PENG Jian.Xiong, ZHOU Xi.Guo. China Medical Herald, 2006, 29(3): 29-31
陈 莉, 彭剑雄, 周细国. 中国医药导报, 2006, 29(3): 29-31
15 Fan F, Shen H, Zhang G, Jiang X, Kang X. Clin. Chim. Acta, 2014, 431: 113-117
16 WANG Chen, WU Jie, ZONG Chen, XU Jie, JU Huang.Xian. Chinese J. Anal. Chem., 2012, 40(1): 3-10
汪 晨, 吴 洁, 宗 晨, 徐 洁, 鞠熀先. 分析化学, 2012, 40(1): 3-10
17 Sell S, Nichols M, Becker F F, Leffert H L. Cancer Res., 1974, 34(4): 865-871
18 XU Jian.Ye, LIN Ding, LI Wei.Dao, WU Li.Xiang, LIU Yu, YI Ling, HUANG Xue.Mei, RAN Chong.Xin. Chinese Journal of Evidence.Based Medicine, 2009, 9(05): 525-530
徐建业, 林 丁, 李伟道, 吴立翔, 刘 预, 易 玲, 黄学梅, 冉崇新. 中国循证医学杂志, 2009, 9(05): 525-530
19 XU Wei.Wen. Journal of Molecular Diagnosis and Therapy, 2010, 2(2): 140-144
徐伟文. 分子诊断与治疗杂志, 2010, 2(2): 140-144
20 Kuhn E, Addona T, Keshishian H, Burgess M, Mani D R, Lee R T, Sabatine M S, Gerszten R E,Carr S A. Clin. Chem., 2009, 55(6): 1108-1117
21 Waldmuller S, Muller M, Rackebrandt K, Binner P, Poths S, Bonin M, Scheffold T. Clin.Chem., 2008, 54(4): 682-687
22 Blackmore S, Pfeiffer C M, Lee A, Fazili Z, Hamilton M S. Clin.Chem., 2011, 57(7): 986-994
Abstract A fused quartz capillary was taken as the carrier for the immunoassay of the tumor marker alpha fetal protein (AFP) as a model protein. The capture antibody of AFP was immobilized in capillary. Based on a sandwich immunoassay format, the antigen and corresponding horseradish peroxidase (HRP) labeled antibodies were introduced into the capillary for online incubation. After the injection of the chemiluminescence substrate, the chemiluminescence signals were captured by the CCD camera and changed into figures. The results could be read by gray level analysis of the figures. When the capture antibody was diluted 100 times, the enzyme labeled antibody was diluted 200 times, and the exposure time was 20 s, the detection range of AFP was 3.1-50 ng/mL and the critical concentrations of 20 ng/mL clinical applications were covered. The limit of detection was 2.7 ng/mL. Twenty clinical samples were tested with fine accuracy. The recoveries of the spiked samples were between 96.0% and 106.7%. In the assay, the sample consumption was low and the experimental material was simple and cheap. The method does not require large instruments, and is appropriate for clinical application
Keywords Quartz capillary; Alpha fetal protein; Immunoassay; Gray level analysis