上转换发光免疫层析试纸条快速定量检测己烯雌酚
2017-02-06王瑜任舒悦姜会聪白家磊彭媛宁保
王瑜+任舒悦+姜会聪+白家磊+彭媛+宁保安+高志贤
摘 要 采用溶剂热法合成上转换纳米颗粒(UCNPs).NaYF4∶Yb,Er,进行表面功能化修饰, 将其与己烯雌酚(DES)单克隆抗体偶联, 制备荧光探针,以牛血清白蛋白.己烯雌酚(BSA.DES)偶联物和羊抗鼠二抗分别喷涂硝酸纤维膜,形成试纸条检测线(T线)和质控线(C线),建立了上转换发光免疫层析试纸条快速定量检测DES的方法。实验结果表明,此试纸条定量检测DES线性范围为25~10000 ng/mL(y=0.43927x-0.57647,R2=0.996), 检出限为20.84 ng/mL,单个样品检测时间为15 min,批内和批间变异系数均小于10%,特异性识别能力强, 在37℃存放下7天检测值RSD的平均值约为15%。加标回收实验显示平均回收率为90.1%~115.2%,相对标准偏差小于5%,与高效液相色谱法有较好的一致性。
关键词 上转换纳米颗粒; 免疫层析试纸条; 己烯雌酚; 定量检测
1 引 言
己烯雌酚(Dethylstilbestrol, DES)作为一种人工合成的雌激素药物,广泛应用于妇科病的预防和治疗[1], 同时它还具有促进动物生长和提高饲料转化率等作用[2]。DES可通过食物链进入人体,导致激素分泌异常、甚至乳腺癌和胚胎畸形等严重后果,因此许多国家已明令禁止将DES用于动物养殖[3]。我国国家标准规定的DES检测方法为液相色谱.串联质谱法[4],目前用于 DES检测的方法主要有酶联免疫分析法[5]、高效液相色谱法[6]、液相色谱.质谱联用法[7]、电化学法[8]、放射免疫法[9]等。以上方法准确灵敏,但存在过程复杂、操作繁琐以及携带不便等缺点。因此,建立简单、灵敏、快速的检测方法十分必要。
近年来,基于荧光标记的免疫层析技术得到广泛关注,量子点(Quantum dots, QDs)为免疫层析技术的常用的荧光标记物[10]。 Beloglazova等[11]将QDs作为免疫探针, 建立了检测玉米赤霉烯酮的免疫层析方法, 且灵敏度良好。段宏等[12]利用量子点荧光微球为探针,制备免疫层析试纸条定量检测恶性疟原虫。稀土掺杂上转换纳米颗粒(UCNPs)是一种新型材料,其上转换发光机制源于稀土离子在红外光激发下,可以转化为高能量可见光[13]。NaYF4∶Yb, Er为双掺的上转换稀土化合物,量子产率高,荧光稳定性好[14]。与QDs相比,UCNPs具有稳定性好、亮度高、干扰背景几乎为零、不易光解和光漂白等优点[15]。目前, 上转换发光免疫层析技术的研究逐渐受到关注,於然等[16]将修饰羧基的上转换颗粒用于免疫层析试纸, 检测脱氧雪腐镰刀菌烯醇,但抗体标记较复杂,检测范围窄。本研究以修饰醛基的UCNPs为载体,将DES单抗直接标记在颗粒表面,制备出新型的荧光探针,建立了上转换免疫层析试纸条快速定量检测DES的新方法。方法检测范围宽,操作简单,适用于大量样品现场检测。
2 实验部分
2.1 仪器与试剂
JEM.100CXII透射电子显微镜(日本电子株式会社);FTS6000傅里叶红外光谱仪(美国Bio.Rad公司); LGJ.10D型冷冻干燥机(北京四环科学仪器厂); HM3010单维往复划膜仪(上海金标公司); ZQ2000微电脑自动斩切机(上海金标公司); 硝酸纤维素膜(NC膜)、加样垫、结合垫、吸水垫、PVC底板及UPT.3A便携式上转换发光免疫分析仪,均由北京热景生物技术有限公司提供。
氯化钇(YCl3·6H2O)、氯化镱(YbCl3·6H2O)、氯化铒(ErCl3·6H2O)、十八烯(C 18H 36)购于山东西亚化学工业有限公司;四乙氧基硅烷(TEOS)、3.氨丙基三乙氧基硅烷(APTES),牛血清白蛋白(BSA)购于上海Sigma公司;己烯雌酚(DES)、雌二醇(E2)、己烷雌酚(HEX)、双烯雌酚(DIEN)、双酚A(BPA)购于北京百灵威公司;己烯雌酚单克隆抗体(DES.ab)、己烯雌酚抗原(DES.BSA)本实验室制备; 羊抗鼠抗体(北京索莱宝公司); 实验用水为超纯水(18.2 MΩ cm);其它试剂均为分析纯。牛奶样品购于当地超市。
2.2 上转换纳米材料NaYF4∶Yb, Er的合成与表面修饰
根据文献[17,18\]的方法并加以改进。称取0.18 mmol YbCl3·6H2O,0.80 mmol YCl3·7H2O和0.02 mmol ErCl3·6H2O,加入10 mL C 18H 34O2和30 mL C 18H 36。将溶液加热至160℃并维持30 min,形成均匀溶液,同时除去O2和水,然后冷却至50℃。逐滴加入20 mL溶有5 mmol NaOH和8 mmol NH4F的甲醇溶液并搅拌30 min,尽快升温至100℃除去水和甲醇。在氮气保护下迅速加热至320℃并维持1 h。反应完成后,溶液自然冷却至室温,所得产物用环己烷和乙醇洗3次,烘干备用。
称取上述UCNPs 100 mg于60 mL乙醇中,超声分散。加入2.5 mL氨水,20 mL超纯水和25 μL TEOS,40℃下搅拌反应6 h。随后,加入50 μL APTES,40℃继续搅拌反应6 h。所得产物用乙醇洗涤3次,干燥备用。称取10 mg修饰氨基的UCNPs, 分散于10 mL PBS缓冲液(0.01 mol/L, pH 7.4),然后加入20 mL 2.5%的戊二醛溶液,振荡反应30 min,所得产物用PBS缓冲液洗涤两次。
2.3 DES单抗标记的UCNPs探针和UCNPs试纸条的制备
称取10 mg 修饰后的UCNPs,加入2 mL超纯水超声分散。随后,加入4.8 μL (10.5 mg/mL)的DES单克隆抗体, 室温振荡1 h,再加入50 μL 20%牛血清白蛋白(BSA)溶液封闭1 h。用PBS洗涤两次后,将偶联上抗体的UCNPs用PBS重悬,于4℃下保存待用。
上转换发光试纸条包括加样垫、结合垫、层析膜、吸水垫和PVC板。将标记好抗体的UCNPs均匀滴涂在结合垫上,真空冷冻干燥。用划膜仪将0.8 mg/mL DES.BSA和1 mg/mL羊抗鼠IgG喷涂在NC膜上,分别作为检测线(T线)和质控线(C线),37℃干燥1 h。将加样垫、结合垫、NC膜、吸水垫裁剪成合适大小,依次粘贴在PVC板上,用自动切条机切成4 mm宽的试纸条,干燥备用。
2.4 UCNPs试纸条的检测流程及条件优化
DES的检测流程如图1所示。将不同浓度的样品取100 μL滴加到检测卡加样垫上,室温反应15 min后,UPT.3A免疫分析仪读取试纸条T和C线荧光强度。当样品中没有DES时,UCNPs探针经NC膜迁移至试纸条T线区域, 未结合的UCNPs探针与DES.BSA结合,T线出现荧光条带; 反之,UCNPs探针上的DES单克隆抗体与DES结合,免疫复合物经NC膜进一步迁移至试纸条C线区域与羊抗鼠二抗结合,C线出现荧光条带,T/C的值与DES浓度呈负相关。如果C线没有产生荧光条带,说明试纸条无效。
以结合垫宽度、加样垫宽度、DES.BSA浓度、羊抗鼠二抗浓度为因素,设计四因素三水平正交试验优化试纸条性能,具体见表1。通过正交试验选取阴性样本T0/C0与阳性样本T/C的差值最大时的条件为试纸条最佳工艺条件。采用免疫动力学分析方法确定试纸条最佳检测时间。最优条件下,将浓度为500 ng/mL的DES溶液加入加样孔,每隔30 s,UPT.3A免疫分析仪读取试纸条T/C的值,以T/C的值达到稳定的时间为最佳检测时间。
2.5 DES检测的标准曲线
用10%甲醇溶液配制DES系列标准溶液(0, 25, 50, 100, 200, 500, 800, 1000, 4000, 8000和10000 ng/mL)。UCNPs试纸条检测,15 min后UPT.3A免疫分析仪读取试纸条T和C线荧光强度以及T和C线荧光强度比值,每个浓度重复检测3次。以DES浓度对数为横坐标,阴性样本T0/C0对数与阳性样本T/C对数的差值为纵坐标,绘制DES检测的标准曲线。
2.6 UCNPs试纸条的性能评价
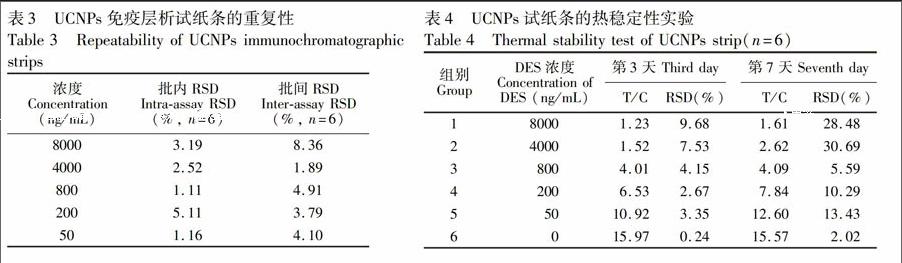
2.6.1 重复性和热稳定性测试 将同批和不同批次的试纸条分别检测DES,重复3次,通过软件计算其变异系数(CV, %),评价试纸条的批内和批间重复性。
根据文献[19,20\]和实验室前期工作,试纸条的热稳定性是一个重要的评价指标。将试纸条密封存放于37℃恒温恒湿箱,在第0, 3, 7天取出6条分别检测DES,重复3次,观察试纸的热稳定性并推测其保存期限。
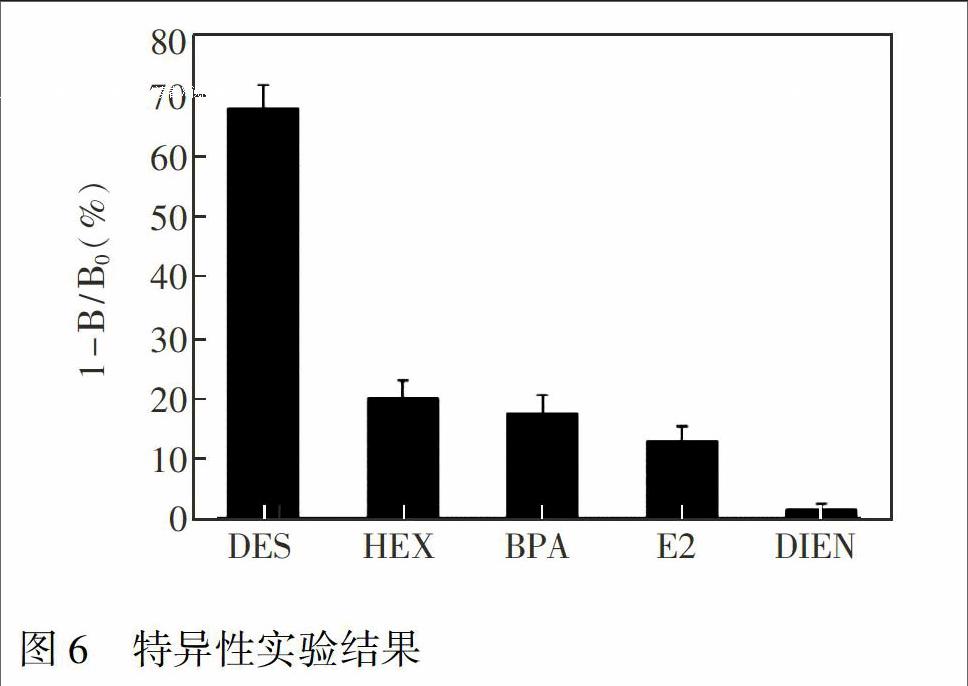
2.6.2 特异性 分别配制浓度为270 ng/mL的DES, HEX, DIEN, BPA, E2标准溶液。用UCNPs试纸条检测,重复3次,通过计算其竞争抑制率(1 - B/B0)判断试纸条的特异性,其中B为阳性时试纸条的T/C值, B0为阴性时试纸条的T0/C0值。
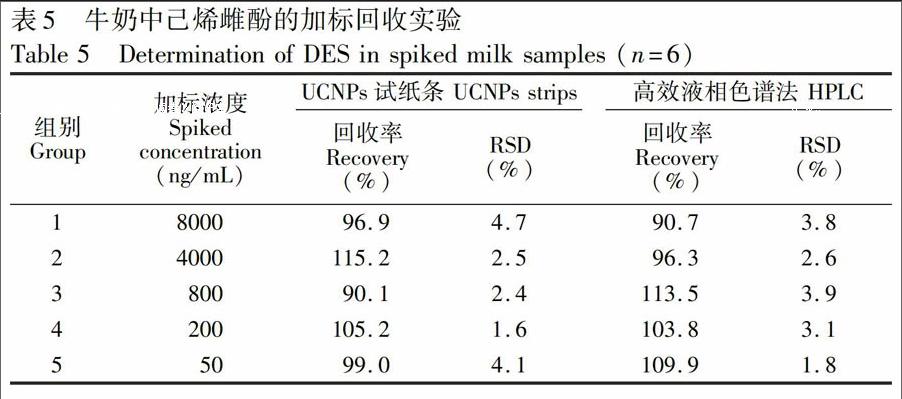
2.6.3 实际样品检测 牛奶样品购买于当地超市。分别取1 mL牛奶置于离心管中,按50, 200, 800, 4000和8000 ng/mL水平添加DES标准品。每个样品中加入等体积的乙酸乙酯萃取,小心振荡,静置,待样品分层后,收集上清液,用氮气吹干。最后,将残留物溶解在10%甲醇溶液中进行分析。同时用高效液相色谱法[21]进行对比。
3 结果与讨论
3.1 UCNPs修饰前后的表征
UCNPs修饰前后的透射电镜图见图2。由图2A可见,合成的UCNPs粒径均一且颗粒分散性较好,粒径约为110 nm,呈六角盘状,厚度约为60 nm。由图2B可见, 修饰后的UCNPs表面均匀包裹一层SiO2,厚度约为9 nm。傅里叶红外光谱仪对修饰前后UCNPs进行表征,图3a为油酸包覆的上转换纳米颗粒,1703.21 cm 1处为羧基CO的振动峰,2856.57 和2928.49 cm 1处为长链烷基中CH2的伸缩振动峰。修饰硅壳后的UCNPs如图3b所示,在1095.56 cm 1处出现属于硅氧键 (SiO)的对称伸缩振动峰,说明上转换颗粒表面包覆有SiO2,在3394.69和1633.85 cm 1处出现的特征吸收峰,分别属于氨基(NH2)的伸缩振动和弯曲振动峰。证明本方法成功制备出包覆硅壳并修饰上氨基的上转换纳米颗粒。
3.2 UCNPs试纸条的优化
结合垫宽度、加样垫宽度、DES.BSA浓度、羊抗鼠二抗浓度是影响试纸条检测灵敏度的关键参数。本研究通过正交试验优化,结果见表2:当结合垫宽度为0.7 cm,加样垫宽度为1.8 cm,DES.BSA浓度为0.8 mg/mL,羊抗鼠二抗浓度为1 mg/mL时,阴性样本T0/C0与阳性样本T/C的差值最大。因此,本实验选择该条件为试纸条的最优条件。
免疫动力学曲线见图4,T线和C线荧光强度比值随着反应时间的延长呈现下降趋势,在15 min后即趋于稳定。此结果表明,试纸条最佳的检测时间为加样后15 min。
3.3 UCNPs试纸条定量检测DES的标准曲线及检出限
UCNPs免疫层析试纸条检测DES的标准曲线见图5。结果表明,DES浓度在25~10000 ng/mL时,其对数值和阴性样本T0/C0对数与阳性样本T/C对数的差值呈线性关系,线性回归方程为y=0.43927x-0.57647(R2=0.996)。检出限按m0-3SD(m0为20次空白测试T/C的平均值,SD为20次空白测试的标准差)计算为20.84 ng/mL。
3.4 UCNPs试纸条检测性能的评价
3.4.1 UCNPs试纸条重复性和热稳定性 由表3可知,UCNPs试纸条批内和批间重复性相对较好。通过计算得出批内RSD小于6%,批间RSD变异系数(CV)小于10%。结果表明,UCNPs试纸条重复性好。
实际应用中,UCNPs试纸条应存放在室温或4℃以保持生物分子活性。一般认为,如果试纸条存放在37℃,它的检测能力将更快受到损害。因此,将试纸条密封存放于37℃恒温恒湿箱,分别在第0, 3, 7天取出检测,以第0天的检测值作为对照组。如表4所示,第3天的检测值的RSD小于10%,而第7天的检测值的RSD平均值约为15%,说明UCNPs试纸条热稳定性良好。
3.4.2 UCNPs试纸条的特异性 选取DES的结构类似物DINE,HEX,BPA和功能类似物E2评价试纸条的特异性。由图6可知,在浓度为270 ng/mL时,只有DES的竞争抑制率为67.7%,其结构类似物和功能类似物的竞争抑制率均小于20%,表明UCNPs试纸条具有良好的特异性识别能力。
3.4.3 加标样品的检测 UCNPs试纸条的准确性以及精密度通过加标回收实验进行评价。从表5可知,5个加标水平的平均回收率为90.1%~115.2%,相对标准偏差(RSD)均小于5%,表明UCNPs试纸条的精密度及准确性满足快速定量检测DES的需求。为了进一步验证UCNPs试纸条的可靠性,同时用高效液相色谱法测定加标样品中的DES,回收率为96.3%~113.5%,相对标准偏差(RSD)均小于4%。同时,两种方法的测定结果有较好的一致性。
4 结 论
本研究建立了上转换发光免疫层析法快速定量检测DES的方法。与胶体金试纸条相比,方法不仅具有更高的灵敏度,而且可以定量分析;与高效液相色谱法相比,方法检测时间仅需15 min, 操作过程简单,检测设备轻巧便携,可用于食品中己烯雌酚的现场大批量快速定量检测。
References
1 Veurink M, Koster M, de Jong.van den Berg L T W. Pharm World Sci., 2005, 27(23): 139-143
2 Lone K P. CRC Crit. Rev. Food Sci. Nutr., 1997, 37(2): 93-209
3 Becker J. Nature, 2009, 289: 215
4 GB/T22992.2008, Determination of Zearalanol, Zearalanone, Diethylstilbestrol, Hexestrol and Dienoestrol Multi.Residues in Milk and Milk Powder. National Standards of the People′s Republic of China
牛奶和奶粉中玉米赤霉醇、玉米赤霉酮、己烯雌酚、己烷雌酚、双烯雌酚残留量的测定. 中华人民共和国国家标准. GB/T 22992.2008
5 Wang W J, Ling Y, Xu T, Gao H B, Sheng W, Li J. Chin. J. Chem., 2007, 25(8): 1145-1150
6 Xu Y J, Geng J P, Zhang X Z, Zhang S J, Tian X H, Liu H H. Chin. J. Chem., 2010, 28(1): 86-90
7 YAN Xiao.Feng, SUN Zhi.Wen. Feed China, 2010, (11): 38-40
闫小峰, 孙志文. 饲料广角, 2010, (11): 38-40
8 HUANG Sheng.Quan, FU Meng, ZHANG Jie, LI Wen.Zhi, ZHANG Qin, SHAO Ke.Feng, ZHAO Bo. J. Food Sci. Technol., 2016, 34(1): 66-71
黄生权, 付 萌, 张 洁, 李文治, 张 芹, 邵科峰, 赵 波. 食品科学技术学报, 2016, 34(1): 66-71
9 Peteghem C H V, Haver G M V. Anal. Chim. Acta, 1986, 182(00): 293-298
10 Ren M L, Xu H Y, Huang X L, Kuang M, Xiong Y H, Xu H, Xu Y, Chen H Y, Wang A. ACS Appl. Mater. Interfaces, 2014, 6(16): 14215-14222
11 Beloglazova N V, Speranskaya E S, de Saeger S, Hens Z, Abé S, Goryacheva Yu I. Anal. Bioanal. Chem., 2012, 403: 3013-3024
12 DUAN Hong, CHEN Xue.Lan, JIANG Hu, SHEN Jun, DONG Sheng.Ming, XIONG Yong.Hua, Ardrew Wang. Chinese J. Anal. Chem., 2015, 43(3): 338-343
段 宏, 陈雪岚, 江 湖, 沈 骏, 董胜明, 熊勇华, Andrew Wang. 分析化学, 2015, 43(3): 338-343
13 Cheng L, Wang C, Liu Z. Nanoscale, 2013, 5(1): 23-37
14 Wang F, Banerjee D, Liu Y, Chen X, Liu X. Analyst, 2010, 135(8): 1839-1854
15 Wang F, Liu X. Chem. Soc. Rev., 2009, 38(4): 976-989
16 YU Ran, MA Xue.Mei, XIE Fei. J. B. Univ. Technol., 2015, 41(12): 1915-1920
於 然, 马雪梅, 谢 飞. 北京工业大学学报, 2015, 41(12): 1915-1920
17 Cen Y, Tang J, Kong X J, Wu S, Yuan J, Yu R Q, Chu X. Nanoscale, 2015, 7(33): 13951-13957
18 Wu S, Duan N, Ma X, Xia Y, Yu Y, Wang Z, Wang H. Chem. Commun., 2012, 48(40): 4866-4868
19 DENG Shen.Liang, LAI Wei.Hua, XU Yang. Food Science, 2007, 28(2): 232-236
邓省亮, 赖卫华, 许 杨. 食品科学, 2007, 28(2): 232-236
20 Song C M, Zhi A M, Liu Q T,Yang J F, Jia G C, Shervin J, Tang L, Hu X F, Deng R G, Xu C L, Zhang G P. Biosens. Bioelectron., 2013, 50: 62-65
21 ZHAO Jin.Lian, DU Lan.Xiang, LI Yue.Juan, XU Jing.Dong. J. G. Univ. Agric., 2009, 44(2): 153-156
赵金莲, 杜兰祥, 李月娟, 许敬东. 甘肃农业大学学报, 2009, 44(2): 153-156
Abstract The upconversion nanoparticles (UCNPs) NaYF4∶Yb,Er were synthesized by the solvent thermal method. Fluorescence probe was prepared by coupling the anti.diethylstilbestrol (DES) monoclonal antibody with UCNPs. The DES.labeled bovine serum albumin (BSA) conjugates and goat anti.mouse antibodies were sprayed onto the nitrocellulose membrane as the test line and the control line, respectively. The resultant fluorescence probes were introduced into the immunochromatographic strip for rapid determination of DES. The UCNPs.based immunochromatographic strips for determination of DES exhibited a good linear range from 25 ng/mL to 10000 ng/mL (y=0.43927x-0.57647, R2=0.996), with a limit of detection of 20.84 ng/mL. The detection time of the proposed UCNPs based immunochromatographic strips for each sample was only 15 min. The RSDs of the intra and inter assay were less than 10%. The strip showed excellent specificity to structural and functional analogues, and the average RSD of detection value after storage at 37℃ for 7 days was about 15%. The recovery experiment showed that the average recoveries of DES at 5 spiked concentration levels were 90.1%-115.2%, and the RSDs were below 5%. These results were consistent with that of HPLC.
Keywords Upconversion nanoparticles; Immunochromatographic strip; Diethylstilbestrol; Quantitative determination