基于铜纳米簇的聚集诱导发光检测铅离子
2017-02-06韩冰雁侯绪芬相荣超于明波李莹彭
韩冰雁+侯绪芬+相荣超+于明波+李莹+彭婷婷+贺高红
摘 要 基于谷胱甘肽保护的非贵金属铜纳米簇(Cu NCs@GSH)的聚集诱导发光现象, 建立了快速检测铅离子 (Pb2+)的“Turn on”型荧光分析方法。Cu NCs@GSH溶液荧光强度很弱, 当存在Pb2+时, 荧光强度可显著增强, 溶液显示明亮的橙黄色。基于此原理建立了检测Pb2+的荧光方法, 线性范围为200~700 μmol/L, 检出限为106 μmol/L, 常见金属离子不干扰Pb2+的测定。本方法简单快速、选择性高, 可实现对Pb2+的可视化定性检测。
关键词 聚集诱导发光; 铜纳米簇; 铅离子
1 引 言
荧光纳米簇(NCs)作为一种新型荧光探针, 广泛用于各种离子尤其是金属阳离子[1~5]、小分子[6~9]的检测以及细胞标记、细胞成像[10~12]、环境分析[13]等领域。Deng等[14]发现甲硫氨酸保护的金纳米簇可作为灵敏的荧光“Turn.off”传感器, 选择性检测Cu2+。Cao等[15]采用单宁酸制备了水溶性的CuNCs, 并利用电子转移机理引起的荧光淬灭, 实现了对Fe3+的高灵敏检测。Yang等[16]以半胱氨酸为保护剂合成CuNCs荧光探针, 利用Hg2+和半胱氨酸之间的相互作用, 通过荧光淬灭实现对Hg2+的检测。目前, 利用荧光纳米簇检测金属离子的工作大部分基于荧光淬灭机理。由于抑制荧光的物质比较多, 荧光淬灭是较为普遍的现象, 对选择性或灵敏度影响较大[17]。
2001年, Luo等[18]发现硅杂环戊二烯衍生物在溶液中几乎不发光, 而在形成固体后发光大大增强, 将此现象称为“聚集诱导发光”(Aggregation.induced emission, AIE)。此后, 基于AIE机理的检测方法被应用于多个发光体系。近年来, AIE不仅应用在设计合成强荧光的纳米簇, 而且在化学传感器、生物荧光探针等领域表现出广阔的应用前景[19, 20]。2014年, Dou等[21]将AIE机理引入到荧光纳米簇领域, 基于弱荧光的AuNCs, 通过聚集诱导发光合成了具有强荧光的Au@Ag NCs。Guo等[22]报道了基于Au(I).巯基复合物的聚集诱导免标记方法检测Ca2+的方法。Li等[23]探讨了Ag+增强AuNCs荧光的机理, 并利用聚集诱导现象检测Ag+。利用“Turn.on”型荧光探针对金属离子检测, 探针对特定的目标物有灵敏的响应信号, 且引起荧光信号增强, 因此, 该类探针具有更高的选择性或灵敏度。不过, 目前金属纳米簇AIE现象的研究主要集中在Au、Ag等贵金属上, 在非贵金属Cu纳米簇上的研究较少。Jia等[24,25]首先发现了CuNCs的溶剂AIE现象, 阳离子诱导CuNCs的AIE现象未见报道。
本研究合成了还原型谷胱甘肽(L.GSH)保护的铜纳米簇(CuNCs@GSH), 其荧光强度较弱; 基于AIE原理, Pb2+可使其荧光强度显著增强, 采用CuNCs@GSH为荧光探针, 建立了“Turn.on”型定量检测Pb2+的特异性检测方法, 在紫外光下可实现对Pb2+的可视化定性检测。
2 实验部分
2.1 仪器与试剂
F97Pro荧光分光光度计(上海棱光技术有限公司); Tecnai G2透射电子显微镜(FEI公司); PHS.3CpH计(上海仪电科学仪器股份有限公司)。
L.GSH, Cu(NO3)2·3H2O, ZnCl2, CrCl3, CoSO4·7H2O, MnCl2·4H2O, NiSO4·6H2O和Fe(NO3)3·9H2O(生工生物工程上海股份有限公司); Pb(NO3)2(西格玛奥德里奇上海贸易有限公司); CaCl2(天津市大茂化学试剂厂); MgCl2(西陇化工股份有限公司); Hg(NO3)2·H2O(百灵威科技有限公司)。所用试剂均为分析纯以上, 实验用水为超纯水。
2.2 Cu NCs@GSH合成
参照文献[11\]方法合成Cu NCs@GSH, 具体如下: 5.0 mL Cu(NO3)2(20 mmol/L)与5.0 mL L.GSH(80 mmol/L)溶液混合, 用1 mol/L NaOH调节至pH≈5.0, 在室温下搅拌反应1 h, 得到微黄色透明溶液。取500 μL反应液, 使用截留分子量3000的超滤离心管(美国Millipore)进行离心分离, 除去未反应的GSH和Cu2+, 得到CuNCs@GSH(460 μL)。
2.3 Pb2+的检测
将纯化后的CuNCs@GSH溶液稀释10倍, 取450 μL于0.5 mL离心管中, 分别加入50 μL不同浓度的Pb(NO3)2溶液, 测定荧光强度, 激发波长360 nm。
3 结果与讨论
3.1 Cu NCs@GSH的聚集诱导增强现象
以360 nm为激发波长, 合成的Cu NCs@GSH溶液在624 nm处出现最大发射峰, 如图1A所示, 与文献[11\]报道的结果基本一致。其透射电镜图(TEM)如图1B所示,图中没有观察到大的金属纳米粒子和团聚现象, 合成的纳米簇尺寸相对均匀, 平均粒径约2.6 nm, 证明成功合成了Cu NCs。
如图2a所示, 在365 nm的紫外光下, 制备的CuNCs@GSH溶液稀释10倍后几乎观察不到荧光现象。向此溶液中加入400 μmol/L Pb2+时, 溶液变为乳白色, 且发出强的橙黄色荧光, 如图2b所示, 荧光强度急剧增强约38倍。同时, 荧光发射峰位置由624 nm蓝移至607 nm。这可能是由于Pb2+可以与CuNCs@GSH表面残留的羧基之间存在强的静电吸附作用[26], 通过形成GSH.Pb2+.GSH使分散在水溶液中的GSH.Cu(I)复合物相互靠近[27,28], 电子从配体转向Cu2+和Pb2+(Ligand.to.metal.metal charge transfer), 使溶液荧光显著增强[29]。Luo等[30]在研究金纳米簇AIE现象时发现, 纳米簇表面Au+.Au+之间的作用在聚集状态时变得更紧密, 会造成发射峰的蓝移。在本研究中, 可能由于CuNCs@GSH表面Cu+.Cu+之间的作用变得更强, 造成了发射峰蓝移的现象。
3.2 基于AIE原理检测Pb2+
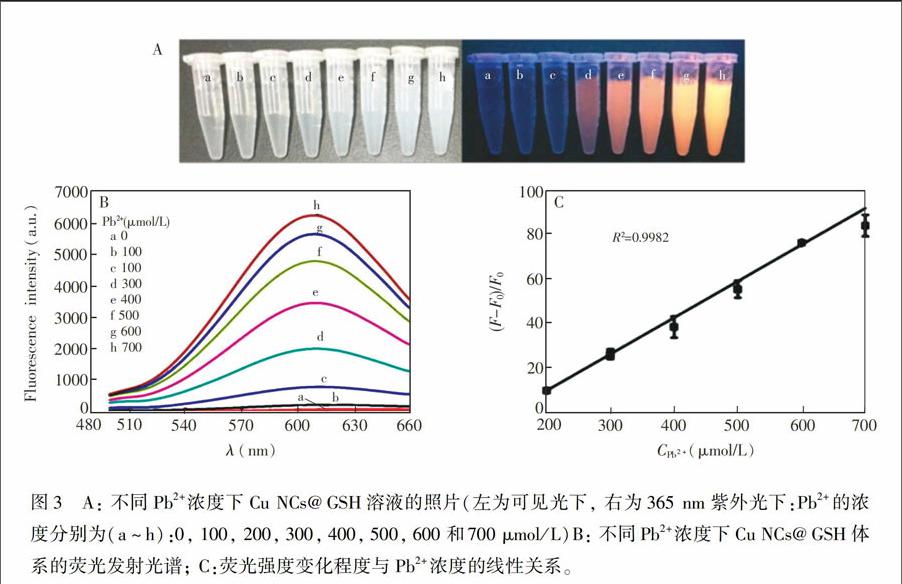
如图3A所示, 在反应体系中, 当Pb2+浓度由100 μmol/L增加到700 μmol/L时, CuNCs@GSH溶液由澄清逐渐变为乳白色溶液。在365 nm波长的紫外光下可观察到, 随着Pb2+浓度增加, 溶液发出明亮的橙黄色荧光。由图3B可见, 随着Pb2+浓度增加, 体系的荧光强度也随之不断升高。以Pb2+浓度(μmol/L)为横坐标, 荧光强度变化的程度(F-F0)/F0为纵坐标(F0、F分别为Cu NCs@GSH加入Pb2+前后的荧光强度)绘制标准曲线, 如图3C所示, 二者在Pb2+的浓度为200~700 μmol/L范围内, 呈现良好的线性关系, 线性方程为(F-F0)/F0=0.1635C-23.0369, 相关系数R2=0.9982, 检出限为106 μmol/L(S/N=3)
3.3 体系的选择性
考察了400 μmol/L Pb2+和4 mmol/L Hg2+, Ca2+, Na+, Co2+, K+, Fe3+, Zn2+, Cu2+, Cr3+, Mn2+, Mg2+, Ni2+的荧光响应。如图4A所示, 13种金属离子中, 400 μmol/L Pb2+使体系荧光变化最为明显, 荧光强度显著增强, 在紫外光下观察到溶液发出明亮的橙黄色荧光。如图4B所示, 400 μmol/L Pb2+使体系荧光强度增强约38倍, Hg2+和Cu2+使荧光完全淬灭, Ca2+, Na+, Co2+, K+, Fe3+, Cr3+, Mn2+, Mg2+和Ni2+对体系的荧光几乎没有影响。Zn2+对体系也有AIE现象, 但10倍于Pb2+浓度的Zn2+仅使体系荧光增强2.5倍左右, 其AIE效果远不如Pb2+。上述结果表明, 本方法具有良好的选择性。
3.4 实际水样中Pb2+的检测
河水样品取自大连理工大学盘锦校区中的凌水河, 用0.22 μm滤膜过滤, 除去水中的杂质和大的颗粒物。采用标准加入法向待测样品中加入Pb2+, 测定各个样品的荧光强度。河水中未检出Pb2+。加标回收实验结果如表1所示, Pb2+的回收率约为98.9%~101.1%, 表明本方法可以用于检测实际河水样品中的Pb2+。
本研究基于阳离子AIE的Cu NCs@GSH发光现象, 建立了检测Pb2+的分析方法。Pb2+使得Cu NCs@GSH的荧光显著增强, 显示明亮的橙黄色荧光。CuNCs探针廉价易得, 聚集诱导简单快速, 并具有很高的选择性, 有望在冶金等领域中实现对Pb2+的可视化定性检测。
References
1 Singh A, Kaur S, Kaur A, Aree T, Kaur N, Singh N, Bakshi M S. ACS Sustainable Chem. Eng., 2014, 2(4): 982-990
2 Zhong YG, Deng C, He Y, Ge Y, Song G W. Anal.Methods, 2015, 7(4): 1558-1562
3 Zhang J R, Zeng A L, Luo H Q, Li N B. J.Hazard.Mater., 2016, 304: 66-72
4 Zhou T Y, Rong M C, Cai Z M, Yang C Y J, Chen X. Nanoscale, 2012, 4(14): 4103-4106
5 Zhong Y P, Zhu J J, Wang Q P, He Y, Ge Y L, Song C W. Microchim. Acta, 2015, 182(5): 909-915
6 Wang P, Li B L, Li N B, Luo H Q. Spectrochim.Acta, 2015, 135(140): 198-202
7 Zhang J X, Tu L P, Zhao S, Liu G H, Wang Y Y, Wang Y, Yue Z. Biosens. Bioelectron., 2015, 67: 296-302
8 Zhang J, Lyu Y L, Zhang W, Ding H, Liu R J, Zhao Y S, Zhang G J, Tian Z Y. Talanta, 2016, 146: 41-48
9 LIAO Xiao.Qing, WANG Hui.Ying, LI Zai.Jun. Chinese J. Anal. Chem., 2015, 43(12): 1820-1828
廖小晴, 王会影, 李在均. 分析化学, 2015, 43(12):1820-1828
10 Wang C, Wang C X, Xu L, Cheng H, Lin Q, Zhang C. Nanoscale, 2014, 6(3): 1775-1781
11 Wang C, Ling L, Yao Y G, Song Q J. Nano Res., 2015, 8(6): 1975-1986
12 Zhang Y, Yan M F, Wang S B, Jiang J J, Gao P F, Zhang G M, Dong C, Shuang S M. RSC Adv., 2016, 6(11): 8612-8619
13 ZHANG Xia.Hong, ZHOU Ting.Yao, CHEN Xi. Chinese J. Anal. Chem., 2015, 43(9): 1296-1305
张夏红, 周廷尧, 陈 曦. 分析化学, 2015, 43(9): 1296-1305
14 Deng H H, Zhang L N, He S B, Liu A L, Li G W, Lin X H, Xia X H, Chen W. Biosens. Bioelectron., 2015, 65: 397-403
15 Cao H Y, Chen Z H, Zheng H Z, Huang Y M. Biosens. Bioelectron., 2014, 62: 189-195
16 Yang X M, Feng Y J, Zhu S S, Luo Y W, Zhuo Y, Dou Y. Anal. Chim. Acta, 2014, 847: 49-54
17 Chen D J, Li S X, Zheng F Y. Anal. Methods, 2016, 8: 632-636
18 Luo J D, Xie Z L, Lam J W Y, Cheng L, Chen H Y, Qiu C F, Kwok H S, Zhan X W, Liu Y Q, Zhuc D B, Tang B Z. Chem. Commun., 2001, (18): 1740-1741
19 Yuan M S, Du X, Xu F, Wang D E, Wang W J, Li TB, Tu Q, Rong Z Y, Ting D Z, Wang J. Dyes Pigm., 2015, 123: 355-362
20 Kumbhar H S, Deshpande S S, Shankarling G S. Dyes Pigm., 2016, 127: 161-169
21 Dou X Y, Yuan X, Yu Y, Luo Z T, Yao Q F, Leong D T, Xie J P. Nanoscale, 2014, 6: 157-161
22 Guo Y H, Tong X Y, Ji L, Wang Z L, Wang H Y, Hu J M, Pei R J. Chem. Commun., 2015, 51(3): 596-598
23 Li B Z, Wang X, Shen X, Zhu W Y, Xu L, Zhou X M. J. Colloid Interface Sci., 2016, 467: 90-96
24 Jia X F, Yang X, Li J, Li D Y, Wang E K. Chem. Commun., 2014, 50: 237-239
25 Jia X F, Li J, Wang E K. Small, 2013, 9(22): 3873-3879
26 Raize O, Argaman Y, Yannai S. Biotechnol. Bioeng., 2004, 87(4): 451-458
27 Ji L Y, Guo Y H, Hong S N, Wang Z L, Wang K W, Chen X, Zhang J Y, Hu J M, Pei R J. RSC Adv., 2015, 5(46): 36582-36586
28 Liu C J, Ling J, Zhang X Q, Peng J, Cao Q E, Ding Z T. Anal. Methods, 2013, 5(20): 5584-5588
29 Goswami N, Yao Q F, Luo Z T, Li J G, Chen T K, Xie J P. J. Phys. Chem. Lett., 2016, 7(6): 962-975
30 Luo Z T, Yuan X, Yu Y, Zhang Q B, Leong D T, Lee J Y, Xie J P. J. Am. Chem. Soc., 2012, 134(40): 16662-16670
Abstract A turn.on fluorescence analysis method was established for detection of Pb2+ based on aggregation.induced emission. Glutathione.protected non.noble metal copper nanoclusters (CuNCs@GSH) exhibited nearly no fluorescence. However, the fluorescence intensity of CuNCs@GSH was remarkably improved in the presence of Pb2+and showed bright orange fluorescence. A fluorescencent method for detection of Pb2+ was established based on this principle. The fluorescence change of the CuNCs@GSH solution showed a linear relationship with Pb2+ concentration within the range of 200-700 μmol/L. The limit of detection was 106 μmol/L (S/N=3). This method is simple, rapid and highly selective, and can be used for the visual qualitative detection of Pb2+ under ultraviolet (UV) lamp.
Keywords Aggregation.induced emission; Copper nanoclusters; Lead ion