去铁胺治疗重型β-地中海贫血患儿的疗效及不良反应分析
2017-01-20黄春生陈国华
黄春生,陈国华
(广东省惠州市第一人民医院,广东 惠州 516000)
去铁胺治疗重型β-地中海贫血患儿的疗效及不良反应分析
黄春生,陈国华
(广东省惠州市第一人民医院,广东 惠州 516000)
目的 研究去铁胺(DFO)治疗重型β-地中海贫血患儿持续每天使用的祛铁效果及不良反应。方法2014年1月至2015年1月于广东省惠州市第一人民医院住院治疗的70例重型β-地中海贫血患者,根据随机数表法分为试验组35例,对照组35例。当血清铁蛋白(SF)>1 000μg/L时开始祛铁,所有患儿均给予DFO治疗,实验组患儿每日持续使用去铁胺,对照组每隔1天使用1次去铁胺。对于患者可能出现的眼部不良反应进行评估及眼科专科检查。连续治疗12个月,每12周进行一次血清血蛋白检查、去铁胺剂量的调整及视力评估。比较给药前后的铁负荷变化及眼部不良反应情况。结果治疗前两组SF、尿铁排泄量(UIE)水平差异均无统计学意义(P>0.05);两组治疗3个月、6个月、9个月及12个月的SF相比,试验组明显低于对照组(t值分别为4.357、6.183、5.146、6.002,均P<0.05);UIE相比,试验组明显高于对照组,且差异均具有统计学意义(t值分别为3.713、4.262、6.113、4.002,均P<0.05)。不良反应情况:治疗组治疗6个月出现3例视力模糊,治疗后12个月其中1例颜色视力受损(色觉障碍),1例视野缺损伴有盲点,1例角膜浊斑,另有5例出现视力下降,无视力丧失情况;不良反应率达22.9%;对照组治疗12个月出现2例视力下降,不良反应率为8.6%,两组眼睛不良反应差异具有统计学意义(χ2=4.20,P<0.05)。结论去铁胺对重型β-地中海贫血患儿的持续治疗优于间歇治疗,并且有显著的祛铁效果,其眼部不良反应较高,需要得到临床医生的注意,适时适当服药或停药,改善患者的生存质量。
重型β-地中海贫血;去铁胺;疗效;不良反应
地中海贫血是人类常见的单基因遗传病,轻者与正常人无异,重者须依赖输血维持生命。长期输血会造成铁超负荷,铁超负荷是重型β-地中海贫血患者致残、致死的首要原因。去铁胺(DFO)自从20世纪60年代应用于地中海贫血的治疗,2007年国际地中海贫血协会祛铁指南将DFO用作祛铁的一线用药,DFO已经成为目前临床应用最为广泛并且最有效的药物[1]。国内外有研究对不同剂量DFO间歇治疗重型β-地中海贫血患者的疗效进行了分析[2-3],但并未对持续使用DFO的疗效进行相关研究,故本研究旨在对去铁胺(DFO)治疗重型β-地中海贫血患儿持续每天使用的祛铁效果及不良反应进行分析,指导患者更加及时祛铁及改善各种脏器的铁沉积,改善患者的生活质量。
1 资料与方法
1.1 一般资料
2014年1月至2015年1月于广东省惠州市第一人民医院住院治疗的重型β-地中海贫血患者作为研究对象。纳入标准:①根据临床特点、实验室检查,结合阳性家族史,确诊为重型β-地中海贫血患者,血清铁蛋白含量>1 000μg/L;②患者年龄3~14岁;③患者均建立完善的病历档案;④患者意识清楚,无任何精神性疾病及其他交流障碍;⑤患者法定监护人均知情同意并签署知情同意书。排除标准:①存在眼部异常症状的患者;②患有感染、肝炎或肝损害的患者;③缺乏维生素C的患者。共纳入符合标准的患者70例,男31例,女39例,平均年龄(10.1±3.6)岁。根据随机数字表法分为试验组35例,对照组35例,试验组患儿每日持续使用DFO,对照组间断使用DFO。该研究经过医院伦理委员会审批同意。
1.2 给药方法
由临床医生、眼科医生、护士等组成的专业小组负责70例重型β-地中海贫血患儿的检查分析。病人接受10~20次红细胞输注,当铁负荷过重,即血清铁蛋白(SF)>1 000ug/L时开始祛铁,所有患儿均给予DFO(瑞士Novartis公司生产)治疗,按DFO与SF浓度关系给药,SF<2 000μg/L时给药剂量为25mg·kg-1·d-1,当2 000ug/L≤SF<3 000μg/L时为35mg·kg-1·d-1,当SF>3 000μg/L时为55mg·kg-1·d-1。根据SF水平每12周调整DFO的用量。试验组患儿每日持续使用去铁胺;对照组每隔1天使用1次。均通过便携式输液泵皮下注射,晚间持续8~12小时,连续治疗12个月。
1.3 观察指标
两组于治疗前及治疗后3个月、6个月、9个月、12个月分别检测SF及尿铁排泄量(UIE)。对于患者可能出现的眼部不良反应症状如视力模糊、视力下降、视力丧失等情况,请患儿及其家属进行问卷评估。定期对患儿进行眼科专科检查,评估患儿是否患有颜色视力受损、夜盲、视野缺损、盲点、视网膜病、视神经炎、白内障、角膜混浊等,每12周进行1次评估及检查。连续观察12个月,比较给药前后的铁负荷变化及眼部不良反应情况。
1.4 样本采集
1.4.1 血液采集
采集患者早晨空腹血,离心取血清-20℃冰箱备检,集中一次采用Access化学发光仪(美国Beckman公司)测定分析患者治疗前后SF含量。
1.4.2 尿液采集
收集患儿24h尿液,标志尿量及体重,不使用防腐剂,用以分析UIE。
1.5 统计学方法
采用SPSS 19.0进行统计学分析,计量资料用均数±标准差表示,组间比较采用t检验,计数资料用率表示,组间比较采用χ2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 患儿的一般资料
两组患儿在年龄、性别等一般资料方面差异无统计学意义(P>0.05),见表1。
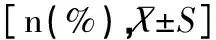
表1 患儿的一般资料
2.2 患儿治疗前、治疗后3、6、9、12个月血清铁蛋白水平的比较
治疗前SF水平差异均无统计学意义(P>0.05);治疗3个月、6个月、9个月及12个月的SF相比,试验组明显低于对照组(t值分别为4.357、6.183、5.146、6.002,均P<0.05)。见表2。
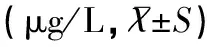
表2 两组患儿治疗前、治疗后3、6、9、12个月SF水平的比较
2.3 两组患儿治疗前、治疗后3、6、9、12个月尿铁排泄量水平的比较
治疗前UIE水平差异均无统计学意义(P>0.05),治疗3个月、6个月、9个月及12个月试验组UIE明显高于对照组,且差异均具有统计学意义(t值分别为3.713、4.262、6.113、4.002,均P<0.05),见表3。
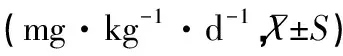
表3 患儿治疗前、治疗后3、6、9、12个月尿铁排泄量水平的比较
2.4 治疗后眼部不良反应发生情况
试验组治疗6个月出现3例视力模糊;治疗后12个月1例颜色视力受损(色觉障碍),1例视野缺损伴有盲点,1例角膜浊斑,另有5例出现视力下降的现象,无视力丧失情况,不良反应率达22.9%;对照组治疗12个月出现2例视力下降,不良反应率为8.6%。两组眼睛不良反应差异具有统计学意义(χ2=4.20,P<0.05)。
3 讨论
3.1 重型β-地中海贫血患的铁负荷情况
重型β-地中海贫血患者骨髓红系造血活跃,肠道受刺激后会加大铁的吸收,再加上患者需要长期进行输血治疗,所以会出现体内铁负荷过多[4]。人体内多余的铁会以含铁血黄素的形式在心脏、肝脏以及内分泌器官中沉积,出现器官的损害[5]。机体铁负荷状况最简单的反应方法就是在排除感染、肝炎或肝损害及维生素C缺乏等因素后,检测人体内的血清铁蛋白含量。SF水平能客观的反应人体内铁负荷的情况,肝脏铁是反映人体Fe的直接指标,但是由于技术问题不适宜应用。本研究采用尿铁含量,DFO化学成分为甲磺酸去铁胺,有研究显示其可与铁离子特异性结合,形成大分子铁胺复合物,从尿及粪便中排出。
3.2 持续使用去铁胺治疗重型β-地中海贫血患儿的疗效
规范性长期输血和去铁治疗是重型β-地中海贫血最主要的治疗方法,目前临床上应用的铁螯合剂主要包括去DFO、去铁酮(DFP,L1)和地拉罗司(DFX,ICL670)。去铁酮是一种口服去铁剂,由于其在临床的使用时间短,长期疗效及安全性尚有争议,有待进一步观察研究[6]。在本研究中采用的是去铁胺治疗重型β-地中海贫血患儿持续每天使用祛铁的疗效。本文研究结果显示,治疗3个月、6个月、9个月及12个月的SF相比,试验组明显低于对照组(均P<0.05),治疗3个月、6个月、9个月及12个月试验组UIE明显高于对照组(均P<0.05),与李惠丽等[7]研究结果基本一致,由此可见,DFO对重型β-地中海贫血患儿的持续治疗优于间歇治疗,并且有显著的祛铁效果。
3.3 不良反应情况
DFO短期使用偶见过敏反应,长期使用可致眼部的不良反应,视力模糊,视力下降,视力丧失,视觉敏感度降低、颜色视力受损(色觉障碍),夜盲(夜盲症),视野缺损,盲点,视网膜病(视网膜色素退化),视神经炎,白内障(晶状体浑浊),角膜浊斑等都是去铁胺的眼部不良反应,重型β-地中海贫血患儿持续每天使用DFO祛铁需对视力进行评估,本研究显示,眼部不良反应率达22.9%,这些眼部不良反应需要得到患儿及临床医生的注意。除了注意患者眼部的不良反应,也需注意患者听力、骨等方面的生长情况[8],定期进行专科检查。之前,由于本实验人员的问题未进行相关检查,会在今后进一步做相关研究。
综上所述,去铁胺对重型β-地中海贫血患儿的持续治疗优于间歇治疗,并且有显著的祛铁效果,但其眼部不良反应相对较高,需要适时适当的时机停药或再服药,改善患者的生存质量。
[1]于春蓝,刘容容,赖永榕,等.广西重型 β-地中海贫血HBS1L-MYB基因多态性与胎儿血红蛋白的相关性研究[J].广西医药,2015,37(5):364-3665.
[2]Rashid M, Karimi M. Compliance of deferoxamine injection in beta-thalassaemia major patients in Iran[J]. Transfusion Medicine,2012,22(22):104-107.
[3]陆倩倩,杨高晖,赖永榕,等.304例重型β-地中海贫血铁过载状况临床分析[J].广西医科大学,2015,32(3):1003-1005.
[4]Ibrahim Aslan, Duran canatan, Nihal Balta,etal. Bone-Mineral Density in Thalassemia Major Patients from Antalya, Turkey[J].International Journal of Endocrinology,2012,2012(4):271-272.
[5]Olivieri N F, Saunthararajah Y, Thayalasuthan V, et a1.A pilot study of subcutaneous decitabine in beta-thalassemia intermedia[J].Blood,2011,118(10):2708.
[6]叶龙英,胡彩汀.不同的红细胞制品输注治疗儿童重型地中海贫血的不良反应[J].实用临床医学,2015,16(7):698-700.
[7]李惠丽,刘日阳.去铁胺对重型β-地中海贫血患儿个体化祛铁治疗的研究[J].吉林医学,2014, 35(20):237-247.
[8]Viola F,Barteselli G,Dell’arti L,etal.Abnormal fundus autofluorescence results of patients in long-term treatment with deferoxamine[J].Ophthalmology, 2012,119(8):1693-1700
[专业责任编辑:潘凯丽]
Effect and adverse reactions of Deferoxamine for treatment of severe beta-thalassemia major in children
HUANG Chun-sheng, CHEN Guo-hua
(TheFirstPeople’sHospitalofHuizhou,GuangdongHuizhou516001,China)
Objective To study the effect of removing iron and adverse reactions of Deferoxamine (DFO) in the treatment of severe beta-thalassemia major (β-TM) in children. Methods Seventy cases of severeβ-TM treated in the First People’s Hospital of Huizhou during the period of January 2014 to January 2015 were randomly divided into experimental group (35 cases) and control group (35 cases). When SF>1 000ug/L removing iron was performed, and all the children were given DFO. In the experimental group continuous use of DFO was provided daily, while the control group used DFO every other day. Adverse reactions possibly occurring in eyes were assessed and specialist examinations were performed in department of ophthalmology. Treatment lasted 12 months. Serum protein levels were examined, dosage of DFO was adjusted and visual acuity was assessed every 12 weeks. Iron load and adverse reactions in eyes were compared before and after administration. Results There were no significant differences in levels of UIE and SE before treatment between two groups (P>0.05). After treatment for 3 months, 6 months, 9 months and 12 months, SF was significantly lower in the experimental group (tvalue was 4.357, 6.183, 5.146 and 6.002, respectively, allP<0.05), while UIE level was significantly higher in the group with significant difference (tvalue was 3.713, 4.262, 6.113 and 4.002, respectively, allP<0.05). In the experimental group there were 3 cases of blurred vision after 6 months of treatment. After 12 months of treatment there was 1 case of color vision defect (color deficiency), 1 case of visual field defect associated with blind spots, 1 case of corneal opacities, 5 cases of poor vision, but no case with loss of vision. Adverse reaction rate was 22.9% in the experimental group. In the control group 12 months after treatment there were 2 cases of poor vision loss, and the adverse reaction rate was 8.6%. The difference in adverse reactions in eyes was statistically significant between two groups (χ2=4.20,P<0.05). Conclusion The continuous treatment of severe β-TM in children is better than the intermittent treatment, and it has significant effect of removing iron. The incidence of adverse reaction in eyes is relatively high, which needs to attract attention of clinicians, timely appropriate medication or stop drug so as to improve the quality of life of patients.
severe beta-thalassemai major (β-TM); Deferoxamine (DFO); effect; adverse reaction
2016-02-20
黄春生(1983-),女,主治医师,主要从事小儿内科疾病的诊疗工作。
陈国华,副主任医师。
10.3969/j.issn.1673-5293.2016.06.018
R556
A
1673-5293(2016)06-0726-03
