GM1联合抚触治疗HIE患儿的效果及对神经元相关蛋白的影响
2017-01-20冯冉冉崔文文
冯冉冉,崔文文,刘 勇
(1.济宁市第一人民医院儿科,山东 济宁 272011;2.新疆喀什地区英吉沙县第一人民医院儿科,新疆 英吉沙 844500)
【临床研究】
GM1联合抚触治疗HIE患儿的效果及对神经元相关蛋白的影响
冯冉冉1,崔文文1,刘 勇2
(1.济宁市第一人民医院儿科,山东 济宁 272011;2.新疆喀什地区英吉沙县第一人民医院儿科,新疆 英吉沙 844500)
目的 探讨单唾液酸四己糖神经节苷脂钠(GM1)联合抚触治疗新生儿缺血缺氧性脑病(HIE)患儿的临床效果及对患儿血清白细胞介素-18(IL-18)、半胱氨酸天冬氨酸蛋白酶3(Caspase3)、S-100蛋白B(S-100B)的影响。方法选取济宁市第一人民医院儿科2013至2015年收治的100例HIE患儿,采用随机数字表法分为治疗组和对照组各50例,两组均予以基础治疗+GM1,治疗组同时给予抚触治疗,两组患儿均治疗3~5个疗程,对比分析两组治疗效果。结果①治疗前,治疗组和对照组的血清IL-8、Caspase3和S-100B水平及NBNA评分差异均无统计学意义(均P>0.05),治疗7天后,治疗组的血清IL-8、Caspase3和S-100B水平显著低于对照组(t值分别为3.444、2.968、2.795,均P<0.05)、NBNA评分显著的高于对照组(t=4.580,P<0.05);②治疗组的意识障碍、原始反射、肌张力、惊厥的改善时间显著的短于对照组(t值分别为6.283、3.414、5.231、3.829,均P<0.05);③治疗1个疗程后,治疗组的有效率92.00%,显著的高于对照组的76.00%(χ2=4.762,P<0.05)。结论GM1联合抚触治疗HIE患儿的效果优于单用GM1,具有一定的临床推广价值。
单唾液酸四己糖神经节苷脂钠;抚触;新生儿缺血缺氧性脑病;白细胞介素-18;半胱氨酸天冬氨酸蛋白酶3;S-100蛋白B
新生儿缺氧缺血性脑病(hypoxie-ischemic encephalopathy,HIE)是指在围产期窒息而导致脑的缺氧缺血性损害,围产期窒息是本症的主要病因,其中由宫内窒息引起者占50%,娩出过程中窒息占25%~30%[1]。本症不仅严重威胁着新生儿的生命,并且是新生儿期后病残儿中最常见的病因之一。在一般性治疗的基础上,如纠正低氧血症和高碳酸血、纠正代谢性酸中毒、持续性低流量给氧等,同时采用苯巴比妥钠以及甘露醇积极控制惊厥、降低颅内压,可以改善HIE患者意识昏迷、肌张力障碍等。单唾液酸四己糖神经节苷脂钠(monosialotetrahexosylganglioside,GM1)主要分布于神经节细胞膜上,GM1可以促进轴突、神经元胶质细胞以及突触的生长,GM1的补充在HIE的临床治疗中已被证实具有一定的效果,但疾病的总体缓解率仍然不足35%[2-3],同时原始反射、肌张力、惊厥的改善时间仍然较长。本次研究重在探讨GM1联合抚触治疗新生儿HIE的临床效果,并初步探讨白细胞介素-18(IL-18)、半胱氨酸天冬氨酸蛋白酶3(Caspase3)、S-100蛋白B(S-100B)在这一过程中的改变和临床意义。
1 研究对象及方法
1.1 纳入排除标准
纳入标准:①对HIE患儿的诊断主要依据《实用儿科学》中的诊断标准[4];②新生儿Apgar评分<7分,均为足月新生儿;③行头颅部位CT检查可发现高密度改变;④患儿HIE分度依据《实用儿科学》标准均为重度、中度;⑤治疗方案获得医学伦理委员会批准,并获得患儿家长的知情同意。排除标准:①合并先天性疾病、代谢性疾病的患儿;②对智能发育可能造成不良影响的自然或生物因素患儿。
1.2 研究对象
选取济宁市第一人民医院儿科2013至2015年收治的100例HIE患儿,采用随机数字表法分为治疗组和对照组各50例。治疗组,男27例、女23例;胎龄37~42周,平均(39.4±1.6)周;出生体重2 948~3 617g,平均(3 194.0±181.7)g;HIE病情:中度39例、重度11例。对照组,男31例、女19例;胎龄37~42周,平均(39.6±1.3)周;出生体重3 018~3 726g,平均(3 105.0±201.4)g;HIE病情:中度40例、重度10例。两组患儿的上述基线资料比较差异均无统计学意义(均P>0.05)。
1.3 治疗方法
治疗组:给予抚触治疗,按照头部、四肢、背部、胸部、腹部的顺序进行抚触,按照国际标准进行抚触,在患儿吃奶后1小时、清醒安静时抚触20~30分钟,每日2次,连续7~20天。同时,给予GM1注射液(国药准字H19980008)治疗,每次20mg,加入0.9%的生理盐水500mL中静脉滴注,每日1次,连续治疗1周。对照组:仅给予GM1注射液治疗。同时两组均常规给予吸氧、镇静、利尿、降低颅内压、控制惊厥支持治疗。
1.4 疗效指标及监测方法
1.4.1 疗效指标
检测并比较两组患儿治疗第1天、第7天的外周血IL-18、Caspase3、S-100B水平;对比两组患儿治疗第1天、21天后的新生儿神经行为测定(NBNA)评分;对比两组患儿的临床症状:意识障碍、原始反射、肌张力、惊厥的改善时间。
临床疗效:参考中华医学会儿科学分会制定的HIE患儿疗效标准[5],显效:治疗1个疗程后患儿的精神恢复、哭声响亮、面色红润、心率100~120次/分钟,肌张力恢复正常、原始反射恢复;有效:治疗1个疗程后患儿的各项临床症状有所缓解、心率100~120次/分钟,肌张力部分恢复、原始反射恢复;无效:患儿的各项临床症状无改善或者加重。
1.4.2 检测方法
血清IL-18的检测:一次性真空采血管(血液凝固实验专用)内有3.1%柠檬酸钠,日本株氏会社生产,严格按标准采集标本,IL-18的检测采用Sysmex系列CA-1500全自动生化分析检测仪器检测,试剂由DadeBehring公司配套生产。
Caspase3、S-100B的检测:患者于入院当时采肘静脉血,2mL血样在室温下静置30分钟后,4 000rpm离心10分钟分离血清,-80℃超低温冰箱保存,避免反复冻融。放射免疫试剂盒(南京碧云天科技有限公司)检测血清Caspase3浓度,免疫放射试剂盒(南京凯基生物科技有限公司)检测血清S-100B浓度。
1.5 统计学方法

2 结果
2.1 两组患儿治疗前后的血清白细胞介素-18、半胱氨酸天冬氨酸蛋白酶3和S-100蛋白B水平情况
治疗前,治疗组和对照组的血清IL-8、Caspase3和S-100B水平比较差异均无统计学意义(均P>0.05),治疗后7天,治疗组的血清IL-8、Caspase3、S-100B水平均显著低于对照组(均P<0.05),见表1。

表1 两组患儿治疗前后的血清IL-8、Caspase3、S-100B水平比较
2.2 两组患儿治疗前后的新生儿神经行为测定评分情况
治疗第1天,治疗组和对照组的NBNA评分比较差异无统计学意义(P>0.05);治疗后第21天,治疗组的NBNA评分显著高于对照组(P<0.05),见表2。
2.3 两组患儿临床症状缓解时间情况
治疗组的意识障碍、原始反射、肌张力、惊厥症状的改善时间显著短于对照组(均P<0.05),见表3。
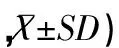
表2 两组患儿治疗前后的NBNA评分比较(分
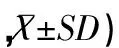
表3 两组患儿临床症状缓解时间比较(天
2.4 两组患儿的临床效果情况
治疗1个疗程后,治疗组的有效率为92.00%,显著的高于对照组的76.00%,两组比较差异有统计学意义(P<0.05),见表4。

表4 两组患儿临床效果比较(n)
3 讨论
3.1 新生儿新生儿缺氧缺血性脑病发展机理和诊疗现状探讨
新生儿HIE是较常见的危重症之一,也是当前新生儿神经系统致残的重要病因,于生后12小时或24小时内出现异常神经症状,如意识障碍、肌张力改变及原始反射异常,其中重度HIE患儿可出现昏迷状态、反射消失、肌张力减弱或消失,生后数小时至12小时出现惊厥且呈持续状态,临床预后不佳,神经系统发育迟缓或者存在认知、运动以及言语等中枢神经系统不同程度的后遗症。从病理机制的研究可以发现,腺嘌呤核苷三磷酸(ATP)减少所引起的细胞内水肿及血管通透性增加的细胞外水肿,以及神经元细胞的坏死等是HIE的主要病理改变[6]。GM1作为神经元鞘膜的营养因子,对于脑水肿以及缺血性脑损伤恢复期的神经元细胞的持续性坏死等具有显著的保护作用[7]。GM1具有可以清除自由基的作用,从而减轻其对神经细胞膜的损害,而新生儿抚触对皮肤黏膜的机械性刺激,可通过皮肤触觉感受器传至中枢神经系统,兴奋迷走神经以及内脏自主神经丛,通过神经-内分泌系统促进垂体性激素如生长激素、促肾上腺皮质激素以及甲状腺激素等的释放,促进新生儿各个系统的发育,同新生儿抚触可以改善脑部血流、增加5-羟色胺的分泌,进而有利于神经系统的发育和智能的成熟[8-9]。在通过新生儿神经行为NBNA评分评估治疗有效性的基础上,本次研究的创新性在于探讨了GM1联合抚触治疗HIE患儿后血清炎症以及神经细胞凋亡因子的改变。
3.2 白细胞介素-18、半胱氨酸天冬氨酸蛋白酶3和S-100蛋白B等神经元相关蛋白在新生儿缺氧缺血性脑病发生发展中的作用
在HIE发生发展的过程中,神经元胶质细胞分泌的IL-8通过血脑屏障大量进入血液循环,导致血清IL-8明显升高,IL-8作为炎症因子参与脑组织的损伤;Caspase3是神经元细胞凋亡过程中显著表达的凋亡蛋白,在缺氧、缺血后再灌注细胞凋亡信号传导的许多途径中发挥作用;S-100B蛋白在HIE动物模型中显著表达,血清IL-8、Caspase3和S-100B的上升往往提示HIE预后不佳,IL-8、Caspase3和S-100B每升高20%,神经系统的后遗症发生率可增加5%[10-11]。治疗组联合GM1以及新生儿抚触治疗后IL-8、Caspase3和S-100B明显下降,表明治疗组的治疗效果更为明显,IL-8、Caspase3和S-100B的下降抑制了脑组织缺血性因子对于局部神经元的轴突破坏和神经元鞘膜的分解。
3.3 抚触对新生儿神经行为测定评分的影响
NBNA评分对于中枢神经系统功能异常的早期发现以及预后评估都具有积极意义。本研究显示,治疗后第21天,治疗组的NBNA评分显著高于对照组。新生儿抚触可促进神经系统发育和智能成熟,对于脑部前庭以及颞叶部位的抚触,可以促进抬头、翻身等动作的成熟,另外,新生儿抚触可以增强GM1对于神经元细胞膜的缺血性修复,增加局部损伤脑组织中的GM1浓度,增强GM1的治疗效果。
3.4 新生儿抚触的整体性临床效果探讨
Hattori等[12]采用神经营养因子联合新生儿抚触治疗HIE后发现,在治疗后的3天内,患儿的肌张力障碍明显改善,惊厥发生次数下降至0.6次/日。本研究的结论与之较为相似,意识障碍、原始反射、肌张力、惊厥改善时间明显缩短,多数HIE症状在1周内均基本恢复,虽然肌张力在治疗8天后才基本逐渐改善,但相比于对照组也缩短了3天左右,统计学差异较为明显,表明GM1联合新生儿抚触对HIE的发病具有良好的阻断作用,可以促进神经功能和生长发育功能的恢复。新生儿抚触增强了脑神经细胞发育速度,同时可能减少或避免部分迟发性神经细胞的凋亡,进而提高HIE治疗的有效率,治疗组的有效率达92.00%,表明新生儿抚触在HIE的临床治疗中具有重要的应用前景。然而本次研究并未探讨新生儿抚触的时机,部分研究表明HIE患儿出生48小时后的抚触效果不佳,疾病缓解率不足20%[12],提示新生儿抚触的时机问题仍然需要进一步探讨。
新生儿抚触联合GM1治疗HIE可以促进脑组织损伤因子血清IL-8、Caspase3和S-100B的下降,缩短意识障碍、原始反射、肌张力等症状的改善时间,疗效确切,能明显改善HIE患儿的预后,值得临床上广泛推广。
[1]郭映辉,冯志山,邵智利,等.新生儿缺氧缺血性脑病血清IL-18和Caspase-3及S-100B蛋白水平检测及临床意义[J].中华检验医学杂志,2014,37(4):276-280.
[2]Koyuncuoglu T, Turkyilmaz M, Goren B,etal.Uridine protects against hypoxic-ischemic brain injury by reducing histone deacetylase activity in neonatal rats[J].Restor Neurol Neurosci,2015,33(5):777-784.
[3]张雪雁,李军.新生儿缺氧缺血性脑病分度与磁敏感加权成像出血检出率的相关性研究[J].磁共振成像,2014,5(3):166-169.
[4]杜奕,李艳,陈志强,等.足月缺氧缺血性脑病患儿1H-MRS与新生儿神经行为测定评分的相关性[J].中国医学影像技术,2014,30(6):822-826.
[5]黄群,谭丹凤,马敏,等.缺氧缺血性脑病新生儿血浆高迁移率族蛋白1和细胞间黏附分子-1表达水平及其与新生儿神经行为评分的相关性[J].中国神经免疫学和神经病学杂志,2014,21(5):368-371.
[6]Teo J D, Morris M J, Jones N M.Hypoxic postconditioning reduces microglial activation, astrocyte and caspase activity, and inflammatory markers after hypoxia-ischemia in the neonatal rat brain[J].Pediatr Res,2015,77(6):757-764.
[7]Zhang Y,Lan R,Wang J,etal.Acupuncture reduced apoptosis and up-regulated BDNF and GDNF expression in hippocampus following hypoxia-ischemia in neonatal rats[J].J Ethnopharmacol,2015,172:124-132.
[8]朱道湘.缺血性脑血管病患者颈部血管超声特点分析[J].现代仪器与医疗,2014,20(3):39-41.
[9]Sun M Y, Cui K J, Yu M M,etal.Bax inhibiting peptide reduces apoptosis in neonatal rat hypoxic-ischemic brain damage[J].Int J Clin Exp Pathol,2015,8(11):14701-14708.
[10]钱小霞.脑脊液和血清TNF-α、IL-6及IL-2检测对HIE的临床价值[J].免疫学杂志,2014,30(1):57-60.
[11]Askalan R, Gabarin N, Armstrong E A,etal.Mechanisms of neurodegeneration after severe hypoxic-ischemic injury in the neonatal rat brain[J].Brain Res,2015, 1629:94-103.
[12]Hattori T, Sato Y, Kondo T,etal.Administration of umbilical cord blood cells transiently decreased hypoxic-ischemic brain injury in neonatal rats[J].Dev Neurosci,2015,37(2):95-104.
[专业责任编辑:帖利军]
Effect of GM1 combined with touching in treating children with hypoxic-ischemic encephalopathy and their influence on neuron related protein
FENG Ran-ran1, CUI Wen-wen1, LIU Yong2
(1.DepartmentofPediatrics,FirstPeople’sHospitalofJining,ShandongJining272011,China; 2.DepartmentofPediatrics,FirstPeople’sHospitalofYengisarCountyinKashiDistrictofXinjiang,XinjiangYengisar844500,China)
Objective To explore the clinical effects of monosialotetrahexosylganglioside (GM1) combined with touching in treating neonates with hypoxic-ischemic encephalopathy (HIE) and their influence on neonatal serum interleukin 18 (IL-18), cysteine aspartic proteinase 3 (caspase-3) and S-100 protein B (S-100B). Methods A total of 100 cases of neonates diagnosed with HIE were chosen as research objects. They were hospitalized at the department of pediatrics in the First People’s Hospital of Jining from 2013 to 2015. According to random number table, they were divided into treatment group (n=50) and control group (n=50). Children from both groups received basic treatment plus GM1 therapy. As for neonates in the treatment group, they were also treated with touching therapy. After 3 to 5 courses of treatment, therapeutic effects of the treatments of both groups were compared. Results Before treatment, no statistically significant difference was identified between two groups in serum levels of interleukin-18 (IL-18), Caspase3, and S-100B as well as NBNA score (allP>0.05). Seven days after treatment, the serum levels of IL-8, Caspase3 and S-100B in the treatment group were significantly lower than these of the control group (tvalue was 3.444, 2.968 and 2.795, respectively, allP<0.05). NBNA score was significantly higher in the treatment group than in the control group (t=4.580,P<0.05). The time needed for improvement of clinical symptoms like disturbance of consciousness, primitive reflex and convulsions in the treatment group was significantly shorter than that of the control group (tvalue was 6.283, 3.414, 5.231 and 3.829, respectively, allP<0.05). After a course of treatment, the effective rate in the treatment group was 92.00%, which was remarkably higher than that of the control group (76.00%) (χ2=4.762,P<0.05).Conclusion The clinical effects of GM1 combined with touching therapy are superior to those of using GMI alone. Therefore, it is worth clinical promoting.
monosialotetrahexosylganglioside sodium; touching; hypoxic-ischemic encephalopathy (HIE); interleukin-18 (IL-18); Caspase3; S-100B
2016-02-02
冯冉冉(1989-),女,主治医师,硕士,主要从事新生儿相关疾病的临床诊疗工作。
刘 勇,副主任医师。
10.3969/j.issn.1673-5293.2016.06.015
R722
A
1673-5293(2016)06-0718-04
