抗衰老Klotho蛋白对高糖作用下血管内皮细胞的保护作用*
2017-01-19代文静周敬群张家俊曹志刚
张 军, 代文静, 周敬群, 张家俊, 曹志刚
(三峡大学仁和医院 1ICU科, 2心血管内科,湖北 宜昌 443000)
抗衰老Klotho蛋白对高糖作用下血管内皮细胞的保护作用*
张 军1△, 代文静2, 周敬群2, 张家俊1, 曹志刚1
(三峡大学仁和医院1ICU科,2心血管内科,湖北 宜昌 443000)
目的: 研究抗衰老Klotho蛋白对高糖作用下血管内皮细胞的保护作用及其作用机制。方法: 体外培养人脐静脉血管内皮细胞(HUVECs),设置PBS对照组、5.5 mmol/L葡萄糖组、33.3 mmol/L葡萄糖组、0.1 μmol/L Klotho+33.3 mmol/L葡萄糖组、1 μmol/L Klotho+33.3 mmol/L葡萄糖组和10 μmol/L Klotho+33.3 mmol/L葡萄糖组。使用MTT法检测各组细胞活力;同时检测各组细胞培养上清中丙二醛(MDA)的含量以及乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)的活性;流式细胞术检测各组细胞中活性氧(ROS)含量变化;ELISA检测各组细胞培养液中一氧化氮(NO)、内皮素1(ET-1)和细胞间黏附分子1(ICAM-1)的浓度变化;Western blot法检测各组细胞中核因子κB(NF-κB)蛋白的表达。结果: 与PBS对照组相比,33.3 mmol/L葡萄糖能够显著降低HUVECs的细胞活力,增加细胞中ROS的含量,增加细胞培养上清中LDH活性和MDA含量,降低SOD和GSH的活性,同时降低NO分泌,诱导ET-1、ICAM-1分泌及细胞中NF-κB蛋白的表达(P<0.05)。不同浓度Klotho蛋白和33.3 mmol/L高糖同时作用HUVECs时,细胞活力逐渐上升,ROS和MDA含量以及LDH活性逐渐下降, SOD和GSH活性则逐渐上升,同时NO分泌增加,ET-1、ICAM-1分泌及NF-κB蛋白表达显著下降(P<0.05)。结论: 抗衰老Klotho蛋白能够提升高糖作用下HUVECs的细胞活力,减少高糖诱导的ROS生成及氧化损伤,恢复HUVECs的正常分泌功能,并通过减少NF-κB蛋白表达发挥抗损伤作用。
高糖; Klotho蛋白; 人脐静脉血管内皮细胞; 氧化应激; 动脉粥样硬化
糖尿病患者由于血糖浓度较高,极易导致血管并发症,其较非糖尿病患者心血管病发病率及病死率高2到3倍。长期高血糖导致的血管动脉粥样硬化是糖尿病患者死亡率上升的主要原因之一[1]。糖尿病性并发心血管疾病由于发病病因、机制、病理表现复杂尚无有效的防治方法,多发于中老年人群,提示机体衰老因素可能参与到糖尿病并发心血管疾病病因中。Klotho蛋白是一种新型与抗衰老相关的蛋白,对于抵抗机体衰老发挥重要作用[2]。已有研究表明分泌型Klotho蛋白能够抑制机体衰老、发挥抗氧化、抗凋亡作用并保护心血管、肾脏等系统,从而对多种衰老相关疾病进行调节[3]。目前,由高血糖引起血管内皮细胞功能失调导致的动脉粥样硬化等心血管并发症的明确机制及有效防治方法尚不明确。因此,本研究以高浓度葡糖糖作用于人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)模拟糖尿病患者血管内皮细胞受损状态,研究人抗衰老Klotho蛋白对高糖作用下HUVECs损伤的影响,为验证抗衰老因素在糖尿病并发血管内皮损伤疾病防治中发挥作用提供新依据。
材 料 和 方 法
1 材料
HUVECs购自中科院细胞资源中心(细胞培养级,CD31/vWF阳性率≥95%);RMPI-1640细胞培养基、胎牛血清和EDTA胰酶购自HyClone;人Klotho蛋白购自R&D;MTT、二甲基亚砜(DMSO)和双氢罗丹明123购自Sigma;乳酸脱氢酶(lactate dehydroge-nase,LDH)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和还原型谷胱甘肽(glutathione,GSH)检测试剂盒购自南京建成生物工程研究所;一氧化氮(nitric oxide,NO)ELISA试剂盒购自上海凯博生化试剂公司;内皮素1(endothelin-1,ET-1)和细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)检测ELISA试剂盒购自武汉华美生物公司;兔抗人核因子κB(nuclear factor-κB,NF-κB)和β-actin多克隆抗体购自Abcam;HRP标记II抗和ECL化学发光试剂购自北京中杉金桥公司;其他试剂均为国产分析纯。
2 方法
2.1 MTT法检测细胞活力 复苏活化冻存的HUVECs,用含10%胎牛血清的RPMI-1640完全培养基培养。选取增殖期状态良好的HUVECs,胰酶消化后用培养基稀释浓度至107/L种于96孔板中。细胞分组为PBS对照组、5.5 mmol/L葡萄糖组、33.3 mmol/L葡萄糖组、0.1 μmol/L Klotho+33.3 mmol/L葡萄糖组、1 μmol/L Klotho+33.3 mmol/L葡萄糖组和10 μmol/L Klotho+33.3 mmol/L葡萄糖组。每组设置6个平行孔,分别加药处理24 h和48 h。每孔加入20 μL的MTT溶液继续温育4 h后,去除培养基加入DMSO,振荡5 min后在酶标仪检测各组细胞在波长492 nm处的吸光度(A)。
2.2 LDH、MDA、SOD和GSH的检测 按照相同的分组方法将增殖期的HUVECs以1×108/L分组处理培养48 h后,收集各组细胞培养液上清,利用比色法检测试剂盒检测HUVECs细胞分别经5.5、33.3 mmol/L葡萄糖及33.3 mmol/L葡萄糖与0.1、1、10 μmol/L Klotho蛋白联合作用后对细胞分泌LDH、MDA、SOD和GSH的影响。
2.3 流式细胞术检测细胞内活性氧簇(reactive oxygen species,ROS)生成的变化 以同样分组方法将HUVECs等量接种于不同培养板中,待细胞贴壁后经5.5、33.3 mmol/L葡萄糖及33.3 mmol/L葡萄糖与0.1、1、10 μmol/L Klotho蛋白联合处理48 h后消化收集细胞。用PBS洗涤细胞2次后,分别在各组细胞中加入1 μmol/L的双氢罗丹明123孵育1 h,孵育完成后离心收集细胞并用PBS洗涤1次。各组细胞内活性氧可将双氢罗丹明123氧化为罗丹明123发出荧光,以连续传代处于对数期的HUVECs中荧光量为阴性对照,利用流式细胞仪检测各组细胞中荧光阳性率反映各组HUVECs细胞内ROS变化情况。
2.4 ELISA方法检测细胞培养上清液NO、ET-1和ICAM-1含量的变化 将HUVECs分组接种于6孔板中后,按相同的分组分别用5.5、33.3 mmol/L葡萄糖及33.3 mmol/L葡萄糖与0.1、1、10 μmol/L Klotho蛋白联合处理48 h,同时设置PBS空白对照。收集各组细胞培养上清液按照ELISA试剂盒说明书检测各组HUVECs经处理后NO、ET-1和ICAM-1分泌量的变化。
2.5 Western blot法检测NF-κB的蛋白表达 按照相同方法和分组处理培养的HUVECs,48 h后消化收集细胞,PBS洗涤2次后利用RAPI蛋白提取液提取各组细胞中总蛋白。BCA试剂盒测定各组细胞中总蛋白。每组上样30 μg总蛋白进行SDS-PAGE,转膜封闭后分别孵育抗NF-κB和β-actin的 I 抗4 ℃过夜,TBST洗涤后孵育HRP标记 II 抗2 h,TBST洗涤2次后ECL化学发光显影拍照。利用Quantity One 软件分析NF-κB蛋白相对表达量。
3 统计学处理
采用软件SPSS 13.0进行统计学分析。所有数据采用均数±标准差(mean±SD)表示。在方差齐性检验后各组间数据比较采用单因素方差(one-way ANOVA)分析,用SNK-q检验进行各组均数间两两比较。以P<0.05为差异有统计学意义。
结 果
1 Klotho蛋白对高糖作用下HUVECs细胞活力的影响
与空白对照组HUVECs细胞相比,5.5 mmol/L葡萄糖单独处理HUVECs细胞24 h和48 h后细胞的A值有所下降,但差异无统计学显著性;而33.3 mmol/L葡萄糖单独处理组中HUVECs细胞的A值均显著下降,差异有统计学显著性(P<0.05)。当不同浓度抗衰老Klotho蛋白与33.3 mmol/L葡萄糖同时作用于HUVECs细胞时,可以显著提升细胞A值。与33.3 mmol/L葡萄糖单独作用组相比,1、10 μmol/L Klotho蛋白作用24 h细胞的A值显著上升(P<0.05),而0.1、1、10 μmol/L Klotho蛋白作用48 h时细胞A值均显著上升(P<0.05)。说明抗衰老Klotho蛋白可以促进高糖作用下损伤的HUVECs细胞活力的上升,见图1。
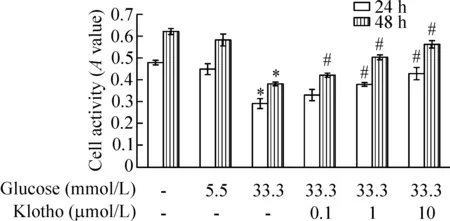
Figure 1.The effect of Klotho protein on the activity of HUVECs treated with high glucose. Mean±SD.n=6.*P<0.05vsPBS control;#P<0.05vs33.3 mmol/L glucose.
图1 Klotho蛋白对高糖作用下HUVECs活力的影响
2 Klotho蛋白对高糖作用下HUVECs中LDH、MDA、SOD和GSH的影响
如图2所示,与PBS对照组相比,33.3 mmol/L葡萄糖作用下,HUVECs分泌LDH活力和MDA含量显著上升,而SOD和GSH活力则显著下降(P<0.05)。当0.1、1、10 μmol/L抗衰老Klotho蛋白和33.3 mmol/L葡萄糖同时作用时,HUVECs分泌LDH活力和MDA含量均逐渐降低,而SOD和GSH活力则逐渐上升,且具有浓度依赖效应(P<0.05)。

Figure 2.The effect of Klotho protein on the content of MDA, and the activities of LDH, SOD and GSH in the culture supernatants of HUVECs treated with high glucose. Mean±SD.n=6.*P<0.05vsPBS control;#P<0.05vs33.3 mmol/L glucose.
图2 Klotho蛋白对高糖作用下HUVECs分泌LDH、MDA、SOD、GSH的影响
3 Klotho蛋白对高糖作用下HUVECs中ROS生成的影响
流式细胞术检测发现抗衰老Klotho蛋白可以抑制高糖诱导下HUVECs产生的ROS,结果见图3。与PBS对照组相比,5.55 mmol/L葡萄糖诱导HUVECs产生ROS不明显,但33.3 mmol/L葡萄糖组中产生ROS的量则显著上升(P<0.05)。当抗衰老Klotho蛋白和高浓度葡萄糖同时作用于HUVECs时,细胞内活性氧ROS有所下降,并随着Klotho作用浓度的升高ROS含量逐渐降低,与高糖单独作用组相比,差异有统计学显著性(P<0.05)。这说明Klotho蛋白能够减少高糖对HUVECs氧化损伤产生的ROS。

Figure 3.The effect of Klotho protein on the ROS production in the HUVECs treated with high glucose. A: PBS control; B: 5.5 mmol/L glucose; C: 33.3 mmol/L glucose; D: 0.1 μmol/L Klotho+33.3 mmol/L glucose; E: 1 μmol/L Klotho+33.3 mmol/L glucose; F: 10 μmol/L Klotho+33.3 mmol/L glucose. Mean±SD.n=6.*P<0.05vsPBS control;#P<0.05vs33.3 mmol/L glucose.
图3 Klotho蛋白对高糖作用下HUVECs细胞ROS生成的影响
4 Klotho蛋白对高糖作用下HUVECs培养上清中NO、ET-1和ICAM-1的影响
ELISA方法检测抗衰老Klotho蛋白对高糖作用下HUVECs培养上清中的NO、ET-1和ICAM-1含量,结果见表1。与PBS对照组相比,5.5 mmol/L葡萄糖作用组中HUVECs分泌NO、ET-1及ICAM-1含量的变化较小,但33.3 mmol/L葡萄糖作用组HUVECs中NO含量显著降低,而ET-1和ICAM-1含量显著上升(均P<0.05)。当不同浓度Klotho蛋白和33.3 mmol/L高糖同时作用于HUVECs细胞时,随着Klotho浓度的升高,NO含量逐渐上升而ET-1和ICAM-1含量逐渐下降,与高糖单独作用组相比,差异有统计学显著性(P<0.05)。
5 Klotho蛋白对高糖作用下HUVECs中NF-κB蛋白表达的影响
通过Western blot法检测抗衰老Klotho蛋白对高糖作用下HUVECs中NF-κB表达的影响,结果见图4。低浓度5.5 mmol/L和高浓度33.3 mmol/L葡萄糖作用HUVECs时,细胞中NF-κB蛋白均显著上升,且高糖作用组中上升更为明显(P<0.05)。但当不同浓度Klotho蛋白和33.3 mmol/L高糖同时作用HUVECs时,细胞内NF-κB蛋白则显著下降,随着Klotho作用浓度的升高,NF-κB表达渐下降,与高糖单独作用组相比,差异有统计学显著性(P<0.05)。
表1 Klotho蛋白对高糖作用下HUVECs培养上清中NO、ET-1和ICAM-1含量的影响
Table 1.The effect of Klotho protein on the concentrations of NO, ET-1 and ICAM-1 in the culture supernatants of HUVECs treated with high glucose (Mean±SD.n=6)

GroupNO(μmol/L)ET⁃1(mmol/L)ICAM⁃1(μg/L)PBScontrol93.58±4.850.57±0.053.63±0.235.5mmol/Lglucose85.43±6.750.62±0.123.95±0.3533.3mmol/Lglucose54.17±5.17∗0.97±0.06∗8.64±0.47∗0.1μmol/LKlotho+33.3mmol/Lglucose67.33±3.48#0.85±0.047.33±0.27#1μmol/LKlotho+33.3mmol/Lglucose75.29±4.19#0.71±0.08#5.37±0.30#10μmol/LKlotho+33.3mmol/Lglucose83.45±3.98#0.64±0.07#4.11±0.46#
*P<0.05vsPBS control;#P<0.05vs33.3 mmol/L glucose.

Figure 4.The effect of Klotho protein on NF-κB protein expression in HUVECs treated with high glucose. Mean±SD.n=6.*P<0.05vsPBS control;#P<0.05vs33.3 mmol/L glucose.
图4 Klotho蛋白对高糖作用下HUVECs NF-κB表达的影响
讨 论
糖尿病患者常常引发血管并发症,因为其血管内慢性高血糖水平容易使血管内皮细胞丧失正常生理功能,血管内皮功能损伤被认为是动脉粥样硬化等心血管疾病的发病起始因素,可以导致机体多发性器官病变[4]。而糖尿病及心血管疾病多发于老年人群,相比于青少年群体,其发病率和死亡率均较高,提示机体衰老因素与血管性疾病病因有关联[5]。抗衰老Klotho蛋白是一种与人类衰老相关的蛋白因子,有膜型和分泌型两种形式。分泌型Klotho蛋白可作为抗衰老调节激素对多种靶器官发挥调节作用,研究表明它能够保护心血管系统,对衰老等多种相关疾病进行调节[6]。进一步研究表明,Klotho蛋白与人类心血管疾病、癌症、肾损伤等多种代谢疾病都有密不可分的关系,前期研究中已发现Klotho蛋白能够抑制高糖作用下内皮细胞的衰老和凋亡,但关于其是否在高糖引起的血管内皮损伤氧化应激和炎症反应中发挥作用尚未见研究[7]。本研究中以不同浓度葡萄糖作用于HUVECs模拟糖尿病人受损血管内皮,MTT检测可以发现33.3 mmol/L高浓度葡萄糖作用组中HUVECs细胞活力显著下降,而当Klotho蛋白与高糖同时作用于HUVECs时,细胞活力却能够显著上升,说明抗衰老Klotho蛋白能够减轻高糖对HUVECs的损伤作用。
动脉粥样硬化等心血管障碍性疾病都与血管内皮细胞氧化应激有关,而糖尿病患者由于血管内血糖浓度过高,使血管内皮细胞产生ROS增多而加速其损伤程度[8]。本文通过流式细胞术检测也发现,当不同浓度葡糖糖单独作用于HUVECs时细胞内产生ROS的含量会显著上升,说明高糖能够诱导血管内皮细胞的ROS。而当抗衰老Klotho蛋白同时作用于HUVECs时,细胞内ROS含量逐渐下降,并具有明显的浓度效应,说明Klotho蛋白有助于减少高糖引起的HUVECs细胞ROS损伤。同时血管内皮细胞的抗氧化生理功能还能通过LDH、MDA、SOD及GSH反映出来。LDH在细胞内糖分解和异生中起着重要作用,其分泌的多少反映机体氧化损伤的严重程度[9]。MDA是机体脂质过氧化的敏感指标,水平的高低可以反映细胞的氧化损伤程度,而细胞内存在的抗氧化系统SOD和GSH可以对抗氧化应激对细胞的损伤[10]。本研究中不同浓度Klotho蛋白和高糖同时作用于HUVECs时,与高糖单独损伤组相比,细胞中LDH和MDA水平显著下降,而抗氧化SOD和GSH活性均明显上升,说明抗衰老Klotho蛋白作用于高糖损伤的HUVECs,能够刺激其抗氧化损伤系统发挥作用,进而对氧化损伤的细胞发挥保护和修复作用。
正常血管内皮细胞还具有分泌功能,能够分泌NO、ET-1、ICAM-1等因子,并在动脉粥样硬化形成中发挥重要作用[11]。NO是血管内皮细胞释放的重要舒血管物质能够直接反映内皮细胞功能的强弱,而内皮素ET-1是机体内强收缩血管物质,能够促进血管平滑肌的增生,血管损伤时会显著上升,也可以反映血管的损伤程度[12]。ICAM-1能够在受损的内皮细胞及血管中斑块形成处较强表达,从而导致动脉粥样硬化[13]。研究表明糖尿病患者血管内皮细胞功能受损,血清中NO分泌含量下降,而ET-1及ICAM-1会显著上升[14]。本文研究发现单独高糖作用HUVECs时,细胞中NO分泌含量显著下降,而ET-1及ICAM-1含量均显著上升,说明高糖损伤HUVECs正常分泌功能。当抗衰老Klotho蛋白与高糖同时作用于HUVECs时,细胞分泌NO含量能够逐渐上升,而ET-1和ICAM-1水平会渐下降,说明Klotho蛋白能够恢复HUVECs正常分泌功能,对于预防动脉粥样硬化斑块形成有积极作用。同时有研究[15]表明ROS能够激活细胞中NF-κB表达的上调,而NF-κB能够调节编码多种炎症介质的基因,使血管内皮细胞发生炎症反应、免疫应答或凋亡,从而诱发动脉粥样硬化,而通过阻断NF-κB信号通路能够阻止糖尿病血管病变的发生、发展。本研究中Western blot检测也发现,在高糖环境下HUVECs中NF-κB蛋白表达上调,但不同浓度Klotho蛋白能够逐渐抑制高糖诱导HUVECs中NF-κB蛋白的表达,说明其保护高糖下血管内皮细胞可能通过减少NF-κB蛋白表达阻断NF-κB信号通路发挥作用。
综上所述,本研究发现抗衰老Klotho蛋白能够提升高糖作用下HUVECs细胞活力,抵抗高糖诱导的氧化损伤,恢复内皮细胞正常分泌功能,从而对血管内皮细胞发挥保护作用,并可通过减少NF-κB蛋白表达发挥作用。通过本研究能够对高血糖引起的动脉粥样硬化等心血管并发症的防治提供新的视野和思路。
[1] 虞建新, 吴 奇, 杨 欢. 丹参酮ⅡA对高糖诱导人脐静脉内皮细胞凋亡的作用[J]. 中国病理生理杂志, 2015, 31(09):1720-1723.
[2] Torres PU, Prie D, Molina-Bletry V, et al. Klotho: an antiaging protein involved in mineral and vitamin D meta-bolism[J]. Kidney Int, 2007, 71(8): 730-737.
[3] Hu MC, Shi M, Zhang J, et al. Klotho deficiency causes vascular calcification in chronic kidney disease[J]. J Am Soc Nephrol, 2011, 22(1):124-136.
[4] 廖静秋, 林佳琼, 张伟杰, 等. JAK/STAT信号通路在高糖诱导人脐静脉内皮细胞损伤中的作用[J]. 中国病理生理杂志, 2016, 32(03):392-397.
[5] 耿 婕, 陈树涛, 王 林. 老年冠心病患者血脂代谢特点分析[J]. 天津医药, 2011, 39(3):208-211.
[6] Lim K, Lu TS, Molostvov G, et al. Vascular Klotho deficiency potentiates the development of human artery calcification and mediates resistance to fibroblast growth factor 23[J]. Circulation, 2012, 125(18):2243-2255.
[7] 张 军, 代文静, 周敬群,等. Klotho蛋白对高糖作用下人脐静脉血管内皮细胞凋亡和衰老的作用[J]. 广东医学, 2015, 36(15):2323-2327.
[8] Ceriello A, Assaloni R, Da Ros R, et al. Effect of atorvastatin and irbesartan, alone and in combination, on postprandial endothelial dysfunction, oxidative stress, and inflammation in type 2 diabetic patients[J]. Circulation, 2005, 111(19): 2518-2524.
[9] 朱惠莲, 侯孟君, 李 燕, 等. 氧化型低密度脂蛋白经血凝素样氧化型低密度脂蛋白受体 1途径诱导血管内皮细胞损伤[J]. 中国动脉硬化杂志, 2004, 12(4): 383-386.
[10]许惠琴, 农伟虎, 刘成鼎, 等. 山茱萸最佳配伍组分对高糖致 ECV304 细胞氧化损伤的保护作用[J]. 中国药理学通报, 2011, 27(8): 1077-1080.
[11]Mudau M, Genis A, Lochner A, et al. Endothelial dysfunction: the early predictor of atherosclerosis[J]. Cardiovasc J Afr, 2012, 23(4): 222-231.
[12]Li Q, Park K, Li C, et al. Induction of vascular insulin resistance and endothelin-1 expression and acceleration of atherosclerosis by the overexpression of protein kinase C-β isoform in the endothelium[J]. Circ Res, 2013, 113(4):418-427.
[13]Rautou PE, Leroyer AS, Ramkhelawon B, et al. Microparticles from human atherosclerotic plaques promote endothelial ICAM-1-dependent monocyte adhesion and transendothelial migration[J]. Circ Res, 2011, 108(3):335-343.
[14]郑仁东, 任 安, 陈若平, 等. 2 型糖尿病患者血管内皮功能的改变[J]. 中国临床保健杂志, 2009, 12(2):134-135.
[15]Xia F, Wang C, Jin Y, et al. Luteolin protects HUVECs from TNF-α-induced oxidative stress and inflammation via its effects on the Nox4/ROS-NF-κB and MAPK pathways[J]. J Atheroscler Thromb, 2014, 21(8): 768-783.
(责任编辑: 陈妙玲, 罗 森)
Protective effect of anti-aging Klotho protein on human umbilical vein endothelial cells treated with high glucose
ZHANG Jun1, DAI Wen-jing2, ZHOU Jing-qun2, ZHANG Jia-jun1, CAO Zhi-gang1
(1ICU,2DepartmentofCardiology,RenheHospital,ThreeGorgesUniversity,Yichang443000,China.E-mail:zhoujingqun-1@medmail.com.cn)
AIM: To study the protective effect of anti-aging Klotho protein on human umbilical vein endothe-lial cells (HUVECs) treated with high glucose (HG).METHODS: HUVECs were culturedinvitro, and divided into PBS control group, 5.5 mmol/L glucose group, 33.3 mmol/L glucose group, 0.1 μmol/L Klotho+33.3 mmol/L glucose group, 1 μmol/L Klotho+33.3 mmol/L glucose group, and 10 μmol/L Klotho+33.3 mmol/L glucose group. The viability of the HUVECs was measured by MTT assay. The content of malondialdehyde (MDA), and the activities of lactate dehydrogenase (LDH), superoxide dismutase (SOD) and glutathione (GSH) in cell culture supernatants were observed. The production of reactive oxygen species (ROS) in HUVECs was analyzed by flow cytometry. The levels of nitric oxide (NO), endothelin (ET-1), intercellular adhesion molecule-1 (ICAM-1) in HUVEC culture medium were detected by ELISA. The protein expression of nuclear factor-kappa B (NF-κB) in the HUVECs was determined by Western blot. RESULTS: Compared with PBS control group, 33.3 mmol/L glucose significantly decreased the HUVEC viability, increased ROS, LDH and MDA levels, reduced the activities of SOD and GSH, decreased the NO secretion, and induced the ET-1 and ICAM-1 secretion and the protein expression of NF-κB in HUVECs. When HUVECs were treated with Klotho protein at different concentrations combined with 33.3 mmol/L glucose, the cell viability was increased significantly, the ROS, LDH and MDA levels were decreased significantly, the antioxidant SOD and GSH activities were significantly increased, the secretion of NO was increased, but ET-1 and ICAM-1 releases and protein expression of NF-κB were significantly reduced.CONCLUSION: Anti-aging Klotho protein promotes the viability of HUVECs treated with HG, reduces the oxidative damage and ROS production, and restores the normal secretory function of HUVECs, thus playing a protective role in vascular endothelial cells through reducing the protein expression of NF-κB.
High glucose; Klotho protein; Human umbilical vein endothelial cells; Oxidative stress; Atherosclerosis
1000- 4718(2017)01- 0067- 06
2016- 05- 24
2016- 10- 27
湖北省教育厅自然科学研究计划重点项目(No. D20091308)
R587.1; R363.2
A
10.3969/j.issn.1000- 4718.2017.01.011
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0717-6555730; E-mail: zhoujingqun-1@medmail.com.cn
