地西他滨抑制K562白血病细胞增殖和诱导分化的作用*
2017-01-19余潇苓赵燕娜郑智茵高瑞兰尹利明
余潇苓, 赵燕娜, 郑智茵, 高瑞兰, 尹利明
(浙江中医药大学附属第一医院血液病研究所,浙江 杭州 310006)
地西他滨抑制K562白血病细胞增殖和诱导分化的作用*
余潇苓, 赵燕娜, 郑智茵, 高瑞兰, 尹利明△
(浙江中医药大学附属第一医院血液病研究所,浙江 杭州 310006)
目的: 观察地西他滨(DAC)抑制白血病K562细胞生长和诱导分化的作用。方法: 不同浓度的DAC处理K562细胞。MTT法和半固体集落生成实验检测K562细胞增殖能力;瑞氏染色观察细胞形态;流式细胞术检测分化相关抗原CD11b和CD42b阳性表达率;Western blot 检测细胞周期蛋白依赖性激酶2(CDK2)、细胞周期蛋白E1(cyclin E1)、细胞周期负调控因子P27、红系分化核转录因子GATA-1及粒系分化核转录因子PU.1蛋白的表达水平。结果: DAC能够减少K562 细胞集落形成的数量,降低细胞活力,减少核质比,抑制K562细胞进入S期,并阻滞在G2/M期,提高分化相关抗原CD11b和CD42b阳性表达率,上调P27、GATA-1 和PU.1蛋白表达,同时下调CDK2和cyclin E1蛋白表达。结论: DAC可能通过调控细胞周期抑制K562细胞增殖,同时诱导多向分化。
地西他滨; 白血病; 细胞增殖; 分化; 细胞周期
白血病是严重危害人类生命健康的造血系统恶性肿瘤,其发病率和死亡率在儿童和青年的恶性肿瘤中位居首位,其生物学特征是造血细胞增殖失控、分化成熟受阻、正常凋亡过程发生障碍,以致异常分化的细胞大量增殖。近年研究发现白血病细胞抑癌基因启动子CpG岛高度甲基化,导致抑癌基因沉默,可能是白血病细胞增殖失控和分化阻滞的原因之一[1]。DNA甲基化转移酶抑制剂能够诱导甲基化沉默基因表达,而表达的抑癌基因能够调控细胞增殖。地西他滨(decitabine; 商品名Dacogen,DAC)是一种DNA甲基化转移酶抑制剂,低剂量能够诱导DNA去甲基化和造血干细胞分化[2],而高剂量则有细胞毒作用。目前,治疗骨髓增生异常综合征的疗效确切[3],而用于白血病的治疗正在探索中[4-6]。本研究观察DAC 抑制K562白血病细胞增殖和诱导分化的作用,并初步探讨其可能的机制。
材 料 和 方 法
1 材料
K562细胞由浙江省中医院血液病研究所保存;DAC 购自Sigma;注射用水和细胞培养液稀释为20 mmol/L,4 ℃保存备用;IMDM培养基购自 Gibco;小牛血清购自杭州四季青公司;PE标记的小鼠抗人CD11b和CD42b抗体购自BD;抗细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)、细胞周期蛋白E1(cyclin E1)、P27、GATA-1和PU.1抗体购自Cell Signaling Technology;抗β-actin抗体购自联科生物技术有限公司。
2 实验方法
2.1 细胞培养 将K562细胞常规培养于含10%小牛血清的IMDM完全培养基中,置于37 ℃、5% CO2、饱和湿度培养箱中培养,隔天换液。
2.2 MTT实验检测细胞活力 取对数生长K562细胞,调整细胞浓度至1×108/L,分别加入不同浓度DAC和阳性对照药物佛波酯(12-O-tetradecanoylphorbol-13-acetate,TPA),分别接种于96孔培养板,每孔2×104细胞(200 μL),复种6孔。DAC 终浓度分别为0、0.1、0.2和0.4 μmol/L,TPA终浓度为0.1 μmol/L。上述培养体系置37 ℃、5% CO2及饱和湿度的培养箱中培养72 h后,加入5 g/L MTT 20 μL,在相同条件下继续孵育4 h。离心弃上清,每孔加入二甲基亚砜150 μL,微量振荡器振荡5 min,使结晶完全溶解,酶标仪检测490 nm波长的吸光度,计算各实验组细胞生长的抑制率。该实验重复3次。细胞抑制率(%)=(对照组吸光度-实验组吸光度)/对照组吸光度×100%。
2.3 K562细胞半固体集落形成实验 计数并调整细胞浓度为5×106/L,进行K562白血病细胞集落培养,分别加入不同浓度的DAC和TPA。DAC终浓度为0、0.1、0.2和0.4 μmol/L,TPA终浓度为0.1 μmol/L。培养体系为IMDM培养液、30%小牛血清、1% L-谷氨酰胺、100 U青/链霉素和0.3%琼脂,接种于24孔板, 每孔2.5×102个细胞(0.5 mL),重复3孔。置于37 ℃、5% CO2的饱和湿度培养箱中培养7 d。以大于40个细胞的聚合为一个K562白血病细胞集落,记录K562白血病细胞集落数,并计算抑制率(%)=(对照组集落数-实验组集落数)/对照组集落数×100%。该实验重复3次。
2.4 瑞氏染色(Wright’s staining)观察细胞形态的改变 取对数生长K562细胞,调整细胞浓度至1×108/L,分别加入不同浓度DAC 和TPA,分别接种于6孔培养板,每孔2×105细胞(3 mL)。DAC 终浓度分别为0、0.1、0.2和0.4 μmol/L,TPA终浓度为0.1 μmol/L。上述培养体系置37 ℃、5%CO2及饱和湿度的培养箱中,隔天换液,培养7 d后收集细胞,细胞离心涂片机制作细胞涂片。瑞氏染色,油镜下观察细胞形态变化。
2.5 流式细胞术检测分化相关抗原阳性表达率 收集各组细胞,PBS洗涤并调整细胞浓度为1×109/L,取100 μL细胞悬液分别加入抗分化相关抗原CD11b和CD42b的单克隆抗体,4 ℃孵育30 min,PBS洗去未结合的抗体,流式细胞术检测细胞阳性表达率,每一个检测标本记录10 000个细胞。DIVA软件进行阳性率的分析。同样的实验重复3次。
2.6 Western blot 法检测K562细胞CDK2、cyclin E1、P27、GATA-1和PU.1的蛋白表达 按照本研究所已报道的方法[7],采用细胞裂解液(含50 mmol/L Tris、150 mmol/L NaCl、1% Triton X-100和蛋白酶抑制剂)提取总蛋白。将40 μg蛋白加入SDS凝胶加样缓冲液20 μL中煮沸后,经SDS-PAGE分离后,将蛋白条带用电转移到NC膜上,分别加特异性的抗CDK2、cyclin E1、P27、GATA-1和PU.1抗体,4 ℃孵育过夜,加辣根过氧化物酶标记的Ⅱ抗,经充分洗涤后用ECL发光剂。采用灰度扫描系统测定并分析目的蛋白条带。同样的实验重复3次。
3 统计学处理
采用 SPSS 17.0软件进行数据分析,计量资料以均数±标准差(mean±SD)表示,药物实验组与对照组比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 地西他滨抑制K562细胞增殖
DAC处理K562细胞3 d,0.1~0.4 μmol/L组的A值分别为0.61±0.04、0.54±0.03和0.50±0.03,其中0.2和0.4 μmol/L DAC组的A值明显低于对照组(P<0.05)。DAC处理K562细胞7 d,0.1~0.4 μmol/L组的K562细胞集落数分别为109.3±8.1、72.3±7.9和48.0±8.4(每103个K562细胞),显著低于对照组(P<0.01),见图1。
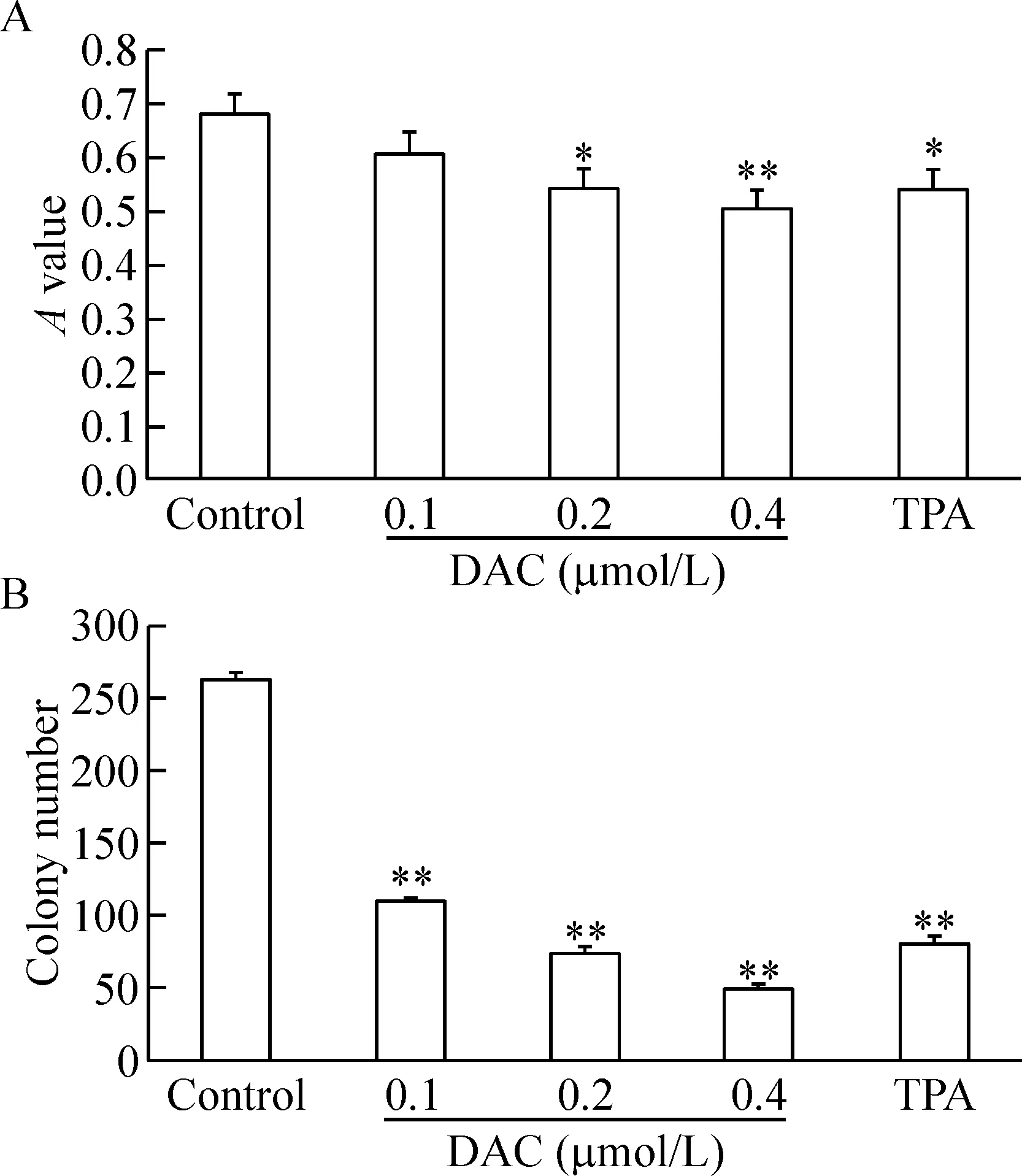
Figure 1.The proliferation of K562 cells detected by MTT assay (A) and colony formation assay (B). Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图1 MTT实验和集落形成实验证实DAC抑制K562细胞增殖
2 DAC 诱导K562细胞形态学改变
DAC 处理K562细胞7 d,瑞氏染色显示随着药物浓度增大,K562细胞体积增大,胞浆丰富,核浆比减少,胞浆内可见空泡等细胞形态学改变,见图2。
3 地西他滨提高K562细胞分化相关抗原阳性表达率
地西他滨处理K562细胞7 d,流式细胞术检测K562细胞分化程度,结果显示K562细胞分化相关抗原CD11b和CD42b阳性表达率均明显高于对照组,且呈一定的剂量依赖关系,见图3、表1。
4 DAC 对K562细胞周期的影响
不同浓度DAC处理K562细胞72 h,流式细胞术分析细胞周期分布情况。结果显示随着药物浓度的增加,S期细胞的比例逐渐减少,G2/M期的细胞比例逐渐增加,见图4、表1。
5 DAC 对K562细胞周期和分化相关蛋白表达水平的影响
Western blot实验结果显示,随着药物浓度增加,CDK2和cyclin E1的蛋白表达水平逐渐降低,而P27、GATA-1和PU.1的蛋白表达水平逐渐增加(P<0.05),见图5。

Figure 2.The morphologial changes of K562 cells induced by DAC (×400). A: control; B: 0.1 μmol/L DAC; C: 0.2 μmol/L DAC; D: 0.4 μmol/L DAC; E: TPA.
图2 DAC对K562细胞形态的影响

Figure 3. DAC increased the CD11b and CD42b positive rate in K562 cells.
图3 DAC提高K562细胞CD11b和CD42b阳性表达率

Figure 4. DAC changed the cell cycle distribution of the K562 cells.
图4 DAC对K562细胞细胞周期分布的影响
表1 DAC对细胞CD11b和CD42b阳性率和细胞周期分布的影响
Table 1.The effects of DAC on the CD11b and CD42b positive rates and the cell cycle distribution of the K562 cells (%. Mean±SD.n=3)

TreatmentCD11bCD42bG0/G1SG2/MControl3.51±0.327.92±0.5744.91±4.2147.14±3.857.96±1.200.1μmol/LDAC4.20±0.33∗16.10±1.04∗∗35.06±3.14∗33.66±2.98∗27.49±2.13∗∗0.2μmol/LDAC8.10±0.73∗∗30.21±3.68∗∗36.66±3.11∗28.14±2.01∗∗36.20±2.87∗∗0.4μmol/LDAC5.38±0.47∗13.80±0.89∗∗35.40±3.24∗25.52±2.57∗∗39.09±3.47∗∗TPA12.21±0.44∗∗14.80±0.43∗∗53.84±4.16∗∗37.75±3.11∗∗8.04±0.68
*P<0.05,**P<0.01vscontrol group.
讨 论
DAC是一种DNA甲基化转移酶抑制剂,具有去甲基化的作用。该药在血液系统疾病如骨髓增生异常综合征的实验研究和临床应用方面已取得令人满意的疗效,并且在治疗髓系白血病方面也有较好的疗效,但是机制尚不明确。
在一定诱导因素作用下,白血病K562细胞株可向红系、粒-单系和巨核系细胞分化,是研究白血病细胞增殖与分化的理想细胞模型。我们观察到每103个K562细胞能够形成264.7±19.1个集落,也就是这些集落来自于264.7±19.1个原始细胞,表明每个K562细胞的增殖能力不同,具有异质性的特点,提示能够形成集落的K562细胞更原始。同时,我们发现浓度为0.1~0.4 μmol/L的DAC能够显著减少K562细胞形成集落的数量,抑制K562细胞原始细胞的增殖,抑制率达到58.7%~81.9%。MTT实验的结果显示,浓度为0.1~0.4 μmol/L的DAC抑制K562细胞增殖,抑制率达到10.3%~25.6%。MTT实验是以K562细胞群作为观察对象,白血病细胞集落形成实验以K562细胞群中原始细胞作为观察对象。因此,2种实验相结合能够更全面地观察和分析DAC抑制K562细胞增殖的作用。
阻止白血病细胞进入细胞周期,抑制恶性增殖是抗白血病常用手段和疗法[8-9]。研究表明,DAC对细胞周期分布的影响具有时效性和空间性。熊鸣等[10]报道DAC处理K562耐药细胞24 h,发现S期细胞比例减少,G2/M期细胞无变化;而处理48 h, G2/M期细胞比例增加。韩新爱等[11]报道,DAC处理K562细胞72 h后,G0/G1期细胞比例显著增高,S期细胞比例降低, G2/M期细胞比例无变化。国外文献报道DAC抑制肿瘤细胞进入细胞周期,并阻滞在G2/M期[12-13]。我们的实验结果显示DAC处理K562细胞72 h,上调细胞周期负调控因子P27蛋白表达,下调细胞周期 CDK2和cyclin E1蛋白的表达,抑制细胞进入S期,同时细胞阻滞在G2/M期,与已报道的结果基本一致,但略有不同,可能是药物浓度不同所致。此外,阳性对照药物TPA增加G0/G1期K562细胞比例,降低S期细胞比例,而G2/M期细胞比例无变化,其对细胞周期的作用与DAC不同。
目前,针对白血病分化阻滞的发病机制,诱导白血病细胞分化以治疗髓系白血病的方法受到关注,但是临床上常用的细胞分化诱导剂应用范围局限,如砷剂和维甲酸仅限于治疗M3早幼粒白血病患者,难于满足临床需要。研究发现,基因组甲基化程度的高低水平调控细胞分化能力[14-15],进一步发现甲基化水平与分化程度呈正相关。我们观察了DAC诱导K562细胞分化的作用,在0.1~0.4 μmol/L的浓度范围内,DAC能够诱导K562细胞分化,不仅有细胞形态学的改变,而且细胞分化抗原和分化相关蛋白的表达水平均也有不同程度的提高,提示DAC非特异性诱导K562细胞向多系分化。然而,阳性对照药TPA诱导K562细胞分化的作用不同于DAC;TPA增加粒系分化抗原CD11b阳性表达的细胞比例较多,而巨核系分化抗原CD42b表达阳性的细胞比例较少,提示TPA诱导K562细胞趋于分化为粒系。
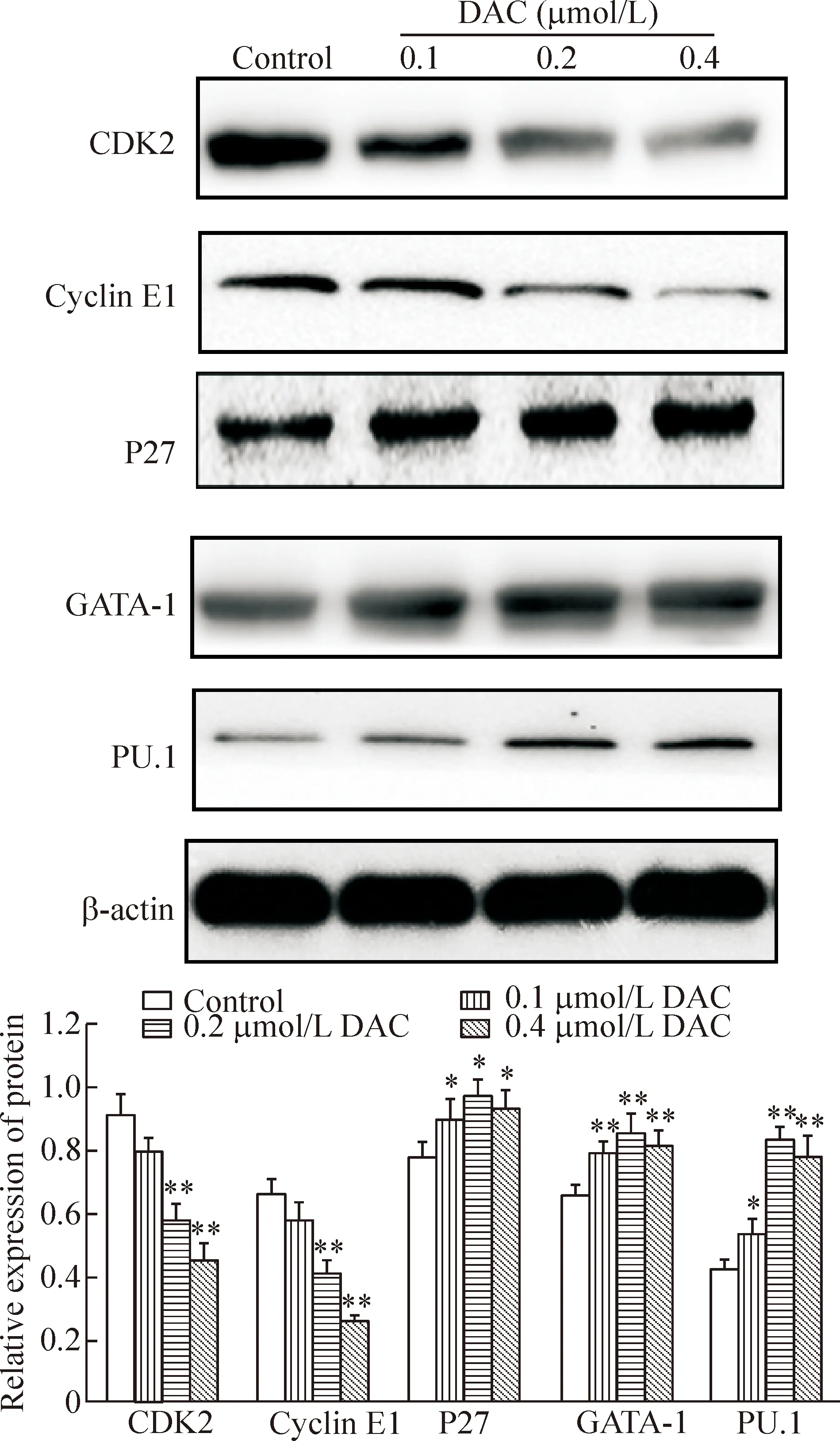
Figure 5.DAC regulated the protein expression of CDK2, cyclinE1, P27, GATA-1 and PU.1 in the K562 cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图5 DAC对K562细胞CDK2、cyclinE1、P27、GATA-1和PU.1蛋白表达水平的调节作用
综上所述,本研究初步探讨了DAC诱导髓系白血病分化的作用。但仍有许多问题有待进一步解决,譬如DAC临床应用的诱导分化剂量、诱导K562细胞分化的去甲基化机制、诱导K562细胞分化的细胞周期分布等。
[1] Celik H, Kramer A, Challen GA. DNA methylation in normal and malignant hematopoiesis[J]. Int J Hematol, 2016, 103(6):617-626.
[2] Iancu-Rubin C, Hoffman R. Role of epigenetic reprogramming in hematopoietic stem cell function[J]. Curr Opin Hematol, 2015, 22(4):279-285.
[3] Gangat N, Patnaik MM, Tefferi A. Myelodysplastic syndromes: Contemporary review and how we treat[J]. Am J Hematol, 2016, 91(1):76-89.
[4] Chang E, Ganguly S, Rajkhowa T, et al. The combination of FLT3 and DNA methyltransferase inhibition is synergistically cytotoxic to FLT3/ITD acute myeloid leukemia cells[J]. Leukemia, 2016, 30(5):1025-1032.
[5] Engen CB, Hajjar E, Gjertsen BT. Development of personalized molecular therapy for acute myeloid leukemia[J]. Curr Pharm Biotechnol, 2016, 17(1):20-29.
[6] Wouters BJ, Delwel R. Epigenetics and approaches to targeted epigenetic therapy in acute myeloid leukemia[J]. Blood, 2016, 127(1):42-52.
[7] Wen WW, Sun X, Zhuang HF, et al. Effects of panaxa-diol saponins component as a new Chinese patent medicine on proliferation, differentiation and corresponding gene expression profile of megakaryocytes[J]. Chin J Integr Med, 2016, 22(1):28-35.
[8] Sanz MA, Iacoboni G, Montesinos P, et al. Emerging strategies for the treatment of older patients with acute myeloid leukemia[J]. Ann Hematol, 2016, 95(10):1583-1593.
[9] Blachly JS, Byrd JC, Grever M. Cyclin-dependent kinase inhibitors for the treatment of chronic lymphocytic leukemia[J]. Semin Oncol, 2016, 43(2):265-273.
[10]熊 鸣, 王立新.地西他滨对K562/O2细胞阿霉素耐药性的影响[J]. 中国病理生理杂志, 2016, 32(1):69-75.
[11]韩新爱, 曾慧兰, 韩艳萍, 等.地西他滨对NB4及K562细胞增殖和凋亡的影响[J].中国实验血液学杂志, 2013, 21(2):356-360.
[12]Shang D, Han T, Xu X, et al. Decitabine induces G2/M cell cycle arrest by suppressing p38/NF-κB signaling in human renal clear cell carcinoma[J]. Int J Clin Exp Pathol, 2015, 8(9):11140-11148.
[13]Valdez BC, Li Y, Murray D, et al. 5-Aza-2’-deoxycytidine sensitizes busulfan-resistant myeloid leukemia cells by regulating expression of genes involved in cell cycle checkpoint and apoptosis[J]. Leuk Res, 2010, 34(3):364-372.
[14]Duan L, Liu Y, Wang J, et al. The dynamic changes of DNA methylation in primordial germ cell differentiation[J]. Gene, 2016, 591(2):305-312.
[15]Gore AV, Weinstein BM. DNA methylation in hemato-poietic development and disease[J]. Exp Hematol, 2016, 44(9):783-790.
(责任编辑: 林白霜, 罗 森)
Effect of decitabine on proliferation and differentiation of K562 cells
YU Xiao-ling, ZHAO Yan-na, ZHENG Zhi-yin, GAO Rui-lan, YIN Li-ming
(InstituteofHematology,TheFirstAffiliatedHospitalofZhejiangChineseMedicalUniversity,Hangzhou310006,China.E-mail:yinlm_hz@163.com)
AIM: To investigate the effect of decitabine (Dacogen, DAC) on the proliferation and differentiation of K562 cells. METHODS: The K562 cells were treated with different concentrations of DAC. The colony formation ability of the cells was detected by the colony formation assay with semi-solid culture. The cell viability was detected with MTT assay. The morphologic features were observed under inverted microscope with Wright’s staining. The changes of the cell cycle distribution and the expression of CD11b and CD42b were analyzed with flow cytometry. The protein expression of CDK2, cyclin E1, P27, GATA-1 and PU.1 in the K562 cells was determined by Western blot. RESULTS: DAC significantly decreased the colony number of the cells and cell viability in a dose-dependent manner. The morphological changes of the cells displayed partial differentiation. After treated the K562 cells with DAC for 72 h, the cell proportion in S phase was obviously decreased, while the cell proportion in G2/M phase was obviously increased in a dose-dependent manner. After treated the K562 cells with DAC for 7 d, the percentage of CD11b and CD14 positive cells was further elevated, and the protein expression of P27, GATA-1 and PU.1 was increased. However, the protein expression of CDK2 and cyclin E1 was decreased. CONCLUSION: DAC inhibits the proliferation and induces differentiation of the K562 cells via regulation of cell cycle.
Decitabine; Leukemia; Cell proliferation; Differentiation; Cell cycle
1000- 4718(2017)01- 0013- 05
2016- 07- 22
2016- 11- 14
国家自然科学基金资助项目(No. 81373876);浙江省自然科学基金资助项目(No. Y14H290004)
R730.23
A
10.3969/j.issn.1000- 4718.2017.01.003
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0571-87071625; E-mail: yinlm_hz@163.com
