ENDOD1在前列腺癌组织及细胞中的表达及意义*
2017-01-19彭叔彬邱剑光黄文涛王德娟
彭叔彬, 曾 花, 邱剑光, 胡 成, 黄文涛, 李 科△, 王德娟△
(中山大学附属第三医院 1泌尿外科, 2急诊科,广东 广州 510630)
ENDOD1在前列腺癌组织及细胞中的表达及意义*
彭叔彬1, 曾 花2, 邱剑光1, 胡 成1, 黄文涛1, 李 科1△, 王德娟1△
(中山大学附属第三医院1泌尿外科,2急诊科,广东 广州 510630)
目的: 观察比较核酸内切酶结构域内含蛋白1(endonuclease domain containing 1,ENDOD1)在良性前列腺增生和前列腺癌组织中的表达差异;筛选存在ENDOD1特异性低表达的前列腺癌细胞系,继而通过调控该细胞ENDOD1蛋白表达,研究其在前列腺癌细胞中的生物学功能,初步探索ENDOD1基因与前列腺癌发生、进展的联系。方法: 利用免疫组化SP法检测20例良性前列腺增生和21例前列腺癌术后标本组织中ENDOD1表达情况;利用RT-qPCR和Western blot方法观察ENDOD1的mRNA和蛋白在前列腺正常上皮细胞和不同类型前列腺癌细胞中的表达差异,筛选出特异性低表达细胞系;构建pCMV-N-Flag-ENDOD1重组质粒,转染前列腺癌细胞株,过表达ENDOD1蛋白,通过MTT法测定调控前后前列腺癌细胞活力的变化,流式细胞术检测细胞周期和凋亡,Transwell实验评价肿瘤细胞迁移和侵袭能力的改变。结果: 免疫组化评分的方差分析结果显示ENDOD1表达与前列腺癌Gleason评分呈负性关联;RT-qPCR和Western blot实验结果表明ENDOD1在雄激素非依赖性前列腺癌细胞系PC3和DU145中存在着特异性低表达(P<0.05)。同时,MTT实验显示,在DU145细胞中,过表达 ENDOD1肿瘤细胞活力显著下降(P<0.05);而流式细胞术检测结果表明过表达ENDOD1能够使DU145细胞周期停滞在G0/G1期,但细胞凋亡率无明显差异。此外,在Transwell实验中,过表达ENDOD1的DU145细胞迁移和侵袭能力明显下降(P<0.05)。结论: ENDOD1在Gleason评分越高的前列腺癌中表达越低,同时在雄激素非依赖性前列腺癌细胞系存在着特异性低表达;而过表达ENDOD1能明显抑制雄激素非依赖性前列腺癌细胞的生长、迁移和侵袭能力。
前列腺肿瘤; 核酸内切酶结构域内含蛋白1; 肿瘤侵袭
前列腺癌(prostate cancer,PCa)是西方发达国家男性最常见的恶性肿瘤,死亡率仅次于肺癌,居于第二位[1]。根治性手术是目前局限性前列腺癌治疗的主要手段,而对于复发及进展性前列腺癌的治疗主要是采用雄激素剥夺及去势治疗[2]。然而报道指出,去势治疗一段时间后,部分患者可能会由激素依赖性前列腺癌(androgen dependent prostate cancer,ADPC)进展为去势抵抗性前列腺癌(castration resistant prostate cancer,CRPC),最终引起肿瘤进展、转移,从而导致死亡[3]。目前,CRPC的发生及进展机制仍不完全明确[4],尚缺乏有效的评估、预测及治疗方法。因此,寻找新颖可靠的CRPC进展标志物和治疗靶点,研究ADPC向CRPC演变的机制,对于预测PCa进程,探索有效的治疗措施,延长患者生存期和提高患者生活质量有着重大意义。
雄激素受体(androgen receptor,AR)在前列腺癌由ADPC向CRPC转归过程中扮演着重要的角色,其相关信号通路的激活是CRPC发生的重要因素[5]。新近研究利用蛋白组学方法筛选发现,核酸内切酶结构域内含蛋白1(endonuclease domain containing 1,ENDOD1)为AR调控基因,提示其可能与PCa的发生、进展密切相关[6]。目前关于ENDOD1基因的研究仍很少,尤其是其在前列腺癌中的生物学功能和分子机制尚不明确。本研究拟通过分析ENDOD1在前列腺癌组织和前列腺细胞系的表达情况,发掘其预测前列腺癌进展的临床应用价值;并通过构建质粒观察过表达ENDOD1基因对前列腺癌细胞增殖、周期、迁移和侵袭等生物学功能的影响。
材 料 和 方 法
1 材料和试剂
1.1 细胞、质粒、菌株 实验所需前列腺正常上皮细胞RWPE1,局限性PCa细胞株22Rv1(激素依赖性),转移性PCa细胞株LNCaP(激素依赖性)、PC-3和DU145(激素非依赖性)均由中国科学院典型培养物保藏委员会细胞库提供;pCMV-N-Flag质粒为本实验室保存;大肠杆菌DH5α菌株购自于TaKaRa。
1.2 主要试剂 胎牛血清、RPMI-1640细胞培养基、PBS缓冲液购自Gibco;TRIzol Reagent、Lipofectamine 2000、Keratinocyte serum-free medium购自Invitrogen;PrimeScriptTMRT Reagent Kit with gDNA Eraser和SYBR® Premix Ex TaqTMII购自TaKaRa;质粒DNA小提试剂盒购自Omega;LB培养基购自上海生工生物工程公司;Transwell细胞培养板和Matrigel基质胶购自BD;兔源ENDOD1多克隆抗体购自Abcam;免疫组化试剂盒购自康为世纪公司。
1.3 标本 本实验中20例前列腺增生(benign prostatic hyperplasia, BPH)标本和21例PCa标本均来自中山大学附属第三医院泌尿外科2010年6月~2015年10月间BPH患者行前列腺电切术和PCa患者行前列腺癌根治术后病理证实的石蜡包埋标本,其中BPH组年龄50.2(42~82)岁,PCa组年龄66.3(48~80)岁,Gleason评分≤6分7例,7分8例,≥8分6例。
2 方法
2.1 细胞培养 前列腺正常上皮细胞RWPE1置于Keratinocyte serum-free medium培养液、所有前列腺癌细胞置于含10%胎牛血清的RPMI-1640培养液中于5% CO2、37 ℃、饱和湿度条件下恒温培养。
2.2 免疫组化SP法检测ENDOD1在前列腺癌组织中的表达 切片常规脱蜡、水化,过氧化氢溶液浸泡,修复,Ⅰ抗封闭,Ⅱ抗孵育,DAB显色,苏木素复染,脱水,封片等[7]。由2位高年资病理医师分别对41张病理片进行判断,最后将结果汇总。每张玻片随机选择5个高倍镜视野,细胞内出现棕黄色颗粒为阳性表达。阳性细胞百分比:0%为0分,<10%为1分,11%~50%为2分,51%~80%为3分,>80%为4分。细胞染色强度:胞质无棕黄色颗粒为0分;淡棕黄色颗粒,明显高于背景和阴性对照为1分;染色清晰的棕黄色颗粒,介于强弱之间为2分;有大量深棕色颗粒,阳性染色强为3分。免疫反应性评分(immunoreactivity score,IRS)等于染色强度乘以阳性细胞染色百分比[8]。
2.3 RT-qPCR检测ENDOD1的mRNA在前列腺正常上皮细胞和前列腺癌细胞系中的表达水平 前列腺正常上皮细胞RWPE1和PCa细胞22Rv1、LNCap、PC3、DU145分别培养于6孔板中,当细胞铺满整个板时,采用TRIzol法提取总RNA,紫外分光光度计检测RNA浓度及纯度,以RNA为模板使用TaKaRa的逆转录试剂盒进行逆转录,逆转录条件为37 ℃ 15 min,85 ℃ 5 s。以不同细胞的cDNA为模板,ENDOD1特异性荧光定量引物进行RT-qPCR,具体步骤见SYBR® Premix Ex TaqTMⅡ(TliRNaseH Plus)说明书。本实验以GAPDH作为内参照,以2-ΔΔCt法计算mRNA的相对表达量,实验样品至少重复3次。引物由华大基因合成,ENDOD1的正义链为5’-GACCGCATCCCCGTGTA-3’,反义链为5’-AATCGCCTCCTCAAGGTT-3’;GAPDH的正义链为5’-TCCTCTGACTTCAACAGCGACACC -3’,反义链为5’-TCTCTCTTCCTCTTGTGCTCTTGG-3’。
2.4 ENDOD1质粒的提取和转染 将ENDOD1质粒转化DH5α感受态细菌,涂布于含卡那霉素LB培养基中,培养12~16 h,随机挑选单克隆菌落,接种于4 mL含卡那霉素的LB固体培养基,37 ℃、200 r/min摇菌过夜,根据质粒DNA小提试剂盒步骤提取ENDOD1质粒。待细胞密度融合为60%~80%时,采用Lipofectamine 2000方法转染,实验分为2组,转染组(过表达组)为pCMV-N-Flag-ENDOD1质粒转染DU145细胞,空白对照组为pCMV-N-Flag-空载质粒转染DU145细胞。
2.5 Western blot法检测ENDOD1蛋白在不同前列腺细胞中的表达水平以及转染DU145细胞后ENDOD1的表达水平 在各个细胞中加入含蛋白酶抑制剂的细胞裂解液,用细胞刮子刮下细胞,制备蛋白样品,测量其浓度,进行SDS-PAGE,转印至PVDF膜后用5%脱脂奶粉溶液封闭,TBST洗涤,Ⅰ抗(ENDOD1兔抗人多克隆抗体和内参照GAPDH抗体)4 ℃孵育过夜,Ⅱ抗室温孵育,洗膜后显影,灰度扫描,分析结果。
2.6 MTT法检测细胞的活力 取对数期生长细胞转染过表达质粒和空载质粒后,置于96孔板培养,收集各个时点细胞(1 d,2 d,3 d,4 d,5 d),加入MTT试剂(5 g/L,即0.5% MTT)孵育4 h,酶标仪测量各个时点490 nm处吸光度(A)值。
2.7 流式细胞术检测细胞周期 质粒转染48 h后,收集细胞调整浓度为1×109/L,70%冷乙醇固定2 h,100 μL RNase A 37 ℃水浴30 min,400 μL PI 4 ℃避光30 min,上流式细胞仪检测。
2.8 流式细胞术检测细胞凋亡 质粒转染48 h后,收集5×105细胞,500 μL binding buffer悬浮细胞,加入5 μL Annexin V-FITC混匀,再加入5 μL PI后用流式细胞仪检测。
2.9 Transwell实验检测细胞迁移和侵袭能力 收集过表达组和空白对照组细胞,侵袭实验时,Transwell上室需要加入100 μL Matrigel,下室加入含20%胎牛血清的1640培养液。铺胶上室和无铺胶上室都套入下室,分别加入过表达组和对照组细胞悬液100 μL,37 ℃培养箱培养24 h,取出上室,4%多聚甲醛固定30 min,0.1%结晶紫染色,光镜下观察,随机计数3个高倍镜视野中下室细胞数,即为穿膜细胞数,每组重复3次。
3 统计学处理
采用SPSS 19.0统计学软件进行分析。数据以均数±标准差(mean±SD)表示;计量资料采用单因素方差分析,两两比较采用LSD-t检验。计数资料采用2检验。以P<0.05 为差异有统计学意义。
结 果
1 ENDOD1在BPH及PCa标本中表达及ENDOD1的IRS评分与Gleason评分的关系
免疫组化结果显示,ENDOD1主要表达在细胞质中,BPH组的IRS为5.2±3.0,PCa组的IRS为4.8±3.3,其差异没有统计学显著性。PCa组织中Gleason评分≤6的IRS为7.8±3.6,Gleason评分=7的IRS为3.9±1.5,Gleason评分≥8的IRS为2.5±1.8,差异存在统计学显著性(P<0.05),结果表明在PCa组织中,随着Gleason评分的升高,ENDOD1的表达水平逐渐降低,ENDOD1的表达可能与PCa的进展呈负性关联,见图1。
2 ENDOD1在前列腺正常上皮细胞和前列腺癌细胞中的mRNA和蛋白表达水平
以前列腺正常上皮细胞RPWE1和PCa细胞LNCap、22Rv1、PC3、DU145的RNA为模板,进行RT-qPCR。结果表明,与RWPE1相比,ENDOD1在转移性PCa细胞系LNCaP(激素依赖性)中表达明显上升(P<0.05);而在转移性激素非依赖性PCa细胞PC3和DU145中表达明显下降(P<0.05),其中在DU145细胞中ENDOD1的表达水平最低。同时,Western blot的实验结果与RT-qPCR的结果一致,证明ENDOD1在转移性激素非依赖性PCa细胞DU145中存在着特异性低表达,见图2。
3 过表达ENDOD1后检测其表达水平以及对DU145细胞活力的影响
以DU145为后续实验细胞系,在转染pCMV-N-Flag-ENDOD1质粒过表达ENDOD1基因后,Western blot检测ENDOD1蛋白的表达明显升高,证实转染成功。MTT实验结果表明,在观察周期内,ENDOD1过表达组比对照组增殖率明显下降,差异有统计学意义(P<0.05),提示ENDOD1能够抑制DU145细胞的活力,见图3。

Figure 1.A: IHC staining of ENDOD1 protein in BPH specimen and PCa specimen (×200); B: ENDOD1 immunoreactivity scores (IRS) in BPH samples and PCa specimens. IRS were determined by multiplying the level of staining intensity (negative=0, weak=1, moderate =2, strong=3) and the percentage of positively stained cells (0%=0, <10%=1, 11%~50%=2, 51%~80%=3, >80%=4). GS: Gleason scores. Mean±SD.*P<0.05vsBPH.
图1 ENDOD1蛋白在前列腺组织中表达及IRS评分与Gleason评分的关系
4 过表达ENDOD1对DU145细胞周期及凋亡率的影响
DU145过表达组停留在G0/G1期的细胞比例明显增加,ENDOD1能够诱导DU145出现G0/G1期阻滞;细胞凋亡结果显示DU145过表达组和对照组的细胞凋亡率差异无统计学显著性,2组细胞的凋亡率分别为3.28%和1.05%。因此ENDOD1可能通过诱导G0/G1期阻滞抑制DU145细胞生长,但对肿瘤细胞凋亡没有影响,见图4。
5 过表达ENDOD1对DU145细胞迁移和侵袭能力的影响

Figure 2.The mRNA (A) and protein (B) expression of ENDOD1 in RWPE1, LNCap, 22Rv1, PC3 and DU145 cells. Mean±SD.n=3.*P<0.05vsRWPE1.
图2 前列腺正常上皮细胞及各种PCa 细胞中ENDOD1 mRNA和蛋白的表达

Figure 3.The protein expression of ENDOD1 in the DU145 cells transfected with pCMV-N-Flag-ENDOD1 (A) and the cell activity of the DU145 cells with ENDOD1 overexpression (B). OV: overexpression. Mean±SD.n=3.*P<0.05vsnegative control (NC).
图3 转染ENDOD1质粒后ENDOD1表达水平及DU145细胞的活力
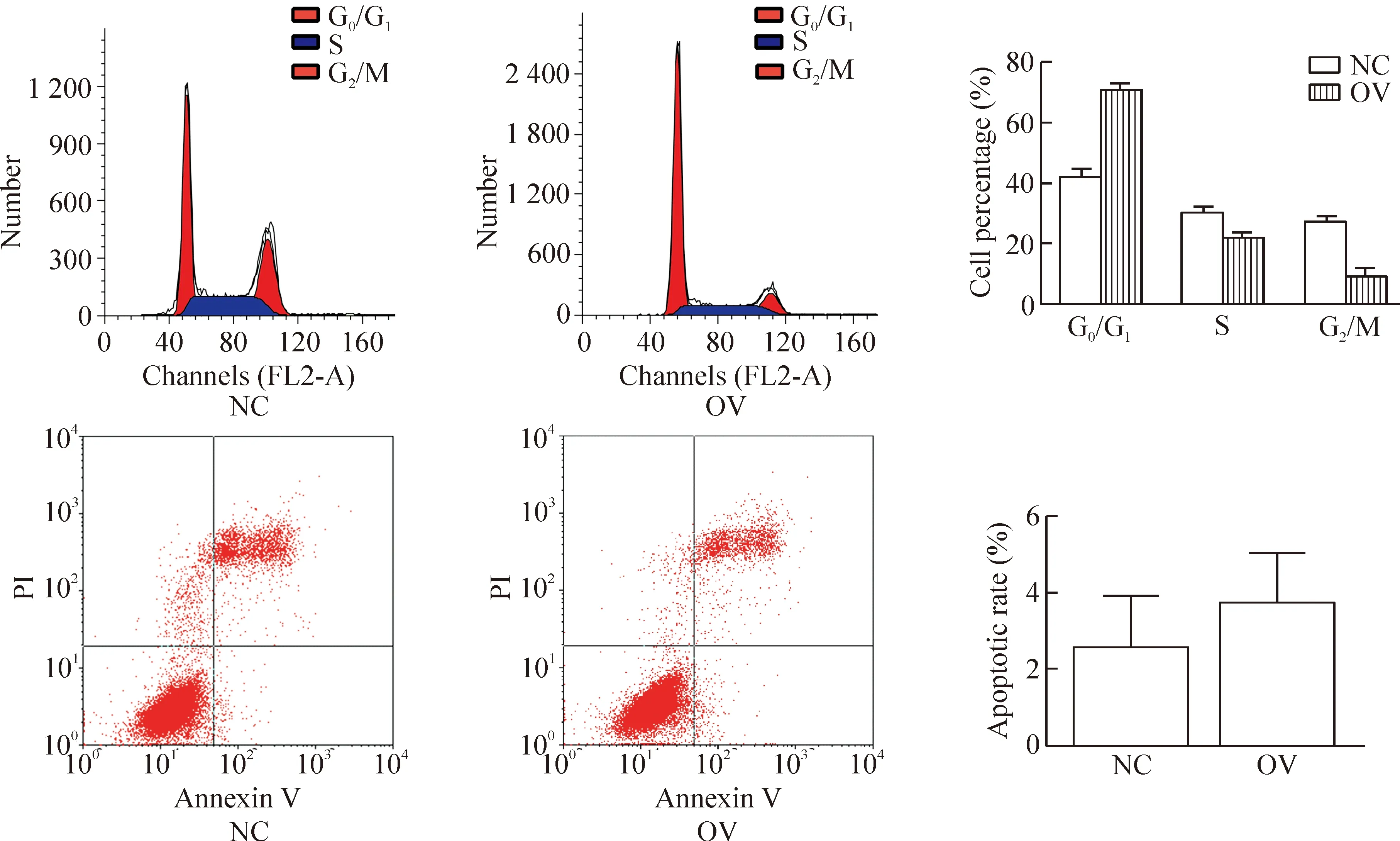
Figure 4.The cell cycle and apoptosis of DU145 with ENDOD1 overexpression (OV) detected by flow cytometry.n=3.*P<0.05vsnegative control (NC).
图4 过表达ENDOD1基因对DU145细胞周期和凋亡的影响
将转染ENDOD1和对照质粒的DU145培养于Transwell小室24 h后,计算穿膜细胞数。Transwell迁移和侵袭实验结果显示过表达ENDOD1组较对照组迁移和侵袭能力明显下降,迁移实验中过表达组和对照组穿膜细胞数分别是(99±10)个和(212±12)个,侵袭实验2组穿膜细胞数分别是(32.7±5.0)个和(78.7±6.4)个,差异均具有统计学意义(P<0.05),提示ENDOD1过表达可明显抑制PCa细胞的迁移和侵袭能力,见图5。
讨 论
我国PCa发病率与西方国家相比相对较低,但近年来随着老龄化的加速、生活环境的改变和饮食结构的调整,我国前列腺癌的发病率逐年升高[9]。PCa的主要特点是早期症状不明显,患者就诊时往往已处于进展期,常延误了最佳的诊治时机。虽然,随着诊疗手段的发展,PCa的检出率有所提高,但目前仍缺乏有效预测PCa进展的方法[10]。ENDOD1作为DNA/RNA非特异性核酸酶族的成员,主要功能是水解核酸中的磷酸二酯键[11]。有研究证实核酸酶家族参与了突变和DNA损伤的修复以及细胞程序性死亡[12-13],在肿瘤的发生和发展过程中扮演着重要角色。Gaedcke等[14]报道ENDOD1能抑制直肠上皮肿瘤的发生,可作为新的直肠癌肿瘤标志物;Cunha等[15]报道ENDOD1表达下降促进软组织肿瘤的局部进展和转移。因此, ENDOD1可能在肿瘤的发生、发展过程中起着重要的作用。在前列腺癌中,国外报道发现ENDOD1是AR调节基因,可能参与调控AR的表达[6]。Romanuik等[16]也报道ENDOD1在高级别前列腺癌中表达降低且与淋巴结转移相关。同时,研究表明AR基因的扩增和突变,以及其相关信号通路的激活与PCa向CRPC转归密切相关[5]。本研究结果表明ENDOD1蛋白在转移性激素依赖性细胞中表达明显上升,而在转移性激素非依赖性细胞中表达明显下降,说明ENDOD1的表达随着AR表达的缺失而下降,ENDOD1可能是AR调控的靶基因,这与国外研究结果一致。因此,ENDOD1蛋白表达的下降可作为预测前列腺癌由激素依赖向激素非依赖转变的潜在标记物,具体机制有待于进一步探索。
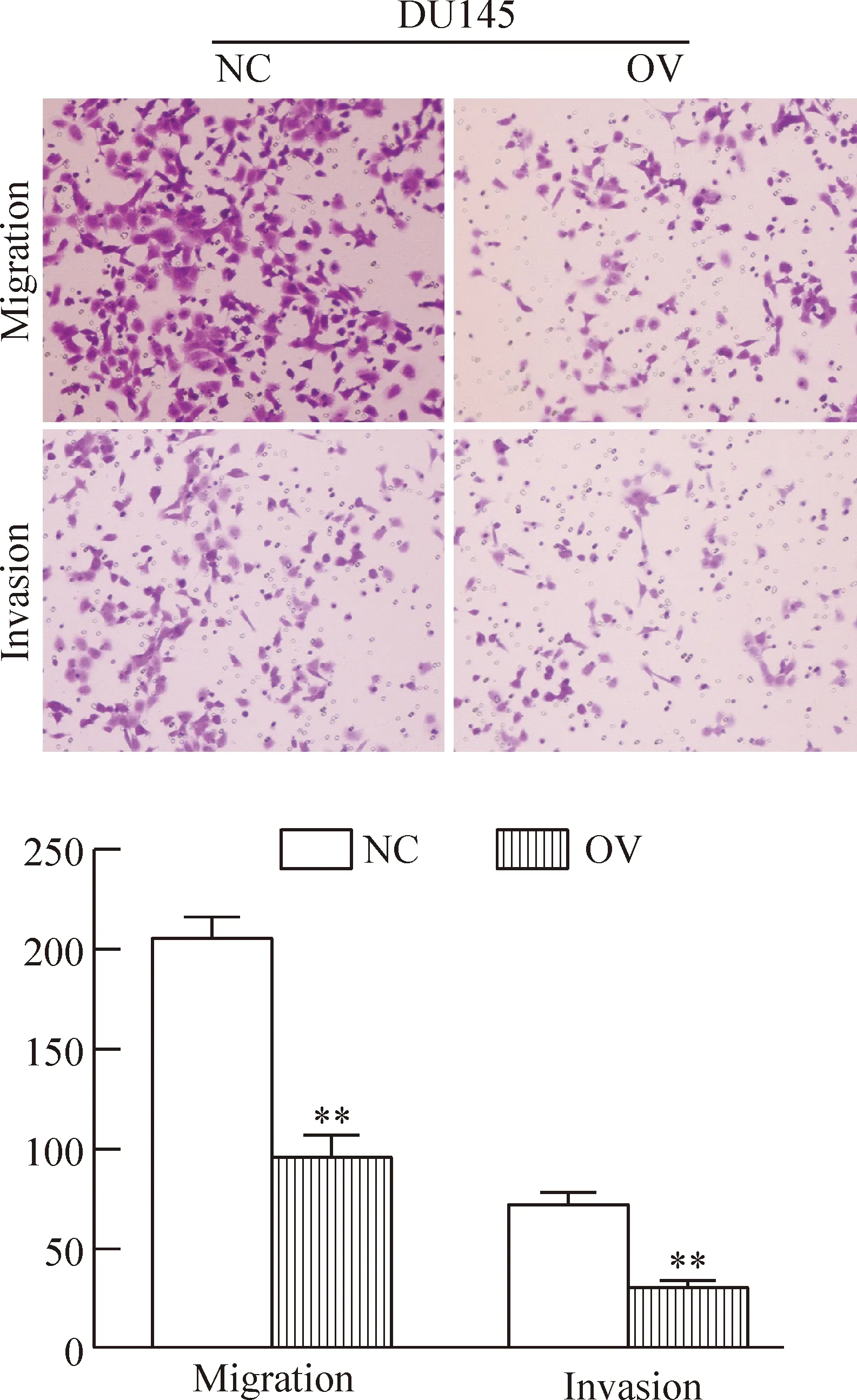
Figure 5.The results of Transwell migration assay and Matrigel invasion assay of DU145 cells with ENDOD1 overexpression (OV) (crystal violet staining, ×40). Mean±SD.n=3.**P<0.01vsnegative control (NC).
图5 过表达ENDOD1基因对DU145细胞迁移及侵袭能力的影响
总之,本研究发现ENDOD1与PCa患者的Gleason评分呈负性关联,其表达可能影响PCa的进展;同时,ENDOD1在转移性激素非依赖性PCa细胞系中存在特异性低表达,提示其与PCa中AR表达具有相关性。继而,我们通过细胞功能学实验发现,过表达ENDOD1能够明显抑制前列腺癌细胞的增殖、迁移和侵袭能力,从而说明ENDOD1可能作为一种新的前列腺癌肿瘤抑制因子,参与影响了PCa的进程,是一种潜在的PCa诊断和判断预后的新标记物。
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1):5-29.
[2] Cornford P, Bellmunt J, Bolla M, et al. EAU-ESTRO-SIOG guidelines on prostate cancer. Part ii: treatment of relapsing, metastatic, and castration-resistant prostate can-cer[J]. Eur Urol, 2016. pii: S0302-2838(16)30469-9.
[3] 方习武, 夏术阶, 唐孝达. 雄激素受体在人类前列腺癌发展中的作用研究[J]. 中国病理生理杂志, 2004,20(7):1275-1279.
[4] Watson PA, Arora VK, Sawyers CL. Emerging mechanisms of resistance to androgen receptor inhibitors in prostate cancer[J]. Nat Rev Cancer, 2015,15(12):701-711.
[5] Chandrasekar T, Yang JC, Gao AC, et al. Mechanisms of resistance in castration-resistant prostate cancer (CRPC)[J]. Transl Androl Urol, 2015, 4(3):365-380.
[6] Marques RB, Dits NF, Erkens-Schulze S, et al. Modulation of androgen receptor signaling in hormonal therapy-resistant prostate cancer cell lines[J]. PLoS One, 2011, 6(8):e23144.
[7] 黄 斌, 陈俊星, 李秀博, 等. 蛋白激酶Cε在前列腺癌组织中表达的临床意义[J]. 中华泌尿外科杂志, 2011, 32(9):607-609.
[8] Yu S, Xu Z, Zou C, et al. Ion channel TRPM8 promotes hypoxic growth of prostate cancer cells via an O2-independent and RACK1-mediated mechanism of HIF-1α stabilization[J]. J Pathol, 2014, 234(4):514-525.
[9] 孙颖浩. 我国前列腺癌的研究现状[J]. 中华泌尿外科杂志, 2004, 25(2):77-80.
[10]李 科, 陈 怡, 董 艳, 等. ACSL3在前列腺癌细胞系中的表达及其对前列腺癌转移的影响[J]. 中国病理生理杂志, 2014, 30(2):250-255.
[11]Lyu ZZ, Zhao BB, Koiwai K, et al. Identification of endonuclease domain-containing 1 gene in Japanese flounder Paralichthys olivaceus[J]. Fish Shellfish Immunol, 2016, 50:43-49.
[12]Doherty R, Madhusudan S. DNA repair endonucleases: physiological roles and potential as drug targets[J]. J Biomol Screen, 2015, 20(7):829-841.
[13]Kawane K, Nagata S. Nucleases in programmed cell death[J]. Methods Enzymol, 2008, 442:271-287.
[14]Gaedcke J, Grade M, Jung K, et al. Mutated KRAS results in overexpression of DUSP4, a MAP-kinase phosphatase, and SMYD3, a histone methyltransferase, in rectal carcinomas[J]. Genes Chromosomes Cancer, 2010, 49(11):1024-1034.
[15]Cunha IW, Carvalho KC, Martins WK, et al. Identification of genes associated with local aggressiveness and metastatic behavior in soft tissue tumors[J]. Transl Oncol, 2010, 3(1):23-32.
[16]Romanuik TL, Wang G, Morozova O, et al. LNCaP Atlas: gene expression associated withinvivoprogression to castration-recurrent prostate cancer[J]. BMC Med Genomics, 2010, 3:43.
(责任编辑: 林白霜, 余小慧)
Value of endonuclease domain containing 1 in progression of prostate cancer
PENG Shu-bin1, ZENG Hua2, QIU Jian-guang1, HU Cheng1, HUANG Wen-tao1, LI Ke1, WANG De-juan1
(1DepartmentofUrology,2DepartmentofEmergency,ThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China.E-mail:sasaer@126.com)
AIM: To analyze the difference of endonuclease domain containing 1 (ENDOD1) expression between benign prostatic hyperplasia (BPH) tissues and prostate cancer (PCa) tissues and to investigate the effect of ENDOD1 on the biological function of human prostate cancer cells. METHODS: The BPH samples (n=20) and PCa samples (n=21) were processed and analyzed according to the instruction of immunohistochemical (IHC) staining. The mRNA and protein levels of ENDOD1 in the normal prostate epithelial cells and prostate cancer cells were evaluated by RT-qPCR and Western blot, respectively. The recombinant plasmids pCMV-N-Flag-ENDOD1 was constructed and was transfected into the human prostate cancer cells. The proliferation, apoptosis, migration and invasion abilities of the prostate cancer cells were evaluated by MTT assay, flow cytometry, Transwell migration and Matrigel invasion assays, respectively. RESULTS: The analysis of variance of the immunoreactivity score showed that PCa tissues with high Gleason score displayed significantly lower ENDOD1expression than that with low Gleason score and BPH (P<0.05). The expression of ENDOD1 at mRNA and protein levels in PC3 cells and DU145 cells was significantly lower than that in the LNCap cells (P<0.05). The proliferation of DU145 transfected with ENDOD1 was inhibited. The flow cytometry indicated that ENDOD1 over-expression in the DU145 cells resulted in a notable increase in G0/G1phase arrest (P<0.05), but the apoptotic rates showed no statistical difference. The results of Transwell assay showed that migration and invasion abilities of the cells were also inhibited after transfection with over-expressing ENDOD1 plasmid (P<0.05). CONCLUSION: The expression of ENDOD1 significantly decreased in prostate cancer with high Gleaon score. Meanwhile, the ENDOD1 is specifically down-regulated in androgen independent prostate cancer (AIPC) cell lines. Over-expression of ENDOD1 remarkably inhibits the proliferation, migration and invasion abilities of AIPC.
Prostate cancer; Endonuclease domain containing 1; Neoplasm invasion
1000- 4718(2017)01- 0007- 06
2016- 11- 08
2016- 12- 08
国家自然科学基金资助项目(No.81402111);广东省自然科学基金资助项目(No.2015A030313031);广东省医学科研基金资助项目(No.A2016435)
R730.23
A
10.3969/j.issn.1000- 4718.2017.01.002
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-85252660; E-mail: sasaer@126.com
