JAK-STAT信号通路、IL-1β和IL-6在X射线辐照诱导PC12细胞损伤中的调控作用
2017-01-19喻晶,张宜,刁波
喻 晶, 张 宜, 刁 波
(中国人民解放军武汉总医院医学实验科,湖北 武汉 430070)
JAK-STAT信号通路、IL-1β和IL-6在X射线辐照诱导PC12细胞损伤中的调控作用
喻 晶, 张 宜△, 刁 波
(中国人民解放军武汉总医院医学实验科,湖北 武汉 430070)
目的: 探究JAK-STAT信号通路及炎症因子IL-1β、IL-6是否参与X射线诱导的PC12细胞辐射损伤。方法: 采用X射线分别以2、4和8 Gy剂量照射PC12细胞,照射后24 h通过酶联免疫法检测IL-1β和IL-6的表达水平;Western blot检测p-JAK1、p-JAK2、p-STAT1、p-STAT3和p-STAT5的蛋白水平。结果: 与正常对照组相比,细胞经不同剂量X射线照射24 h后,IL-1β和IL-6的表达水平均升高,且与辐照剂量呈剂量依赖性;p-JAK1、p-JAK2、p-STAT1、p-STAT3和p-STAT5的蛋白水平均升高,且上调程度与辐照剂量呈剂量依赖性。结论: JAK-STAT信号通路、IL-1β和IL-6可能参与X射线照射诱导PC12细胞的损伤调控。
X射线; PC12细胞; JAK-STAT信号通路; IL-1β; IL-6
随着现代科学技术的迅猛发展,核能和核技术在能源、军事、医疗卫生等国民生活生产中的大量运用,人体受到电离辐射的机会日益增多。其中在医疗领域,放射治疗已经成为大脑原发性、继发性肿瘤和脑转移瘤等头部肿瘤不可或缺的非手术治疗手段,其疗效显著,明显延长患者的生存期,但射线在对临床疾病进行诊断与治疗的同时,也使接受辐照的患者经受不同程度的辐射后遗效应[1]。中枢神经系统是电离辐射暴露的主要靶器官,脑部在受到射线辐照后会出现头痛、头晕、疲劳乏力、学习记忆能力减退[2]、急性和慢性认知功能缺陷[3]等精神症状。
脑经辐照后神经细胞的损害多由于继发性炎症反应所致[4]。白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-6(interleukin-6,IL-6)作为一种炎性介质参与中枢神经内分泌活动。Janus激酶-信号转导子与转录激活子(Janus kinase-signal transducer and activator of transcription,JAK-STAT)信号通路在免疫功能调节[5]以及神经炎症[6-7]等过程中发挥着特异且多效性的生物学功能,是细胞信号转导的一个重要途径。炎症因子IL-1β、IL-6和JAK-STAT信号通路在辐照诱导神经系统损伤中的调控作用未见报道。本实验选取PC12细胞作为辐射的模型细胞,考察X射线暴露对PC12细胞辐照后的损伤效应,观察辐照对炎症因子IL-1β和IL-6以及JAK-STAT信号通路的影响,为进一步研究辐射对神经系统的损伤机制提供参考及实验依据。
材 料 和 方 法
1 药品、试剂与仪器
DMEM高糖培养基购自HyClone;胎牛血清(fetal bovine serum,FBS)购自NQBB;胰蛋白酶购自Amersco;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量测定试剂盒购自碧云天生物公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)鼠抗人多克隆抗体购自杭州贤至生物有限公司;抗p-JAK1、p-JAK2、p-STAT1、p-STAT3、p-STAT5、JAK1、JAK2、STAT1、STAT3和STAT5抗体购自Abcam;辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔抗体购自武汉博士德生物工程有限公司;IL-1β和IL-6酶联免疫试剂盒购自Perprotech;TRIzol试剂购自Gibco;其它试剂购于国药试剂,均为分析纯。
医用直线加速器(Electa-Precise e1293);荧光化学成像系统(上海天能科技有限公司);酶标分析仪(中国深圳雷杜生命科学股份有限公司);超纯水系统(Millipore);DYCZ-40电泳仪和DYCZ-24DN垂直电泳槽(北京六一仪器厂);水平摇床(江苏海门其林贝尔仪器制造有限公司)。
2 方法
2.1 细胞培养 PC12细胞由本院医学实验科保存。细胞用含10% FBS、1×105U/L青霉素和100 mg/L链霉素的DMEM高糖培养液,以1.0×108/L密度接种于培养瓶中,置于37 ℃、5% CO2、饱和湿度的恒温培养箱内常规培养。取对数生长期的细胞进行实验。
2.2 照射条件 采用6 MeV X射线,照射剂量为2、4和8 Gy,剂量率为200 cGy/min,皮靶距为60 cm,照射野为20 cm×20 cm。
2.3 IL-1β和IL-6的检测 各剂量组细胞经照射后24 h收集细胞上清液,使用酶联免疫法测定,具体步骤参照IL-1β和IL-6酶联免疫试剂盒进行。
2.4 Western blot实验 将各组细胞分别经2、4、8 Gy剂量辐照,24 h后弃去培养液,PBS洗3次,裂解液裂解细胞,以12 000 r/min离心15 min。收集细胞裂解物,蛋白浓度用BCA法进行测定。取40 μg总蛋白在十二烷基硫酸钠(sodium dodecyl sulfate, SDS)缓冲液中煮7 min,进行SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)并电转移至硝酸纤维素膜上。硝酸纤维素膜用含50 g/L脱脂奶粉的TBST缓冲液室温封闭90 min,然后依次滴加(1∶500~1∶1 000)的抗JAK1、JAK2、STAT1、STAT3、STAT5、p-JAK1、p-JAK2、p-STAT1、p-STAT3、p-STAT5和GAPDH抗体,4 ℃过夜后TBST缓冲液洗涤 10 min、3次,然后用1∶5 000的HRP-羊抗兔或鼠IgG孵育2 h,然后用TBST缓冲液洗涤3次,每次10 min。最后用增强化学发光(enhanced chemiluminescence, ECL)液进行曝光显影,荧光化学成像系统进行照相并用其附带的软件分析蛋白的相对表达量。
3 统计学处理
采用SPSS 16.0软件处理,数据均以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组间两两比较采用Dunnett-t检验。以P<0.05为差异有统计学意义。
结 果
1 X射线辐照对PC12细胞IL-1β和IL-6含量的影响
PC12细胞经2、4和8 Gy X射线辐照后,IL-1β的含量由正常对照组的(83.471±17.109) ng/L,分别增加到(139.975±16.420) ng/L、(225.378±21.007) ng/L和(301.674±23.415) ng/L。与正常对照组比较,PC12细胞经X射线照射后IL-1β的含量升高均有统计学意义(P<0.01),见图1。
PC12细胞经2、4和8 Gy X射线照射后,IL-6含量由正常对照组的(115.585±7.783) ng/L,分别增加到(153.030±15.462) ng/L、(195.174±10.461) ng/L和(227.356±14.257)ng/L。与正常对照组比较,PC12细胞经X射线照射后IL-6的含量升高均有统计学意义(P<0.01),见图1。
2 X射线辐照对PC12细胞p-JAK1、p-JAK2、p-STAT1、p-STAT3和p-STAT5蛋白水平的影响
PC12细胞经2、4和8 Gy X射线照射后:p-JAK1的相对蛋白水平由0.359±0.0340分别上调到0.563±0.0573、0.0828±0.0404和0.972±0.0440;p-JAK2的相对蛋白水平由0.449±0.0404分别上调到0.569±0.0380、0.752±0.0358和0.891±0.0421;p-STAT1的相对蛋白水平由0.084±0.0273分别上调到0.252±0.0291、0.530±0.0521和0.711±0.0262;p-STAT3的相对蛋白水平由0.217±0.0510分别上调到0.490±0.0450、0.711±0.0528和0.961±0.0492;p-STAT5的相对蛋白水平由0.424±0.0535分别上调到0.620±0.0392、0.728±0.0401和0.872±0.0399。与正常对照组比较,PC12细胞经 X射线照射后p-JAK1、p-JAK2、p-STAT1、p-STAT3和p-STAT5蛋白的水平上调均有统计学意义(P<0.01),见图2。
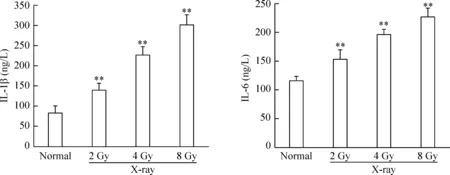
Figure 1.The effect of X-ray irradiation on the levels of IL-1β and IL-6 in the PC12 cells. Mean±SD.n=3.**P<0.01vsnormal group.
图1 X射线辐射对PC12细胞中IL-1β和IL-6含量的影响
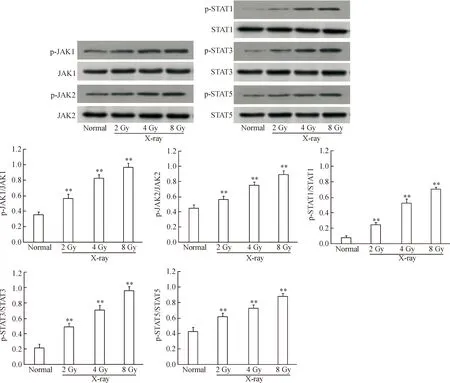
Figure 2.The effect of X-Ray irradiation on the protein levels of p-JAK1, p-JAK2, p-STAT1, p-STAT3 and p-STAT5 in the PC12 cells. Mean±SD.n=3.**P<0.01vsnormal group.
图2 X射线辐射诱导对PC12细胞中p-JAK1、p-JAK2、p-STAT1、p-STAT3和p-STAT5的蛋白表达水平的影响
讨 论
近年来,电离辐射已渗透到人类生产生活中的许多领域,如恶性肿瘤患者接受的放疗、职业性工作者经受的辐射性损害和航天飞行中人员受到的空间辐射等。辐射技术的高速发展带来收益的同时也不可避免地给人们造成了辐射损害。电离辐射对中枢神经系统发育的影响已成为国际放射防护委员会和联合国原子辐射效应科学委员会非常关注的重要内容[8]。如何减少辐射带来的损伤,保护人体的健康,已经成为辐射防护研究人员和相关预防医学工作者重要的研究课题[9]。
放射性的脑损伤是中枢神经系统或临近器官病变接受放疗后经过一段潜伏期,所产生的神经系统损伤疾病,是放射性治疗后最严重的并发症,常为进行性,甚至是致死性[10],目前仍没有有效的治疗手段。电离辐射引起生物活性分子的电离和激发是辐射生物效应的基础,一般来说,照射剂量越大,剂量率越高,效应越显著。近年来有研究发现,电离辐射损伤可以引起机体一些细胞因子、酶类和基因表达的改变[11],而一些分子的改变与机体的损伤程度和辐射剂量相关。本实验发现,X射线辐照PC12细胞后,随着辐照剂量的增加,细胞的损伤效应越严重,表现为释放过量的炎症因子,激活JAK-STAT信号通路。
辐射可以引起机体的炎症反应,这种炎症反应是通过自分泌或旁分泌产生的炎症细胞因子介导的,炎症因子是细胞对外界损伤刺激产生正常免疫反应的产物[12]。IL-1作为一种炎性介质参与中枢神经内分泌活动,通过下丘脑-垂体-肾上腺轴,调节垂体前叶细胞的生长。IL-1有2种结构不同的分子:IL-1α和IL-1β,而以IL-1β为主要的分泌形式。IL-1发挥生物学作用是通过与位于其靶细胞膜上的高亲和性受体结合来实现的,介导脑损伤后的许多病理生理反应,如发热、白细胞聚集、血管内皮渗透性增加等,从而与脑水肿的形成及颅内压的增高密切相关。正常情况下,脑组织中的IL-1活性较低,而在中枢神经系统的病理情况下,IL-1的活性则明显增高。有研究发现,辐射可诱导大鼠脑组织局部炎症因子IL-1β的明显升高[13]。IL-1还可诱导中枢神经系统中某些重要的神经毒性分子的释放,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6、IL-8等。其中,IL-6是炎症反应和机体免疫的多向性细胞因子[14],参与多种疾病的病理过程如免疫应答、急性期反应等,在不同组织中通过复杂的细胞信号传导途径,调节细胞增殖、分化和凋亡等[15]。有研究发现,IL-6参与中枢神经系统的神经炎症,调节许多重要的神经元和突触功能,包括突触传递和突触可塑性的细胞机制[16],其在正常中枢神经系统中低表达,在中枢神经系统感染和损伤时表达水平升高[17]。本实验发现,PC12细胞经X射线辐照后,辐照组IL-1β和IL-6的含量较未辐照组明显增加,且随着辐照剂量的增加,细胞释放的IL-1β和IL-6亦增加,炎症反应越严重。
此外,炎症反应可以同时激活细胞内多种不同的应激信号通路,并使其之间的平衡关系发生改变。JAK-STAT信号通路作为IL-6家族下游主要的信号转导通路,参与多种细胞因子诱导的信号转导,涉及细胞的生长、分化、炎症、突变和凋亡等多种神经功能[18]。以往JAK-STAT信号通路的研究主要集中在肿瘤、肝脏、造血系统、心血管系统。近年来研究发现,JAK-STAT参与神经炎症、神经退行性病变等神经系统疾病,在细胞损伤及应激状态下,JAK-STAT信号通路能被激活[19]。研究显示,炎症因子IL-6的上调可以激活STAT3的磷酸化[20],海马神经元细胞在炎症反应中出现促炎性细胞因子IL-6的升高,JAK1、STAT3和STAT5磷酸化的过表达[21]。与本实验的结果。
生命是一个复杂的系统,从分子水平的事件发展到可观察到的生物学效应,需要经历细胞、组织器官和系统等不同层次的信号传导、调节和放大,发生在任一层级的任何效应都要经历一个时间过程且受许多环境因素的影响和多维空间的调节。本实验发现,X射线辐照PC12细胞,诱导其释放过量的炎症因子IL-1β和IL-6,激活JAK-STAT信号通路的磷酸化,继而进一步启动损伤。炎症因子IL-1β、IL-6和JAK-STAT信号转导通路的异常激活,可能是电离辐射致神经系统损伤的机制之一。然而,JAK-STAT信号通路下游调控分子,JAK-STAT信号通路抑制剂是否对辐射损伤有效,以及JAK-STAT是否与其它信号通路共同调控辐射致神经系统损伤机制还有待更深入的研究。
[1] Balentova S, Adamkov M. Molecular, cellular, and functional effects of radiation-induced brain injury:a review[J]. Int J Mol Sci, 2015, 16(11):27796-27815.
[2] Burns TC, Awad AJ, Li MD, et al. Radiation-induced brain injury: low-hanging fruit for neuroregeneration[J]. Neurosurg Focus, 2016, 40(5):E3.
[3] Acharya MM, Baulch JE, Lusardi TA, et al. Adenosine kinase inhibition protects against cranial radiation-induced cognitive dysfunction[J]. Front Mol Neurosci, 2016, 9:42.
[4] Dong X, Luo M, Huang G, et al. Relationship between irradiation-induced neuro-inflammatory environments and impaired cognitive function in the developing brain of mice[J]. Int J Radiat Biol, 2015, 91(3):224-239.
[5] O’Shea JJ, Plenge R. JAK and STAT signaling molecules in immunoregulation and immune-mediated disease[J]. Immunity, 2012, 36(4):542-550.
[6] Benveniste EN, Liu Y, McFarland BC, et al. Involvement of the Janus kinase/signal transducer and activator of transcription signaling pathway in multiple sclerosis and the animal model of experimental autoimmune encephalomyelitis[J]. J Interferon Cytokine Res, 2014, 34(8):577-588.
[7] Liu Y, Gibson SA, Benveniste EN, et al. Opportunities for translation from the bench: therapeutic intervention of the JAK/STAT pathway in neuroinflammatory diseases[J]. Crit Rev Immunol, 2015, 35(6):505-527.
[8] Leuraud K, Richardson DB, Cardis E, et al. Ionising radiation and risk of death from leukaemia and lymphoma in radiation-monitored workers (INWORKS): an international cohort study[J]. Lancet Haematol, 2015, 2(7):e276-e281.
[9] Williams JP, Calvi L, Chakkalakal JV, et al. Addressing the symptoms or fixing the problem?Developing countermeasures against normal tissue radiation injury[J]. Radiat Res, 2016, 186(1):1-16.
[10]Kohutek ZA, Yamada Y, Chan TA, et al. Long-term risk of radionecrosis and imaging changes after stereotactic radiosurgery for brain metastases[J]. J Neurooncol, 2015, 125(1):149-156.
[11]Acharya MM, Green KN, Allen BD, et al. Elimination of microglia improves cognitive function following cranial irradiation[J]. Sci Rep, 2016, 6:31545.
[12]Mancilla-Herrera I, Alvarado-Moreno JA, Cérbulo-Vázquez A, et al. Activated endothelial cells limit inflammatory response, but increase chemoattractant potential and bacterial clearance by human monocytes[J]. Cell Biol Int, 2015, 39(6):721-732.
[13]Lee WH, Sonntag WE, Mitschelen M, et al. Irradiation induced regionally specific alterations in pro-inflammatory environments in rat brain[J]. Int J Radiat Biol, 2010, 86(2):132-144.
[14]Ishihara K, Hirano T. IL-6 in autoimmune disease and chronic inflammatory proliferative disease[J]. Cytokine Growth Factor Rev, 2002, 13(4-5):357-368.
[15]Donegan JJ, Girotti M, Weinberg MS, et al. A novel role for brain interleukin-6: facilitation of cognitive flexibility in rat orbitofrontal cortex[J]. J Neurosci, 2014, 34(3):953-962.
[16]Gruol DL. IL-6 regulation of synaptic function in the CNS[J]. Neuropharmacology, 2015, 96(Pt A):42-54.
[17]Campbell IL, Erta M, Lim SL, et al. Trans-signaling is a dominant mechanism for the pathogenic actions of interleukin-6 in the brain[J]. J Neurosci, 2014, 34(7):2503-2513.
[18]Duan W, Yang Y, Yan J, et al. The effects of eurcumin post-treatment against myocardial isehemia and reperfasion by activation of the JAK2/STAT3 signaling pathway[J]. Basic Res Cardiol, 2012, 107(3):263.
[19]Nicolas CS, Amici M, Bortolotto ZA, et al. The role of JAK-STAT signaling within the CNS[J]. JAKSTAT, 2013, 2(1):e22925.
[20]Hao Y, Jing H, Zhang J, et al. Intra-amygdala microinfusion of IL-6 impairs the auditory fear conditioning of rats via JAK/STAT activation[J]. Behav Brain Res, 2014, 275:88-95.
[21]Manickam M, Tulsawani R. Survival response of hippocampal neurons under low oxygen conditions induced byHippophaerhamnoidesis associated with JAK/STAT signaling[J]. PLoS One, 2014, 92(2):e87694.
(责任编辑: 林白霜, 罗 森)
Effects of JAK-STAT signaling pathway, IL-1β and IL-6 on injury of PC12 cells with X-ray irradiation
YU Jing, ZHANG Yi, DIAO Bo
(DepartmentofMedicalExperiments,WuhanGeneralHospitalofChinesePeople’sLiberationArmy,Wuhan430070,China.E-mail:fish0826@163.com)
AIM: To investigate the role of JAK-STAT pathway, IL-1β and IL-6 in the PC12 cells with X-ray irradiation.METHODS: The PC12 cells were irradiated with X-ray at doses of 2, 4 and 8 Gy. After 24 h, the levels of IL-1β and IL-6 were detected by ELISA. The protein levels of p-JAK1, p-JAK2, p-STAT1, p-STAT3 and p-STAT5 were measured by Western blot.RESULTS: Compared with control group, the levels of IL-1β and IL-6 increased. The protein levels of p-JAK1, p-JAK2, p-STAT1, p-STAT3 and p-STAT5 increased with the doses of X-ray exposed.CONCLUSION: JAK-STAT signaling pathway, IL-1β and IL-6 play a role in the injury of PC12 cells with X-ray irradiation.
X-ray; PC12 cells; JAK-STAT signaling pathway; IL-1β; IL-6
1000- 4718(2017)01- 0174- 05
2015- 07- 27
2016- 03- 11
R363
A
10.3969/j.issn.1000- 4718.2017.01.030
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 027-50772965; E-mail: fish0826@163.com
