miRNA-181a对多发性骨髓瘤细胞增殖和迁移的作用*
2017-01-19张艳丽欧阳桂芳牧启田盛立霞
严 笑, 张艳丽, 欧阳桂芳, 牧启田, 盛立霞
(宁波市第一医院血液科, 浙江 宁波 315000)
miRNA-181a对多发性骨髓瘤细胞增殖和迁移的作用*
严 笑, 张艳丽△, 欧阳桂芳, 牧启田, 盛立霞
(宁波市第一医院血液科, 浙江 宁波 315000)
目的: 通过沉默人多发性骨髓瘤细胞株RPMI8226中miRNA-181a的表达,观察RPMI8226细胞的增殖、迁移和细胞周期的变化,并探讨其可能的作用机制。方法: 实时荧光定量PCR检测多发性骨髓瘤患者和健康者血清标本中miRNA-181a的表达水平;转染miRNA-181a inhibitor后,CCK-8法与集落形成实验检测细胞的增殖能力,划痕实验检测细胞的迁移能力,流式细胞术检测细胞的周期变化,Western blot法检测cyclin D1、p-PI3K和p-Akt蛋白水平的变化。结果: 多发性骨髓瘤患者血清中miRNA-181a呈高表达,显著高于正常人;转染miRNA-181a inhibitor后,RPMI8226细胞的存活率和集落形成能力下降,迁移能力降低,G0/G1期细胞比例明显减少,S期细胞比例增多,cyclin D1蛋白表达显著低于正常对照组, PI3K和Akt的磷酸化水平明显低于正常对照组。结论: 沉默miRNA-181a的表达能够抑制RPMI8226细胞的增殖,并降低细胞的迁移能力,可能与细胞周期及PI3K/Akt信号通路有关。
miRNA-181a; 多发性骨髓瘤; 细胞周期
多发性骨髓瘤(multiple myeloma,MM)是一种来源于浆细胞的血液系统恶性肿瘤,患者的骨髓中克隆性浆细胞出现异常增生,临床主要表现为贫血、肾功能损害,骨损伤以及反复感染等[1]。多发性骨髓瘤占所有肿瘤发生率的1%[2],在全部血液系统恶性肿瘤中占12%~15%,并随年龄增长而发病率逐渐增多,好发于60岁以上的老年人[3-4]。
微小RNA(microRNA,miRNA)是一类长度约22个碱基的非编码RNA,根据靶基因的作用不同在调控肿瘤发生发展时具有癌基因或抑癌基因的作用。近年来研究表明,某些miRNA在小鼠和人的胎盘组织中呈高表达[5]。miRNA-181a是miRNA-181家族成员之一,研究发现其在肿瘤和自身免疫疾病方面的表达异常,引起细胞功能障碍[6]。本实验拟通过沉默miRNA-181a对人多发性骨髓瘤细胞株RPMI8226增殖和迁移能力的影响,探讨miRNA-181a的表达是否能为多发性骨髓瘤的临床治疗具有指导意义。
材 料 和 方 法
1 实验材料
22例多发性骨髓瘤患者血清标本和26例健康者血清标本来自宁波市第一医院血液科。人来源多发性骨髓瘤细胞株RPMI8226(中国医学科学院肿瘤细胞库);胎牛血清(Gibco);CCK-8试剂盒(武汉博士德生物工程有限公司);LipofectamineTM2000(Invitrogen);miRNA-181a inhibitor(上海吉玛制药技术有限公司);抗cyclin D1(Santa Cruz)、p-PI3K和p-Akt抗体(Cell Signaling Technology)。
2 方法
2.1 细胞复苏与传代 将人多发性骨髓瘤细胞株RPMI8226置于37 ℃水浴箱中快速融化,加入含10%胎牛血清的RPMI-1640培养液10 mL,800 r/min离心5 min,弃去上清,重悬后将细胞加入RPMI-1640培养基中,置于37 ℃、5% CO2培养箱中培养,待细胞融合至约80%~90%时传代。
2.2 实验分组与细胞转染 实验随机分为3组:正常对照(control)组、miRNA-181a inhibitor阴性对照组(NC inhibitor组)和转染miRNA-181a inhibitor组。在转染前1 d,用0.25%胰酶消化RPMI8226细胞,接种于48孔板中,培养24 h后,加入无血清培养液继续培养1 h,按照LipofectamineTM2000转染试剂盒说明书操作,转染miRNA-181a inhibitor,4 h后更换新鲜含10%胎牛血清的培养液,继续培养48 h。
2.3 实时荧光定量PCR检测miRNA-181a的表达 严格按照TRIzol说明书进行操作,提取细胞总RNA,进行蛋白定量后,逆转录合成cDNA,用PCR仪扩增,反应条件为:92 ℃ 35 s, 63 ℃ 35 s, 72 ℃ 45 s,共32个循环;72 ℃ 10 min。miRNA-181a的上游引物为5’-GCGGTAACATTCAACGCTGTCG-3’,下游引物为5’-GTGCAGGGTCCGAGGT-3’;内参照U6的上游引物为5’-CGCTTCGGCAGCACATATA-3’,下游引物为5’-TTCACGAATTTGCGTGTCAT-3’。实验结果在荧光定量操作系统中进行分析对比,采用2-ΔΔCt对miRNA-181a的表达进行相对定量。
2.4 CCK-8法和集落形成实验检测细胞的增殖能力 收集对数生长期的多发性骨髓瘤细胞RPMI8226,用无血清的RPMI-1640培养液重悬,调整密度约为每孔1×105个,接种于96孔板,放置在37 ℃、5% CO2培养箱孵育,并于12 h、24 h、36 h和48 h时分别取各时段的细胞,加入10 μL CCK-8溶液,37 ℃孵育3~4 h,于450 nm波长处用酶标仪测定的吸光度(A)值,计算细胞存活率。存活率(%)=实验组A值/空白组A值×100%。
收集处于对数生长期的细胞集落形成实验,重悬成单个细胞,调整细胞密度为1×108/L,接种于24孔板中继续培养,每孔加入4 mL含20%胎牛血清的DMEM培养液,置于37 ℃、5% CO2培养箱继续培养,出现肉眼可见的集落,弃去培养液,PBS洗涤,加入5 mL甲醇固定15 min,加入吉姆萨溶液染色20 min,自来水冲洗,晾干,计算集落形成率。集落形成率(%)=集落形成数/接种细胞数×100%。
2.5 划痕实验 收集各组细胞,以5×108/L密度接种于96孔板中,待细胞融合约90%,用枪头沿着与皿底垂直方向划痕,PBS洗细胞3次,加入无血清培养基,放置在37 ℃、5% CO2培养箱培养24 h后,观察细胞迁移轨迹,拍照记录。
2.6 细胞周期的测定 收集各组对数生长期细胞,用预冷PBS缓冲液洗涤2次,弃去PBS,用预冷70%乙醇溶液重悬细胞,4 ℃固定过夜,离心收集细胞,PBS洗涤2次,加入100 mg/L RNase A于37 ℃水浴30 min,加入含50 mg/L碘化丙啶溶液的PBS溶液500 μL,4 ℃避光孵育30 min,在流式细胞仪检测细胞周期。
2.7 Western blot实验 细胞处理48 h后,收集各组细胞,加入裂解液,收集蛋白并调整蛋白浓度,后加入上样缓冲液,上样并通过SDS-PAGE分离蛋白,转膜,加入封闭液封闭1 h,分别孵育相应Ⅰ抗[cyclin D1(1∶1 000)、p-PI3K(1∶1 000)、PI3K(1∶4 000)、p-Akt(1∶1 000)和Akt(1∶1 000)],4 ℃孵育过夜,洗涤3次,再次加入相应Ⅱ抗,室温孵育30 min,化学发光法显色,成像扫描分析系统保存图像。灰度值采用ImageJ扫描并记录。其中p-PI3K/PI3K和p-Akt/Akt后的相对变化量,表示磷酸化水平变化。
3 统计学处理
所有实验结果采用SPSS 15.0统计软件进行分析,实验结果以均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验,多组定量数据符合方差齐性要求采用单因素方差分析,各组均数间均数的两两比较采用Bonferroni校正的t检验, 以P<0.05为差异有统计学意义。
结 果
1 多发性骨髓瘤患者血清标本miRNA-181a的表达
多发性骨髓瘤患者血清中miRNA-181a的表达水平显著高于正常血清标本(P<0.05),提示mi-RNA-181a在多发性骨髓瘤患者血清中呈高表达。
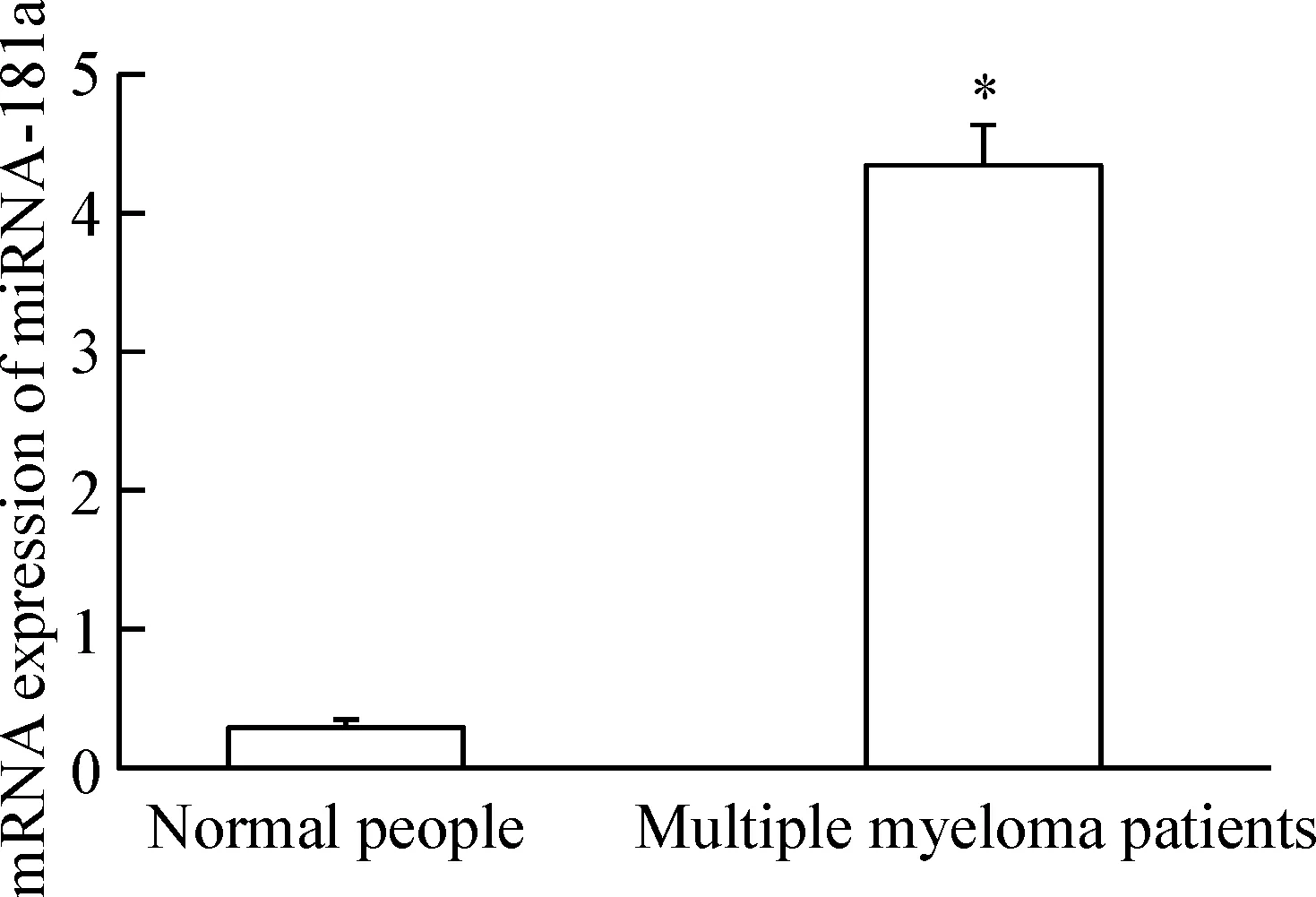
Figure 1.The mRNA expression levels of miRNA-181a in serum from normal people (n=26) and multiple myeloma patients (n=22). Mean±SD.*P<0.05vsnormal people.
图1 正常人与骨髓瘤患者血清中miRNA-181a的表达
2 沉默miRNA-181a对RPMI8226细胞增殖能力的影响
MTT实验结果显示,正常对照组的RPMI8226细胞随时间增加存活率迅速增加;转染miRNA-181a inhibitor后,RPMI8226细胞的存活率随时间增加的幅度显著低于正常对照组(P<0.05);正常对照组与阴性对照组间差异无统计学显著性,见图2。平板集落形成实验的结果显示,与正常对照组相比,沉默miRNA-181a后,细胞的集落形成能力明显降低,差异具有统计学意义(P<0.05),见图3。
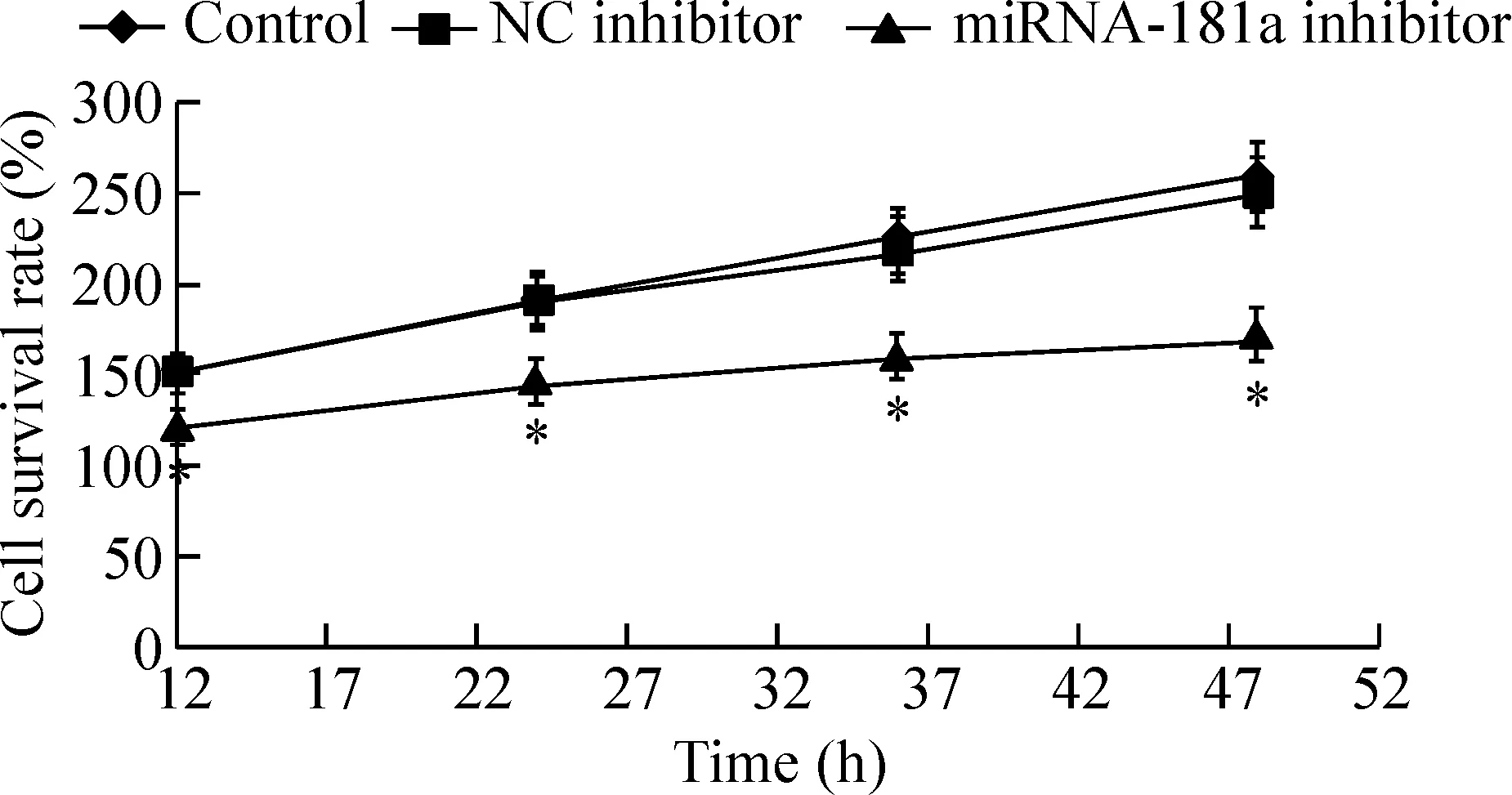
Figure 2. The effect of inhibition of miRNA-181a expression on the viability of RPMI8226 cells. Mean±SD.n=3.*P<0.05vscontrol.
图2 沉默miRNA-181a对细胞存活率的影响
3 沉默miRNA-181a对RPMI8226细胞迁移能力的影响
划痕实验结果显示,与正常对照组相比,转染miRNA-181a inhibitor后,RPMI8226细胞的迁移能力显著降低(P<0.05),而正常对照组与阴性对照组的差异无统计学显著性,见图4。
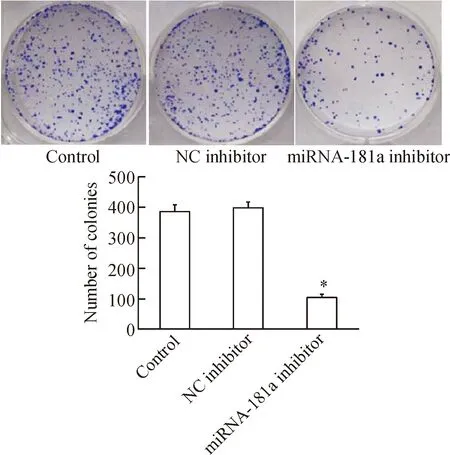
Figure 3.The effect of inhibition of miRNA-181a expression on the colony formation ability of RPMI8226 cells. Mean±SD.n=3.*P<0.05vscontrol.
图3 沉默miRNA-181a对RPMI8226细胞集落形成能力的影响
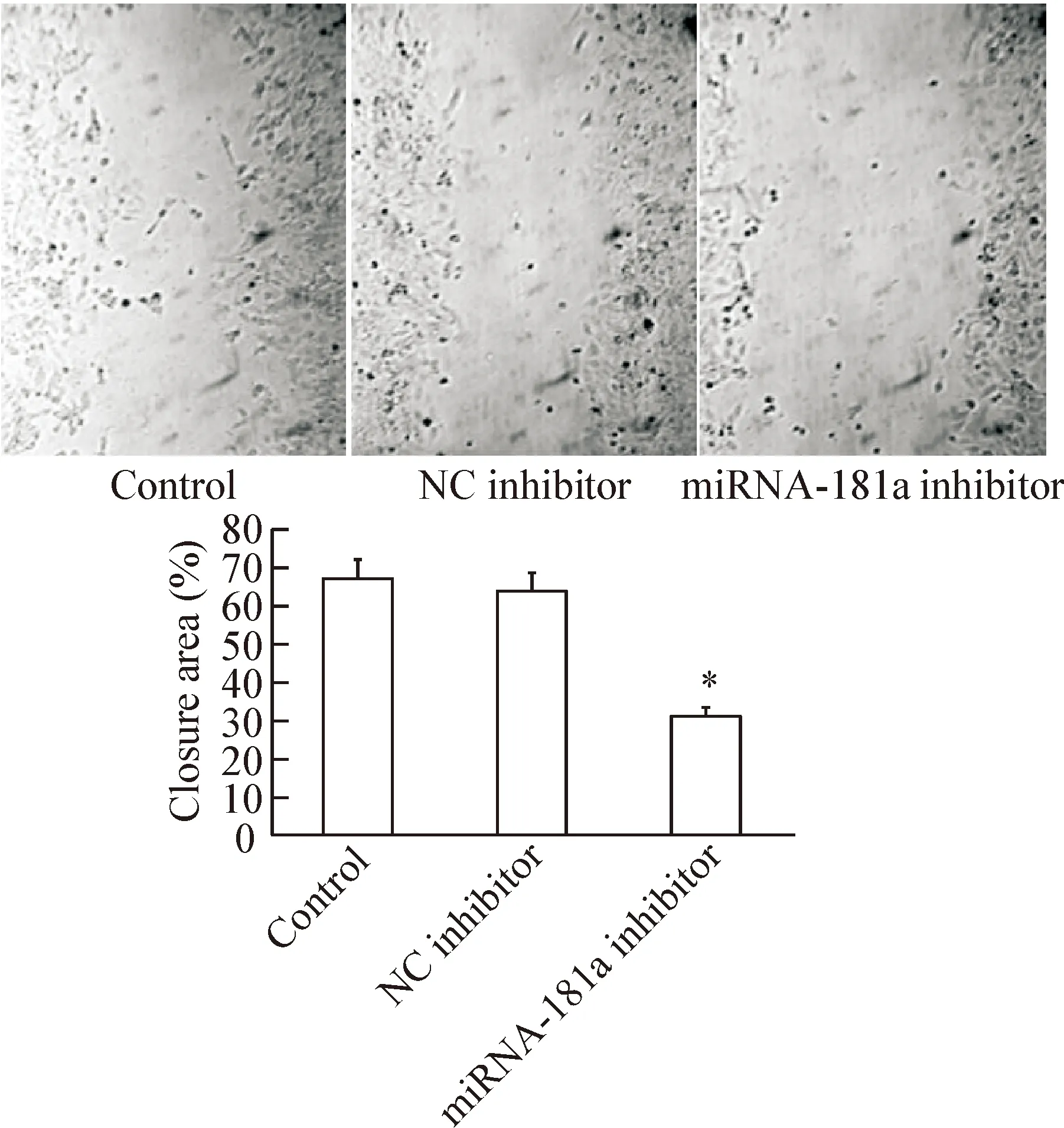
Figure 4. The effect of inhibition of miRNA-181a expression on the migratory ability of RPMI8226 cells. Mean±SD.n=3.*P<0.05vscontrol.
图4 沉默miRNA-181a对RPMI8226细胞迁移能力的影响
4 沉默miRNA-181a对RPMI8226细胞周期的影响
如图5所示,转染miRNA-181a inhibitor后,G0/G1期细胞的比例明显减少,S期的细胞比例显著大于正常对照组(P<0.05),正常对照组与阴性对照组的细胞各周期比例无显著差异。
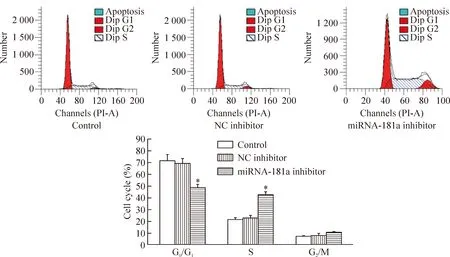
Figure 5.The change of cell cycle in RPMI8226 cells. Mean±SD.n=3.*P<0.05vscontrol.
图5 沉默miRNA-181a对RPMI8226细胞周期变化的影响
5 沉默miRNA-181a对cyclin D1蛋白表达的影响
如图6所示,与正常对照组相比,转染miRNA-181a inhibitor后,RPMI8226细胞的cyclin D1蛋白表达显著下降(P<0.05),正常对照组与阴性对照组间的差异无统计学显著性。
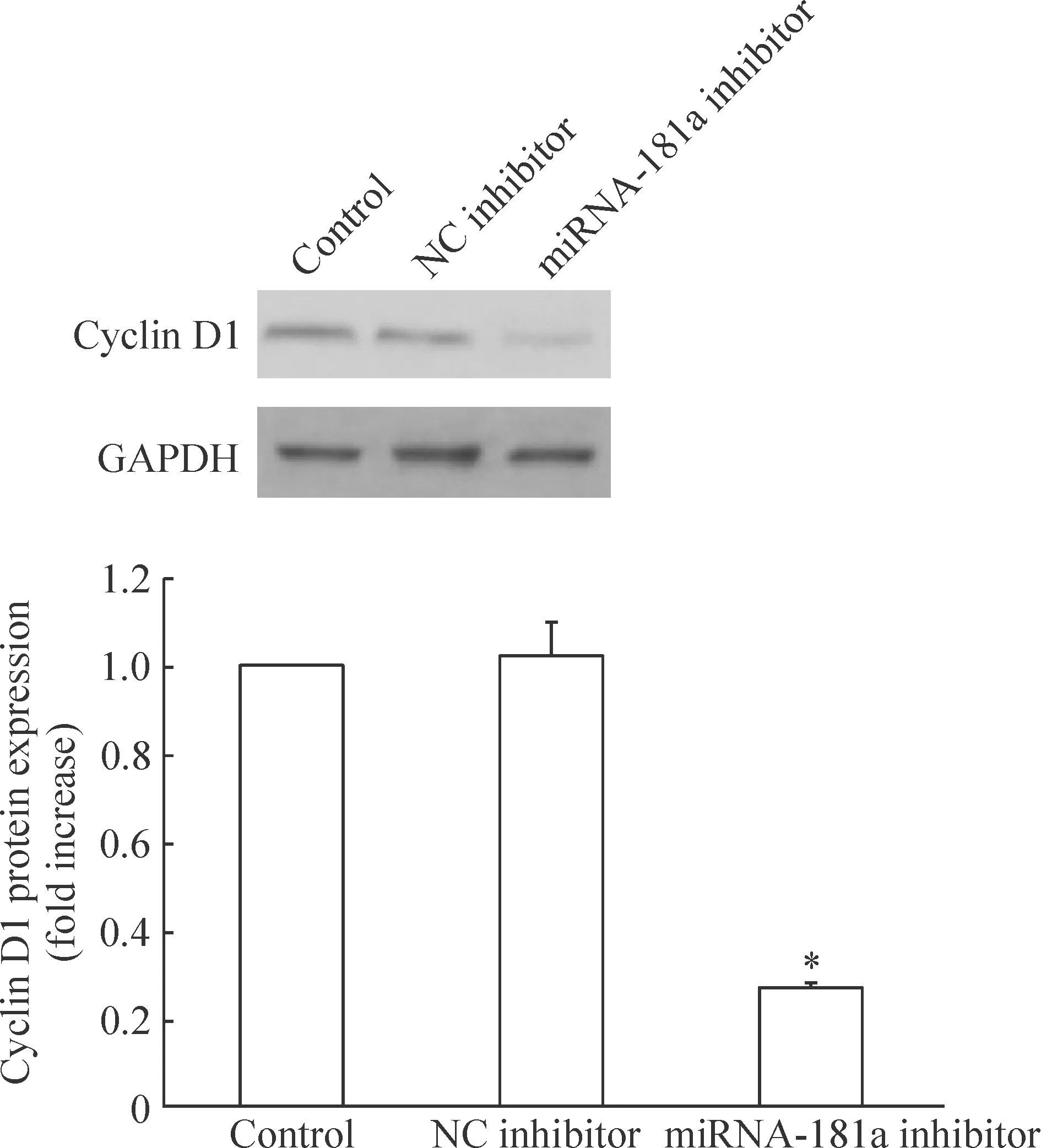
Figure 6.The effect of inhibition of miRNA-181a expression on the protein expression of cyclin D1 in RPMI8226 cells. Mean±SD.n=3.*P<0.05vscontrol.
图6 沉默miRNA-181a对RPMI8226细胞cyclin D1蛋白表达的影响
6 沉默miRNA-181a对PI3K和Akt磷酸化水平的影响
如图7所示,与正常对照组相比,转染miRNA-181a inhibitor后RPMI8226细胞p-PI3K/PI3K和p-Akt/Akt的水平均显著降低,说明沉默miRNA-181a降低PI3K和Akt的磷酸化水平(P<0.05),正常对照组与阴性对照组间的差异无统计学显著性。
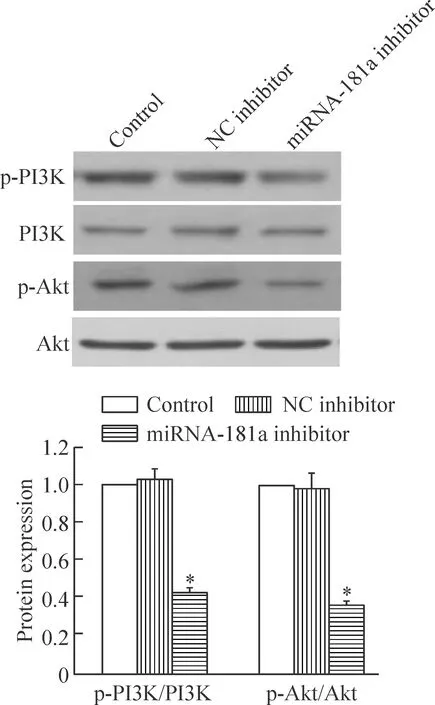
Figure 7.The effect of inhibition of miRNA-181a expression on the phosphorylation of PI3K and Akt. Mean±SD.n=3.*P<0.05vscontrol.
图7 沉默miRNA-181a对RPMI8226细胞p-PI3K和p-Akt磷酸化水平的影响
讨 论
细胞周期是细胞生命活动的基本过程,主要分为G0/G1期、S期、G2期和M期4个时相,其中S期是DNA合成期,G1期和G2期分别是合成前期与合成后期。Cyclin D是细胞周期进程的启动因子,是调节细胞周期的因子之一,当cyclin D的活性被抑制后,细胞将不能进入细胞周期,导致细胞发生异常增殖或诱发肿瘤。研究发现,cyclin D1在肿瘤细胞的G1期表达增多,而在正常细胞中呈低表达或不表达[7]。另外,cyclin D1参与调控G1-S期的转换以及S-G2期的转换,研究发现cyclin D1在HeLa细胞株PRAD21整个细胞周期中呈高表达,提示cyclin D1在癌细胞增殖的过程中可能发挥重要的作用[8]。我们研究发现,可能是由于cyclin D1本来在RPMI8226细胞中表达较高,当沉默miRNA-181a后,并没有引起多发性骨髓瘤细胞株RPMI8226 G1期的阻滞,而引起S期的阻滞,推测是沉默miRNA-181a引起了S-G2期转换的障碍,DNA合成被抑制,从而抑制细胞的增殖。
PI3K/Akt信号通路在细胞周期的调控、血管生成和细胞代谢等方面具有重要作用[9],Akt的磷酸化是PI3K/Akt信号通路在肿瘤发生的关键,射线、辐射和细胞毒性的药物均可激活PI3K/Akt信号通路,使得肿瘤细胞产生应激调节。Akt处于PI3K/Akt信号通路的核心位置,通过激活下游底物,从而抑制细胞凋亡,调控细胞周期以及促进血管形成[10]。此外,研究发现使用PI3K/Akt抑制剂能够抑制SDF-1α和bFGF诱导的间充质干细胞的迁移[11]。细胞迁移需要微管介导的细胞体收缩与伸展的一系列过程,PI3K/Akt信号通路影响多种肿瘤细胞的细胞结构,过表达PI3K/Akt信号通路下游分子核糖体蛋白S6激酶后,会促进卵巢癌细胞定向迁移[12]。我们研究发现,沉默miRNA-181a后,RPMI8226细胞p-PI3K和p-Akt的蛋白水平显著下降,提示沉默miRNA-181a可能通过抑制PI3K/Akt信号通路,从而抑制细胞的增殖与迁移。
本研究表明,miRNA-181a的表达对多发性骨髓瘤的诊断具有提示作用,对于指导临床治疗方面具有参考意义。
[1] Palumbo A, Anderson K. Multiple myeloma[J]. N Engl J Med, 2011, 364(11):1046-1060.
[2] Siegel R, Ward E, Brawley O. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J]. CA Cancer J Clin, 2011, 61(4):212-236.
[3] Kyle RA, Therneau TM, Rajkumar SV, et al. Incidence of multiple myeloma in Olmsted County, Minnesota: trend over 6 decades[J]. Cancer, 2004, 101(11):2667-2674.
[4] Spitzer TR, Sachs DH, Cosimi B. Multiple myeloma[J]. N Engl J Med, 2011, 364(24):2364.
[5] Seitz H, Royo H, Bortolin ML. A large imprinted microRNA gene cluster at the mouse Dlk1-Gtl2 domain[J]. Genome Res, 2004, 14(9):1741-1748.
[6] Lashine YA, Seoudi AM, Salah S, et al. Expression signature of microRNA-181-a reveals its crucial role in the pathogenesis of paediatric systemic lupus erythematosus[J]. Clin Exp Rheumatol, 2010, 29(2):351-357.
[7] 李 峰, 陈临溪. 细胞周期蛋白D与细胞周期调控研究进展[J]. 国外医学:生理、病理科学与临床分册,2005, 25(3):270-273.
[8] Li C, Li X, Chen W, et al. The different roles of cyclinD1-CDK4 in STP and mGluR-LTD during the postnatal development in mice hippocampus area CA1[J]. BMC Dev Biol, 2007, 7:57.
[9] 王和峰, 翟纯刚, 庞文会, 等. PI3K/Akt/mTOR信号通路在巨噬细胞自噬及动脉粥样硬化斑块不稳定中的作用[J]. 中国病理生理杂志,2013,29(3):390-397.
[10]Kang S, Dong SM, Kim BR, et al. Thioridazine induces apoptosis by targeting the PI3K/Akt/mTOR pathway in cervical and endometrial cancer cells[J]. Apoptosis, 2012, 17(9):989-997.
[11]Liu H, Xue W, Ge G, et al. Hypoxic preconditioning advances CXCR4 and CXCR7 expression by activating HIF-1α in MSCs[J]. Biochem Biophys Res Commun, 2010, 401(4):509-515.
[12]Ip CK, Cheung AN, Ngan HY, et al. P70 S6 kinase in the control of actin cytoskeleton dynamics and directed migration of ovarian cancer cells[J]. Oncogene, 2011, 30(21):2420-2432.
(责任编辑: 陈妙玲, 罗 森)
Effects of miRNA-181a on proliferation and migration of multiple myeloma cells
YAN Xiao, ZHANG Yan-li, OUYANG Gui-fang, MU Qi-tian, SHENG Li-xia
(DepartmentofHematology,NingboFirstHospital,Ningbo315000,China.E-mail:zhangyanlimd@126.com)
AIM: To investigate the effect of miRNA-181a inhibition on the proliferation, migration and cell cycle of the human multiple myeloma cell line RPMI8226. METHODS: Real-time PCR was used to detect miRNA-181a expression in serum samples from multiple myeloma or healthy subjects. After transfection with miRNA-181a inhibitor, the cell viability was examined by CCK-8 assay and colony formation assay. The cell migration ability was analyzed by wound healing assay. The cell cycle was detected by flow cytometry. Moreover, the protein level of cyclin D1 and the phosphorylation of PI3K and Akt were determined by Western blot. RESULTS: The expression of miRNA-181a was significantly increased in the serum from multiple myeloma patients as compared with healthy group. Inhibition of miRNA-181a expression by transfection with miRNA-181a inhibitor remarkably decreased the cell viability, migratory ability, the population of G0/G1phase and cyclin D1 protein expression in the RPMI8226 cells. However, the population of S phase and the phosphory-lation of PI3K and Akt were reduced. CONCLUSION: Down-regulation of miRNA-181a inhibits the viability and migratory ability in the RPMI8226 cells via inhibition of cell cycle and PI3K/Akt signaling pathway.
miRNA-181a; Multiple myeloma; Cell cycle
1000- 4718(2017)01- 0033- 05
2016- 07- 18
2016- 11- 04
宁波市自然科学基金资助项目 (No. 2012A610202)
R363.1
A
10.3969/j.issn.1000- 4718.2017.01.006
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0574-87085591; E-mail: zhangyanlimd@126.com
