食用柠檬酸—醇析法提取秋葵果胶的工艺优化※
2017-01-18袁乙平辛松林任宣姿
袁乙平 辛松林 任宣姿 韩 萌
(四川旅游学院,四川 成都 610100)
食用柠檬酸—醇析法提取秋葵果胶的工艺优化※
袁乙平 辛松林 任宣姿 韩 萌
(四川旅游学院,四川 成都 610100)
以黄秋葵作为试验对象,研究并优化用柠檬酸—醇析法提取秋葵果胶的工艺条件。实验研究了不同质量分数的柠檬酸、不同体积分数的乙醇、不同温度、不同水浴时间、不同超声波功率对秋葵果胶提取得率的影响,并在此基础上进行正交试验,结果表明最佳的提取条件为:柠檬酸与秋葵原料质量比为8%,乙醇体积分数为95%,温度为80℃,超声波功率为120W,秋葵果胶提取率为18.57%。
黄秋葵;果胶;食用柠檬酸;提取;正交实验
果胶是植物中的一种酸性多糖物质,具有良好的增稠、胶凝化、乳化稳定性,其用途十分广泛。在食品工业中,果胶可作为果浆、果冻、糖果、冰激凌、果汁以及乳品的稳定剂、蛋黄乳化剂和增稠剂[1]。当前,我国商品化果胶产品主要是苹果果胶和柑橘果胶[2]。2006—2015年,四川省植物工程研究院引种非洲黄秋葵成功,并从中选育出适合四川省栽培的黄秋葵新品种——川秋葵1号[3]。研究表明,秋葵嫩果中果胶含约24.8%[4],果胶含量丰富。
本实验采用柠檬酸-醇析法从秋葵中提取果胶,探讨了食用柠檬酸质量分数、乙醇体积分数、水浴温度、水浴时间、超声波功率五个因素对秋葵果胶提取得率的影响,采用单因素试验与正交试验设计,确定了秋葵果胶提取的最佳工艺条件。
1 实验材料与方法
1.1 材料与试剂
黄秋葵,由四川省植物工程研究院提供;食用柠檬酸(潍坊英轩实业有限公司);95%乙醇(成都市科龙试剂化工厂);所用其他试剂均为分析纯。
1.2 实验仪器及设备
1G909CCC型组织捣碎机(美国Hamilton Beach);GL-22MC型离心机(湖南仪器仪表总厂);FAUO4N电子天平(0.01g)(常州市横正电子仪器有限公司)。
1.3 试验方法
1.3.1 黄秋葵果胶的制备工艺
称取黄秋葵嫩果50g,80℃灭酶15s,水洗3~4次去色素和糖分,加入适量的水,用组织捣碎机捣碎。用不同提取条件提取果胶后,将提取液过滤,弃去滤渣。待滤液冷却至室温后,加入等体积的乙醇,一边添加乙醇一边搅拌,充分反应后静置30min,待果胶沉淀析出后离心(6000r/min,10min,4℃),洗涤残渣2次[5],滤液合并后浓缩弃上清液,下层即果胶。
取一恒质量空皿,将过滤后的湿果胶倒入其中,放于鼓风干燥箱恒温60℃烘干至样品恒质量得到成品[6]。

1.3.2 乙醇体积分数对果胶提取率的影响试验
黄秋葵果胶制备工艺同1.3.1,考察不同体积分数的乙醇对秋葵果胶提取率的影响。称取黄秋葵50g,8%柠檬酸提取果胶,80℃水浴1h,滤液分别加入等体积的55%、65%、75%、85%、95%的乙醇,静置30min,待果胶沉淀析出后离心(6000r/min,10min,4℃),下层即果胶。
1.3.3 柠檬酸的含量对果胶提取率的影响试验
黄秋葵果胶制备工艺同1.3.1,考察不同质量分数的柠檬酸对秋葵果胶提取率的影响。称取黄秋葵50g,分别采用4%、6%、8%、10%、12%的柠檬酸提取果胶,80℃水浴1h,滤液加入等体积的95%乙醇,静置30min,待果胶沉淀析出后离心(6000r/min,10min,4℃),下层即果胶。
1.3.4 水浴温度对果胶提取率的影响试验
黄秋葵果胶制备工艺同1.3.1,考察不同水浴温度对秋葵果胶提取率的影响。称取黄秋葵50g,8%柠檬酸提取果胶,分别采用50℃、60℃、70℃、80℃、90℃水浴1h,滤液加入等体积95%的乙醇,静置30min,待果胶沉淀析出后离心(6000r/min,10min,4℃),下层即果胶。
1.3.5 水浴时间对果胶提取率的影响试验
黄秋葵果胶制备工艺同1.3.1,考察不同水浴时间对秋葵果胶提取率的影响。称取黄秋葵50g,8%柠檬酸提取果胶,80℃水浴20min、35min、50min、65min、80min,滤液加入等体积95%的乙醇,静置30min,待果胶沉淀析出后离心(6000r/min,10min,4℃),下层即果胶。
1.3.6 超声波功率对果胶提取率的影响试验
黄秋葵果胶制备工艺同1.3.1,考察不同超声波功率对秋葵果胶提取率的影响。称取黄秋葵50g,8%柠檬酸提取果胶,80℃水浴1h,采用不同超声波功率90W、105W、120W、135W、150W超声20min,滤液加入等体积的95%的乙醇,静置30min,待果胶沉淀析出后离心(6000r/min,10min,4℃),下层即果胶。
1.3.7 秋葵果胶提取正交试验
根据以上单因素试验结果,选取柠檬酸质量分数、乙醇体积分数、温度、超声波频率4个单因素进行L9(34)正交试验,确定提取秋葵果胶的最佳工艺条件。如表1所示。

表1 正交实验因素水平表
1.3.8 数据分析
所有试验均重复3次,用SAS 9.0统计软件进行分析。
2 结果与分析
2.1 秋葵果胶提取率的单因素试验
由图1可知,秋葵果胶得率随着乙醇含量的增加而增加,当乙醇的体积分数达到95%时,果胶得率最高。果胶溶于有机溶剂乙醇,当用相同体积不同体积分数的乙醇沉淀果胶时,随着所用的乙醇体积分数的增加秋葵果胶得率也相应增加,有利于黄秋葵中的果胶充分沉淀,因而果胶产量不断提高。
由图2可知,当柠檬酸的用量为8%时,秋葵果胶提取率达到最大。若柠檬酸的含量过少,果胶在弱酸性环境中与H+作用的少,原果胶酸解速度慢,且果胶易发生酯的皂化和β-消除反应,降低了水溶性果胶的转化率[5]。若檬酸含量超过8%,提取液的酸度过低,果胶容易发生脱脂反应且在强酸环境下会造成果胶进一步分解,过滤时容易随溶液而滤掉,使产品的得率降低,此外在强酸性环境下会导致部分纤维素、半纤维素的分解,使秋葵果胶中己糖和戊糖的含量增加,果胶色泽加深,变成暗褐色,从而影响成品果胶品质[7]。
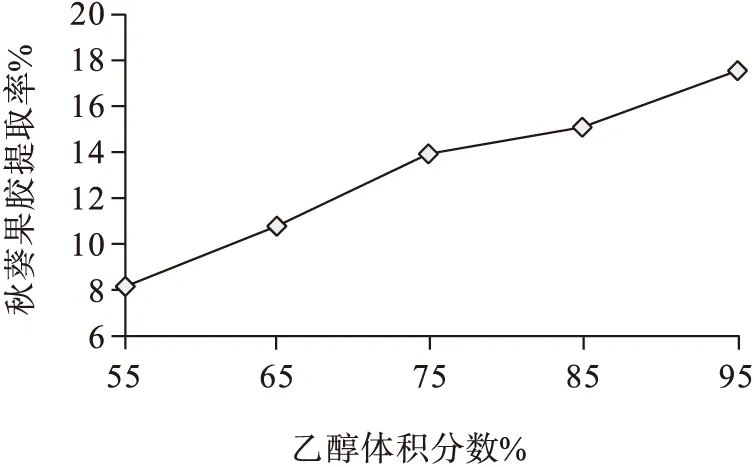
图1 乙醇体积分数对果胶提取率的影响

图2 柠檬酸含量对果胶提取率的影响
由图3可知,随着提取温度的升高,果胶得率增加,当温度达到80℃时,提取率最大,其可能原因是随着提取温度升高,分子热运动加快,果胶溶出速度加快。但温度高于80℃时,得率却降低,这是由于水浴温度过高会破坏溶于提取液的果胶的分子结构,导致果胶水解速度加快,降低果胶胶凝度,同时提取液蒸发也加剧,因此随着提取温度的继续升高,果胶得率下降[5,8]。
由图4可知,果胶产率随着水浴时间增加而增加,65min时得率最高,而当水浴时间的继续增加,果胶产率却降低。这是因为随着水浴浸提时间的延长,果胶充分水解溶于提取剂,果胶得率随之增加,在65min时达到最大值;随着时间的继续增加,果胶分子的甙键、酯键极易与提取剂中的酸作用,从而被破坏掉,所以长时间的提取会导致果胶降解、胶凝度下降,从而使果胶得率降低[9],因此当提取时间超过65min后,果胶得率呈现下降趋势。由此得出果胶提取的最佳时间应该控制在65min左右较为适宜。
如图5所示,当超声功率在90~120W之间时,随着超声功率的增加,秋葵细胞被破坏,细胞壁中的不溶性果胶水解成可溶性果胶溶于提取液中,果胶提取率也相应增加;当超声功率为120W时果胶提取率达到最大值,此时秋葵细胞壁被完全破碎,细胞壁中的果胶大量溶出,果胶质水解度达到最高。而当超声功率继续增加,果胶提取率却相应下降,其原因可能是因为超声功率过高时,秋葵中的果胶水解过于强烈,导致果胶脱脂降解,从而使果胶提取率下降[10]。因此,超声波的功率应该控制120W左右。

图3 水浴温度对果胶提取率的影响

图4 水浴时间对果胶提取率的影响

图5 超声波功率对果胶提取率的影响
2.2 正交试验优化秋葵果胶提取工艺
由表2可知,影响秋葵果胶提取率的主次因素分别为柠檬酸含量(A)>乙醇体积分数(C)>温度(B)>超声波功率(D)。综上试验结果,得出秋葵果胶制备最佳工艺条件为A2B2C3D2,即柠檬酸含量8%,乙醇体积分数95%,提取温度80℃,超声功率120W。但是由表2正交试验结果表明A2B2C3D1为最优工艺条件,因此需要进行验证试验。
通过3次重复性验证试验,采用A2B2C3D2工艺条件,此工艺条件下制备的秋葵果胶得率高达18.57%,而A2B2C3D1条件下制备的果胶提取率为17.78%,因此最优工艺条件为A2B2C3D2,即提取柠檬酸含量8%,乙醇体积分数95%,提取温度80℃,超声功率120W,在此提取条件下果胶得率为18.57%。

表2 L9(34)正交实验设计与结果分析
3 结论与讨论
采用食用柠檬酸、乙醇醇析法提取黄秋葵果胶的最佳条件为:柠檬酸与秋葵原料质量比为8%、萃取温度为80℃、乙醇的体积分数为95%、超声功率120W。在此条件下,黄秋葵的果胶提取率可达18.57%。
本实验表明用柠檬酸—乙醇醇析法从黄秋葵中提取果胶是一种有效的提取方法。此法提取的果胶,安全性较高,能够作为直接食用的果胶产品,可以作为增稠剂添加到各种食品和菜肴中,一方面提高菜肴黏稠、爽滑的口感,另一方面满足人们对于营养和保健的追求。此外,本方法提取的果胶具有质量好、工艺流程简单、污染性小等特点,且不需真空浓缩工艺,缩短工时,节约能源,使得成本大大降低,具有广阔的应用前景。
[1]王迪立,张鹰.柚皮果胶超声波辅助提取工艺及其鉴定[J].农产品加工,2015,4(4):36-39.
[2]叶昌华,卓明,韩菊兰,等.黄秋葵新品种“川秋葵1号”选育及栽培技术要点[J]. 南方农业,2015(34):44-45.
[3]海霞.黄秋葵花果胶类多糖的提取工艺及其性质的研究[D]. 杭州:浙江大学,2014.
[4]段红,曹稳根.果胶及其应用研究进展[J].宿州学院学报, 2006,21(6):80-83.
[5]阮尚全,程晓琴,夏旭,等.酶解—柠檬酸提取塔罗科血橙皮中的果胶及理化性质研究[J].食品工业技术,2016,37(4):313-317.
[6]王迪立,张鹰.柚皮果胶超声波辅助提取工艺及其鉴定[J].农产品加工,2015,4(4):36-39.
[7]岳贤田.超声波辅助提取桔子皮中果胶的研究[J] .河南化工,2010,27 (10):41-43.
[8]郑亚琴.沂州木瓜果胶提取工艺研究[J]. 食品科学,2008,11( 29) :361-364.
[9]李双石,李浡,张虎成,等.超声波提取条件对酿酒葡萄皮渣花色苷的影响[J] .食品工业科技,2013,34(18) :294-297.
[10]万国福,谷绒,唐会英. 超声波处理在果胶提取工艺中的应用[J].食品研究与开发,2006(7):122-125.
The Optimization of Pectin Extraction Process from Okra Fruit with Edible Citric Acid via Alcohol Precipitation Method
YUAN Yiping XIN Songlin REN Xuanzi HAN Meng
(Sichuan Tourism University, Chengdu 610100, Sichuan, China)
The purpose of this study was to improve the extraction techniques of pectin in the fruit of okra by alcohol precipitation method. The effects on extraction rate of different experimental conditions, including different mass fraction of edible citric acid, different volume fraction of ethanol, different temperature, different time of water bath and different power of ultrasonic, were compared in depth. In addition, the orthogonal experiment design was applied to achieve the best condition. The findings suggest that the pectin extraction rate was up to 18.57% under the optimal experimental conditions where the edible citric acid-to-okra fruit mass ratio is 8%, the volume fraction of ethanol is 95%, the temperature is 80℃ and the power of ultrasonic is 120W.
okra; pectin; edible citric acid; extract; orthogonal experiment
本文为四川省哲学社会科学重点研究基地——川菜发展研究中心项目“黄秋葵果胶提取物在川菜特色复合调味品加工中的应用”的阶段性成果,项目编号:CC15Z05。
袁乙平(1993—),女,四川宜宾人,四川旅游学院食品学院2013级本科生,主要从事食品科学研究。 辛松林(1981—),男,辽宁大连人,四川旅游学院食品学院副院长、副研究员,四川农业大学博士研究生,主要从事农产品加工与贮藏研究。 任宣姿(1995—),女,四川南充人,四川旅游学院食品学院2013级本科生,主要从事食品科学研究。
O658
A
2095-7211(2017)01-0020-04
