不同品种小麦籽粒中β-葡聚糖含量的比较研究
2017-01-17白沙沙于佳立陈月晓崔亚娟
白沙沙,赵 萌,于佳立,陈月晓,崔亚娟
(1北京市营养源研究所,北京 100069;2北京联合大学,北京 100094)
不同品种小麦籽粒中β-葡聚糖含量的比较研究
白沙沙1,赵 萌1,于佳立2,陈月晓1,崔亚娟1
(1北京市营养源研究所,北京 100069;2北京联合大学,北京 100094)
建立了酶解法(葡聚糖酶、β-葡萄糖苷酶、葡萄糖氧化酶和过氧化氢酶)测定小麦籽粒中的β-葡聚糖含量,对该方法的标品测定回收率和加标回收率进行研究,利用该方法测定了8个品种小麦籽粒中β-葡聚糖含量,并分析其含量的差异性。结果表明:酶解法具有良好的测定结果;8个品种小麦籽粒中β-葡聚糖含量在0.44%~0.68%之间,小麦籽粒中β-葡聚糖含量由于品种和产地的不同而呈现一定的差异性,试验结果为从膳食中摄入β-葡萄糖提供了参考。
小麦;β-葡聚糖;酶解法
β-葡聚糖广泛存在于植物、微生物和动物体内,具有抗肿瘤、抗炎、降低胆固醇、调节血糖、降血脂、提高人体免疫力等[1-5]多种生理功能,对慢性病的预防和调理具有重要意义。小麦及其制品是人们日常膳食的主要谷物,中国居民膳食指南推荐每人每日摄入量在250~400g[6],因此研究测定不同品种小麦籽粒中β-葡聚糖含量对筛选和培育富含β-葡聚糖的小麦品种具有指导作用,为从膳食中摄入β-葡聚糖提供了参考[7,8]。
β-葡聚糖含量的测定方法主要有酶解法、苯酚-硫酸法、刚果红法、荧光法、高效液相色谱法[9-15 ]等。酶解法测定谷物β-葡聚糖是利用特定的β-葡聚糖内切酶酶解得到寡糖,经葡萄糖苷酶水解后采用葡萄糖氧化酶/过氧化氢酶试剂测定葡萄糖的含量,该内切酶主要是针对(1,3)、(1,4)糖苷键链接的β-葡聚糖,酶法专一性酶解β-葡聚糖,其测定含量准确可靠,AOAC992.28[16]、AOAC995.16[17]方法和我国农业标准NY/T2006-2011[18]测定谷物大麦及燕麦中β-葡聚糖含量均为酶解法。
酶解法是利用葡聚糖酶专一性水解(1,3)、(1,4)-β-D-葡聚糖[19]生成寡糖,利用β-葡萄糖苷酶将寡糖水解成葡萄糖,葡萄糖氧化酶酶解葡萄糖生成葡萄糖酸和过氧化氢,在过氧化氢酶作用下过氧化氢与4-氨基安替比林氧化缩合生成红色醌类化合物,510nm处测定吸光度值,其吸光度值与葡萄糖含量成正比,根据葡萄糖转化β-葡聚糖脱水转换因子可以求得β-葡聚糖含量。本研究以8个品种小麦籽粒为试验材料采用酶解法测定其β-葡聚糖含量,利用统计分析法确定8个品种小麦籽粒中β-葡聚糖含量的差异性。
1 材料与方法
1.1 材料与试剂
1.1.1 小麦样品制备 本实验选择2015年夏季收获的冬小麦,品种为:衡观35(河南辉县)、西农979(河南辉县)、济麦22(河北邢台)、小偃22(西安杨凌)、老麦16(河北邢台)、周麦16(河南鹤壁)、小宝丰(河南鹤壁)和农夫399(河北邯郸)共8个品种。
样品制备:小麦收获脱粒除杂除尘后自然晾晒至干燥。干燥后的小麦籽粒用万能粉碎机磨成全麦粉,过40目筛,烘干至恒质量,备用。
1.1.2 主要试剂 乙醇:分析纯,北京化工厂;磷酸二氢钠:分析纯,北京化工厂;乙酸钠:分析纯,北京化工厂;酶试剂及葡萄糖标准购自爱尔兰Megazyme公司,其中葡萄糖标准品浓度为1mg/mL,葡聚糖酶、β-葡萄糖苷酶、葡萄糖氧化酶-过氧化物酶缓冲液混合物均按照酶试剂说明进行配置。葡萄糖标准工作液:移取1mg/mL葡萄糖标准品20、40、60、80、100μL于试管中,分别添加50mmol/L乙酸钠缓冲液至200μL,得到试管中葡萄糖标准品的质量分别为20、40、60、80、100μg。试剂空白为200μL 50mmol/L乙酸钠缓冲液。
1.2 仪器和设备
粉碎机:A11 basic,德国IKA公司;高速冷冻离心机:RXⅡ,日本HITACHI公司;漩涡振荡器:XW-80A,上海医科大学仪器厂;分光光度计:722S,上海精密科学仪器有限公司;水浴锅:DZKW-4六孔,北京中兴伟业仪器有限公司。
1.3 酶解处理
精确称取粉碎待测样于试管中(精确至0.0001g)。向待测试管中加入0.2mL 50%乙醇溶液,漩涡震荡分散;加入4.0mL磷酸钠缓冲液,充分震荡。将试管放入沸水浴中保持1min,漩涡震荡数秒,沸水浴中继续保持2min,漩涡震荡。
1.3.1 葡聚糖酶酶解 取出试管后于50℃水浴中保温5min,添加0.2mL葡聚糖酶溶液,漩涡震荡数秒,加盖,50℃水浴保温60min,其间将试管取出震荡处理3~4次。此步骤葡聚糖酶将(1,3)、(1,4)-β-D-葡聚糖酶解生成寡糖。
1.3.2 β-葡萄糖苷酶酶解 取出试管,向其中加入5mL 200mmol/L乙酸钠缓冲液,混合均匀,室温下冷却,离心(1 000×g、10min),取上清液,备用。分别准确移取0.1mL上清液于试管底部,向其中分别添加0.1mL β-葡萄糖苷酶溶液,反映空白添加0.1mL 50mmol/L乙酸钠缓冲液,各试管在50℃下保温10min。此步骤β-葡萄糖苷酶将寡糖水解成葡萄糖。
1.3.3 显色反映 分别移取3.0mL葡萄糖氧化酶-过氧化物酶缓冲液混合物至各试管,50℃下反应20min,冷却至室温。葡萄糖氧化酶酶解葡萄糖生成葡萄糖酸和过氧化氢,在过氧化氢酶作用下过氧化氢与4-氨基安替比林氧化缩合生成红色醌类化合物。
1.4 比色测定
以试剂空白调零,于510nm处测定吸光度值。
1.5 计算
按照式(1)计算样品中β-葡聚糖含量(%):β-葡聚糖含量[18]=△A×F×94×10-4×0.9/W
(1)
式(1)中,△A:样品吸光值与反应空白吸光值的差值;F:吸光值转化为μg葡萄糖的转换因子;94:体积校正因子(从9.4mL吸取0.1mL用于分析);0.9:葡萄糖转化为β-葡聚糖的脱水转换因子;W:样品质量,g。
1.6 数据分析
利用SPSS数据分析软件对实验结果进行处理。
2 结果与分析
2.1 标准曲线绘制
精确移取1mg/mL葡萄糖标准品0、20、40、60、80、100μL于6支试管中,分别添加50mmol/L乙酸钠缓冲液至200μL,使得每管中葡萄糖标准品的质量为0、20、40、60、80、100μg。移取3.0mL葡萄糖氧化酶-过氧化物酶缓冲液混合物至各试管,在50℃水浴条件下反应20min,取出冷却至室温。于510nm处以试剂空白(即0μg试管)调零,测定各试管吸光度值。吸光度A与葡萄糖标准品质量进行线性回归,得到回归方程(附图)。

附图 葡萄糖标准曲线
2.2 燕麦粉标准品的测定
采用该方法测定β-葡聚糖标示量为8%的燕麦粉标准品中β-葡聚糖含量,准确称取0.1g(精确至0.000 1g)燕麦粉标准品,平行测定3次,结果分别为8.13%、8.12%和7.93%,测定回收率分别为101.6%、101.5%和99.1%,说明该方法具有良好的测定回收率,能够满足实验需要。
2.3 加标回收率测定
以8%含量燕麦粉标准品添加入空白样品进行加标回收率试验。进行3个标准添加水平的回收率试验,每个添加水平重复测定3次,分别计算加标回收率和标准偏差,β-葡聚糖3个水平的平均加标回收率在98.2%~101.1%,标准偏差在1.86%~4.75%(表1),能够满足检测实际样品需要。

表1 β-葡聚糖加标回收试验结果 单位:%
2.4 不同品种小麦籽粒β-葡聚糖含量的测定
按照上述验证的酶解法分别对8个品种小麦籽粒制备的籽粒粉进行β-葡聚糖含量的测定,每个品种进行4次平行测定,统计4次测定结果的平均值和标准偏差。表2结果显示,8个小麦品种β-葡聚糖含量在0.40%~0.71%,标准偏差范围在1.19%~3.73%。其中衡观35小麦籽粒中β-葡聚糖含量最低,为0.44%;β-葡聚糖含量最高的小麦品种为农夫399,为0.68%,是衡观35小麦籽粒中β-葡聚糖含量的1.6倍左右。为判断8个小麦品种籽粒中β-葡聚糖含量的差异性,进一步对测定结果进行方差分析。

表2 8个品种小麦籽粒中β-葡聚糖含量
经过SPSS16.0统计软件对8个品种小麦籽粒中β-葡聚糖含量进行方差分析,表3结果显示,含量最低的衡观35与其余7个品种在P<0.01水平均具有显著差异;西农979与济麦22、小宝丰的β-葡聚糖含量差异不显著,与其他5个品种在P<0.01水平具有显著差异;济麦22与老麦16的β-葡聚糖含量差异不显著,与小偃22、小宝丰的β-葡聚糖含量在P<0.05水平具有显著差异,与周麦16、农夫399的β-葡聚糖含量在P<0.01水平具有显著差异;小偃22与老麦16的β-葡聚糖含量差异不显著,与周麦16、小宝丰、农夫399的β-葡聚糖含量在P<0.01水平具有显著差异;老麦16与周麦16、小宝丰、农夫399的β-葡聚糖含量在P<0.01水平具有显著差异;周麦16与小宝丰、农夫399的β-葡聚糖含量在P<0.01水平具有显著差异;小宝丰与农夫399的β-葡聚糖含量在P<0.01水平具有显著差异。
采自河南辉县的衡观35和西农979、河北邢台的济麦22和老麦16、河南鹤壁的周麦16和小宝丰,同一产地的不同品种在P<0.01水平具有显著差异,品种的不同对小麦籽粒β-葡聚糖含量具有显著的差异性。
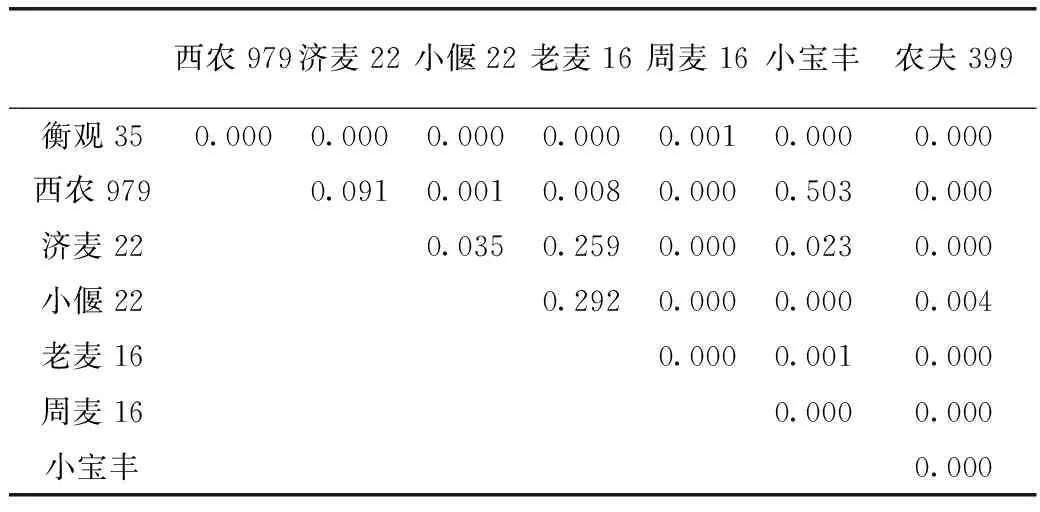
表3 8个品种小麦籽粒中β-葡聚糖含量差异显著性
3 结论
本文建立了酶解法测定β-葡聚糖含量,并研究了该方法的标品测定回收率和加标回收率,通过对β-葡聚糖标示量为8%的燕麦标准品进行酶解测定,测定结果与标准值一致,说明酶分解测定β-葡聚糖含量具有良好的测定结果;通过样品加标回收测定回收率,低、中、高3个添加水平测得回收率在98.2%~101.1%之间,该方法稳定、干扰少。
通过酶解法对衡观35、西农979、济麦22、小偃22、老麦16、周麦16、小宝丰和农夫399共8个品种小麦籽粒中β-葡聚糖含量进行测定,结果显示,8个品种小麦籽粒中β-葡聚糖含量在0.40%~0.71%之间。
对8个品种小麦籽粒β-葡聚糖含量的差异性分析得到:西农979与济麦22、小宝丰的β-葡聚糖含量差异不显著;济麦22与老麦16的β-葡聚糖含量差异不显著;小偃22与老麦16的β-葡聚糖含量差异不显著;其他品种间β-葡聚糖含量均具有一定的显著性差异。进一步分析得到同一产地的不同品种间β-葡聚糖含量存在显著差异,说明品种的不同是产生β-葡聚糖含量差异的因素。
4 讨论
酶解法测定小麦籽粒中β-葡聚糖含量的文章未见报道,本研究8种小麦籽粒中β-葡聚糖含量测定结果在0.40%~0.71%,与单贺年[20]利用HPGPC法(高效凝胶渗透色谱法)测定不同品种小麦β-葡聚糖含量范围在0.42%~0.61%具有一致性。小麦中β-葡聚糖含量虽低于燕麦和大麦[19]等谷物中β-葡聚糖含量(燕麦3%~7%,大麦5%~11%),基于小麦制品的日摄取量大,筛选和育种β-葡聚糖含量较高的小麦品种对慢性病的预防和调理具有重要意义。
本研究对小麦籽粒中β-葡聚糖含量的测定结果为进一步研究小麦籽粒不同组织结构中(如麸皮、胚乳、糊粉层等)β-葡聚糖的含量提供了基础,进一步测定和分析小麦籽粒不同组织结构β-葡聚糖含量,为小麦深加工和开发β-葡聚糖功能性产品,促进谷物β-葡聚糖在食品工业中的应用具有的指导意义。◇
[1]蔡成刚,蒋新龙,蒋昌海.β-葡聚糖结构功能与开发研究进展[J].农产品加工学刊,2011,9:114-117.
[2]Judith H,Daniel J S,Kay M B.Physiological responses of men and women to barley and oat extracts(Nu-trimx).II.Comparision of glucose and insulin response[J]. Cereal Chemistry,2003,80(3):80-83.
[3]Tapola N,et al.Glycemic responses of oat bran products in type 2 diabetic patients[J].Nutrition,Metabolism & Cardiovascular Diseases,2005,15:225-261.
[4]Volman J J,et al.Dietary modulation of immune function by β-glucans[J]. Physiology & Behavior,2008,94:276-284.
[5]El Khoury D,Cuda C,Luhovyy L L,et al.Beta Glucan:Health Benefits in Obesity and Metabolic Syndrome[J]. Journal of Nutrition and Metabolism,2012,12:851362.
[6]中国营养学会.《中国居民膳食指南》[M].抗萨:西藏人民出版社,2011.
[7]Adam M B,Brigid T, Kristin K,et al.Major Cereal Grain Fibers and Psyllium in Ralation to Cardiovascular Health[J].Nutrients,2013,5:1471-1487.
[8]金玉红,张开利,张兴春,等.小麦组分含量与小麦芽β-葡聚糖酶活力的相关性分析[J].中国粮油学报,2008,23(5):28-32.
[9]熊茉君,王 新,张红霞.β-葡聚糖含量测定方法的比较[J].华西药学杂志,2005,20(5):438-440.
[10]张娟,杜先锋,饶砚琴.刚果红法测定燕麦中β-葡聚糖含量的研究[J].安徽农业大学学报,2007,34(1):23-26.
[11]连喜军,鲁晓翔,刘勤生,等.荧光素钠法测定β-葡聚糖含量的研究[J].食品研究与开发,2006,27(10):116-119.
[12]徐建光,梁达奉,曾练强,等.酶解法定量测定葡聚糖的研究[J].化学与生物工程,2010,27(4):92-94.
[13]连喜军,鲁晓翔,蔡保松.酶法测定大麦提取物葡聚糖含量研究[J].粮食与油脂,2006,5:12-15.
[14]宋 萍,李文俊.青稞秸秆中β-葡聚糖含量的测定[J].特产研究,2009,1:50-52.
[15]吕耀昌,王强,赵炜,等.燕麦、大麦中β-葡聚糖的酶法测定[J]. 食品科学,2005,26(1):180-182.
[16]AOAC Official Method 992.28.(1→3)(1→4)-Beta-D-Glucans in Oat and Barley Fractions and Ready-To-Eat Cereals:1992.
[17]AOAC Official Method 995.16.β-D-Glucan in Barley and Oats Streamlined Enzymatic Method:1995.
[18]中华人民共和国农业部农产品加工局.NY/T2006-2011.谷物及其制品中β-葡聚糖含量的测定[S].
[19]申瑞玲,何俊,赵学伟.谷物β-葡聚糖的提取方法、化学结构及功能性质研究进展[J]. 食品科学,2009,30(3):288-291.
[20]单贺年,鞠兴荣,袁建,等.HPGPC测定麦类中β-葡聚糖含量[J].粮食与食品工业,2014,21(6):72-77.
(责任编辑 李婷婷)
Content Comparison of β-Glucan in Different Varieties of Wheat Grain
BAI Sha-sha1,ZHAO Meng1,YU Jia-li2,CHEN Yue-xiao1,CUI Ya-juan1
(1Beijing Research Institute for Nutritional Resources,Beijing 100069,China;2Beijing City University,Beijing 100094,China)
The Enzymatic Hydrolysis Method including dextranase,β-glucosidase,glucose oxidase and catalase was established for the determination on the content of β-glucan in wheat grain.The standard determination recovery rate and sample added recovery rate of the method were investigated and the differences of the β-glucan contents from 8 varieties of wheat grain were compared.The results showed that the Enzymatic Hydrolysis Method had good determination results,and the β-glucan content of 8 varieties of wheat grain were between 0.44% and 0.68%.Differencs were found in the β-glucan content among different varieties.This results provided new insight into the consumption of β-glucan from diet.
wheat;β-glucan;Enzymatic Hydrolysis Method
北京市级财政项目“食物中四类植物化学物检测技术的开发改进及植物化学物配方食品加工方法研究”(项目编号:PXM2014_178102_000011)。
白沙沙(1987— ),女,硕士,中级工程师,研究方向:食品分析。
崔亚娟(1979— ),女,博士,研究员,研究方向:食品分析。
