晚期非小细胞肺癌患者表皮生长因子受体基因突变状态研究
2017-01-16卓安山官振标童皖宁徐世林赵红霞
卓安山,官振标,李 奕,童皖宁,孙 星,徐世林,赵红霞,李 雷
·基础医学· ·论著·
晚期非小细胞肺癌患者表皮生长因子受体基因突变状态研究
卓安山,官振标,李 奕,童皖宁,孙 星,徐世林,赵红霞,李 雷
目的 探讨晚期非小细胞肺癌(non-small-cell carcinoma,NSCLC)患者肺组织或胸水表皮生长因子受体(epidermal growth factor,EGFR)基因突变状态,以期为肺癌患者选择靶向治疗提供依据。方法 选择经组织学或细胞学确诊为中晚期NSCLC 患者118例,采用扩增受阻突变系统(ARMS)-qPCR方法,对不同途径获取的肺组织或胸水细胞块进行EGFR基因(18~21外显子)突变情况测定。结果 (1)118例晚期NSCLC患者,EGFR基因突变者45例,突变率为38.1%,其中男性占44.4%,女性占55.6%;(2)不同途径采集的标本,EGFR基因突变率不同,以手术切除和CT引导肺活检标本阳性率较高,胸水细胞块阳性率较低,与前两者比较,差异均有统计学意义(P<0.05);(3)不同病期采集的胸水标本阳性率不同,随着肿瘤病情进展,阳性率有增高趋势,但各期比较,差异无统计学意义(P>0.05);(4)在EGFR基因突变患者中,以19外显子缺失(占40.0%)和21外显子L858R点突变(占42.2%)比例较高,18外显子缺失(占8.9%)和20外显子缺失(占6.7%)相对较低,后两者与前两者比较,差异均有统计学意义(P<0.05);另外发现2例(4.4%)患者为19和21外显子同时突变,其余43例(95.6%)为单基因突变,未发现多基因突变的情况。结论 对晚期NSCLC患者应尽可能作EGFR基因检测,以期为选择分子靶向(TKIs)治疗提供依据。
非小细胞肺癌;表皮生长因子受体;酪氨酸激酶抑制剂;靶向治疗;基因突变
目前,肺癌已成为全世界发病率和死亡率最高的恶性肿瘤,全世界每年新发肺癌病例和相关死亡病例均超过100万[1],其中80%左右为非小细胞肺癌(non-small-cell lung cancer,NSCLC)[2],且绝大多数确诊时已处中晚期,失去了手术治疗的机会[3]。虽然目前治疗肺癌的手段很多,但总体5年生存率仍未突破15%[4]。近年来国内外多项研究发现,小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)治疗晚期NSCLC疗效优于化疗,且不良反应轻[5-7],并发现TKIs(如吉非替尼、厄洛替尼和埃克替尼等)疗效与表皮生长因子(epidermal growth factor,EGFR)基因的突变有密切的相关性,EGFR基因突变的患者疗效更优[6-7]。这就提示在决策晚期NSCLC患者治疗方案时,了解其EGFR基因突变状态十分重要。我院自2010年1月开始对确诊为晚期NSCLC患者进行组织学或胸水EGFR基因突变检测,以期为晚期NSCLC患者选择EGFR-TKIs治疗提供依据。现报道如下。
1 资料与方法
1.1 研究对象 选择2010年1月至2016年1月经组织学和或细胞学检查确诊为晚期NSCLC患者,共118例。其中男56例,女62例,年龄49~86岁,平均(61.8±12.7)岁;吸烟者48例,不吸烟者70 例;病理分型为腺癌者98例,非腺癌者20例;肿瘤TNM分期属Ⅱ期者43例,Ⅲ期者57例,Ⅳ期者18例。
1.2 标本采集 118例患者标本中,经手术切除标本13例,经CT引导肺穿刺活检标本44例,经支气管镜活检标本37例,恶性胸水细胞块24例。
1.3 EGFR基因突变检测 所有获得的标本均采用扩增受阻突变系统(amplification refractory mutation system,ARMS)-qPCR方法同时测定其EGFR基因外显子18、19、20、21(Exon18~21)突变情况。试剂盒购自浙江湖州数问生物技术有限公司,操作方法严格按说明书进行。
1.4 统计学处理 采用SPSS 13.0统计软件包进行处理,计数资料以百分比表示,组间比较采用χ2检验,多组间比较采用F检验。P<0.05为差异有统计学意义。
2 结果
2.1 肺癌患者EGFR基因突变情况 118例患者中,发现EGFR基因突变者45例,阳性率为38.1%;其中男性占44.4%(20/45),女性占55.6%(25/45),女性突变率较男性略高,但两者差异无统计学意义(P>0.05)。在45例基因突变者中,吸烟者19例(占42.2%),不吸烟者26例(占57.8%),两者差异无统计学意义(P>0.05)。
2.2 肺癌患者不同标本来源EGFR基因突变情况手术标本和肺穿刺标本EGFR基因突变率较高,分别与胸水细胞块标本比较,差异均有统计学意义(P<0.05)。见表1。
表1 肺癌患者不同标本来源EGFR基因突变情况[例(%)]

标本来源检测例数外显子突变位置18192021突变例数手术标本1312036(46.2)a肺穿刺标本441721121(46.7)a气管镜活检标本37151714(37.8)胸水细胞块2402024(16.7)合计11831632345(38.1)
注:与胸水细胞块组比较aP<0.05。EGFR为表皮生长因子
2.3 肺癌患者不同分期EGFR基因突变情况 随着肿瘤病情进展,EGFR基因突变率呈增加趋势,但不同分期间比较,差异均无统计学意义(P>0.05)。见表2。
表2 肺癌患者不同分期EGFR基因突变情况[例(%)]
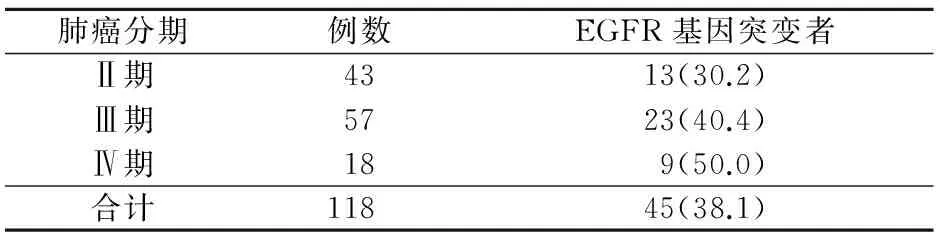
肺癌分期例数EGFR基因突变者Ⅱ期4313(30.2)Ⅲ期5723(40.4)Ⅳ期189(50.0)合计11845(38.1)
注:EGFR为表皮生长因子
2.4 肺癌患者不同组织学类型EGFR基因突变情况 在118例患者中,腺癌98例(占83.1%),EGFR基因突变42例,突变率为42.9%;非腺癌20例(占16.9%),EGFR基因突变3例,突变率为15.0%;两者比较差异有统计学意义(P<0.05)。提示腺癌患者的EGFR基因突变率明显高于非腺癌患者。
2.5 肺癌患者EGFR基因突变分布情况 在EGFR基因突变的45例患者中,18外显子突变4例(占8.9%),19外显子突变18例(占40.0%),20外显子突变3例(占6.7%),21外显子点突变19例(占42.2%)。19和21外显子突变比例明显高于18和20外显子,两者比较差异均有统计学意义(P<0.05)。另外发现2例(4.4%)患者为19和21外显子同时突变,其余43例(95.6%)患者均为单基因突变,本组未发现多基因突变的情况。
3 讨论
近年来,以铂类为基础的第三代化疗药物使晚期NSCLC患者的预后有了一定的改观,但其远期疗效仍不能令人满意,中位总生存期依然徘徊在8~10个月左右[10]。因此,探讨疗效好、生存期限长、不良反应小的治疗方案,已成为晚期NSCLC治疗中的一个重要问题。最近国内外多项研究发现,EGFR基因突变患者应用EGFR-TKIs治疗的有效率高达55%~83%,不亚于化疗[3,7-8]。因此,目前不少权威指南已将TKIs推荐为EGFR基因突变肺癌患者的一线治疗药物[9-10]。
EGFR是一种细胞膜表面的糖蛋白受体,也是原癌基因C-erb-1(HER-1)的表达产物,具有酪氨酸激酶活性,它通过与配体结合后激活下游信号通路,调节肿瘤细胞的增殖、分化、血管生成和凋亡,从而调控肿瘤的一系列生物学行为。最近研究发现EGFR由28个外显子组成,肺癌患者EGFR基因突变主要发生在18~21外显子,且这种突变与靶向药物的敏感性有关[6,8,11]。研究发现EGFR基因突变的患者接受EGFR-TKIs治疗有更好的疗效[6-7,11],这就为晚期NSCLC患者选择TKIs治疗奠定了基础。
文献报道,突变的EGFR基因属NSCLC中的第一代驱动基因,且多为亚裔、女性、不吸烟、腺癌的患者[12]。基因突变在亚裔NSCLC患者中占30%~40%[4]。本组检测结果表明,NSCLC患者EGFR基因突变率为38.1%,其中腺癌患者EGFR基因突变率为42.9%,明显高于非腺癌,结果与文献报道基本一致[8-9]。本研究表明腺癌患者EGFR基因有较高的突变率,这一结果为肺腺癌患者选择TKIs治疗提供了实验依据。
另据文献报道,随着肺癌TNM分期递增,EGFR基因突变率呈递减现象[8]。而本组检测结果发现,各分期之间突变率虽然无明显差异,但似乎随着TNM分期增加,EGFR基因突变率呈上升趋势,结果与张著学等[8]报道相悖,与周南和Rosell等[9,14]报道相一致。造成这种差异的原因,目前尚不清楚,是否与晚期肺癌患者肿瘤负荷增大有关,值得进一步探讨。
有学者指出,不同标本EGFR基因突变率不同[5,13]。本组检测结果也发现,手术切除和肺活检标本基因突变率较高(分别为46.1%和47.7%),胸水细胞块标本基因突变率较低(16.7%),与前两者比较,差异均有统计学意义(P<0.05)。这一结果证实,不同方法采集的标本其阳性率不同,有条件者应尽可能采集组织标本以供检测。但对晚期NSCLC患者,特别是高龄老年、无手术指征,又不适合行肺活检或支气管镜等有创检查,合并胸腔积液的患者,抽取胸水作EGFR基因测定,仍不失为一种简单方便的方法。
另据文献报道,EGFR基因突变主要发生在EGFR酪氨酸激酶编码区的第18、19、20和21外显子,其中以19外显子缺失和21外显子L858R点突变最为常见,分别占45%左右;外显子18的突变率较低,约占5%;外显子20的突变率最低,仅占1%左右[3,5]。本研究检测结果发现,19外显子缺失占40.0%,21外显子L858R点突变占42.2%,18外显子缺失占8.9%,20外显子缺失占6.7%,结果与文献报道基本一致[8,15]。另外,值得指出的是,本研究中45例EGFR基因突变者,除2例(4.4%)患者为19和21外显子同时双突变外,其余43例(95.6%)患者均为单基因突变,未发现多基因突变情况,这一结果与文献报道不尽相同[8],其原因有待于继续积累资料进行深入探讨。
致谢:本项研究有关EGFR基因测定,由上海复旦临床病理诊断中心枫林医药医学检验所罗孝伟和魏韶荣两位老师协助完成,在此特表谢意。
[1] Allemani C, Weir HK, Carreira H, et al. Global surveillance of cancer survival 1995-2009: analysis of individual data for 25,676,887 patients from 279 population-based registries in 67 countries (CONCORD-2)[J]. Lancet, 2015, 385(9972): 977-1010. DOI:10.1016/S0140-6736(14)62038-9.
[2] Daniel C. Lung cancer, a worrying epidemiological evolution[J]. Rev Infirm, 2012,(184): 14-16.
[3] 马玲,刘莉,张涛,等. 晚期NSCLC患者血清EGFR基因突变状态的测定及意义[J]. 中国肺癌杂志, 2013, 16(6): 303-307. DOI:10.3779/j.issn.1009-3419.2013.06.06.
[4] Antonicelli A, Cafarotti S, Indini A, et al. EGFR-targeted therapy for non-small cell lung cancer: focus on EGFR oncogenic mutation[J]. Int J Med Sci, 2013, 10(3): 320-330. DOI:10.7150/ijms.4609.
[5] Melosky B. Review of EGFR TKIs in Metastatic NSCLC, Including Ongoing Trials[J]. Front Oncol, 2014, 4: 244-246. DOI:10.3389/fonc.2014.00244.
[6] Lindeman NI, Cagle PT, Beasley MB, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors[J]. J Mol Diagn, 2013, 15(4): 415-453. DOI:10.1016/j.jmoldx.2013.03.001.
[7] Schuler M, Wu YL, Hirsh V, et al. First-line afatinib versus chemotherapy in patients with non-small cell lung cancer and common epidermal growth factor receptor gene mutations and brain metastases[J]. J Thorac Oncol, 2016, 11(3): 380-390. DOI:10.1016/j.jtho.2015.11.014.
[8] 张著学,彭学勤,薛英波,等. 肺腺癌中表皮生长因子受体基因突变与临床病理因素的关系[J]. 实用医学杂志, 2015, 31(13): 2155-2157. DOI:10.3969/j.issn.1006-5725.2015.13.027.
[9] 周南,李龙芸,郑直,等. 蝎形探针扩增阻滞突变系统检测肺癌患者血清与肿瘤组织中表皮生长因子受体基因突变[J]. 癌症进展, 2011, 9(1): 19-26. DOI:10.3969/j.issn.1672-1535.2011.01.005.
[10] 史钟,范云. EGFR敏感突变NSCLC患者的最佳治疗模式探讨[J]. 中国肺癌杂志, 2015, 18(2): 110-116. DOI:10.3779/j.issn.1009-3419.2015.02.11.
[11] 《非小细胞肺癌血液EGFR基因突变检测中国专家共识》制定专家组. 非小细胞肺癌血液EGFR基因突变检测中国专家共识[J]. 中华医学杂志, 2015, 95(46): 3721-3726. DOI:10.3760/cma.j.issn.0376-2491.2015.46.001.
[12] Zhou Xiaoyun, Li Longyun, Cui Wei, et al. Correlation analysis of serum free DNA EGFR mutation and EGFR-TKI response in lung cancer patients[J]. Oncol Progress, 2011, 9(1):13-18.
[13] Bordi P, Del Re M, Danesi R, et al. Circulating DNA in diagnosis and monitoring EGFR gene mutations in advanced non-small cell lung cancer[J]. Transl Lung Cancer Res, 2015, 4(5): 584-597. DOI:10.3978/j.issn.2218-6751.2015.08.09.
[14] Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer[J]. N Engl J Med, 2009, 361(10): 958-967. DOI:10.1056/NEJMoa0904554.
[15] 刘红雨,李颖,陈钢,等. 187例非小细胞肺癌中EGFR基因突变和扩增的检测及其临床意义[J]. 中国肺癌杂志, 2009, 12(12): 1219-1228. DOI:10.3779/j.issn.1009-3419.2009.12.01.
(本文编辑:莫琳芳)
Research on the gene mutation of epidermal growth factor receptor in the patients with advanced non-small cell lung cancer
Zhuo Anshan, Guan Zhenbiao, Li Yi, Tong Wanning, Sun Xing, Zhao Hongxia, Li Lei
(DepartmentofRespiration,No. 411Hospital,CPLA,Shanghai200081,China)
Objective To investigate the gene mutation of epidermal growth factor receptor (EGFR) in the lung tissue and pleural fluid of the patients with advanced non-small cell lung cancer (NSCLC), so as to provide medical evidence for the selection of targeted therapy in those patients with lung cancer.MethodsOne hundred and eighteen patients confirmed to have advanced NSCLC through histology or cytology were chosen for the study. Gene mutation of EGFR (exon 18-21) in the lung tissue and pleural effusion cell block obtained with different methods was detected by using amplification refractory mutation system (ARMS) -qPCR.Results(1)Of the 118 patients with advanced NSCLC, 45 were detected to have EGFR gene mutation, with the mutation rate of 38.1%, in which male patients accounted for 44.4% and female patients accounted for 55.6%.(2)The rate of EGFR mutation varied with different ways of sample collection, with surgical excision and CT-guided lung biopsy having relatively higher detection rate and pleural effusion cell block having relatively lower detection rate. Statistical significance could be noted, when comparisons were made between them(P<0.05).(3)The positive rate of pleural fluid samples varied with the samples collected at different stages of the disease. With the progress of the disease, the positive rate tended to increase. However, no statistical significance could be seen, when comparisons were made between different stages(P>0.05).(4)In the patients with EGFR gene mutation, the patients with 19 exon deletion and 21 exon L858R mutation had relatively higher proportion, accounting for 40% and 42.2% respectively. The patients with 18 and 20 exon deletion had relatively lower proportion, accounting for 8.9% and 6.7% respectively. Statistical significance could be noticed, when comparisons were made between the former two exons and the latter two exons(P<0.05). There were another 2 patients with simultaneous mutation of 19 and 21, which accounted for 4.4% of all the patients, and there were 43 patients with single gene mutation, which accounted for 95.6%. Detection results revealed that there were no patients with multi-gene mutation.ConclusionThe detection of EGFR gene should be performed in all the patients with advanced NSCLC, in order to provide evidence for the proper selection of targeted molecular therapy.
Non-small cell lung cancer; Epidermal growth factor receptor; Tyrosine kinase inhibitor; Targeted molecular therapy; Gene mutation
200081 上海,解放军第四一一医院呼吸科
R563
A
10.3969/j.issn.1009-0754.2016.06.005
2016-09-04)
