hsa-miR-759促进胃癌细胞SGC-7901增殖的机制研究
2017-01-16储著凌侯乐伟胡国强
储著凌,侯乐伟,胡国强,胡 君,尹 鹏,朱 清
·临床医学· ·短篇论著·
hsa-miR-759促进胃癌细胞SGC-7901增殖的机制研究
储著凌,侯乐伟,胡国强,胡 君,尹 鹏,朱 清
NGX6;SGC-7901;hsa-miR-759;增殖活性
世界范围内,胃癌发病率在所有恶性肿瘤中居第4位,其致死率则位于第2位,我国是胃癌高发国家,每年新增病例约占全球新增数量的40%。由于我国早期胃癌诊断率较低,治疗方法多以手术切除为主,这使得胃癌的致死率高于世界平均水平,因此,寻找胃癌诊断的新方法以及治疗的新途径尤为重要[1]。目前,早期胃癌临床治疗多以手术为主,内镜下黏膜切除术(EMR)和内镜下黏膜下剥离术(ESD)是主要的2种手术方法[2-3]。临床原发肿瘤的切除,通常对于肠型黏膜内癌,病灶部位无溃疡或溃疡疤痕的胃癌有较好的效果,而对伴有远处转移的胃癌多数是无法治愈的。对于进展期或复发性的肿瘤,化疗的作用有限,即使联用放疗也难以达到治愈。因此,寻找潜在的胃癌基因治疗靶点,对胃癌的深度和彻底治疗尤为重要。NGX6基因位于人基因组的9号染色体[4],相关研究表明,NGX6具有明显的肿瘤抑制作用[5]。那么,NGX6在胃癌的发生机发展中是否具有关键的作用,NGX6在胃癌中表达异常的原因是什么,NGX6蛋白表达上调是否对胃癌具有抑制作用?为了阐明上述问题,笔者将在胃癌细胞株SGC-7901中展开相关研究。
1 材料与方法
1.1 材料
人胃癌及其癌旁组织取自解放军第四五四医院,SGC-7901细胞株,293工具细胞株购于中国科学院典型培养物保藏委员会细胞库,DMEM(Dulbecco minimum essential medium)高糖细胞培养基、0.25 %胰蛋白酶、胎牛血清(fetal bovine serum,FBS)、Lipofectamine 3000转染试剂购于Invitrogen公司产品,荧光素酶报告基因表达载体(PGL3-promoter)和荧光素酶检测系统购于Promega公司,RNA提取试剂盒及M-MLV反转录试剂盒为大连宝生物功臣有限公司产品,NGX6蛋白一抗及二抗均为美国Santacruz公司产品,细胞及组织总蛋白提取及定量试剂盒、化学发光试剂盒均为美国Pierce公司产品,miRNA合成、测序均在上海生工工程有限公司完成,MTT(4,5-dimethyl-2-thiazolyl-2,5-diphenyl-2-H-tetrazolium bromide)和二甲基亚砜(dimethyl sulfoxide ,DMSO)为Sigma公司产品,无内毒素质粒DNA提取试剂盒为Qiagen公司产品,荧光定量检测试剂盒、限制性内切酶,连接酶均为Takara公司产品。
1.2 仪器和设备
细胞培养箱购于美国Thermo公司,微量移液器、水平离心机、高速低温离心机均为Eppendorf公司产品,转膜仪、垂直电泳槽及电泳仪为上海天能公司产品,紫外分光光度检测仪与酶标仪购于Thermo公司,PCR仪为美国ABI公司产品。
1.3 实验方法
1.3.1 胃癌标本中hsa-miR-759及NGX6蛋白含量检测 收集贲门癌及其癌旁组织5对,生理盐水漂洗后经滤纸吸干水分,将组织装入2.0 ml细胞冻存管,编号后液氮保存。实验前,取出液氮保存的组织样本,切取约200 mg,加入1 ml Trizol,后进行组织匀浆并将匀浆液4℃下12 000×离心2 min,收集上清,然后酚氯仿法提取组织Total RNA。取2 μg RNA经M-MLV反转录制备cDNA,荧光定量法检测组织中hsa-miR-759含量。另取相同大小组织,加入1 ml组织裂解液T-MER,经充分匀浆后进行组织蛋白提取和定量,实验过程完全按照试剂盒说明书进行,蛋白提取完成之后,通过免疫印迹法检测组织中NGX6蛋白相对含量。
1.3.2 生物信息学预测hsa-miR-759与NGX6 3′-UTR结合位点 采用Targetscan预测软件对NGX6(NM_016446) 3′-UTR区与hsa-miR-759进行结合位点预测,预测结果显示(图2A),hsa-miR-759在NGX6的3′-UTR区存在7个碱基的种子区“5′-CACUCUG-3′”。
1.3.3 载体构建 设计合成长链DNA,5′-CTAGACCUCCAGCTGTTCCACACTCTGTCCUCCAGCTGTT CCACACTCTGTT-3′,下游引物,5′-CTAGAACAGAGTGTGGAACAGCTGGAGGACAGAGTGTGGAA CAGCTGGAGGT-3′,2端分别添加XbaⅠ酶切位点,片段包含hsa-miR-759与NGX6基因3′UTR区结合位点,长链退火形成双链DNA,后克隆至荧光素酶报告基因表达载体PGL3-promoter,重组载体命名为野生型荧光素酶报告基因表达载体pGL3-WT-NGX6,同样的方法,将预测结合位点进行错义突变,即由“5′-CACTCTG-3′”突变为“5′- TGCTCAC -3′”,构建野生型荧光素酶报告基因表达载体pGL3-MT-NGX6。重组载体经序列分析无误后,扩增转化其对应的转化细菌,然后进行无内毒素质粒DNA制备,提取过程严格按照试剂盒说明进行,使用ddH2O将质粒DNA终浓度调整至500 mg/L,-20℃保存。
1.3.4 双荧光素酶报告基因法验证has-hsa-miR-759与NGX6靶位关系 化学法合成hsa-miR-759 mimics(5′- CAGUUUUAACAAACGUGAGACGtt -3′),hsa-miR-759 inhibitor(5′- CGUCUCACGUUUGUUAAAACUGtt -3′)和hsa-miR-759 NC(5′- AACUUAGGAACGU GUCGACAUAtt -3′),RNA通过3′末端降解。接种对数期的293细胞至24孔培养板,每孔500 μl细胞悬液(1×105个细胞),培养基使用含10%FBS的DMEM完全培养基,37℃和5% CO2条件下培养24 h,参照Lipofectmaine 3000转染试剂说明书进行质粒和RNA共转染实验。实验分为9组:细胞对照组(不做处理),pGL3-WT-NGX6转染组,pGL3-MT-NGX6转染组, miRNA125-NC+pGL3-WT-NGX6转染组,miRNA125-NC+ pGL3-MT-NGX6转染组, hsa-miR-759-mimics+pGL3-WT- NGX6转染组,hsa-miR-759-mimics+pGL3-MT- NGX6,hsa-miR-759-inhibitor+pGL3-WT- NGX6转染组和hsa-miR-759-inhibitor+pGL3-MT- NGX6转染组。细胞转染后48 h,收集细胞,检测胞内荧光素酶活性。
1.3.5 转染hsa-miR-759-mimics/inhibitor对SGC-7901细胞hsa-miR-759含量及NGX6蛋白表达的影响检测 接种对数生长期的SGC-7901细胞至6孔细胞培养板,每孔添加2 mL细胞悬液(5×105个细胞),使用含10%FBS的DMEM完全培养基,正常条件过夜培养,然后进行转染实验,转染过程及RNA用量完全参照试剂盒Lipofectmaine 2000说明书。实验分为4组,细胞对照组,hsa-miR-759 NC转染组,hsa-miR-759 mimics转染组和hsa-miR-759 inhibitor转染组。转染后48 h,收集细胞,提取细胞Total RNA,荧光定量法检测hsa-miR-759含量,同时,提取细胞总蛋白,免疫印迹法检测胞内NGX6蛋白表达状况。
1.3.6 SGC-7901细胞增殖活性的检测 实验分为4组,细胞对照组、NC转染组、hsa-miR-759 mimics转染组和hsa-miR-759 inhibitor转染组。取转染后48 h的SGC-7901细胞,胰酶消化法制备细胞悬液,离心收集细胞沉淀,用含10 %FBS的DMEM完全培养基调整细胞密度至1×105个/ml,并接种细胞到96孔细胞培养板,每孔添加100 μl细胞悬液,37℃和5% CO2条件下培养细胞,在接种后24、48和72 h,MTT法检测细胞活性。检测前,每孔细胞加入MTT溶液(5 mg/ml)10 μl,轻晃使其分布均匀,正常条件继续培养4 h,去上清,每孔加入150 μl DMSO溶液,37℃放置15 min,酶标仪检测490 nm波长下细胞液的吸光度值,制作细胞生长曲线。
1.3.7 Realtime-PCR检测hsa-miR-759含量 取2 μg的细胞总RNA,反转录制备cDNA,特异反转录引物:H.sapiens 6 snRNA: 5′-TACCTTGCGAAGTGCTTAAAC-3′,hsa-miR-759: 5′-GTCGTATCCAGTGCGTGTCGTG GAGTCGGCAATTGCACTGGATACGAGTCAA-3′,取2 μl反转录产物作为PCR反应模板,SYBR Premix ExTaq10 μl,引物(10 μmol/L)各取0.25 μl,反应体系用dH2O补足至20 μl。PCR反应条件:95℃ 10 s;55℃ 10 s;72 ℃ 10 s,反应循环数为42。PCR引物序列:U6上游引物5′-GTGCTCGCTTCGGC AGCACAT-3′,下游引物5′-TACCTTGCGAAGTGC TTAAAC-3′;hsa-miR-759上游引物5′-GCCGGCGCCCGAGCTCTGGCTC-3′,下游引物5′- GCAGAGTGCAAACAATTTTGAC-3′。结果分析中,以U6作为对照,ΔΔCt法分析定量结果。
1.3.8 Western blotting检测NGX6蛋白相对含量 SDS-聚丙烯酰胺凝胶分离胶浓度为11%,蛋白上样量为10 μg,然后经110 V电压90 min电泳,400 mA恒定电流转膜90 min,转膜后以5%的脱脂牛奶封闭2 h,4 ℃一抗过夜孵育,NGX6和GAPDH一抗稀释(TBST)比分别为1︰300和1︰1 000;一抗过夜孵育后,TBST洗膜3次,加入二抗孵育2 h,羊抗鼠二抗稀释比为1︰2 000;TBST洗膜3次,添加ECL化学发光液反应底物,曝光X底片,最后对目的条带光密度值进行分析。
1.4 统计学处理
所有数值都用均数±标准差(x±s)表示。细胞增殖的数据通过方差分析和两两比较,P<0.05表示差异有统计学意义,所有分析均以SPSS 13.0统计软件完成。
2 结果
2.1 胃癌标本中hsa-miR-759与NGX6蛋白含量检测
相比较于癌旁组织,胃癌组织中的hsa-miR-759含量明显降低,差异有统计学意义(P<0.05)(图1A);NGX6蛋白含量检测结果(图2B)显示,胃癌组织和癌旁组织中蛋白含量分别为(1.00±0.16)和(4.31±0.85),差异有统计学意义(P<0.05)。

注:与肿瘤组织比较aP<0.05。A为miR-759含量,B为NGX6蛋白含量电泳图和蛋白表达水平图1 肿瘤标本中hsa-miR-759与NGX6蛋白含量检测
2.2 hsa-miR-759与NGX6靶位关系验证
生物信息学预测显示,miR-759在NGX6基因3′UTR区有6个碱基的结合位点(图2A)。细胞共转染后48 h,荧光素酶相对活性检测结果显示(图2B),hsa-miR-759 mimics能够明显抑制野生型荧光素酶表达载体荧光素酶活性,从5.51±0.68降至1.82±0.39,差异具有统计学意义(P<0.05),而hsa-miR-759 inhibitor则能够增强野生型荧光素酶报告基因表达载体的荧光素酶活性,5.51±0.68上升至10.02±0.49,组间差异有统计学意义(P<0.05);对于突变型荧光素酶报告基因表达载体,无论hsa-miR-759 mimics或者hsa-miR-759 inhibitor都对其无明显影响。以上数据和结果说明,hsa-miR-759可以通过预测靶位结合于NGX6基因3′UTR区,并对基因表达进行负调控。
2.3 SGC-7901细胞转染后hsa-miR-759含量及NGX6蛋白表达检测
SGC-7901细胞转染hsa-miR-759-mimics或者inhibitor后48 h,细胞内hsa-miR-759含量明显升高或者降低(图3A),与对照组比较,差异有统计学意义(P<0.05),而hsa-miR-759-NC转染组hsa-miR-759含量与对照组比较,差异无统计学意义(P>0.05);蛋白含量检测结果说明(图3B),SGC-7901细胞转染hsa-miR-759-mimics或者inhibitor后48 h,细胞内NGX6含量明显降低或者升高,与细胞对照组比较,差异有统计学意义(P<0.05),而hsa-miR-759-NC转染组NGX6蛋白表达与对照组比较,差异无统计学意义(P>0.05)。
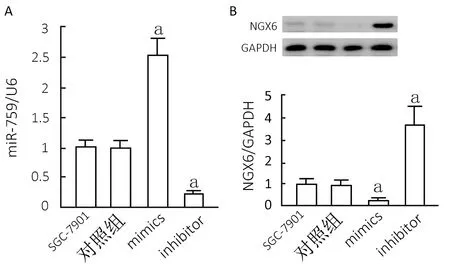
注:与对照组比较aP<0.05。A为各组miR-759含量,B为各组NGX6蛋白含量电泳图和蛋白表达水平图3 转染后SGC-7901细胞内hsa-miR-759及NGX6蛋白含量检测
2.4 hsa-miR-759含量变化对SGC-7901细胞增殖活性的影响
细胞活性检测结果(图4)所示,转染后48 h和72 h,与转染对照组比较,hsa-miR-759 mimics转染组细胞增殖活性则明显增强,hsa-miR-759 inhibitor转染组SGC-7901细胞增值活性明显降低(P<0.05 vs 对照组,相同时间点),NC转染组细胞增殖活性与对照组比较,差异无统计学意义(P>0.05)。
3 讨论
微小RNA(micro RNA, miRNA) 属于内源性非编码RNA,可以通过种子区与其靶基因3′-UTR区结合,从而抑制基因翻译[3]。miRNA与肿瘤关系密切,作为癌基因和肿瘤抑制基因,参与关键的发病机制[6-7]。miRNA-483-3p和miRNA-21在胰腺导管癌患者血清中的含量明显升高,miRNA-483-3p可以作为管内乳头状黏液性肿瘤(IPMN)患者和胰腺导管腺癌的血浆样品(PDAC)患者的区分标志物,而miRNA21则可以作为PDAC患者预后标志物[8]。miR-34c被发现可以对乳腺癌的细胞周期产生调控作用[9]。前列腺的相关研究表明,miR-23a的下调,会导致MAPK、JAK/STAT等肿瘤调控通路的过度激活,进而导致细胞增殖的失控,体外研究表明,miR-23a有作为胰腺癌基因治疗的潜在靶点[10]。这些研究表明,miRNAs调控机制的失活,是多种肿瘤发生发展的内在因素和始作俑者,因此其完全具有成为肿瘤基因治疗靶点的可能。miRNA与胃癌亦具有密切的关系,miR-144-zfx调控轴在胃癌恶性病变中具有关键作用[11],miR-107有潜力作为胃癌患者胃癌肿瘤缺氧检测的生物标志物[12],而mir-367被证实是胃癌的侵袭和转移的一个关键的负调控因子[13]。与胃癌相关的miRNA研究表明,miRNA在胃癌细胞的增殖,分化和凋亡中具有关键作用,是胃癌的发生、侵袭和转移的重要调控因子[13]。
NGX6基因位于染色体9号染色体的q21-22区域[4],研究表明在多种肿瘤中存在其等位基因的事实[5]。Guo Q等研究发现,NGX6与胃癌的发病率和死亡率密切相关,NGX6可以作为种新型的肿瘤抑制基因,过表达基因可以抑制人体胃癌细胞株HT-29的侵袭,NGX6的这种肿瘤抑制作用可能与Wnt通路的激活抑制有关[14-15]。NGX6具有多种生物学功能,如调节相关基因的蛋白表达,涉及细胞信号转导通路,负调控细胞周期,抑制血管生成,增加患者对抗癌药物的敏感性。有研究表明,NGX6通过组蛋白H3K9负调控核转录因子SP1的启动子甲基化,进而影响其作为转录因子的功能,NGX6可以作为恶性肿瘤的潜在靶基因,具有极大的应用研究价值[16-17]。
在胃癌组织中验证NGX6的表达,数据显示NGX6在胃癌组织中的表达量明显低于癌旁组织,对胃癌组织中NGX6蛋白低表达的原因做了研究,生物信息学显示,hsa-miR-759可能靶向调控NGX6,那么在胃癌中hsa-miR-759的表达情况是否也具有异常呢。荧光定量检测结果显示,胃癌组织中hsa-miR-759的含量显著高于癌旁组织,hsa-miR-759 与NGX6在胃癌中的表达具有显著的负相关性。那么hsa-miR-759在胃癌中的高表达是否导致NGX6表达降低,是否是胃癌的发生、发展的关键因素,无疑是一个值得研究的课题。
Hsa-miR-759定位于人13号染色体,截止目前,未见有关于其与肿瘤或者胃癌的相关报道。首先对hsa-miR-759与NGX6蛋白表达相关性做出分析,在二者具有显著负相关性的基础上,通过生物信息学对二者结合位点做了分析,并通过荧光素酶报告基因实验进行了验证。hsa-miR-759在胃癌中的高表达导致了肿瘤组织内NGX6表达的显著降低,通过基因干预的方式,改变了细胞内hsa-miR-759的含量,并且对SGC-7901细胞的增殖活性产生了明显影响,这组数据是令人鼓舞的,通过转染miR-759-inhibitor到SGC-7901细胞,明显抑制了细胞内hsa-miR-759相对含量,增强了细胞内NGX6蛋白含量,同时抑制了肿瘤细胞的增殖活性。所有数据说明,miR-759-inhibitor通过抑制SGC-7901细胞内hsa-miR-759,增强了靶蛋白NGX6表达,而高表达的NGX6则明显抑制了SGC-7901细胞的增殖活性。
本研究的意义在于,首次证实hsa-miR-759-inhibitor可以抑制胃癌细胞SGC-7901的增殖活性,且这种作用是通过上调其靶蛋白NGX6来实现的。这提示,hsa-miR-759有潜力成为基因治疗的新靶点。
[1] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008[J]. GLOBOCAN 2008, Int J Cancer, 2010,127(12):2893-2917.DOI:10.1002/ijc.25516.
[2] Haruta H, Hosoya Y, Sakuma K, et al. Clinicopathological study of lymph-node metastasis in 1,389 patients with early gastric cancer: assessment of indications for endoscopic resection[J]. J Dig Dis, 2008,9(4):213-218.DOI:10.1111/j.1751-2980.2008.00349.
[3] Sakuramoto S, Sasako M, Yamaguchi T, et al. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine[J]. N Engl J Med, 2007,357(18):1810-1820.DOI:10.1056/NEJMoao72252.
[4] Jianbo Y, Bin LH, Li ZH, et al. Refined localization and cloning of a novel putative tumor suppressor gene associated with nasopharyngeal carcinoma on chromosome 9p21-22[J]. Chin J Cancer, 2000,(19):6-9.
[5] Yang J, Tang X, Deng L.Detailed deletion mapping of chromosome 9p21-22 in nasopharyngeal carcinoma[J]. 中华肿瘤杂志, 1999,21(6):419-421.
[6] Abba M, Mudduluru G, Allgayer H. MicroRNAs in cancer: small molecules, big chances[J]. Anticancer Agents Med Chem,2012,12(7):733-743.DOI:10.2174/187152012802650273.
[7] Adams BD, Kasinski AL, Slack FJ. Aberrant regulation and function of microRNAs in cancer[J]. Curr Biol,2014,24(16):R762-776.DOI:org/10.1016/j.cub.2014.06.043.
[8] Abue M, Yokoyama M, Shibuya R, et al. Circulating miR-483-3p and miR-21 is highly expressed in plasma of pancreatic cancer[J]. Int J Oncol, 2015,46(2):539-547.DOI:10.3892/ijo.2014.2743.
[9] Achari C, Winslow S, Ceder Y, et al. Expression of miR-34c induces G2/M cell cycle arrest in breast cancer cells[J]. BMC Cancer, 2014,14:538.DOI:10.1186/1471-2407-14-538.
[10] Aghaee-Bakhtiari SH, Arefian E, Naderi M, et al. MAPK and JAK/STAT pathways targeted by miR-23a and miR-23b in prostate cancer: computational and in vitro approaches[J]. Tumour Biol, 2015,36(6):4203-4212.DOI:10.1007/s13277-015-3057-3.
[11] Akiyoshi S, Fukagawa T, Ueo H, et al. Clinical significance of miR-144-ZFX axis in disseminated tumour cells in bone marrow in gastric cancer cases[J]. Br J Cancer, 2012,107(8):1345-1353.DOI:10.1038/bjc.2012.326.
[12] Ayremlou N, Mozdarani H, Mowla SJ, et al. Increased levels of serum and tissue miR-107 in human gastric cancer: Correlation with tumor hypoxia[J]. Cancer Biomark, 2015,15(6):851-860.DOI:10.3233/CBM-150529.
[13] Bin Z, Dedong H, Xiangjie F, et al. The microRNA-367 inhibits the invasion and metastasis of gastric cancer by directly repressing Rab23[J]. Genet Test Mol Biomarkers, 2015,19(2):69-74.DOI:10.3748/wjg.5411.
[14] Li PF, Chen SC, Xia T, et al. Non-coding RNAs and gastric cancer[J]. World J Gastroenterol, 2014,20(18):5411-5419.DOI:10.3748/wig.u20.i18.5411.
[15] Guo Q, Shen S, Liao M, et al. NGX6 inhibits cell invasion and adhesion through suppression of Wnt/beta-catenin signal pathway in colon cancer[J]. Acta Biochim Biophys Sin (Shanghai), 2010,42(7):450-456.DOI:10.1093/abbs/gmq049.
[16] He S, Zhong Y, Shuai C, et al. Tumor suppressor NGX6 inhibits the growth and metastasis of multiple cancers[J]. Tumour Biol, 2016,37(5):5751-5760.DOI:10.1007/s13277-016-4966-5.
[17] Li J, Tan C, Xiang Q, et al. Proteomic detection of changes in protein synthesis induced by NGX6 transfected in human nasopharyngeal carcinoma cells[J]. J Protein Chem, 2001,20(3):265-271.DOI:10.1023/A:1010912311564.
(本文编辑:张阵阵)
210002 南京,解放军第四五四医院普外科(储著凌、侯乐伟、胡国强、胡君、尹鹏),消化科(朱清)
朱清,电子信箱:luyican321@163.com
R753
B
10.3969/j.issn.1009-0754.2016.06.021
2015-12-24)
