侧脑室注射腺苷A1受体激动剂对硝酸甘油偏头痛模型大鼠的影响
2017-01-12陈金波宋晓文吴欣彤董晓梦鲁文先
李 斌, 陈金波, 宋晓文, 吴欣彤, 董晓梦, 鲁文先, 丁 蕊, 刘 曼
侧脑室注射腺苷A1受体激动剂对硝酸甘油偏头痛模型大鼠的影响
李 斌, 陈金波, 宋晓文, 吴欣彤, 董晓梦, 鲁文先, 丁 蕊, 刘 曼
目的 通过对硝酸甘油偏头痛模型大鼠侧脑室注射腺苷A1受体激动剂(R-phenylisopropyl-adenosine,R-PIA),探讨腺苷在偏头痛中的作用及机制。方法 观察各组大鼠不同时间段内挠头、爬笼次数及心率变化,采用Elisa、免疫组织化学法、Western blot技术检测血液、三叉神经节(trigeminal ganglion,TG)、三叉神经脊束核尾核(spinal trigeminal nucleus caudalis,TNC)处降钙素基因相关肽(calcitonin gene-related peptide,CGRP)的表达。结果 (1)与模型组相比,治疗组大鼠挠头、爬笼次数均减少并呈剂量依赖性(P<0.05),且大鼠心率没有明显变化;(2)治疗组大鼠血液、TG、TNC部位CGRP的表达较模型组均降低(P<0.05)。结论 激活的腺苷A1受体能够通过抑制神经源性炎症反应及痛觉传导,从而抑制三叉神经血管系统的激活及痛觉敏化,对偏头痛产生镇痛作用。
偏头痛; 降钙素基因相关肽; 侧脑室注射; 腺苷A1 受体
偏头痛(migranine)不仅仅是一种头痛,更是一种能够使人衰弱的复杂神经系统疾病,电生理及影像学研究已经揭示了在偏头痛诱发及发作时中枢神经系统,包括大脑皮质、脑干、下丘脑以及外周三叉神经血管系统潜在的变化[1]。其程度多为中至重度,性质多样但以搏动性最具特点,可伴有恶心、呕吐,畏光、畏声[2]。偏头痛发病机制尚未明确,目前三叉神经血管反射学说[3]占主导地位,其中最重要的是神经源性炎症反应及痛觉敏化[4,5]。腺苷是一种内源性神经递质,研究表明,脑干网状结构、静脉、侧脑室内给予腺苷均有镇痛作用[6,7],但其在偏头痛的作用尚未明确。硝酸甘油偏头痛模型是目前唯一可以观察动物行为学表现的偏头痛模型,并且该模型支持三叉神经血管反射学说,是经典偏头痛动物模型之一。
本研究拟通过侧脑室注射R-PIA,观察其对生理状态下偏头痛模型大鼠行为学表现、心率及相关部位CGRP表达的影响,探讨腺苷在偏头痛中的作用及机制 。
1 材料和方法
1.1 实验动物及分组 60只SPF级雄性SD大鼠(250~300 g),购于济南朋悦实验动物繁育有限公司。大鼠按随机数字法分为空白组(n=10)、模型组(n=10)、治疗组(n=30);治疗组再根据不同注药浓度随机分为3组:R-PIA0.5组(n=10)、R-PIA1.0组(n=10)、R-PIA2.0组(n=10);阻滞剂组:R-PIA2.0+DPCPX组(n=10),除空白组大鼠外均建立侧脑室置管模型,置管成功后大鼠单笼饲养1 w,待大鼠血脑屏障恢复后颈部皮下注射硝酸甘油(10 mg/kg)复制偏头痛模型,造模成功后各组随机分为两组(n=5):一组观察大鼠行为学1.0 h后颈外静脉取血、心脏灌注取大鼠TG和TNC部位,分别采用Elisa、免疫组织化学检测CGRP的表达;另一组采用套尾法测量大鼠0 min、20 min、40 min、60 min的心率,1.0 h后颈外静脉取血、取大鼠TG和TNC部位采用Elisa、Western blot技术检测CGRP的表达。
1.2 主要试剂和仪器 主要试剂:兔抗大鼠CGRP抗体(美国Abcam公司),对应辣根过氧化物酶标记的羊抗兔IgG抗体(博士德生物公司),Western blot试剂盒(碧云天生物技术有限公司),CGRP试剂盒(上海西唐生物科技有限公司),DAB染色液及苏木素染色液(福州迈新生物技术有限公司),R-PIA、DPCPX、二甲基亚砜(美国sigma公司),牙托粉,牙托水。主要仪器包括ZHRXZ柔性颅骨钻及ZH蓝星脑立体定位仪(安徽正华生物仪器设备有限公司),酶标仪、电泳仪、湿转转膜仪(美国Bio-rad 公司),OLYMPUS BX51显微镜+DP72显微照相、单管微量给药系统(深圳瑞沃德生命科技有限公司),微量注射器(上海高鸽工贸有限公司),ZH-HX-Z大小鼠无创血压测量分析系统(安徽正华生物仪器设备有限公司)。
1.3 方法
1.3.1 侧脑室置管及偏头痛模型的建立及行为学观察 参照黄贤键等人[8]的方法将大鼠用10%水合氯醛腹腔注射麻醉后固定在立体定位仪上,纵向切开头皮,暴露前囟门。前囟门为零点,旁开1.5 mm向后1.0 mm,颅骨转钻孔后涂少量胶水在导管底部,导管垂直置入,牙科水泥封闭导管周围,盖上导管帽,红霉素软膏涂抹创面。大鼠单笼饲养1 w后颈部皮下注射硝酸甘油(10 mg/kg)复制偏头痛模型[9],采用持续时间分段记数的方法,每30 min为一个时段,记录造模完成后各个时间段内大鼠爬笼、挠头的次数,挠头出现时间以连续挠头5次以上为标志。
1.3.2 实验给药及心率测量 侧脑室置管模型制备成功1 w后,套管连接微量注射器,其中R-PIA、DPCPX均溶于10 μl DMSO中,缓慢匀速(2 μl/min)注入药物后盖上导管帽。实验结束后通过导管注入0.5% Evans蓝10 μl,处死大鼠后去除侧脑室未染色的大鼠,确保给药部位的准确性。大鼠置于保温桶内,暴露尾巴并将其穿过加压尾套,待大鼠安静后开始测量心率,连续测量3次,取平均值,大鼠于实验开始前1 w行适应性训练,使大鼠习惯尾套操作过程。
1.3.3 Elisa 颈外静脉取血2 ml注入预冷的试管中,每毫升血液加入10% Na EDTA 15 μl,颠倒混匀,3000 r/min离心10 min取上层清液分装后置于冰箱保存待测。按试剂盒说明检测各组大鼠血清中CGRP水平,根据标准品的浓度及对应的吸光度(OD)值在回归方程上计算出对应的样品浓度。
1.3.4 免疫组织化学染色 10%水合氯醛腹腔注射麻醉大鼠,开胸经左心室插管至升主动脉快速注射37 ℃生理盐水至右心耳流出液变清、肝脏变白,多聚甲醛磷酸缓冲液灌注至大鼠肝脏变韧,肢体变僵直后取出TG、TNC对应的脑干部位,4%多聚甲醛磷酸缓冲液中固定12~24 h后,常规脱水、包埋、切片,将上述切片烤片,二甲苯脱蜡,梯度酒精复水,0.01 mol/L PBS洗5 min×3次,柠檬酸盐缓冲液微波炉热抗原修复,0.01 mol/L PBS洗5 min×3次,3% H2O2孵育20 min(室温),PBS洗5 min×3次,5% BSA封闭30 min(室温),加一抗(稀释倍数:1∶350)4 ℃ 过夜,0.01 mol/L PBS洗5 min×3次,滴加二抗,37 ℃孵育30 min,0.01 mol/L PBS洗5 min×3次,DAB显色、苏木素复染、盐酸酒精分化、脱水透明、封片后,显微镜下观察。光镜(×40)下观察拍摄,每只大鼠取5张切片,每张切片随机取6个视野,对阳性表达部分进行平均光密度值(MOD)测定,每组至少测定3次取均值。
1.3.5 Western blot (1)大鼠10%水合氯醛腹腔注射麻醉,取出TG、TNC对应的脑干,置于玻璃匀浆器中,加入裂解液和蛋白酶抑制剂研磨均匀,离心(4 ℃ 12000 r/min,10 min)取上清,测定蛋白浓度后向加入蛋白上样缓冲液,100 ℃煮沸5 min,放入-80 ℃保存备用。 (2)每个上样孔中加入40 μg 蛋白样品电泳,然后电转移到PVDF膜,5%脱脂奶粉封闭2 h,加用一抗稀释液稀释的一抗(1∶500),β-actin(1∶3000)作为内参对照,4 ℃孵育过夜,TBST洗膜,加辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶5000),37 ℃振荡孵育2 h,TBST 洗膜,显影、曝光,Image J 软件分析吸光度值(A 值)。最终结果以目的蛋白A值与内参蛋白A 值的比值表示。

2 结 果
2.1 行为学观察 观察大鼠各时间段内挠头、爬笼次数,发现0~30 min除空白组外,各组大鼠挠头、爬笼次数均增多,考虑与针刺等导致大鼠激惹有关,30~60 min,与空白组相比,模型组大鼠挠头、爬笼次数均明显增多,差异具有统计学意义(P<0.05);治疗组与模型组相比爬笼、挠头次数减少,差异具有统计学意义(P<0.05);阻滞剂组与模型组相比差异无统计学意义(P>0.05)(见表1)。
2.2 对CGRP表达的影响 本实验通过Elisa技术检测颈外静脉血CGRP、通过免疫组化及Western技术检测TG、TNC部位CGRP表达,发现与空白组相比各组CGRP水平均明显升高(P<0.05)。治疗组与模型组相比CGRP水平均显著降低(P<0.05);各治疗组间两两比较差异具有统计学意义(P<0.05);阻滞剂组与模型组相比未见明显差异(P>0.05)(见图1~图5)。
2.3 对心率的影响 不同时间点各组大鼠心率两两比较均无统计学意义(P>0.05)(见表2)。
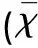
表1 各组大鼠不同时间点挠头、爬笼次数比较±s)
与空白组相比#P<0.05;与模型组相比△P<0.05
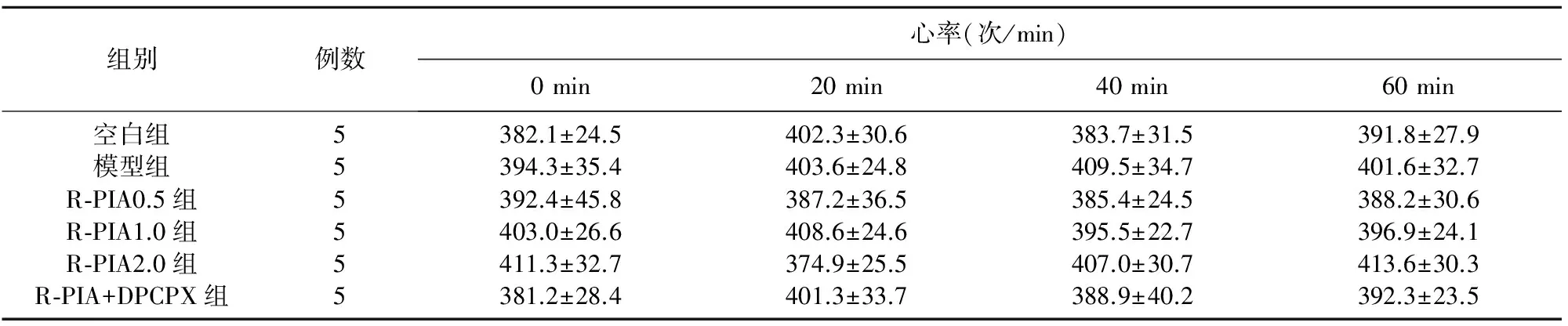
表2 不同时间点各组大鼠心率

与R-PIA0.5组相比#P<0.05;与R-PIA1.0组相比△P<0.05
图1 各组大鼠血浆CGRP水平
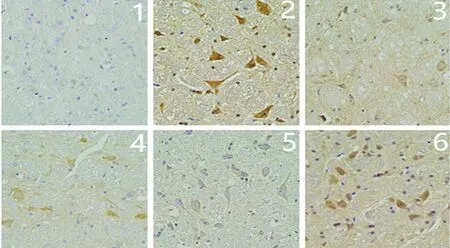
图2 各组大鼠三叉神经脊束尾核(TNC)CGRP的表达(免疫组化×40)
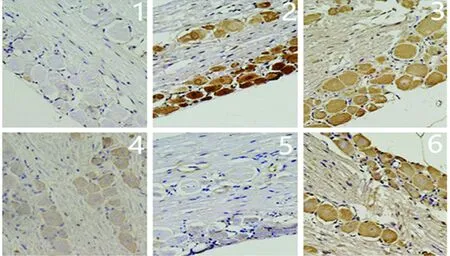
图3 各组大鼠三叉神经节(TG)CGRP的表达(免疫组化×40)
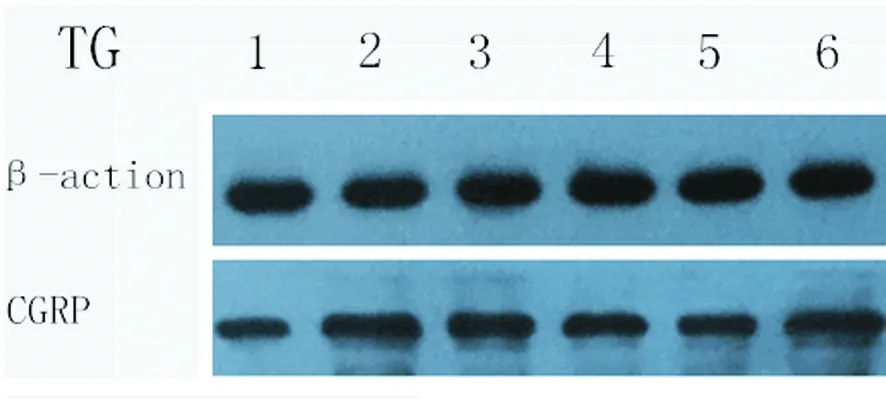
图4 各组大鼠三叉神经节CGRP的表达(WB)
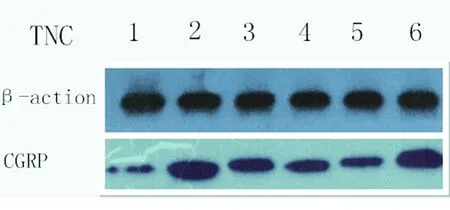
图5 各组大鼠三叉神经脊束核尾核CGRP的表达(WB)
3 讨 论
目前认为,三叉神经血管系统的激活是偏头痛发生的重要环节,颅内疼痛敏感组织周围的三叉神经末梢受到刺激后,伤害性刺激延着传入纤维传至三叉神经尾核导致中枢性敏化,接着传至丘脑的三级神经元,最后传到额叶产生畏光、畏声;传至大脑皮质产生痛觉[10]。CGRP在偏头痛中有重要的作用,偏头痛发作时,三叉神经系统激活导致突触前神经末梢释放血管活性肽,尤其是CGRP,导致脑膜血管舒张以及神经源性炎症,颅外血管产生典型的搏动样疼痛[11]。目前来说,CGRP是急性偏头痛发作时唯一可靠的神经递质[12]。研究者比较一致地认为,CGRP在偏头痛发生机制中的作用集中体现在CGRP与三叉神经血管系统的相互作用中或CGRP对三叉神经血管系统的激活上,其中神经源性炎症反应则是这一机制中的核心内容[13]。研究表明,偏头痛发作时偏头痛的强度和持续时间与血浆CGRP水平呈正相关[14],此外,静脉注射外源性CGRP可以诱发偏头痛样疼痛发作并且CGRP受体阻滞剂对急性偏头痛的治疗是有效的[15,16]。本实验结果显示,与空白组相比,各组大鼠CGRP水平均明显升高,且大鼠出现典型的耳红、挠头、爬笼等表现,其挠头、爬笼次数与CGRP水平正相关,说明硝酸甘油模型能够模拟大鼠偏头痛发作时的三叉神经血管反射学说,其行为学表现能够反映大鼠的头痛程度。
腺苷是一种重要神经递质和调质,广泛分布于全身各个系统。其通过与特异的受体结合,参与体内多个系统疾病的病理生理过程。其中A1R和A2AR在脑内的分布明显多于另外两种受体,且与腺苷的亲和力也更强。A1受体在痛觉的传递、抗抑郁、抗炎中有重要的作用。Goadsby等人研究发现[17],麻醉猫中静脉注射R-PIA能够抑制电刺激偏头痛模型CGRP的表达,并且不伴有血管收缩,提示R-PIA作为非血管收缩药物治疗偏头痛的潜能。结合本实验的结果:通过对偏头痛大鼠侧脑室注射不同剂量R-PIA及DPCPX,发现与模型组相比,治疗组大鼠CGRP水平均降低,并且随着R-PIA剂量增加,对CGRP表达的抑制作用增强,其抑制作用可被DPCPX阻滞,说明侧脑室注射R-PIA可以通过激活腺苷A1受体,对偏头痛产生镇痛作用。
研究证实,腺苷对炎性疼痛及神经性疼痛均有效,主要通过A1R实现,其作用机制目前认为包括两方面:(1)突触前抑制作用,指腺苷能够抑制Ca+依赖性突触的递质释放减少;(2)突触后抑制作用,指腺苷导致突触后膜K+通道开放,突触后膜超极化,抑制伤害性刺激的传导及传入神经纤维释放CGRP,进而抑制中枢敏化。腺苷对偏头痛的作用及其机制尚需进一步研究,研究[18]表明,偏头痛发作时,腺苷A1受体的表达与CGRP水平负相关,考虑A1R的增多可能对偏头痛的发作起到一种保护作用。本实验通过侧脑室注射R-PIA,证实其能够降低偏头痛发作时CGRP的表达,抑制伤害性刺激的传导,减少大鼠行为学评分,对偏头痛具有镇痛作用,其机制考虑同样是激活的A1R抑制Ca+依赖性突触的递质释放减少,加强突触后膜K+通道开放,使突触后膜超极化,从而抑制伤害性刺激的传导及中枢敏化。本实验建立侧脑室置管模型,通过侧脑室注射R-PIA研究其对偏头痛大鼠行为学、心率及相关部位CGRP表达的影响。结果表明侧脑室注射R-PIA能够通过减少血液中CGRP的释放及TG、TNC部位CGRP的表达,减少大鼠挠头、爬笼次数,对偏头痛大鼠产生镇痛作用,此镇痛作用可被DPCPX阻滞;此外,既往研究表明,静脉注射R-PIA可产生一过性低血压、心动过缓,本实验测量大鼠不同时间心率情况,与正常大鼠相比未见明显异常,考虑静脉注射R-PIA能够激活心脏A1R,导致负性变时、变力、变传导。
综上所述,侧脑室注射R-PIA能够对偏头痛产生镇痛作用,考虑与激活的A1R抑制Ca+依赖性突触的递质释放减少,激活突触后膜K+通道,导致细胞膜超极化,从而抑制三叉神经系统激活,减少伤害性刺激向二级感觉中枢的传导,抑制神经源性炎症反应及中枢敏化的产生。进一步探讨腺苷及其受体对偏头痛作用机制的研究将有助于我们更深入的了解偏头痛的发病机制,并且为新的镇痛药物的研究及临床应用提供理论依据。
[1]Russo AF.Calcitonin gene-related peptide (CGRP):a new target for migraine[J].Annu Rev Pharmacol Toxicol,2015,55:533-552.
[2]李舜伟,李焰生,刘若卓,等.中国偏头痛诊断治疗指南[J].中国疼痛医学杂志,2011,17(2):67-86.
[3] Andreou AP,Shields KG,Goadsby P.GABA and valproate modulate trigeminovascular nociceptive transmission in the thalamus[J].Neurobiol Dis,2010,37(2):314-323.
[4]Noseda R,Burstein R.Migraine pathophysiology:anatomy of the trigeminovascular pathway and associated neurological symptoms,CSD,sensitization and modulation of pain[J].Pain,2013,154:S44-S53.
[5]Burstein R,Jakubowski M.Managing migraine associated with sensitization[J].Handb Clin Neurol,2010,97:207-215.
[6]Sjlund KF,Belfrage M,Karlsten R,et al.Systemic adenosine infusion reduces the area of tactile allodynia in neuropathic pain following peripheral nerve injury:a multi-centre,placebo-controlled study[J].Eur J Pain,2001,5(2):199-207.
[7]Ma HC,Wang YF,Feng CS,et al.Effects of adenosine agonist R-phenylisopropyl-adenosine on halothane anesthesia and antinociception in rats[J].Acta Pharmacol Sin,2005,26(2):181-185.
[8] 黄贤键,毛 青,林 勇,等.一种简单实用的大鼠侧脑室置管模型[J].中国临床神经外科杂志,2012,17(8):585-587.
[9]Sufka KJ,Staszko SM,Johnson AP,et al.Clinically relevant behavioral endpoints in a recurrent nitroglycerin migraine model in rats[J].J Headache Pain,2016,17(1):40.
[10] Tepper SJ,Stillman MJ.Clinical and preclinical rationale for CGRP-receptor antagonists in the treatment of migraine[J].Headache,2008,48(8):1259-1268.
[11]Cernuda-Morollon E,Larrosa D,Ramon C,et al.Interictal increase of CGRP levels in peripheral blood as a biomarker for chronic migraine[J].Neurology,2013,81(14):1191-1196.
[12]Schwedt TJ.Chronic migraine[J].BMJ,2014,348:1416.
[13]Charles A.Migraine is not primarily a vascular disorder[J].Cephalalgia,2012,32(5):431-432.
[14] Han TH,Blanchard RL,Palcza J,et al.The dose proportionality of telcagepant after administration of single oral and intravenous doses in healthy adult subjects [J].Arch Drug Inf,2010,3(4):55-62.
[15] Lassen LH,Haderslev PA,Jacobsen VB,et al.CGRP may play a causative role in migraine[J].Cephalalgia,2002,22(1):54-61.
[16]Ho TW,Edvinsson L,Goadsby PJ.CGRP and its receptors provide new insights into migraine pathophysiology[J].Nat Rev Neurol,2010,6(10):573-582.
[17]Goadsby PJ,Hoskin KL,Storer RJ,et al.Adenosine A1 receptor agonists inhibit trigeminovascular nociceptive transmission[J].Brain,2002,25(6):1392-1401.
[18]Lu W,Li B,Chen J,et al.Expression of calcitonin gene-related peptide,adenosine A2a receptor and adenosine A1 receptor in experiment rat migraine models[J].Biomed Rep,2016,4(3):379-383.
Analgesic effect of adenosine A1 receptor agonist into lateral ventricles in rat models of migraine
LIBin,CHENJinbo,SONGXiaowen,etal.
(DepartmentofNeurology,TheAffiliatedHospitalofBinzhouMedicalUniversity,Binzhou256603,China)
Objective To investigate the mechanism of the adenosine in the treatment of migraine,the adenosine A1 receptor agonist was injected into the lateral ventricles of rats of migraine.Methods Observed the numbers of the rats scratching their heads,climbing cage times and heart rate changes,and the ELISA,immunohistochemistry,Western blot techniques were used to detect the expression of the calcitonin gene-related peptide(CGRP).Results Compaired with model group,R-PIA produced a dose-dependent manner of the behavioral manifestations and the expression of CGRP.Conclusion Adenosine A1 receptor agonist can inhibit the activation of trigeminal vascular system by inhibiting the neurogenic inflammation reaction and trigeminovascular nociceptive transmission,which can produce analgesic effect on migraine.
Migraine; CGRP; Intracerebroventricular injection; Adenosine A1 receptor
1003-2754(2016)12-1091-04
2016-08-16;
2016-11-29 基金项目:山东省高等学校科技计划项目(J12LL63) 作者单位: (滨州医学院附属医院神经内科,山东 滨州 256600) 通讯作者:陈金波,E-mail:chenjinbo6719@163.com
R741.041
A
