经颅电刺激对阿尔兹海默病大鼠学习记忆能力和海马CA1区磷酸化tau蛋白表达情况的影响
2017-01-12刘玥,刘芳
刘 玥, 刘 芳
经颅电刺激对阿尔兹海默病大鼠学习记忆能力和海马CA1区磷酸化tau蛋白表达情况的影响
刘 玥, 刘 芳
目的 探讨经颅电刺激对阿尔兹海默病(Alzeheimer’s disease,AD)大鼠学习记忆能力和海马CA1区磷酸化tau蛋白表达的影响。方法 健康SD大鼠,随机分为:正常组、假手术组、模型组及经颅电刺激2 w、4 w、6 w组。采用大鼠侧脑室注射Aβ25-35凝聚态β-淀粉样肽,同时腹腔注射D-半乳糖的方法,建立AD动物模型。Morris水迷宫实验检测各组大鼠学习、记忆能力,HE染色,观察海马CA1区形态学结构,免疫组化测定海马CA1区磷酸化tau蛋白表达情况。结果 (1)Morris水迷宫实验大鼠测试学习和记忆能力,经颅电刺激2 w组与模型组比较差异无统计学意义(P>0.05),经颅电刺激4 w组、6 w组与模型组比较,逃避潜伏期成绩均好于模型组,差异有统计学意义(P<0.05);(2)随电刺激时间延长,经颅电刺激各组磷酸化tau蛋白量逐渐降低,与模型组比较差异有统计学意义(P<0.05)。结论 经颅电刺激能够改善阿尔兹海默病大鼠的学习记忆能力,机制可能与下调海马CA1区磷酸化tau蛋白表达有关,对细胞的重塑有积极影响,远期效果有待进一步研究。
阿尔茨海默病; 经颅电刺激; 海马CA1区; 学习记忆; 磷酸化tau蛋白
阿尔茨海默病(Alzeheimer’s disease,AD)是常见的老年退行性变性疾病,是造成老年人认知功能障碍的主要病因之一。目前发病机制仍不清楚,有研究表明其发病机制可能与tau蛋白过度磷酸化、β淀粉样肽沉积、bcl-2过度表达及脑啡肽酶减少等因素有关[1,2]。AD治疗目前无有效方法,我们过去研究提示经颅电刺激治疗可改善脑梗死大鼠运动功能,原因与经颅电刺激可促进脑的可塑性相关[3]。该方法能否用于改善AD认知障碍目前仍不清楚。本研究使用经颅电刺激(transcranial electrical stimulation,TES)治疗AD模型大鼠,了解该方法对AD模型大鼠空间学习、记忆能力改善的作用和海马CA1区磷酸化tau蛋白表达影响。
1 材料与方法
1.1 实验动物 健康SD大鼠雌雄各半,由贵阳医学院实验动物中心提供[合格证号:SCXK(黔)200220001], 230±10 g,80只,经水迷宫筛选,除去游泳及学习记忆能力差异较大者4只,得到符合实验要求SD大鼠76只。
1.2 药品、试剂及主要设备 Aβ25-35:Sigma(美国)公司;D-半乳糖:进口分装,贵州赛兰德生物科技公司;磷酸化tau蛋白免疫组化试剂盒:武汉博士德生物有限公司; Morris水迷宫、跳台实验装置:中国医学科学院药物研究所;CCS-l型大脑皮质电刺激仪:河南省能源所;大鼠脑定位仪、电钻、10 μl微量进样器:成都仪器厂;OLYMPUS-CX41摄像系统、图像分析软件:美国Olympus公司。
1.3 方法
1.3.1 实验动物筛选 健康Sprague-Dawley(SD)大鼠,分组前行Morris水迷宫训练并检测逃避潜伏期及平均游泳速度,将学习记忆能力及游泳差异较大者剔除。Morris水迷宫实验方法按胡镜清等人方法进行[4]。
1.3.2 建立AD动物模型 (1)大鼠腹腔注射1.25%D-半乳糖(50 mg/kg/d),连续 6 w致衰老,假手术组腹腔注射等容积生理盐水。(2)生理盐水将Aβ25-35稀释为10 μg/μl,37 ℃孵育 1 w,使其变为聚集状态的Aβ25-35。在D-半乳糖连续处理6 w后的第2天起行Aβ25-35注射, SD大鼠用10%水合氯醛(300 mg/kg)腹腔注射麻醉后固定于立体定位仪上,切开头部皮肤,暴露颅骨。根据Paxinos[5]的《大鼠脑立体定位图》,选择右侧侧脑室为注射靶区,于前囟向后1.0 mm,中线旁开1.7 mm,深度3.8 mm处用微型电钻开颅骨,暴露硬脑膜,微量进样器缓慢将10 μg Aβ25-35注入,注射时间为10 min,留针10 min,使 Aβ25-35充分弥散;缝合皮肤,大鼠放回鼠笼中常规饲养.假手术组注入等容积生理盐水。(3)1 w后行水迷宫测试,选取痴呆大鼠纳入实验。纳入标准:行Morris水迷宫实验,方法同前,各组大鼠适应训练至逃避潜伏期成绩基本稳定,以正常组大鼠逃避潜伏期的平均值为参考值,计算每只大鼠的平均逃避潜伏期与参考值之差所占该鼠的平均逃避潜伏期比值。该值>20%则认定该鼠为造模成功大鼠。
1.3.3 分组及实验步骤 共获得符合标准的痴呆大鼠52只,随机分为痴呆组、电刺激组(又分2 w组、4 w组及6 w组),每组13只;正常组6只,假手术组6只。采用CCS-l型大脑皮质电刺激仪,将表面电极改装为圆形刺激电极,直径0.2 cm,阴极和阳极间距为1.5 cm。经颅电刺激治疗时,两级分别置于双侧海马区两侧,刺激脉宽为100 μs,刺激频率0.25 Hz,电压为1000 V窄高压方波刺激,每天连续刺激10次,刺激间隔2~3 s。经颅电刺激组分别刺激2 w、4 w、6 w。假手术组仅给予与电刺激相同的声音刺激,正常组不予特殊处理。
1.3.4 Morris水迷宫实验 正常组、假手术组、模型组,经颅电刺激2 w、4 w、6 w组于实验终点行Morris水迷宫实验,方法同前。大鼠适应训练2 d,第3天行定位航行实验,定位航行实验:把大鼠从平台对侧象限及第Ⅲ象限中点面朝水池壁放入水池中,记录大鼠找到平台的时间即逃避潜伏期。
1.3.5 大鼠海马CA1区组织HE染色及磷酸化tau蛋白表达 1%水合氯醛腹腔麻醉;4%多聚甲醛250 ml灌注固定,取出脑组织,4%多聚甲醛溶液常温下避光保存,石蜡包埋,取海马CA1区组织快速连续切片5片,分别作HE染色观察CA1区细胞形态及磷酸化tau蛋白免疫组化,在400倍视野下测定阳性细胞平均光密度值。
1.3.6 统计学方法 使用SPSS 20.0版统计软件包进行分析,组间采用χ2检验,组内采用t检验,P<0.05表示有统计学意义。
2 实验结果
2.1 各组大鼠造模前、后Morris水迷宫平均逃避潜伏期结果 造模前后水迷宫检测平均潜伏期,两组差异有显著统计学意义,说明造模成功(见表1)。
2.2 不同时期电刺激各组Morris水迷宫平均逃避潜伏期结果 电刺激2 w组在水迷宫实验中逃避潜伏期与模型组无显著差异,电刺激4 w及6 w组与模型组有显著差异P<0.05,4 w组成绩好于2 w组结果有统计学意义P<0.05(见表2)。
2.3 免疫组化检测磷酸化tau蛋白表达情况 电刺激组与模型组比较,随电刺激时间延长,磷酸化tau蛋白量逐渐降低,差异有显著统计学意义(见表3)。
2.4 HE染色模型组海马CA1区锥体细胞带排列紊乱,海马神经元脱失,排列不规则,排列紊乱,细胞层次减少,胞核与胞浆界限不清,细胞周围间隙增宽;部分神经元变性坏死,体积缩小,细胞核固缩为三角形或多角形,染色质深染。核仁消失,细胞脱失明显。电刺激2 w组海马CA1区细胞排列较整齐,神经元胞体肿胀减轻,各项病理改变均有不同程度的改善。电刺激4 w组和6 w组,与模型组大鼠比较,正常细胞数量比模型组明显增多,神经元排列更紧密,形态规则;细胞胞浆较之清亮,胞核染色更加清晰,视野中很少有核碎裂、核溶解的情况。

表1 各组大鼠造模前、后水迷宫平均潜伏期比较
与造模前比较*P<0.05,差异有统计学意义
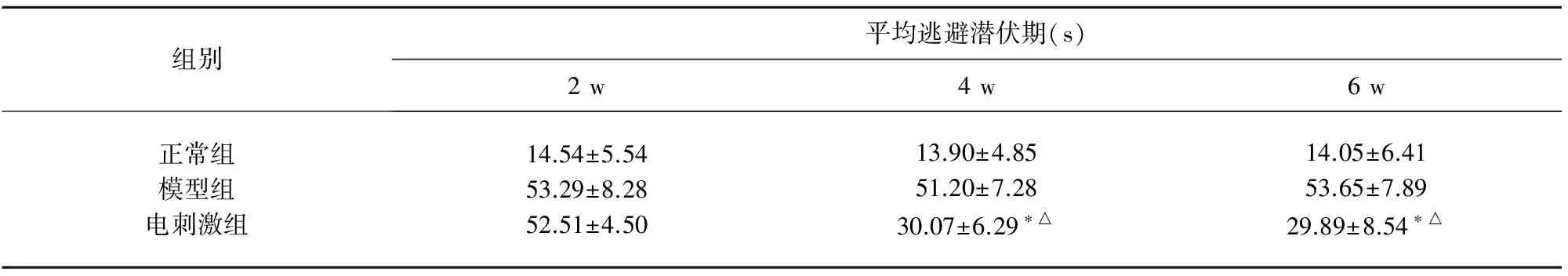
表2 各组大鼠水迷宫平均逃避潜伏期比较
与模型组比*P<0.05,差异有统计学意义;与电刺激2 w组比△P<0.05,差异有统计学意义

表3 各组大鼠海马CA1区磷酸化tau蛋白表达平均吸光度比较
与正常组比*P<0.05;与模型组比#P<0.05
3 讨 论
AD是严重影响老年人记忆和造成学习新知识能力障碍的疾病,目前认为神经元变性和纤维神经缠结为主要的病理标志[6],其中tau蛋白异常磷酸化是重要的病理改变。过度磷酸化的tau蛋白使其同微管蛋白结合能力减弱,破坏细胞骨架的稳定性,导致tau蛋白积聚形成神经元纤维缠结,破坏神经元及突触的正常功能,引起神经元凋亡;异常磷酸化的tau蛋白还可充当支架蛋白,造成树突棘功能障碍,使树突减少[7]。在阿尔兹海默病中,海马体积萎缩是早期病症之一,已经广泛应用于临床诊断。多篇研究发现,海马亚区萎缩要比海马整体萎缩更具敏感性,具体体现在CA1、CA3、presubiculum等部位[8,9]。本实验选择对海马CA1区进行观察,HE染色显示,模型组海马CA1区锥体细胞带排列紊乱,海马神经元脱失,排列不规则,细胞层次减少,体积缩小,显示部分神经元变性坏死。电刺激治疗后海马CA1区神经元形态较模型组规则,说明经颅电刺激可调节细胞结构的恢复。
造模成功后,模型组大鼠水迷宫平均逃避潜伏期时间明显延长,表明记忆能力和学习能力明显降低。予经颅电刺激治疗,最初2 w与模型组比较无明显差异,但4 w、6 w后水迷宫平均逃避潜伏期时间缩短,与模型组及2 w组比较差异有统计学意义,而4 w组和6 w组比较,差异无统计学意义。说明经颅电刺激治疗,可以改善大鼠的认知和学习能力,对记忆障碍有修复作用。修复可能通过减少磷酸化tau蛋白产生,改善神经细胞的可塑性,使突触后兴奋性电位持续增加而产生。但经颅电刺激各组与正常组比较仍有差异,原因可能与细胞重塑后,尚未形成良好的突触联系,导致认知功能和学习能力进入一个平台期。经颅电刺激改善大鼠的认知和学习能力还可能与改善血流动力学有关,Wachter[10]等认为电刺激可以扩张血管,增加血流速度,改善微循环,减轻免疫反应和炎性反应。通过免疫组化检测磷酸化tau蛋白,结果显示,经颅电刺激治疗与模型组比较磷酸化tau蛋白明显降低,治疗6 w和4 w比较,差异有统计学意义,表明经颅电刺激治疗可减少磷酸化tau蛋白的产生,减少神经纤维缠结情况。同时经颅电刺激能改善大脑神经功能,促使脑功能重组,改善认知功能。
本实验表明经颅电刺激治疗短期内能够改善痴呆大鼠的学习记忆能力,对海马CA1区细胞的重塑有积极影响。但由于本实验观察时间较短,随着磷酸化tau降低,大鼠的认知和学习能力是否会随时间的延长而进一步改善,远期效果需要进一步研究。
[1]Ness S,Rafii M,Aisen P,et al.Down’s syndrome and Alzheimer’s disease:towards secondary prevention[J].Nature Reviews Drug Discovery,2012,11(9):655-656.
[2]秦海燕,邹良玉.BCL2L12在阿尔茨海默病发病机制中的作用[J].广东医学,2014,35(3):464-465.
[3]刘 芳,张 璐.经颅电刺激对脑梗死大鼠的运动功能及神经微丝表达的影响[J].中华物理医学与康复杂志,2004,26 (8):449-451.
[4]胡镜清,温泽淮,赖世隆.Morris水迷宫检测记忆属性与方法学初探[J].广州中医药大学学报,2000,17(2):117-120.
[5]Paxinos G,Waston C.The rat brain in dtereotaxic coordinates[M].4th edition.San Diego:Academic Press,1998.
[6]Querfurth HW,Laferla FM.Alzheimer’s disease[J].New England Journal of Medicine,2010,362(4):329-344.
[7]Zempel H,Luedtke J,Kumar Y,et al.Amyloid-β oligomers induce synaptic damage via Tau-dependent microtubule severing by TTLL6 and spastin[J].Embo Journal,2013,32(22):2920-2937.
[8]Mueller SG,Schuff N,Yaffe K,et al.Hippocampal atrophy patterns in mild cognitive impairment and Alzheimer’s disease[J].Human Brain Mapping,2010,31(9):1339-1347.
[9]Martin J,Chadwic K,Heidi M,et al.Maguire.CA3size predicts the precision of memory recall[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(29):10720-10725.
[10]Wachter D,Wrede A,Schulz-Schaeffer W,et al.Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat[J].Experimental Neurology,2011,227(2):322-327.
Influences of transcranial electrical stimulation onlearning and memory ability andphosphorylated tau protein expression of hippocampal CA1area in rats with Alzheimer’s diseases
LIUYue,LIUFang.
(DepartmentofNeurology,AffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,China)
Objective To evaluate the influences of transcranial electrical stimulation onlearning and memory ability andphosphorylated tau protein expression of hippocampal CA1area in rats with Alzheimer’s diseases.Methods Healthy SD rats were randomly divided into:the normal group,the sham-operation group,the model group,and 2-week,4-week,and 6-week transcranial electrical stimulation groups.Rats were given Aβ25-35 condensed state β-amyloid peptide via lateral ventricles and D-galactosevia intraperitoneal injection at the same time to establish AD animal models.Morris water maze task was used to detect the rat learning and memory ability of each group.HE staining was carried out to observe the morphology structure of hippocampal CA1area,and immunohistochemistry was used to determine the phosphorylated tau protein expression in hippocampal CA1area.Results (1)Morris water maze task found no statistically significant differences between 2-week transcranial electrical stimulation group and the model group in rat learning and memory ability (P>0.05),and compared with the model group,the escape latency was better in the 4-week and 6-week transcranial electrical stimulation groups,with statistically significant differences (P<0.05);(2)With the extension of electrical stimulation,the amount of phosphorylated tau protein was gradually decreased in each transcranial electrical stimulation group,with statistically significant differences (P>0.05).Conclusion Transcranial electrical stimulation can improve the learning and memory ability of rats with Alzheimer’s disease.The mechanism may be related to down-regulating phosphorylated tau protein in hippocampal CA1area.It has positive effects on the reshaping of the cells,but the long-term effects remain to be further researched.
Alzheimer’s disease; Transcranial electrical stimulation; Hippocampal CA1area; Learning and memory; Phosphorylated tau protein
1003-2754(2016)12-1104-03
2016-08-13;
2016-11-30 基金项目:贵州省科技技术基金[No.黔科合J字(2011)2236号]作者单位:(贵州医科大学附属医院神经内科,贵州 贵阳 550004) 通讯作者:刘 芳,E-mail:liufang_C@126.com
R749.1
A
