急性淋巴细胞白血病患儿化疗发生肝损伤的影响因素探讨
2017-01-06冷红春
冷红春
(湖北省妇幼保健院 急诊科,湖北 武汉430070)
急性淋巴细胞白血病患儿化疗发生肝损伤的影响因素探讨
冷红春
(湖北省妇幼保健院 急诊科,湖北 武汉430070)
急性淋巴细胞白血病(ALL)是儿童期发病率最高的一种恶性肿瘤,化疗是小儿ALL的首选治疗方案[1]。随着各类药物的研发和科学技术的进步,以及日益完善的化疗方法,小儿ALL的疗效得到了显著提升;肝损伤是一种较为常见化疗相关的并发症[2]。肝损伤会对患儿的身体健康产生一定的影响,并阻碍化疗方案的继续执行,影响化疗疗效,严重时甚至会演变为肝脏衰竭,对患儿生命构成了严重威胁。本研究旨在通过对ALL患儿化疗肝受损以及治疗情况的研究和分析,给减少或减轻化疗肝损伤提供一定的理论参考依据。
1 资料与方法
1.1 研究对象
分析2011年3月至2016年4月在我院接受治疗的65例ALL患儿的临床资料。入选者均由流式细胞学免疫分型及骨髓细胞染色形态学分析明确诊断。参照“儿童急性淋巴细胞白血病诊疗建议”(第二次修订方案)[3]对入选者的危险度、治疗方案、免疫性分型及形态学分型等进行分组判定。入选者均为初治患儿,且化疗前肝功能各项指标均表现正常。根据欧洲药物学术会议1990年制定的药物性肝受损诊断标准[4]评定患儿化疗后肝损伤情况,并给予分型:血清直接胆红素(DBL)或丙氨酸转氨酶(ALT)上升范围在正常上限(N)-2倍正常上限(2N)间即认定为轻度肝受损;2N-5N间为中度肝受损;≥5N为重度肝受损;或总胆红素(TBL)、天冬氨酸转氨酶(AST)、谷氨酰胺转肽酶(GGT)及碱性磷酸酶(ALP)联合上升且其中之一达2N-5N则为中度肝受损,≥5N为重度肝受损;上述四者其他类上升为轻度肝受损。排除肝胆疾病、滥用酒精、心功能不全致使肝缺血等其它导致肝脏受损的疾病患儿。
1.2 研究方法
入选者接受肝水解肽、肝泰乐、复合辅酶、多烯磷脂酰胆碱等一系列保肝药物的治疗。疗效评定:症状未好转,且TBL、ALT及AST继续上升或未下降,则认定为无效;临床症状有所好转,且TBL、ALT及AST部分降低,但未降低至正常水平,则认定为好转;临床症状及体征彻底消失,且TBL低于17 μmol/L,AST及ALT均低于40 U/L。
1.3 统计学方法

2 结果
2.1 临床表现
65例ALL患儿化疗后肝损伤的临床体征及症状不明显,1例肝脏肿大、6例轻度黄疸、3例恶心、5例纳差、10例乏力,无腹水患儿。
2.2 肝损伤发生率及不同性别、年龄的肝损伤发生率
共有52例(80.0%)患儿出现化疗肝损伤情况,其中轻度者15例(23.1%),中度者25例(38.5%),重度者12例(18.5%)。表1结果提示,不同性别及不同年龄间肝损伤发生率无显著差异(P>0.05)。
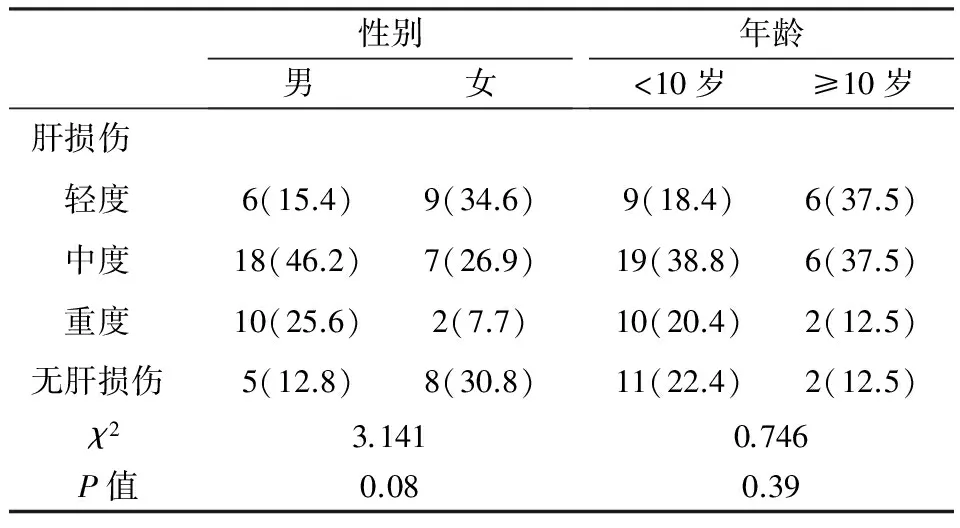
表1 不同性别、年龄ALL患儿的肝损伤发生率的比较(例,%)
2.3 不同程度的ALL患儿的肝损伤发生情况
表2结果提示,低危、中危、高危患儿化疗后肝损伤发生率两两之间无显著差异(P>0.05)。
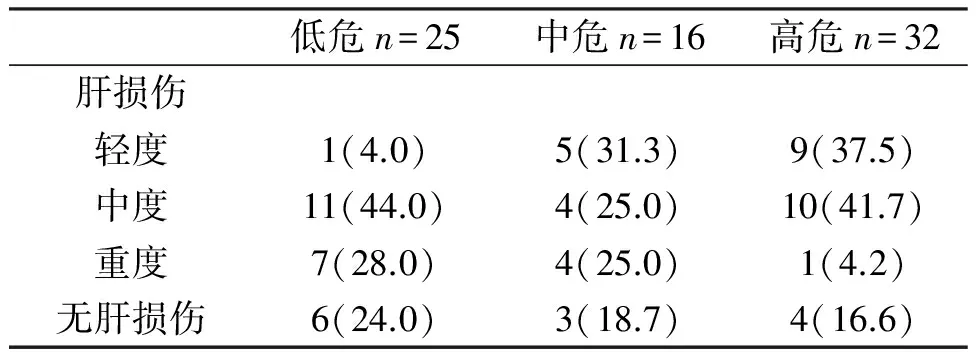
表2 不同程度的ALL患儿的肝损伤发生率比较(%)
注:低危与中危相比,χ2=0.157,P=0.69;中危与高危相比,χ2=0.029,P=0.87;低危与高危相比,χ2=0.405,P=0.52。
2.4 不同化疗阶段的肝损伤发生情况
65例ALL患儿完成诱导缓解治疗的有65例,完成巩固治疗的有64例,完成髓外预防的有64例,完成早期强化的有60例,完成维持加强的有51例。表3结果提示,巩固治疗阶段肝损伤发生率17.2%为最低,与其他化疗阶段的肝损伤发生率均有显著性差异(P<0.01);而其他阶段,相互间均无显著性差异(P>0.05)。

表3 不同化疗阶段的肝损伤发生率比较
2.5 有无感染、输血患儿的肝损伤发生率
表4结果提示,有无感染、有无输血的ALL患儿肝损伤发生率均差异显著(P<0.05)。
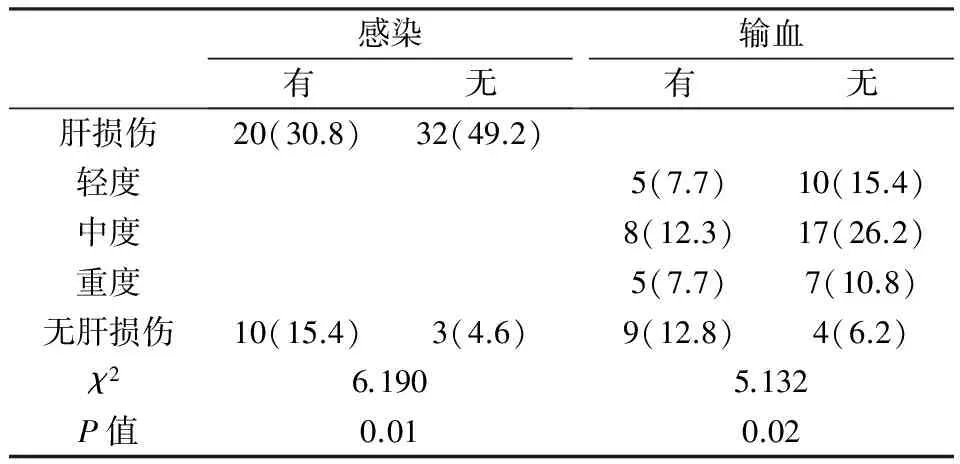
表4 有无感染、输血患儿的肝损伤发生率比较(%)
2.6 保肝药物应用对肝损伤患儿预后的影响
将52例化疗肝损伤患儿分为应用保肝药和未应用保肝药两组,每组26例。表5结果提示,应用与未应用保肝药对肝损伤患儿的预后影响差异显著(χ2=4.127,P=0.04)。
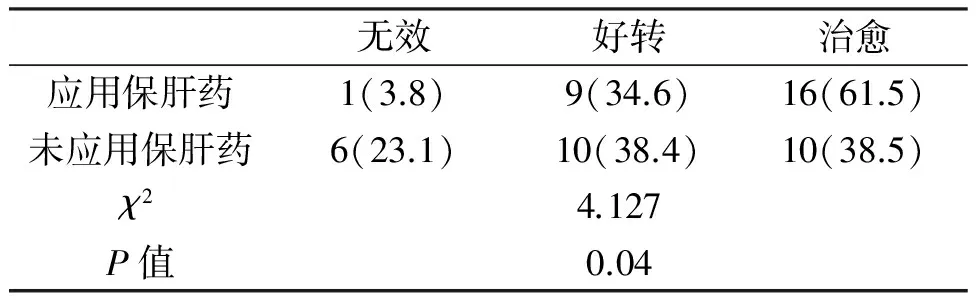
表5 保肝药物应用对肝损伤患儿预后的影响(%)
3 讨论
药源性肝损伤(DILD)主要是指药物以及药物代谢的产物导致的肝脏受损。目前,西方国家中DILD已经是重症肝病的重要原因,其中最为突出的是由抗癌药物和抗生素导致的肝受损[5]。急性淋巴细胞白血病(ALL)患儿治疗期间由于应用此两类药物较为频繁,故DILD发生率更高[6]。
有研究结果显示,ALL化疗后肝损伤的发生率达65.7%[7],本研究发现,65例ALL患儿中共52例(80.0%)化疗后出现了肝损伤现象,提示ALL患儿化疗后肝损伤现象较为常见,且以轻、中度为主。肝脏是化疗药物的主要代谢场所,但目前尚未明确大量药物引发肝损伤的发病机制,已经确定的两个途径是免疫机制和直接干细胞毒性[8]。由肝脏转化及代谢,化疗药物会形成许多活性代谢产物(包括亲电子的自由基和化学物质),与细胞内DNA分子、脂质成分等大分子物质作用产生反应,进而导致氧化应激、DNA变性、脂质过氧化等[9]。肝细胞受损或死亡之后,人体免疫系统所释放的信号启动了免疫系统,尤其是将非特异性免疫系统内各种细胞生产的炎性因子所激活,促进肝损伤速度,同时产生的肝细胞保护性因子对化疗后肝损伤进程产生了一定的控制作用;另外,根据半抗原假说,我们认为在化疗肝损伤过程中特异性免疫系统发挥了重要作用,通过对DILD期间药物特异性抗体与特征性T淋巴细胞的检测得以证实[10]。本研究结果显示,不同年龄及性别的ALL患儿化疗后肝损伤发生率无显著差异,提示DILD的发生与患儿的年龄与性别无关。但本研究发现,男童患儿化疗后肝损伤主要为中重度,而女童患儿则主要是轻中度;年龄偏大者化疗后轻度肝损伤发生率少于年龄较小者,考虑与不同年龄、性别对肝细胞中药敏活性、化疗药物敏感性不同以及免疫状态的不同、药物在肝脏中代谢转化能力的不同可能相关。
本研究发现,化疗阶段不同,化疗后肝损伤发生率差异显著。巩固治疗导致的肝损伤发生率显著比其它化疗阶段低,但其余各阶段均无显著差异,考虑可能与不同化疗阶段使用药物组合不同相关。巩固治疗以阿糖胞苷及环磷酰胺为主,关于此阶段出现肝损伤现象的报道很少,原因可能是巩固阶段的治疗发生肝损伤的几率较低[11]。
本研究发现,化疗期间输血及感染均使肝损伤发生率显著上升,由于感染患儿需要使用大量高级抗生素,且抗生素是导致肝受损的一个重要原因,此外感染期间机体会释放出活性炎性因子,从而加剧组织受损,同时感染还可能使免疫机制激活,进而增加了肝细胞免疫损伤发生率。而输血患儿的骨髓往往受抑制,且血常规低,与化疗药物的剂量可能相关,因此更易出现肝损伤[12]。临床上化疗肝损伤较为常见,且主要呈一过性,其预后较好,停药后大部分肝功能受损情况均可恢复,故很有必要采取积极的应对治疗措施,本研究结果提示保肝药物能显著提升治愈率,单一保肝药物的应用效果并不理想,复合用药才可以发挥更好的疗效。保肝药物的临床使用以促肝细胞再生、解毒、退黄及降酶等为主。常见的降酶类保肝药有水飞蓟素、甘草酸类等;退黄类有苦参素、熊去氧胆酸等;解毒类有复合辅酶、还原型谷胱甘肽类等[13]。
总之,ALL患儿化疗后发生肝损伤的较多,临床治疗期间需要对患儿的肝功能与血常规进行严密监测,如能尽早发现及治疗,则预后情况一般较好;适时应用保肝药物进行治疗的患儿,预后情况较未应用保肝药物者好。
[1]Ragab SM,Badr EA.Evaluation of serum and urine fetuin-A levels in children with acute lymphoblastic leukemia during and after high-dose methotrexate therapy:Relation to toxicity[J].Hematology,2016,21(2):78
[2]Hagag AA,AbdElaal AM,Elfaragy MS,et al.Therapeutic value of black seed oil in methotrexate hepatotoxicity in Egyptian children with acute lymphoblastic leukemia[J].Infect Disord Drug Targets,2015,15(1):64.
[3]Nakano TA,Hunger SP.Blood consult:therapeutic strategy and complications in the adolescent and young adult with acute lymphoblastic leukemia[J].Blood,2012,119(19):4372.
[4]Bénichou C.Criteria of drug-induced liver disorders.Report of an international consensus meeting[J].J Hepatol,1990,11(2):272.
[5]Kubota M,Nakata R,Adachi S,et al.Plasma homocysteine,methionine and S-adenosylhomocysteine levels following high-dose methotrexate treatment in pediatric patients with acute lymphoblastic leukemia or Burkitt lymphoma:association with hepatotoxicity[J].Leuk Lymphoma,2014,55(7):1591.
[6]Bilgir O,Calan M,Bilgir F,et al.An experience with plasma exchange treatment of acute lymphoblastic leukemia in a case with fulminant hepatitis related to L-asparaginase[J].Transfus Apher Sci,2013,49(2):328.
[7]Douer D,Aldoss I,Lunning MA,et al.Pharmacokinetics-based integration of multiple doses of intravenous pegaspargase in a pediatric regimen for adults with newly diagnosed acute lymphoblastic leukemia[J].J Clin Oncol,2014,32(9):905.
[8]Wilson GJ,Bunpo P,Cundiff JK,et al.The eukaryotic initiation factor 2 kinase GCN2 protects against hepatotoxicity during asparaginase treatment[J].Am J Physiol Endocrinol Metab,2013,305(9):E1124.
[9]Yuan ZH,Liu Q,Zhang Y,et al.CYP2B6 gene single nucleotide polymorphisms and leukemia susceptibility[J].Ann Hematol,2011,90(3):293.
[10]Xue T,Luo P,Zhu H,et al.Oxidative stress is involved in Dasatinib-induced apoptosis in rat primary hepatocytes[J].Toxicol Appl Pharmacol,2012,261(3):280.
[11]Li S,Liu D,He G,et al.Sudden death due to cerebral leukemic hemorrhage occurring after acupuncture treatment for gingival bleeding[J].Am J Forensic Med Pathol,2012,33(1):102.
[12]Miano M,Pistorio A,Putti MC,et al.Clofarabine,cyclophosphamide and etoposide for the treatment of relapsed or resistant acute leukemia in pediatric patients[J].Leuk Lymphoma,2012,53(9):1693.
[13]de Beaumais T A,Fakhoury M,Medard Y,et al.Determinants of mercaptopurine toxicity in paediatric acute lymphoblastic leukemia maintenance therapy[J].Br J Clin Pharmacol,2011,71(4):575.
1007-4287(2016)12-2094-03
2016-06-11)
