蛋白激酶SGK3过表达促进乳腺癌细胞株MDA-MB-231增殖和侵袭
2017-01-06邹祥南张国扬刘忠豪杜雪峰郭红艳孙晓杰
邹祥南,张国扬,刘忠豪,杜雪峰,郭红艳,孙晓杰
(齐齐哈尔医学院 1.12级检验专业;2.14级口腔专业;3.14级影像专业;4.生物化学教研室,黑龙江 齐齐哈尔 161006)
蛋白激酶SGK3过表达促进乳腺癌细胞株MDA-MB-231增殖和侵袭
邹祥南1,张国扬2,刘忠豪3,杜雪峰1,郭红艳4*,孙晓杰4*
(齐齐哈尔医学院 1.12级检验专业;2.14级口腔专业;3.14级影像专业;4.生物化学教研室,黑龙江 齐齐哈尔 161006)
目的 研究血清和糖皮质激素诱导的蛋白激酶3(SGK3)过表达对乳腺癌细胞克隆增殖和侵袭行为的影响及其机制。方法 免疫组化方法检测不同类型乳腺癌组织中SGK3蛋白的表达;通过GenEscortTMⅠ介导用重组质粒pEGFPN1-SGK3瞬时转染乳腺癌MDA-MB-231细胞,免疫印迹方法对转染细胞中的蛋白表达进行鉴定;克隆形成实验观察SGK3过表达对单个细胞克隆增殖的影响;细胞侵袭实验观察细胞侵袭能力的变化;免疫印迹方法检测肿瘤转移相关基因的表达。结果 SGK3在乳腺浸润性导管癌的表达明显高于正常乳腺组织和乳腺纤维腺瘤组织(P<0.05)。过表达SGK3的MDA-MB-231细胞,其克隆形成和侵袭力均增强,与对照组细胞相比,均有显著性差异(P<0.01)。SGK3过表达不影响乳腺癌转移抑制因子1(BRMS1)的表达,但却使MMP2和MMP9的表达明显升高。结论 SGK3在乳腺浸润性导管癌组织中呈高表达,SGK3过表达可通过上调肿瘤转移相关基因MMP2和MMP9的表达而促进乳腺癌细胞的侵袭。
SGK3;乳腺癌;侵袭;MMP2;MMP9
(ChinJLabDiagn,2016,20:1990)
血清和糖皮质激素诱导的蛋白激酶3(SGK3)是近年来新发现的PI3K下游信号分子,其与人类乳腺癌、肝癌、大肠癌、前列腺癌等多种肿瘤的发生相关[1-4]。由于SGK3在结构上与PI3K 的下游分子Akt/PKB高度同源,且二者具有相似的上游和下游靶点,因此推测SGK3很可能和Akt/PKB具有相似的细胞内功能。我们前期研究发现,SGK3在乳腺癌细胞MCF-7中高表达能够促进细胞增殖、抑制细胞凋亡[5]。本文在此基础上,利用组织芯片技术检测SGK3在不同类型乳腺癌中的表达,并在细胞水平观察SGK3过表达对乳腺癌骨转移细胞系MDA-MB-231侵袭转移潜能的影响,为阐明SGK3的功能以及靶向PI3K/SGK3的抗肿瘤药物研发奠定基础。
1 材料与方法
1.1 组织芯片、质粒和细胞株 乳腺癌组织芯片BR1503d购自西安艾丽娜生物科技有限公司;重组质粒pEGFPN1-SKG3含有人SGK3 cDNA基因,由本室郭红艳博士构建[6],质粒转化大肠杆菌扩增后用于本实验研究。乳腺癌骨转移细胞系MDA-MB-231由本室冻存,细胞复苏后用含10%小牛血清的RPMI1640培养液于5%CO2、37℃培养箱中培养。
1.2 试剂和抗体 RPMI1640和G418为GibcoBRL公司产品 新生小牛血清、胰酶为Invitrogen公司产品;细胞培养瓶、培养板为丹麦Nunc公司产品;Transwell培养板为美国Costar公司产品;GFP、MMP2、MMP9、BRMS1以及β-actin抗体为CST公司产品;HRP-IgG和ECL发光试剂盒为Santa Cruz公司产品;UltraSensitiveTM S-P超敏试剂盒(鼠/兔)、DAB显色试剂盒为福州迈新生物技术公司产品;DEL2000蛋白分子量标准和结晶紫为鼎国生物公司产品;垂直板电泳及转膜系统MINI型、GEL Doc 2000数字成像系统为美国BioRad公司产品。
1.3 主要方法
1.3.1 免疫组化 乳腺癌组织芯片(BR1503d)为组织微阵列芯片,含正常乳腺组织及乳腺纤维腺瘤各3例、浸润性导管癌60例,芯片样本取自临床19-74岁女性病例,免疫组化方法进行检测,光镜下呈棕黄色判定为SGK3表达阳性,用Imagepro-PLus软件测定IOD值,分析SGK3的表达情况。
1.3.2 基因转染 采用GenEscortTMⅠ介导进行基因转染,具体操作按说明书进行。将生长状态良好的细胞于转染前一天接种到6孔培养板中,待细胞总面积达到60-80%,取pEGFPN1和pEGFPN1-SGK3质粒各3 μg进行瞬时转染,转染细胞分别命名为231/pEGFPN1和231/ pEGFPN1-SGK3,48小时后提取细胞总蛋白,用抗GFP抗体对转染细胞的蛋白表达进行鉴定。
1.3.3 克隆形成实验 将MDA-MB-231、231/pEGFPN1和231/ pEGFPN1-SGK3细胞按103个/孔接种于6孔培养板,每组设3个平行孔,每周换液2-3次,2周后观察克隆形成情况。经甲醇固定、0.4%结晶紫染色后,计数克隆数,并以形成的克隆数除以接种细胞数,计算克隆形成率。
1.3.4 细胞侵袭实验 细胞无血清培养24 h,0.25%胰酶消化细胞,PBS洗2遍,用含0.2%血清的培养基调整细胞密度至2×105/ml,取细胞悬液200 μl加入基质胶包被好的Transwell侵袭小杯,每组3个复孔,孔板下室加入600 μl含10%血清培养基,常规培养24 h。取出Transwell侵袭小杯,PBS冲洗后用棉签轻轻擦掉杯底膜上层的未迁移细胞,甲醇固定30 min,0.1%结晶紫染色20 min,PBS冲洗,显微镜下随机观察5个视野记数并拍照。
1.3.5 免疫印迹实验 提取各组细胞总蛋白,Bradford法蛋白定量后进行SDS-PAGE及转膜。封闭液中室温封闭2 h;按1∶500-1∶1000分别稀释一抗MMP2、MMP9、GFP 、BRMS1以及β-Actin,4℃过夜;TTBS漂洗3次,每次10 min;再按1:1000稀释二抗,室温孵育1 h;用TTBS室温漂洗后进行ECL显色。利用GEL Doc 2000凝胶成像系统及其图像分析软件Multi-AnalystR/PC对Western Blot杂交带进行密度扫描分析。
1.3.6 统计学分析 应用SPSS 17.0软件进行统计分析,实验数据以均数±标准差(mean±SD)表示,多组间比较采用方差分析,采用LSD、Dunnett T3方法,以P<0.05为差异有统计学意义。
2 结果
2.1 蛋白激酶SGK3在不同类型乳腺癌组织中的表达
免疫组化实验结果如图1所示,SGK3在乳腺癌癌旁组织、乳腺纤维腺瘤以及乳腺浸润性导管癌中均有表达,但在癌旁组织(IOD=199.95±52.92)和乳腺纤维腺瘤(IOD=160.48±48.45)中的表达量无明显差异,而在乳腺浸润性导管癌中的表达却明显增高(IOD=338.15±133.35),与前两组相比,差异有统计学意义(P<0.05)。
2.2 融合蛋白SGK3-GFP表达的鉴定
转染48 h后,提取两组细胞总蛋白,用抗GFP抗体进行免疫印迹检测,结果在两组细胞中均检测到蛋白带(图2A),其中转染空载体组表达绿色荧光蛋白(GFP),而转染pGFPN1-SGK3组细胞表达融合蛋白SGK3-GFP,但两组细胞的蛋白表达量无显著差异(P>0.05),见图2B。
2.3 SGK3过表达促进乳腺癌细胞的克隆形成
克隆形成实验结果显示,在形成的克隆大小上三组细胞之间无明显差异,但在克隆形成的数量上231/pEGFPN1-SGK3组明显高于其他两组。计算各组细胞的克隆形成率,结果MDA-MB-231和231/pEGFPN1组分别为15.8%±2.1%和16.9%±3.7%,而231/pEGFPN1-SGK3组为23.9%±4.3%,与前两组细胞相比均有显著性差异(P<0.01),表明SGK3的表达能够促进细胞的克隆增殖能力,见图3。

图1 免疫组化方法检测乳腺癌组织中SGK3蛋白的表达 (40×)
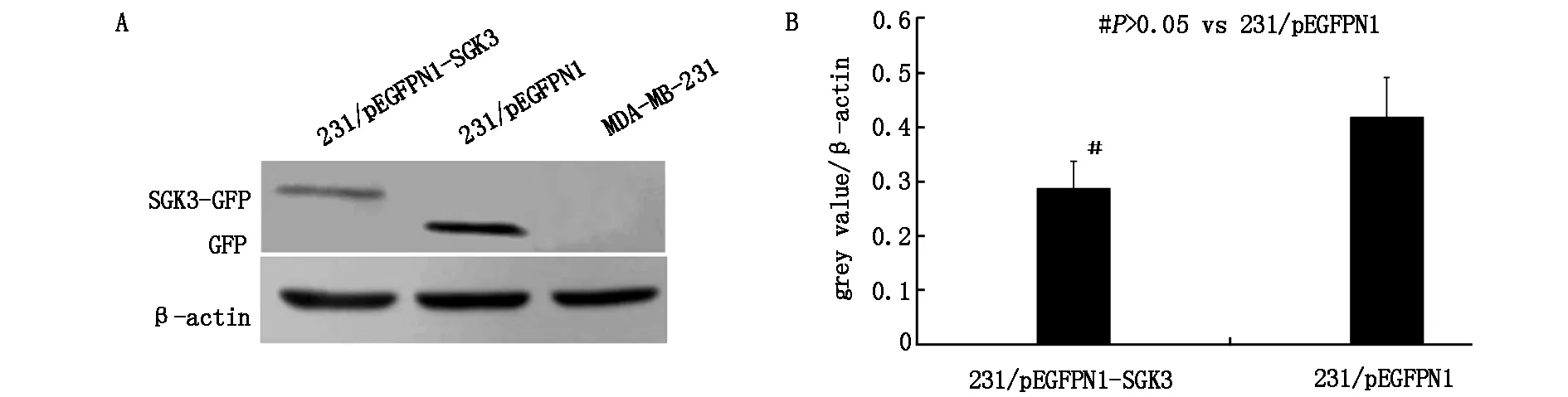
图2 免疫印迹方法鉴定MDA-MB-231细胞中融合蛋白SGK3-GFP的表达

图3 SGK3过表达对MDA-MB-231细胞克隆形成能力的影响
2.4 SGK3过表达促进乳腺癌细胞侵袭
在Transwell侵袭实验24 h后,亲本细胞和空载体细胞组仅有少量细胞穿过,但过表达SGK3的MDA-MB-231细胞组可见大量细胞穿过,细胞计数结果MDA-MB-231、231/pEGFPN1以及231/pEGFPN1-SGK3组穿过的细胞数分别为55.4±9.68、60.6±10.92和115±16.71,与前两组相比,有显著性差异(P<0.05),表明SGK3过表达能够促进乳腺癌细胞通过基质胶的侵袭行为(图4)。

图4 细胞侵袭实验检测各组细胞的侵袭能力
2.5 SGK3过表达对肿瘤转移相关基因表达的影响
免疫印迹实验在各组细胞中均检测到MMP2、MMP9以及BRMS1蛋白的表达,但各组细胞之间BRMS1的表达量无明显差异(P>0.05),而231/pEGFP-SGK3组MMP2和MMP9的表达量却明显高于其它两组,差异有统计学意义(P<0.05)(图5)。

图5 免疫印迹技术检测各组细胞中MMP2、MMP9和BRMS1的表达
3 讨论
SGK3属于丝氨酸/苏氨酸蛋白激酶,其在哺乳动物组织和细胞中广泛表达,通过磷酸化下游的靶蛋白而参与调控细胞增殖、存活、迁移以及物质跨膜转运等[7-9],与人类多种疾病包括肿瘤的发生密切相关。本研究发现SGK3在正常乳腺组织、良性乳腺肿瘤以及乳腺浸润性导管癌中均有表达,但其在浸润性导管癌中的表达明显高于前两者,由此我们推测,SGK3的异常表达很可能与乳腺癌的浸润转移相关。为了探讨SGK3与肿瘤侵袭转移的相关性,我们利用乳腺癌骨转移细胞系MDA-MB-231为实验材料,观察SGK3过表达对细胞克隆增殖以及侵袭转移行为的影响。结果显示,高表达SGK3的细胞其单个细胞的克隆增殖能力以及细胞穿过基质胶的侵袭能力均明显高于对照组,由于肿瘤细胞对细胞外基质(ECM)的降解是侵袭转移的关键步骤,因此本研究结果表明SGK3能够促进肿瘤细胞的侵袭行为。
作为乳腺癌转移抑制因子,BRMS1高表达不仅能够抑制乳腺癌细胞的侵袭转移[10],而且还能通过Stat3信号途径参与非小细胞肺癌凋亡和转移的调控[11]。但本研究发现,SGK3的高表达不影响乳腺癌细胞内源性BRMS1的表达。由于肿瘤细胞侵袭转移能力与其产生或诱导产生降解细胞外基质或基底膜的蛋白酶有关,比如MMP2和MMP9在肿瘤转移区域的表达明显高于原发区域[12],而且MMP2/MMP9可经由PI3K/Akt信号通路诱导表达而促进肿瘤细胞的侵袭转移[13]。本研究证实,高表达SGK3的MDA-MB-231细胞其内源性MMP-2 和 MMP-9 的表达均明显升高,推测SGK3可通过调控MMP2/MMP9的表达而影响MDA-MB-231细胞的侵袭行为。
雌激素受体(estrogen receptor,ER)的表达与乳腺癌淋巴结转移、疾病预后以及患者生存期密切相关,ER+的乳腺肿瘤中SGK3的表达水平与患者的生存和预后呈正相关[14,15],但迄今为止未发现Akt的表达与肿瘤预后的相关性。已知MDA-MB-231为ER-的乳腺癌细胞[16],本研究发现SGK3过表达能够促进该细胞的克隆增殖和侵袭行为,而我们前期研究发现SGK3促进ER+的乳腺癌细胞MCF-7迁移[17],表明SGK3对乳腺癌细胞增殖和侵袭均有影响与ER受体的表达与否可能无关。但有关SGK3与ER-的乳腺癌患者生存和预后的相关性研究还需要大量的临床病例资料分析,这也是我们下一步研究的方向。
[1] Gasser JA,Inuzuka H,Lau AW,et al.SGK3 mediates INPP4B-dependent PI3K signaling in breast cancer [J].Mol Cell,2014,56 (4):595.
[2]Liu M,Chen L,Chan TH,et al.Serum and glucocorticoid kinase 3 at 8q13.1 promotes cell proliferation and survival in hepatocellular carcinoma[J].Hepatology,2012,55(6):1754.
[3]Guo ST,Chi MN,Yang RH,et al.INPP4B is an oncogenic regulator in human colon cancer[J].Oncogene,2016,35(23):3049.
[4]Wang Y,Zhou D,Chen S.SGK3 is an androgen-inducible kinase promoting prostate cancer cell proliferation through activation of p70 S6 kinase and up-regulation of cyclin D1[J].Mol Endocrinol,2014,28 (6):935.
[5]郭红艳,孙晓杰,刘秀财,等.血清和糖皮质激素调节蛋白激酶3过表达对乳腺癌细胞凋亡的影响[J].中国老年学杂志,2012,32(5):982.
[6]郭红艳,孙晓杰,李淑艳,等.蛋白激酶SGK3基因的克隆及其在乳腺癌细胞中的表达[J].中国老年学杂志,2015,35(15):4187.
[7]Munoz C,Pakladok T,Almilaji A,et al.Up-regulation of Kir2.1 (KCNJ2) by the serum & glucocorticoid inducible?SGK3[J].Cell Physiol Biochem,2014,33(2):491.
[8]Pasham V,Rotte A,Bhandaru M,et al,Regulation of gastric acid secretion by the serum and glucocorticoid inducible kinase isoform SGK3[J].J Gastroenterol,2011,46(3):305.
[9] Schmid E,Bhandaru M,Nurbaeva MK,et al.SGK3 regulates Ca(2+) entry and migration of dendritic cells[J].Cell Physiol Biochem,2012,30(6):1423.
[10]Roesley SN,Suryadinata R,Morrish E,et al.Cyclin-dependent kinase-mediated phosphorylation of breast cancer metastasis suppressor 1 (BRMS1) affects cell migration[J].Cell Cycle,2016,15(1):137.
[11]You J,He X,Ding H,et al.BRMS1 regulates apoptosis in non-small cell lung cancer cells [J].Cell Biochem Biophys,2015,71(1):465.
[12]Nishio K,Motozawa K,Omagari D,et al.Comparison of MMP2 and MMP9 expression levels between primary and metastatic regions of oral squamous cell carcinoma[J].J Oral Sci,2016,58(1):59.
[13]Gao Y,Guan Z,Chen J,et al.CXCL5/CXCR2 axis promotes bladder cancer cell migration and invasion by activating PI3K/AKT-induced upregulation of MMP2/MMP9[J].Int J Oncol,2015,47(2):690.
[14]Wang Y,Zhou D,Phung S,et al.SGK3 is an estrogen-inducible kinase promoting estrogen-mediated survival of breast cancer cells [J].Mol Endocrinol,2011,25 (1):72.
[15]Xu J,Wan M,He Q,et al.SGK3 is associated with estrogen receptor expression in breast cancer[J].Breast Cancer Res Treat,2012,134(2):531.
[16]Wu Q,Guo L,Jiang F,et al.Analysis of the miRNA-mRNA-lncRNA networks in ER+ and ER- breast cancer cell lines[J].J Cell Mol Med,2015,19(12):2874.
[17]郭红艳,孙晓杰,刘秀财,等.血清和糖皮质激素调节蛋白激酶3(SGK3)过表达对乳腺癌细胞迁移的影响[J].中国实验诊断学,2012,16(3):391.
Overexpression of protein kinase SGK3 promotes proliferation and invasion of breast cancer cell line MDA-MB-231
ZOUXiang-nan,ZHANGGuo-yang,LIUZhong-hao,etal.
(QiqiharMedicalUniversity,Qiqihar161006,China)
Objective To study the effect of serum and glucocorticoid induced protein kinase 3 (SGK3) overexpression on the proliferation and invasion of breast cancer cells.Methods To detect the expression of SGK3 protein in different types of breast cancer tissues by immunohistochemistry.Transient transfection of MDA-MB-231 cells with pEGFPN1-SGK3 plasmid mediated by GenEscortTMⅠ.The expression of SGK3 in transfected cells was identified by Western blotting.The effect of SGK3 over expression on cell clonal proliferation was observed by colony formation assay.The changes of cell invasion ability were observed by Transwell invasion assay.The expression of tumor metastasis related genes was detected by Western blotting.Results The expression of SGK3 in breast invasive ductal carcinoma was significantly higher than that in normal breast tissues and breast fibroadenoma(P<0.05).The colony formation and the invasion ability were increased in SGK3 overexpression MDA-MB-231cells(P<0.01).Overexpression of SGK3 increased the expression of MMP2 and MMP9 but not effected the expression of breast cancer metastasis suppressor 1 (BRMS1) in MDA-MB-231 cells by Western blotting.Conclusion SGK3 was highly expressed in breast invasive ductal carcinoma tissues,overexpression of SGK3 promote invasion of breast cancer cells in vitro by increasing the expression of tumor metastasis related genes MMP2 and MMP9.
SGK3;breast cancer;invasion;MMP2;MMP9
黑龙江省大学生创新创业训练计划项目(201511230010)
1007-4287(2016)12-1990-05
R737.9;R34
A
2016-05-18)
*通讯作者
