脉冲电场对沙门氏菌细胞膜流动性的影响及其机理*
2017-01-05曾新安欧贇王满生
曾新安 欧贇 王满生
(1.华南理工大学 食品科学与工程学院, 广东 广州 510640; 2.华南理工大学 广东省食品绿色加工与营养调控工程技术研究中心, 广东 广州510640; 3.华南理工大学 广东省天然产物绿色加工与产品安全重点实验室, 广东 广州510640)
脉冲电场对沙门氏菌细胞膜流动性的影响及其机理*
曾新安1,2,3欧贇1,2王满生1
(1.华南理工大学 食品科学与工程学院, 广东 广州 510640; 2.华南理工大学 广东省食品绿色加工与营养调控工程技术研究中心, 广东 广州510640; 3.华南理工大学 广东省天然产物绿色加工与产品安全重点实验室, 广东 广州510640)
研究了脉冲电场作用对鼠伤寒沙门氏菌SalmonellaTyphimurium的杀菌效应及其膜通透性的影响,并结合拉曼光谱技术分析了不同脉冲处理时间对沙门氏菌磷脂构象的影响.结果表明:随着脉冲电场能量的不断输入,沙门氏菌的灭活对数不断增加,且细胞膜的通透性也随之增大;此外,随着脉冲处理时间的延长,沙门氏菌磷脂拉曼峰的峰值比I1 139/I1 082呈现出先增大后减小的趋势,但是均比未经脉冲电场处理的峰值比要高(P<0.05).这说明脉冲电场作用能够增加沙门氏菌磷脂的C—C全反式构象的数目,同时减少了C—C扭曲构象数目;但是,随着脉冲处理时间的延长,峰值比I2 874/I2 862也随之增大(P<0.05),这意味着脉冲电场作用能够有效增大沙门氏菌磷脂C—H的侧向堆积程度,从而导致了磷脂脂链的有序程度增加和细胞膜流动性的减弱.因此,脉冲电场作用能够增大细胞膜的通透性和降低细胞膜流动性,最终会引起细胞损伤或者死亡.这为脉冲电场作用下微生物的灭活机理研究提供了一定的理论依据.
脉冲电场;鼠伤寒沙门氏菌SalmonellaTyphimurium;拉曼光谱;磷脂构象;细胞膜流动性
脉冲电场(PEF)是一种能在短时间内杀灭微生物,并对食品的感官品质和营养成分影响很小的新型非热食品加工技术[1- 3].鉴于PEF的加工优势,近年来其与其他灭菌技术(热处理、超声波等)结合的协同灭菌的加工方式已成为研究热点[4- 6].
一般地,PEF可引发细胞膜的可逆或不可逆电穿孔,修饰细胞膜的结构和功能,增大细胞膜的通透性,最终导致细胞损伤或细胞死亡[7].许多研究表明,在PEF灭菌过程中,微生物细胞膜是脉冲作用的主要位点[8].另外,细胞膜流动性与PEF的电通透性有直接关系.例如,Zhang 等[9]通过荧光偏振法测定酿酒酵母细胞膜流动性,表明PEF能增大酿酒酵母细胞膜的通透性,降低其细胞膜流动性,最终引发细胞死亡.而且细胞膜的磷脂组成及结构在决定细胞膜流动性中起重要作用[10].研究表明,在PEF作用下,脂质体随着电场能量的不断输入,其通透性增大,构象也会发生改变[11].然而,关于PEF对微生物磷脂构象影响方面的研究还鲜有报道.文中以鼠伤寒沙门氏菌SalmonellaTyphimurium为研究对象,研究了PEF对沙门氏菌的杀菌效应及其通透性的影响,并利用拉曼光谱技术分析了PEF对沙门氏菌磷脂构象及其细胞膜流动性的影响,为深入阐述PEF作用下微生物的灭活机理提供了一定的理论指导.
1 材料与方法
1.1 实验材料与实验设备
鼠伤寒沙门氏菌ATCC 14028购自美国标准菌种收藏中心;胰酪胨大豆肉汤培养基(TSB)、酵母提取粉、蛋白胨、琼脂粉等均购于广东环凯微生物科技公司;其他试剂均为分析纯.
SY-Z-500 脉冲电场设备,华南理工大学脉冲电场课题组自行研制(电极距为0.30 cm,处理室体积为0.02 mL);LabRAM HR Evolution拉曼光谱仪,日本Horiba公司生产;TDL-5A 离心机,上海菲恰尔分析仪器有限公司生产;UV-1800 紫外可见光分光光度计,岛津企业管理(中国)有限公司生产.
1.2 实验方法
1.2.1 沙门氏菌的培养
将斜面保藏的沙门氏菌接种至200 mL TSB中,该培养基含0.6%(质量分数)酵母提取粉.在37 ℃下摇瓶培养至稳定生长期后,4 000g转速下4 ℃离心5 min,倾去上清液,菌体沉淀用无菌水洗涤3次,待用.
1.2.2 脉冲电场处理
在PEF处理前,处理室及相关管路均先用75%(体积分数)的乙醇溶液循环冲洗30 min,再用无菌水冲洗30 min,清除残留的乙醇.沙门氏菌用无菌水稀释至浓度约为5×109CFU/mL,并用 2 mol/L KCl将其电导率调节为(180±1)μS/cm.本实验PEF处理流程如图1所示,入口温度始终控制为10 ℃,处理过程中出口温度最高为17 ℃.PEF参数如下:双极方波;脉冲频率1 kHz;脉冲宽度 40 μs;流速1 mL/s;
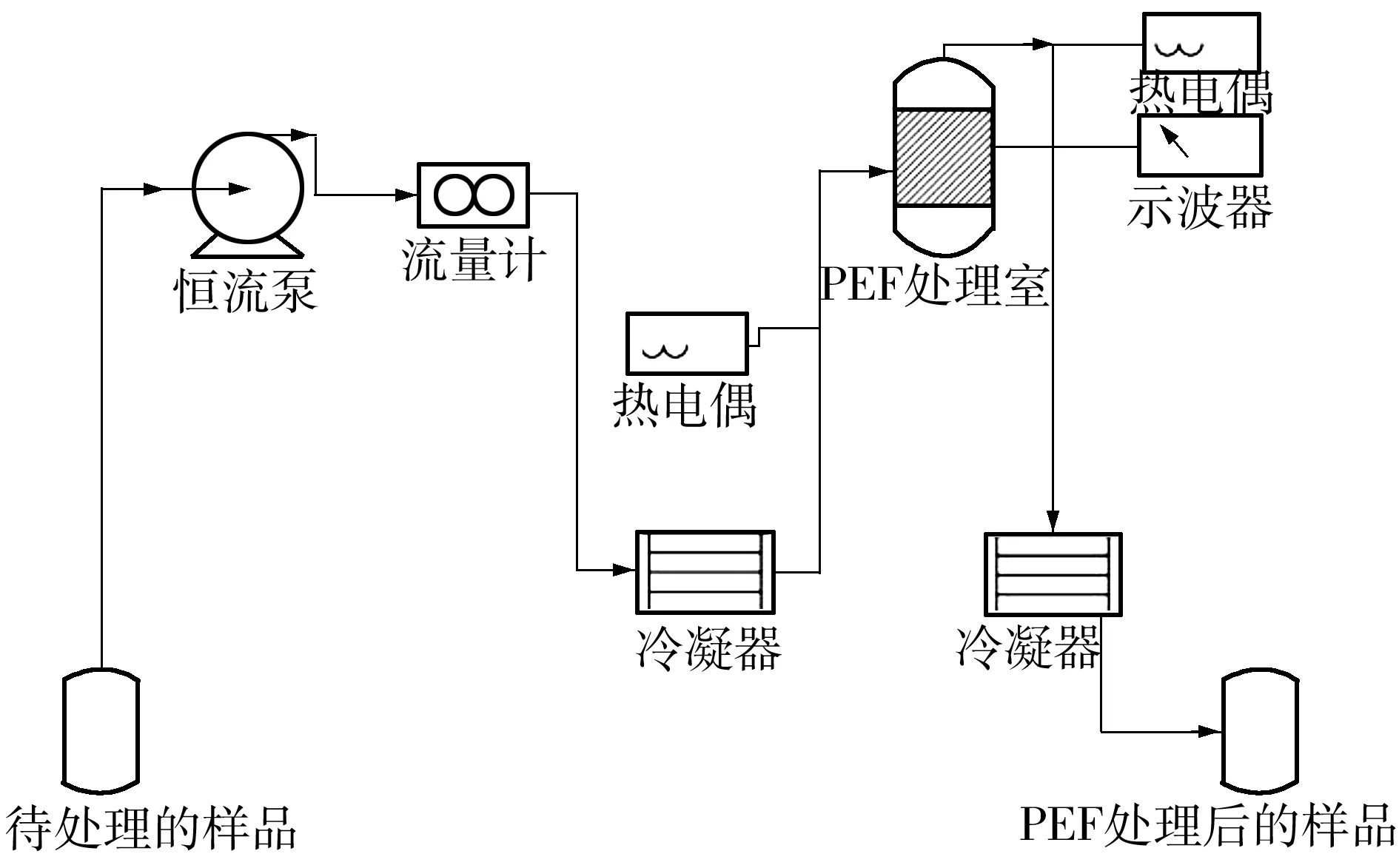
图1 本实验PEF处理流程图
Fig.1 PEF treatment flow diagram used in the proposed experiment
电场强度25 kV/cm;处理时间分别为0.8、1.6、2.4、3.2和4.0 ms.
1.2.3 脉冲电场对沙门氏菌灭活效果的评价
参考Wang等[1]的方法,PEF处理前后的沙门氏菌用0.1%(质量分数)蛋白胨进行10倍梯度稀释至一定浓度,取1 mL 涂布于含有1.8%(质量分数)琼脂的TSB平板上.于37 ℃恒温培养24 h后,菌落计数.
1.2.4 沙门氏菌细胞膜磷脂的提取
参考Yang等[12]的方法提取PEF处理前后的沙门氏菌磷脂,将提取的磷脂用无菌灭酶的离心管收集并于-80 ℃贮存.
1.2.5 沙门氏菌胞外核酸及蛋白含量的测定

1.2.6 沙门氏菌磷脂的拉曼光谱检测
拉曼光谱的激光波长为535 nm,激光功率为80 mW,光栅为600线/cm,狭缝宽度为600 μm.扫描范围为400~4 000 cm-1.积分时间为30 s,10次累加.用毛细管吸取少量磷脂,放在拉曼显微镜下,在25 ℃下聚焦检测.
2 结果与分析
2.1 脉冲处理时间对沙门氏菌的灭活效果与其细胞膜通透性的影响
沙门氏菌经不同脉冲时间处理后其灭活效果如图2所示.从图中可知,随着脉冲处理时间(t)的延长,PEF杀灭沙门氏菌的对数(lg(N0/N))增大,即灭菌效果更佳.其中,N0、N分别表示PEF处理前后的菌落浓度.

图2 不同脉冲处理时间对沙门氏菌灭活效果的影响
Fig.2 Effect of PEF treatment time on the inactivation ofS.Typhimurium
核酸和蛋白质在紫外光区的特征峰分别在260和280 nm处,且吸光值的大小与其浓度成正比[9].沙门氏菌经不同脉冲时间作用后其胞外核酸及蛋白含量的变化如图3所示.由图可知,随着脉冲处理时间的延长,沙门氏菌溶出的蛋白质和核酸也不断地增加.这说明,随着脉冲处理时间的延长,沙门氏菌细胞膜的通透性也有所增加.

图3 不同脉冲处理时间对沙门氏菌通透性的影响
Fig.3 Effect of PEF treatment time on the permeability ofS.Typhimurium
2.2 沙门氏菌磷脂构象分析
拉曼光谱中以C—C和C—H的伸展振动来表示磷脂的构象特点,进而用于表征细胞膜流动性[13].磷脂的C—C振动模式主要在拉曼位移为1 050~1 150 cm-1之间体现[14].PEF处理前后的沙门氏菌磷脂的激光拉曼光谱图(1 000~1 250 cm-1)如图4所示,其中1 082 cm-1处吸收峰用于表征脂链结构中C—C的扭曲旋转构象,而1 139 cm-1处吸收峰则反映脂链中C—C的全反式构象[14].因此,通常用两者的峰值比(I1 139/I1 082)表示脂链的C—C全反式构象与扭曲构象的比例,进而反映出脂链C—C的有序程度.如表1所示,未经PEF处理的沙门氏菌磷脂的I1 139/I1 082为0.949,而与之相比,经PEF处理的沙门氏菌磷脂的I1 139/I1 082要大些(P<0.05).而且由表1还可看出,经PEF处理4 ms的沙门氏菌的磷脂比经PEF处理1.6 ms的磷脂的I1 139/I1 082小,但是比未经PEF处理的磷脂的大(P< 0.05).I1 139/I1 082增加,表明沙门氏菌磷脂的C—C全反式构象与扭曲构象的比例增多,C—C的有序程度增加,从而引起细胞膜流动性降低.
磷脂的C—H的振动模式主要在拉曼位移为2 800~2 900 cm-1的范围[14].如图5所示,在2 800~2 900 cm-1内主要有两个吸收峰.在2 862和2 874 cm-1处的峰分别表示脂链C—H的对称振动和非对称振动.Slateral表示磷脂分子的侧向堆积程度,与I2 874/I2 862的值成正比[14].有研究表明,Slateral增大,则脂链侧向堆积程度增大,排列有序性提高,从而细胞膜流动性降低[14].如表1所示,未经PEF处理的沙门氏菌磷脂的I2 874/I2 862为1.119,而经PEF处理后均有所增大(P<0.05),这说明经PEF处理后沙门氏菌磷脂C—H的侧向堆积程度增大,排列有序性提高,细胞膜流动性降低.由此可知,PEF能够影响沙门氏菌磷脂C—C和C—H的构象,增强脂链的排列有序性,降低其细胞膜流动性,这与Zhang等[9]的研究结果相符.
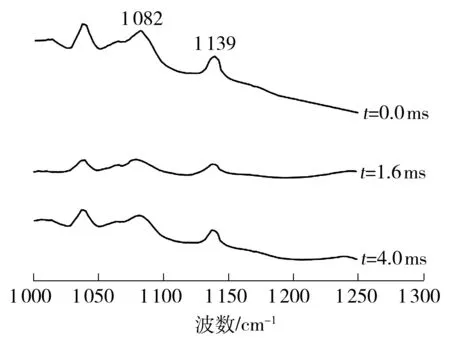
图4 不同脉冲处理时间作用后沙门氏菌磷脂的拉曼光谱图(1 000~1 250 cm-1)
Fig.4 Raman spectra with wave number from 1 000 cm-1to 1 250 cm-1of phospholipid ofS.Typhimurium after PEF exposure for various treatment time
表1 PEF作用下沙门氏菌磷脂的特定峰值比
Table 1 Peak intensity ratios corresponding to the phospholipid ofS.Typhimurium under PEF

t/msI1139/I1082I2874/I28620.00.949±0.002a1.119±0.001a1.60.985±0.005b1.156±0.002b4.00.962±0.003c1.172±0.004c
1)PEF电场强度为25 kV/cm;a,b,c表示差异显著(P<0.05).
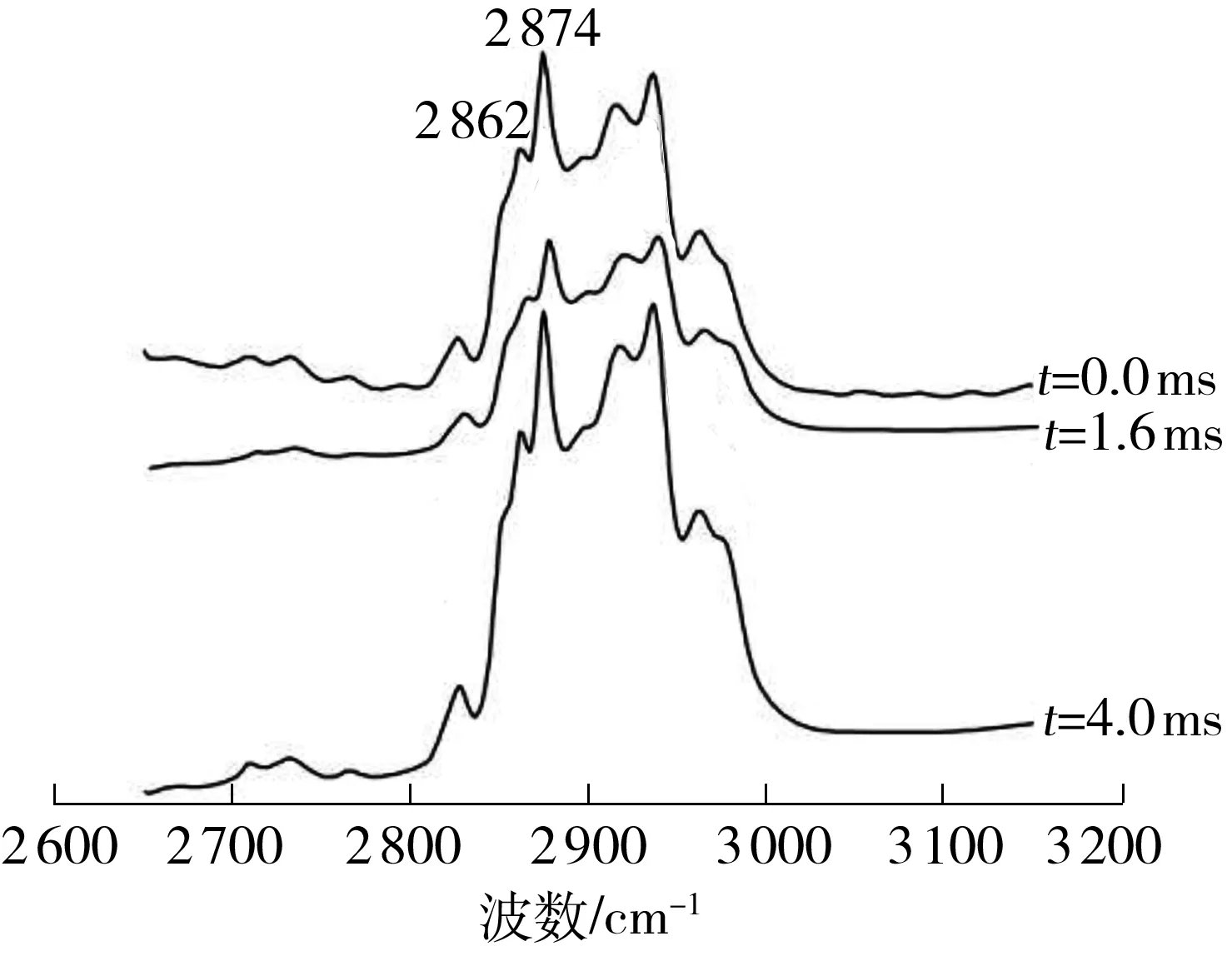
图5 不同脉冲处理时间作用后沙门氏菌磷脂的拉曼光谱图(2 650~3 150 cm-1)
Fig.5 Raman spectra with wave number from 2 650 cm-1to 3 150 cm-1of phospholipid ofS.Typhimurium after PEF exposure for various treatment time
研究表明,细胞膜的磷脂组成及其结构一般会影响微生物细胞膜的流动性[10].例如,细胞膜中卵磷脂/鞘磷脂含量比以及膜中脂肪酸链的链长和饱和度变化均会引起细胞膜流动性的变化[9].此外,细胞膜磷脂的C—C紧密堆积程度及C—H的侧向堆积程度也会影响细胞膜的流动性[13].Liu等[11]通过研究脂质体的构象对其PEF电渗透性的影响,结果发现脂质体C—H的侧向堆积程度越大,细胞膜流动性越低,则脂质体的PEF电渗透性越小.通过文中研究可知,PEF能量的输入不但增大了沙门氏菌的灭活对数,而且增加了沙门氏菌磷脂分子中C—C全反式构象的数目和减少了C—C扭曲构象数目,同时增强了C—H的侧向堆积程度,从而降低了细胞膜的流动性.由于组成沙门氏菌细胞膜磷脂的脂肪酸均是能够被PEF修饰的极性分子[15- 17],因此沙门氏菌经PEF处理后,其细胞膜磷脂组成及结构也能够被诱导修饰,从而引起细胞膜功能的丧失或改变,最终导致细胞损伤或者细胞死亡.另外,有研究表明,增大微生物细胞膜的流动性往往能够减弱该微生物对PEF的抗性[4].因此推测,沙门氏菌可能会通过降低其细胞膜流动性来应对PEF的应激环境,即沙门氏菌磷脂的C—C紧密堆积程度和C—H的侧向堆积程度增大,脂链的有序程度增加,细胞膜流动性降低等可能是沙门氏菌在PEF作用下的主要应激行为.
3 结语
文中研究了脉冲电场对沙门氏菌的杀菌效应及其膜通透性的影响,并结合拉曼光谱技术分析了不同脉冲处理时间对沙门氏菌磷脂构象的影响.结果表明脉冲电场不仅增大了沙门氏菌细胞膜的通透性,还使沙门氏菌磷脂的C—C紧密堆积程度和C—H的侧向堆积程度增大,脂链的有序程度增加,导致沙门氏菌的细胞膜流动性降低.这为脉冲电场的灭菌机理研究提供了一定的理论依据.为深入阐述脉冲电场作用下微生物的灭活机理,接下来将结合微生物的磷脂结构及分子调控与脉冲电场杀菌效果这两者之间的联系继续开展研究.
[1] WANG M S,ZENG X A,SUN D W,et al.Quantitative analysis of sublethally injuredSaccharomycescerevisiaecells induced by pulsed electric fields [J].Lwt-Food Science and Technology,2015,60(2):672- 677.
[2] ZHANG Z H,HAN Z,ZENG X A,et al.Enhancing mechanical properties of chitosan films via modification with vanillin [J].International Journal of Biological Macromolecules,2015,81:638- 643.
[3] AADIL R M,ZENG X A,ALI A,et al.Influence of different pulsed electric field strengths on the quality of the grapefruit juice [J].International Journal of Food Science & Technology,2015,50(10):2290- 2296.
[4] WALKLING-RIBEIRO M,ANANY H,GRIFFITHS M W.Effect of heat-assisted pulsed electric fields and bacteriophage on enterohemorrhagicEscherichiacoliO157:H7 [J].Biotechnology Progress,2015,31(1):110- 118.
[5] AADIL R M,ZENG X A,SUN D W,et al.Combined effects of sonication and pulsed electric field on selected quality parameters of grapefruit juice [J].Lwt-Food Science and Technology,2015,62(1):890- 893.
[6] DAN G,ZHANG Z H,ZENG X A,et al.Synergetic effects of pulsed electric field and ozone treatments on the degradation of high molecular weight chitosan [J].International Journal of Food Engineering,2014,10(4):775- 784.
[7] CHUECA B,PAGAN R,GARCIA-GONZALO D.Transcriptomic analysis ofEscherichiacoliMG1655 cells exposed to pulsed electric fields [J].Innovative Food Science & Emerging Technologies,2015,29:78- 86.
[8] PILLET F,FORMOSA-DAGUE C,BAAZIZ H,et al.Cell wall as a target for bacteria inactivation by pulsed electric fields [J].Scientific Reports,2016,6 (19778):1- 8.
[9] ZHANG Y,ZENG X A,WEN Q B,et al.Fluorescence polarization used to investigate the cell membrane fluidity ofSaccharomycescerevisiaetreated by pulsed electric field [J].Spectroscopy and Spectral Analysis,2008,28(1):156- 160.
[10] LIU Z W,ZENG X A,SUN D W,et al.Synergistic effect of thermal and pulsed electric field (PEF) treatment on the permeability of soya PC and DPPC vesicles [J].Journal of Food Engineering,2015,153:124- 131.
[11] LIU Z W,HAN Z,ZENG X A,et al.Effects of vesicle components on the electro-permeability of lipid bilayers of vesicles induced by pulsed electric fields(PEF) treatment [J].Journal of Food Engineering,2016,179:88- 97.[12] YANG Y,KHOO W J,ZHENG Q,et al.Growth temperature altersSalmonellaEnteritidisheat/acid resistance,membrane lipid composition and stress/virulence related gene expression [J].International Journal of Food Microbiology,2014,172C(1):102- 109.
[13] CZAMARA K,MAJZNER K,PACIA M Z,et al.Raman spectroscopy of lipids:a review [J].Journal of Raman Spectroscopy,2015,46(1):4- 20.
[14] GABER B P,PETICOLAS W L.On the quantitative interpretation of biomembrane structure by Raman spectroscopy [J].Biochimica et Biophysica Acta,1977,465(2):260- 274.
[15] ALVAREZ-ORDONEZ A,FERNANDEZ A,LOPEZ M,et al.Modifications in membrane fatty acid composition ofSalmonellaTyphimurium in response to growth conditions and their effect on heat resistance [J].International Journal of Food Microbiology,2008,123(3):212- 219.
[16] KHAKBAZ P,KLAUDA J B.Probing the importance of lipid diversity in cell membranes via molecular simulation [J].Chemistry and Physics of Lipids,2015,192:12- 22.
[17] STEPANYAN S A,SOLOVIEV V R,STARIKOVSKAIA S M.An electric field in nanosecond surface dielectric barrier discharge at different polarities of the high voltage pulse:spectroscopy measurements and numerical modeling [J].Journal of Physics D-Applied Physics,2014,47(48):485201- 485213.
Effect of Pulsed Electric Fields on Fluidity ofSalmonellaCell Membrane and Its Mechanism
ZENGXin-an1,2,3OUYun1,2WANGMan-sheng1
(1.School of Food Science and Engineering,South China University of Technology,Guangzhou 510640,Guangdong,China; 2.Food Green Processing and Nutrition Regulation Research Center of Guangdong Province,South China University of Technology,Guangzhou 510640,Guangdong,China;3.Guangdong Province Key Laboratory for Green Processing of Natural Products and Product Safety,South China University of Technology,Guangzhou 510640,Guangdong,China)
In the investigation,the effects of the pulsed electric field(PEF)treatment on the survival ratio and cytomembrane permeability ofSalmonellaTyphimurium are discussed,and the effect of the PEF treatment time on the phospholipid conformation ofS.Typhimurium is also analyzed by using the Raman spectra.The results show that(1)as the energy of PEF inputs continuously,the cell viability decreases and the cytomembrane permeability increases;(2)with the increase of the PEF treatment time,the peak value ratio of the Raman spectra ofS.Typhimurium phospholipid,namelyI1 139/I1 082,first increases and then decreases,and it is always higher than that without PEF treatment(P<0.05),which indicates that the PEF treatment can increase the number of the all-trans conformation of C—C and decrease the number of the gauche conformation of C—C;and(3)as the PEF treatment time increases,I2 874/I2 862increases(P<0.05),which means that the PEF treatment increases the lateral chain interaction of C—H and thus results in the increase of the intrachain order of phospholipid molecules and the decrease of the cytomembrane fluidity ofS.Typhimurium.Therefore,it is concluded that the PEF treatment can cause cell damage or cell death by increasing the cytomembrane permeability and decreasing the cytomembrane fluidity.This investigation provides a theoretical basis for the mechanism research of inactivating micro-organisms with the PEF treatment.
pulsed electric field;SalmonellaTyphimurium;Raman spectra;phospholipid conformation;cytomembrane fluidity
2016- 04- 08
国家自然科学基金资助项目(21576099,21376094,31301559);广东省科技攻关项目(2015A030312001,2013B051000010,2013B020203001) Foundation items: Supported by the National Natural Science Foundation of China(21576099,21376094,31301559) and the Key Science and Technology Program of Guangdong Province(2015A030312001,2013B051000010,2013B020203001)
曾新安(1972-),男,博士,教授,主要从事非热加工技术及果酒果醋酿造研究.E-mail:xazeng@scut.edu.cn
1000- 565X(2016)10- 0132- 05
TS 201.1
10.3969/j.issn.1000-565X.2016.10.019
