柚皮苷体外抗肿瘤活性及其机制研究
2017-01-05杨慧慧王秀珍
杨慧慧,王秀珍
(广东药科大学 1.中药学院; 2.药学院,广东 广州 510006)
柚皮苷体外抗肿瘤活性及其机制研究
杨慧慧1,王秀珍2
(广东药科大学 1.中药学院; 2.药学院,广东 广州 510006)
目的 研究柚皮苷的体外抗肿瘤活性。方法 采用MTT法测定柚皮苷对5种不同肿瘤细胞的增殖抑制作用。采用流式细胞术检测柚皮苷对细胞凋亡、细胞活性氧水平及细胞线粒体膜电位水平的变化。采用单细胞凝胶电泳(SCGE)实验检测柚皮苷对细胞DNA的损伤。结果 MTT实验得出柚皮苷对不同的肿瘤细胞产生不同的增殖抑制现象,并且对肿瘤细胞的抑制作用呈浓度依赖性。其对PC-12细胞作用24 h后,流式细胞术检测得到柚皮苷能有效诱导PC-12细胞的凋亡,并且细胞内活性氧水平升高,线粒体膜电位下降。SCGE实验发现柚皮苷使细胞DNA断裂,形成拖尾。结论 柚皮苷通过活性氧调控的线粒体途径诱导肿瘤细胞PC-12的凋亡。
柚皮苷; 流式细胞术; 单细胞凝胶电泳; 细胞凋亡
柚皮苷,双氢黄酮类化合物,白色至浅黄色结晶性粉末,是一种天然的苦味剂,毒副作用较小[1]。研究表明其具有抗炎、抗氧化、抑菌、降血糖、抗肿瘤、防治心血管疾病、抗动脉粥样硬化[2-4]等多种生物活性。柚皮苷对肝癌、W256癌肉瘤、宫颈癌、结肠癌[5-8]等的抗肿瘤效果已得到证实,但其作用机制尚不明确。目前癌症的发生已严重危害到人类的健康与生存,国内外学者研究的热点已从放疗化疗等方面逐步向寻找开发低毒有效的天然抗肿瘤药物方面转变。因此本实验研究柚皮苷对不同肿瘤细胞增殖的抑制作用,进一步阐明柚皮苷抗肿瘤的可能作用机制。柚皮苷的结构如图1。

图1 柚皮苷的结构
Figure 1 Structure of naringin
1 材料与方法
1.1 主要试剂与仪器
柚皮苷(上海晶纯生化科技股份有限公司); RPMI-1640培养基(美国Gibco公司);新生牛血清(杭州四季青生物材料有限公司);MTT细胞增殖及细胞毒性检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、活性氧检测试剂盒、线粒体膜电位检测试剂盒(上海碧云天生物技术有限公司);MCO-15AC型CO2细胞培养箱(日本松下电气公司);SW-CJ-2F型细胞培养超净台(苏州安泰空气技术有限公司);Varioskan Flash型酶标仪(美国Thermo Scientific公司);DMI3000B型倒置荧光显微镜(德国LEICA公司);Fasealibur型流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 体外细胞毒性实验 柚皮苷对肿瘤细胞的体外增殖抑制作用采用MTT实验来评价[9]。柚皮苷分别作用于不同肿瘤细胞48 h后收集对数期的SGC-7901、Bel-7402、PC-12、SiHa、HepG-2细胞,调整细胞悬液,分别向96孔板中每孔加入100 μL CO2细胞培养箱培养,待细胞贴壁后,加入不同浓度梯度的柚皮苷溶液(1.57~100 μmol/L),37 ℃ 5%(φ)CO2继续培养48 h,每孔加入10 μL MTT溶液,培养4 h后加100 μL DMSO,酶标仪490 nm 测吸光度值(A)。
1.2.2 流式细胞术检测细胞凋亡 采用Annexin V-PI双染法检测细胞凋亡[10],取对数生长期的PC-12细胞接种6孔板,待细胞贴壁后,分别向每孔加入不同浓度的柚皮苷(20、40、60 μmol/L)作用24 h,并设置不加药空白对照组。收集各孔细胞,预冷的PBS洗2遍,按Annexin V-FITC细胞凋亡检测试剂盒说明书操作避光染色20 min,转移至流式管中用流式细胞仪检测。
1.2.3 单细胞凝胶电泳 单细胞凝胶电泳实验也称彗星电泳实验[11],取处于对数生长期的PC-12细胞接种于6孔板中,待细胞贴壁后分别向每孔加入不同浓度的柚皮苷(20、40、60 μmol/L)处理24 h,同时留空白对照孔。消化细胞制备细胞悬液,显微镜下计数。采用三层制胶法依次制备琼脂糖玻片,碱性细胞裂解液裂解70 min,预冷电泳液解旋20 min,电泳20 min,中和缓冲液中和30 min,EB染色10 min,倒置荧光显微镜拍照。
1.2.4 细胞活性氧水平的检测 选择生长状态较佳的PC-12细胞接种于6孔板中,待细胞铺满80%后加入不同浓度柚皮苷(20、40、60 μmol/L)处理24 h,留空白对照孔。消化细胞,预冷的PBS洗2遍,用荧光探针DCFH-DA进行染色,染色完毕PBS洗2遍,重悬,转移至流式管,流式细胞仪上机检测。其中检测激发波长488 nm,发射波长525 nm。
1.2.5 细胞线粒体膜电位的检测 取生长状态佳的PC-12细胞接种于6孔板中,待细胞铺满80%后加入不同浓度柚皮苷(20、40、60 μmol/L)处理24 h,预留空白对照孔。消化细胞,PBS洗2遍,JC-1染色工作液避光染色,染色完成后用预冷的JC-1染色缓冲液清洗2遍,PBS重悬,转移至流式管,流式细胞仪上机检测。
2 结果
2.1 柚皮苷对肿瘤细胞的体外增殖抑制作用
柚皮苷分别作用于不同肿瘤细胞48 h后,酶标仪490 nm 测得吸光值,SPSS 19.0 处理MTT结果显示,柚皮苷对PC-12细胞的增殖抑制作用较为明显,IC50为40.8 μmol/L,对SGC-7901细胞作用较弱,IC50为383.7 μmol/L,细胞存活率随柚皮苷的浓度增加而降低。另外对本次实验的其他肿瘤细胞无体外增殖抑制作用,其IC50值均大于1 000 μmol/L。因此本实验选取PC-12细胞作进一步研究。
2.2 柚皮苷对PC-12细胞凋亡的影响
不同浓度柚皮苷作用于PC-12细胞24 h后,细胞凋亡情况如图2。通过流式细胞仪检测可以得出,与空白对照组比较,加药组20 μmol/L的早期凋亡率增加至1.53%,柚皮苷浓度为40 μmol/L时,PC-12细胞早期凋亡率增加至2.31%、当柚皮苷浓度为60 μmol/L 时,PC-12细胞早期凋亡率增加至4.00%。同时加入不同浓度柚皮苷(20、40、60 μmol/L)处理PC-12细胞24 h后,PC-12晚期凋亡率也分别增加至2.98%、3.51%、4.47%。数据表明,柚皮苷有效地诱导了细胞的凋亡,并呈浓度依赖性。
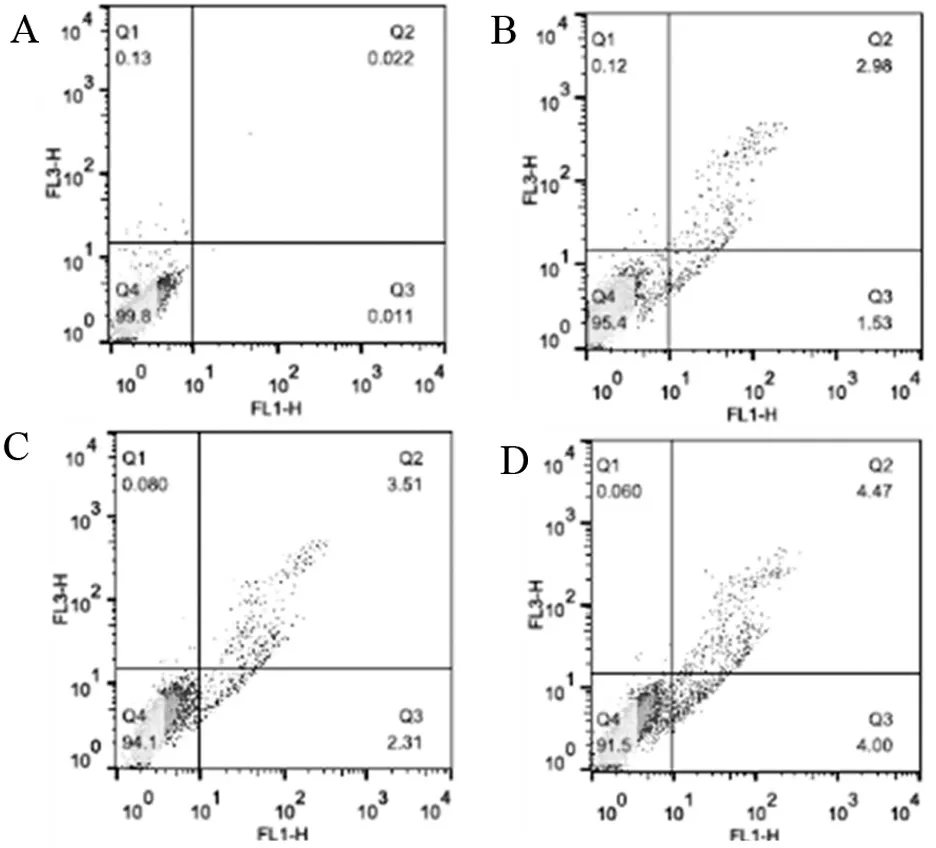
A. PC-12细胞空白对照组细胞凋亡分布图; B、C、D分别为浓度20、40、60 μmol/L柚皮苷诱导 PC-12细胞凋亡分布图。
图2 流式细胞仪检测柚皮苷对PC-12细胞凋亡的影响
Figure 2 Effect of naringin on PC-12 cell apoptosis by FCM
2.3 单细胞凝胶电泳实验
单细胞凝胶电泳实验通过荧光显微镜拍照看出,空白对照组细胞DNA未受损,因此没有出现拖尾现象。当加入浓度为20 μmol/L的柚皮苷后,细胞DNA受损片段化,出现轻微拖尾现象。当加入40 μmol/L的柚皮苷后,尾巴增长,并且亮度也有所增加。加入60 μmol/L的柚皮苷后,细胞DNA受损最严重,拖尾最长。不同浓度柚皮苷对DNA损伤程度见图3。
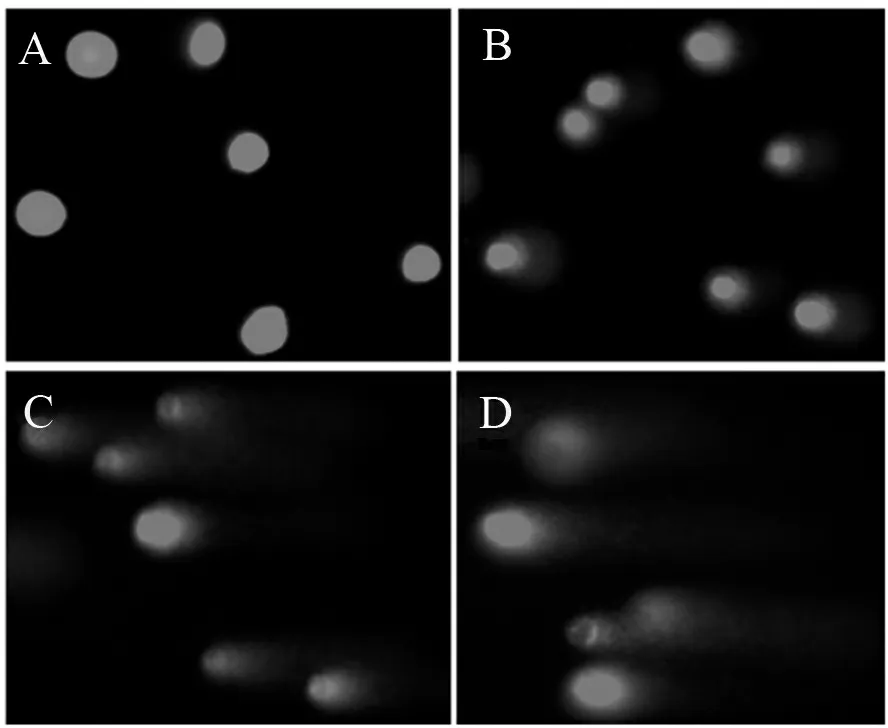
A.空白对照组PC-12细胞核; B. 20 μmol/L柚皮苷;C. 40 μmol/L柚皮苷; D. 60 μmol/L柚皮苷。
图3 不同浓度柚皮苷对PC-12细胞核损伤实验(200×)
Figure 3 Effect of naringin on DNA damage in PC-12 cells(200×)
2.4 细胞活性氧水平变化的检测
不同浓度柚皮苷作用PC-12细胞24 h后,空白对照组活性氧水平荧光强度为6.17,加入20、40、60 μmol/L柚皮苷处理后产生的活性氧水平荧光强度分别为464、467和543。与空白对照比较,活性氧水平荧光强度增加75.2、75.7、88.0倍。活性氧水平荧光强度的增加暗示细胞内活性氧水平提高,而且活性氧水平随柚皮苷浓度增加而提高。活性氧水平荧光强度变化如图4。
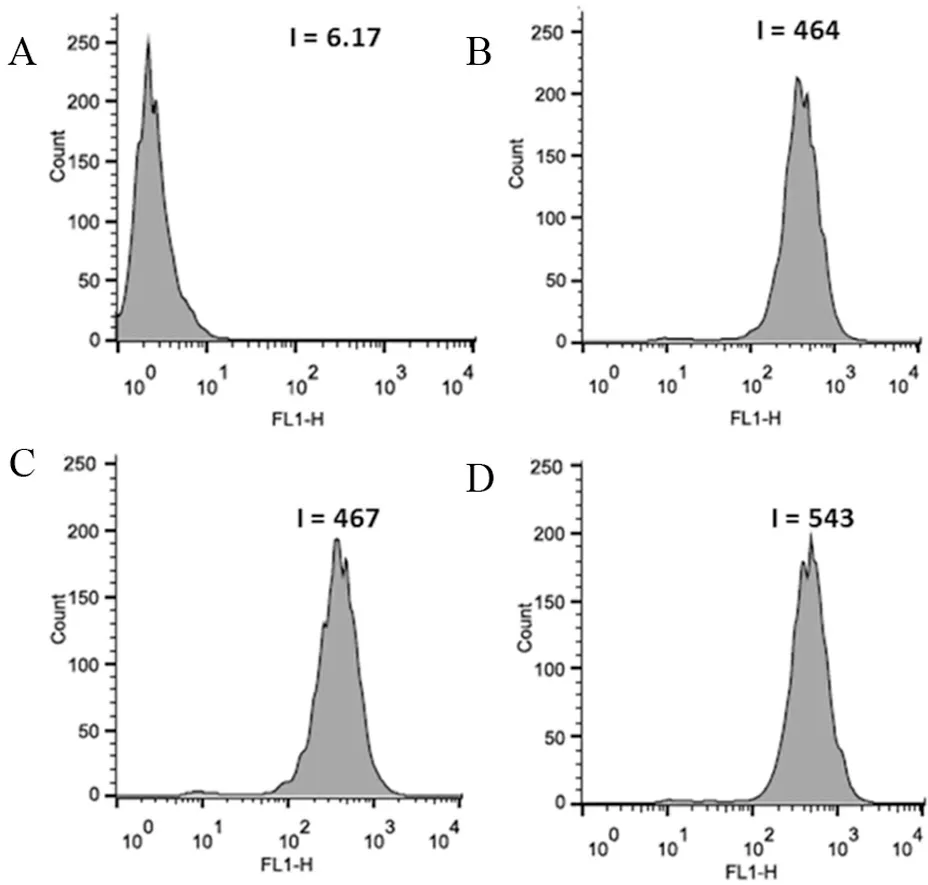
A. 空白对照组PC-12细胞内DCF荧光强度;B、C、D.分别为20、40、60 μmol/L柚皮苷引起细胞内DCF荧光变化。
图4 流式细胞仪检测柚皮苷对PC-12细胞活性氧水平的影响
Figure 4 Effect of naringin on cell ROS levels in PC-12 cells by FCM
2.5 细胞内线粒体膜电位变化的检测
不同浓度柚皮苷作用PC-12细胞24 h后,细胞内线粒体膜电位变化结果见图5。柚皮苷组与空白对照组比较,FL1-H通道的红色荧光减弱,FL2-H通道的绿色荧光增强。空白对照组红色与绿色荧光比值(Q2/Q3)为4.07。加入20、40、60 μmol/L柚皮苷作用PC-12细胞24 h,其红绿比分别为2.96、1.44、1.04。红绿比值的下降,表明红色荧光强度逐渐减少,绿色荧光强度增加。说明柚皮苷能够诱导细胞内线粒体膜电位降低。

A.空白对照组JC-1发出的红色和绿色荧光; B、C、D分别为20、40、60 μmol/L 柚皮苷处理PC-12细胞诱导JC-1发出的红色和绿色荧光。
图5 流式细胞仪检测柚皮苷对PC-12细胞线粒体膜电位的影响
Figure 5 Effect of naringin on the mitochondrial membrane potential in PC-12 cells by FCM
3 讨论
柚皮苷作为黄酮类化合物的一种,已有大量研究报道表明其具有多种生物活性,但是近年来的研究报道主要趋向于抑菌、抗氧化等方面,对于其体外抗肿瘤方面的报道较少,本实验研究以柚皮苷为考察目标,采用MTT法测定其对不同肿瘤细胞的增殖抑制作用,结果发现柚皮苷对肿瘤细胞PC-12具有良好的增殖抑制作用,因此,选取该细胞为实验对象来探究柚皮苷体外抗肿瘤的作用机制。
研究表明柚皮苷的抗肿瘤活性与其苯环取代基有关,A酚环上的糖结合物的类型起重要作用,羟基连在B环上同样也有强的抗肿瘤活性,B环上3、4和5连有羟基或B环有一邻位酚结构和饱和的C环都显示出很强的抗肿瘤活性[12]。文献[13]表明柚皮苷主要抑制细胞增殖,诱导癌细胞凋亡,抑制癌基因表达等。
促进肿瘤细胞的凋亡是抗癌药物发挥作用的重要方式,细胞活性氧水平的变化与细胞线粒体膜电位的变化在肿瘤细胞的死亡和凋亡过程中均起着重要作用[14-15]。当PC-12细胞加入20 μmol/L柚皮苷作用24 h后,细胞内活性氧水平急剧增加,是空白对照组活性氧水平的75.2倍。由于细胞内活性氧的主要来源为线粒体,线粒体膜电位的检测荧光探针能快速灵敏地检测细胞内线粒体膜电位的变化。在高点位时发出红色荧光,而在低细胞膜电位时发出绿色荧光[16]。本研究在流式细胞仪中也检测到线粒体膜电位水平下降,红色绿色荧光比值由空白对照组的4.07降至2.96,线粒体膜电位的下降是细胞早期凋亡的重要标志。并且通过流式细胞仪检测柚皮苷对PC-12细胞的凋亡作用可知,当PC-12细胞加入20 μmol/L柚皮苷作用后,细胞凋亡率由空白对照组的0.033%增加至4.51%。由此可知,本研究所采取的3种实验方法均得出相同结果:柚皮苷浓度为20 μmol/L时已引起了PC-12细胞发生凋亡,并且实验结果显示PC-12细胞凋亡率呈现浓度依赖性。
目前已知抗肿瘤药物作用靶点较多集中在细胞核、线粒体、内质网、溶酶体等[17]。单细胞凝胶电泳(SCGE)实验用于检测单链DNA断裂,在碱性条件下解旋电泳,断链或碎片向阳极迁移,形成拖尾。细胞核DNA损伤愈严重,产生的断链或短片也就愈小,在电场作用下迁移的DNA量多,表现为彗星尾巴长度的增加和尾部荧光强度增强。因此,通过测定DNA迁移部分的吸光度或迁移长度就可定量测定单个细胞DNA损伤程度[11]。本研究中空白对照组细胞核DNA正常,加药组均出现拖尾,并且随着药物浓度的增加尾巴长度与荧光强度均有所增加,由此可知柚皮苷作用于PC-12细胞促使其发生凋亡的作用靶点主要集中在细胞核。
本实验结果表明柚皮苷可以有效地抑制PC-12细胞的体外增殖,并诱导其产生凋亡,这为柚皮苷体的外抗肿瘤机制提供了依据,但是药物进入细胞内的主要作用靶点尚不清晰,是否存在靶点转移现象有待进一步研究。
[1] 马先红,隋新,刘洋. 柚皮活性成分提取工艺的研究进展[J]. 吉林化工学院学报,2014,31(11):38-41.
[2] 谢仁峰,文双娥,李洋,等. 柚皮苷抗炎镇痛作用的研究[J]. 湖南师范大学学报(医学版),2011,8(4):5-8.
[3] XU Z W,LI N H,WOOLEY P H,et al. Narigin promotes osteoblast differention and effectively reverses ovariectomy-associated osteoporosis [J]. J Orthpo Sci,2013,18(3):478-485.
[4] 于广仁,蒋超,肖安风,等.柚皮苷及其酶解产物的生物活性研究 [J]. 食品科技,2014,39(3):155-159.
[5] CAMARGO C A,GOMES-MARCONDES M C,WUTZKI N C,et al. Naringin inhibits tumor growth and reduces interleukin-6 and tumor necrosis factor a levels in rats with Walker 256 carcinosarcoma [J]. Anticancer Res,2012,32(1):129-133.
[6] KIICHIRO K. Suppression of lipopolysaccharideinduced tumor necrosis factor-release and liver injury in mice by naringin [J]. Eur J Pharmacol,1999,368(2/3):245-250.
[7] YU J,WANG L M,WALZEM R L,et al. Antioxidant activity of citrus limonoids,flavanoids and coumarins [J]. J Agric Food Chem,2006,53:2009-2014.
[8] WESOLOWSKA O,WISNIEWSKI J,SRODA-POMIAN K,et al. Multidrug resistance reversal and apoptosis induction in human colon cancer cells by some flavonoids present in citrus plants [J]. J Nat Prod,2012,75(11):1896-1902.
[9] MOSMANN T. Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays [J]. J Immunol Methods,1983,65(1/2):55-63.
[10] YU H Y,JIN C Y,KIM K S,et al. leifolioside A mediates caspase-independent human cervical carcinoma HeLa cell apoptosis involving nuclear relocation of mitochondrial apoptogenic factors AIF and EndoG [J]. J Agric Food Chem,2012,60 (21):400-5406.
[11] ALAPETITE C,WACHTER T,SAGEE,et al. Use of the alkaline comet assay to detect DNA repair deficiencies in human fibroblasts exposed to UVC,UVB,UVA and gamma-rays [J]. Int J Radiat Biol,1996,69(3):359-369.
[12] 王巧能. 积实中黄酮类化合物的提取、分离、鉴定与生物活性研究[D]. 浙江:浙江工商大学,2008.
[13] 李秀娟,周志钦. 柑桔柚皮苷抗癌活性研究进展[J]. 营养与保健,2011,28(1):27-30.[14] FAN C,CHEN J,WANG Y,et al. Selenocystine potentiates cancer cell apoptosis induced by 5-fluorouracil by triggering reactive oxygen species-mediated DNA damage and inactivation of the ERK pathway [J]. Free Radic Biol Med,2013,65:305-316.
[15] THORNEBBRY N A,RANO T A,PETERSON E P,et al. A combinatorial approach defines specificities of members of the caspase family and granzyme B. functional relationships established for key mediators of apoptosis [J]. J Biol Chem,1997,272(29):17907-17911.
[16] THRESS K,KORNBLUTH S,SMITH J J,et al. Mitochondria at the crossroad of apoptotic cell death [J]. Bioenerg Biomemb,1999,31(4):321-326.
(责任编辑:幸建华)
Effect and mechanism of naringin on antitumor activity in vitro
YANG Huihui1,WANG Xiuzhen2
(1.SchoolofTraditionalChineseMedicine,GuangdongPharmaceuticalUniversity,Guangzhou510006,China; 2.SchoolofPharmacy,GuangdongPharmaceuticalUniversity,Guangzhou510006,China)
Objective To study the anticancer activity of naringininvitro. Methods MTT assay was used to detect the growth inhibition of naringin on human cancer cell lines. Flow cytometry was used to analyze the cell apoptosis,reactive oxygen species and the changes of mitochondrial membrane potential. DNA damage was investigated by single cell gel electrophoresis (SCGE). Results Treatment with naringin inhibited the proliferation of PC-12,SGC-7901,Bel-7402,HepG-2 and SiHa cells in a dose-dependent way. Naringin induced cell apoptosis,increased ROS levels and decreased the mitochondrial membrane potential in PC-12 cells. Additionally,naringin induced DNA damage in PC-12 cells. Conclusion Naringin may induce PC-12 cell apoptosis through modulation of ROS-mediated mitochondrial pathway.
naringin; flow cytometry; single cell gel electrophoresis; apoptosis
2016-09-21
杨慧慧,女,2014级硕士研究生,Email:yanghuicd@126.com;通信作者:王秀珍,女,博士,副教授,主要从事小分子药物设计合成及抗肿瘤活性研究,Email:wxzqq1234@163.com。
时间:2016-11-29 10:03
http://www.cnki.net/kcms/detail/44.1413.R.20161129.1003.004.html
R965
A
1006-8783(2016)06-0757-05
10.16809/j.cnki.1006-8783.2016091201
