芹菜素对人胃癌细胞SGC-7901增殖的影响及机制研究
2017-01-05刘欢杨周萍金桂芳王桂香潘雪刁
刘欢,杨周萍,金桂芳,王桂香,潘雪刁
(1.广东药科大学 药学院,广东 广州 510006; 2.三九脑科医院 药剂科,广东 广州 510510)
芹菜素对人胃癌细胞SGC-7901增殖的影响及机制研究
刘欢1,杨周萍2,金桂芳1,王桂香1,潘雪刁1
(1.广东药科大学 药学院,广东 广州 510006; 2.三九脑科医院 药剂科,广东 广州 510510)
目的 探讨芹菜素对胃癌细胞SGC-7901增殖及葡萄糖摄取的影响及其可能的内在机制。方法 采用MTT法检测不同剂量不同作用时间芹菜素对SGC-7901细胞增殖的影响;采用葡萄糖检测试剂盒检测芹菜素对SGC-7901细胞葡萄糖摄取量的影响;蛋白免疫印迹实验检测芹菜素作用SGC-7901细胞后,葡萄糖转运体1(GLUT1)和己糖激酶Ⅱ(HKⅡ)表达水平的影响。结果 芹菜素对胃癌细胞SGC-7901具有增殖抑制作用,并具有一定的剂量和时间依赖性,差异有统计学意义(P<0.05,P<0.01);芹菜素干预后的SGC-7901细胞的葡萄糖摄取量明显减少,芹菜素10 μmol/L和20 μmol/L组与对照组比较,差异有统计学意义(P<0.01);一定剂量的芹菜素能下调SGC-7901细胞中GLUT1、HKⅡ蛋白的表达水平,具有一定的时间和剂量依赖性。结论 芹菜素能抑制胃癌细胞SGC-7901的增殖和葡萄糖摄取的作用,其机制可能与调控GLUT1、HKⅡ蛋白表达水平有关,为临床胃癌的诊断和治疗提供了一定的理论基础。
芹菜素; 人胃癌SGC-7901细胞; 细胞增殖; 葡萄糖摄取
胃癌是源于胃黏膜上皮的恶性肿瘤,在全球范围内其恶性程度排名第5,其发病率排名第3[1]。目前临床上针对早期胃癌根治的方法仍是手术切除术[2]。但是早期胃癌的临床症状多不明显,容易造成延误诊治,大多数属于晚期肿瘤,术后5年生存率维持在30%左右[3]。目前内科治疗方案主要以一线联合化疗(如:顺铂联合5-氟尿嘧啶)为主,但是受疾病本身的特点及治疗效果有限,接受二线治疗的患者甚少[4]。故需找到高效、安全的抗胃癌方案十分重要。
芹菜素(apigenin,API)是一种天然的黄酮类化合物,广泛存在于蔬菜和水果中,具有多种药理作用,如抗炎、抗氧化、降血压、预防动脉粥样硬化、中枢镇静作用等[5]。近年来研究表明芹菜素还具有普遍的抗肿瘤作用,对乳腺癌[6]、膀胱癌[7]、前列腺癌[8]等都有显著的抑制作用。有文献报道芹菜素具有诱导胃癌细胞发生凋亡[9],但是芹菜素对于胃癌细胞糖代谢影响的报道罕见。本实验研究了芹菜素作用SGC-7901细胞后,其细胞增殖及葡萄糖摄取量的变化及其可能相关的机制,为芹菜素抗胃癌活性的研究提供新思路。
1 材料与仪器
1.1 材料
人胃癌细胞SGC-7901购于中科院上海细胞库。芹菜素(质量分数≥98%,阿拉丁);RPMI-1640 培养基(美国Hyclone,批号:AAG204845);胎牛血清(美国 Gibco,批号:41Q6531K);青链霉素双抗(美国Gibco,批号:1491907);0.25%含EDTA的胰酶(美国 Gibco,批号:1715701);PBS粉(鼎国生物公司);葡萄糖检测试剂盒(上海荣盛生物药业有限公司,批号:361500);MTT(Genview,批号:36200204100);Anti-GLUT1一抗、β-actin一抗、Anti-HKⅡ一抗、羊抗鼠-HRP 二抗、羊抗兔-HRP二抗(武汉博士德生物工程有限公司);其余试剂(分析纯)均购于广州试剂。
1.2 主要仪器
371型恒温CO2培养箱(美国Thermo Scientific);SW-CJ-1FD超净工作台(苏净安泰);680型酶标仪(美国Bio-Rad);5424R高速微量冷冻离心机(德国Eppendorf);ME204E电子分析天平(美国Mettler Toledo);PowerPacTMBasic垂直电仪泳仪(美国Bio-Rad)。
2 方法
2.1 体外细胞培养
将SGC-7901 细胞以适宜密度接种于T25规格的培养瓶中,其中含有5 mL RPMI-1640基础培养基,体积比为10%的胎牛血清,100 U/mL 的青霉素和链霉素。细胞于37 ℃,5%(φ)CO2培养箱中培养,细胞贴壁生长。待细胞融合度达80%~90%时开始传代,PBS洗净培养基,1 mL 2.5%含EDTA的胰酶进行消化,含血清的培养基终止消化,吹打细胞形成细胞悬液,2 000 r/min 离心2 min得细胞沉淀,加入适量含血清培养基混匀,将适量细胞数种入新的培养瓶,加入完全培养基至适量。
2.2 检测细胞增殖抑制率
取对数生长期SGC-7901细胞以5×104个/mL密度接种于96孔板中,分为空白对照组(无细胞组)、阴性对照组(不加药组)、芹菜素2.5、5、10、20 μmol/L加药组,每组6个复孔。细胞生长24 h 后,移除完全培养基,加药组依次加入含不同浓度芹菜素的无血清培养基,空白组和阴性对照组加入等体积的无血清培养基。培养24、48、72 h后,避光加入 10 μL/孔 MTT(5 mg/mL)溶液,培养箱中孵育4 h,移弃上清,加入150 μL/孔的二甲基亚砜,水平摇床上100 r/min震荡10 min充分溶解甲瓒结晶,波长570 nm处检测各孔的吸光度A。实验重复3次。
细胞存活率(%)=100-(阴性对照组A-加药组A)/(阴性对照组A-空白对照组A)
2.3 葡萄糖摄取量的检测
选用对数期生长的SGC-7901细胞按5×104个/mL密度接种于96孔板中,设置空白对照组、阴性对照组、芹菜素不同浓度组。用终浓度为2.5、5、10、20 μmol/L芹菜素分别处理 24、48、72 h 后,收集所有组别培养基上清液,根据葡萄糖检测试剂盒说明书要求操作,运用酶标仪于波长505 nm处检测样品吸收度。以空白对照组为葡萄糖总量,分别计算不同组别的葡萄糖消耗量,再将加药组的葡萄糖消耗量与阴性对照组比较,观察芹菜素不同剂量不同作用时间对SGC-7901细胞葡萄糖摄取量的影响。
2.4 GLUT1、HKⅡ蛋白表达的检测
取对数生长的SGC-7901细胞按5×106个/mL 密度接种于直径60 mm的培养皿中,分别设阴性对照组、芹菜素作用组(2.5、5、10、20 μmol/L),待细胞生长密度约70%~80%时弃去培养基,加药组加入不同浓度芹菜素(对照组加等体积的无血清培养基),培养48 h后弃培养基,PBS洗涤细胞,加入适量蛋白裂解液冰上裂解,细胞刮刮下细胞并收集,4 ℃,12 000 r/min离心的细胞总蛋白上清,按BCA蛋白定量试剂盒说明进行蛋白定量,每泳道蛋白上样量为50 μg,8%SDS-PAGE电泳后湿转至PVDF膜上,5%脱脂奶粉室温封闭2 h,4 ℃孵育Anti-GLUT1一抗(1∶1 000)、Anti-HKⅡ 一抗、Anti-β-actin一抗过夜。弃一抗,TBST洗膜3次,8 min/次,室温孵育羊抗兔-HRP二抗(1∶10 000)、羊抗鼠-HRP二抗(1∶5 000)1 h。弃二抗,TBST洗膜3次,8 min/次。暗室中在PVDF膜上孵ECL发光液,根据荧光强度选择X胶片合适的曝光时间,并显影、定影。运用Image J软件处理胶片中条带的灰度值。以各组灰度面积的乘积/内参(β-actin) 灰度面积的乘积反映蛋白相对表达丰度。实验重复3次。
2.5 统计学方法
3 结果
3.1 芹菜素对SGC-7901细胞增殖的影响
和阴性对照组相比,不同浓度的芹菜素作用SGC-7901细胞后,细胞增殖出现不同程度的抑制作用,且呈一定的时间和剂量依赖性。除24 h低浓度的芹菜素组别外,其余组相比对照组差异均有统计学意义(P<0.01)。见图1。
3.2 芹菜素对SGC-7901细胞葡萄糖摄取量的影响
相比阴性对照组,芹菜素干预组的SGC-7901细胞葡萄糖摄取量呈现不同程度的抑制作用,且10、20 μmol/L的芹菜素组的抑制效果与对照组比较,差异有统计学意义(P<0.05,P<0.01)。见图1。
3.3 芹菜素对SGC-7901细胞糖代谢相关蛋白表达的影响
不同浓度芹菜素干预SGC-7901细胞48 h后,Western blot实验结果显示芹菜素具有下调GLIUT1、HKⅡ蛋白的表达水平,并具有一定的剂量依赖性;选用10 μmol/L芹菜素作为最佳干预浓度作用不同时间发现GLUT1和HKⅡ蛋白的表达水平均呈现下调趋势,结果见图2,说明芹菜素对于胃癌细胞SGC-7901糖代谢的影响可能与这些蛋白的表达改变有关。
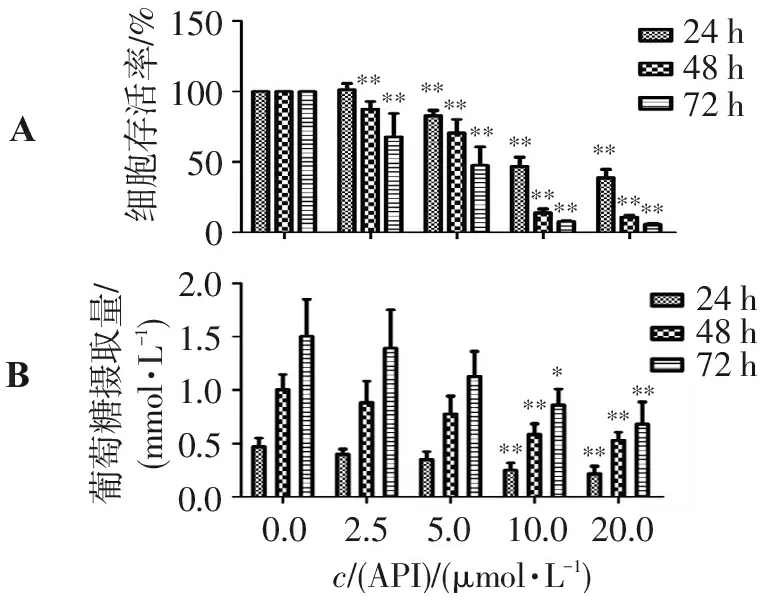
A. SGC-7901细胞活性; B. SGC-7901细胞葡萄糖摄取量;与阴性对照组比较:*P<0.05,**P<0.01。
图1 不同浓度芹菜素作用不同时间对SGC-7901细胞增殖及葡萄糖摄取量的影响
Figure 1 Effect of apigenin on the cell proliferation and glucose uptake of SGC-7901 cells with different concentrations and times
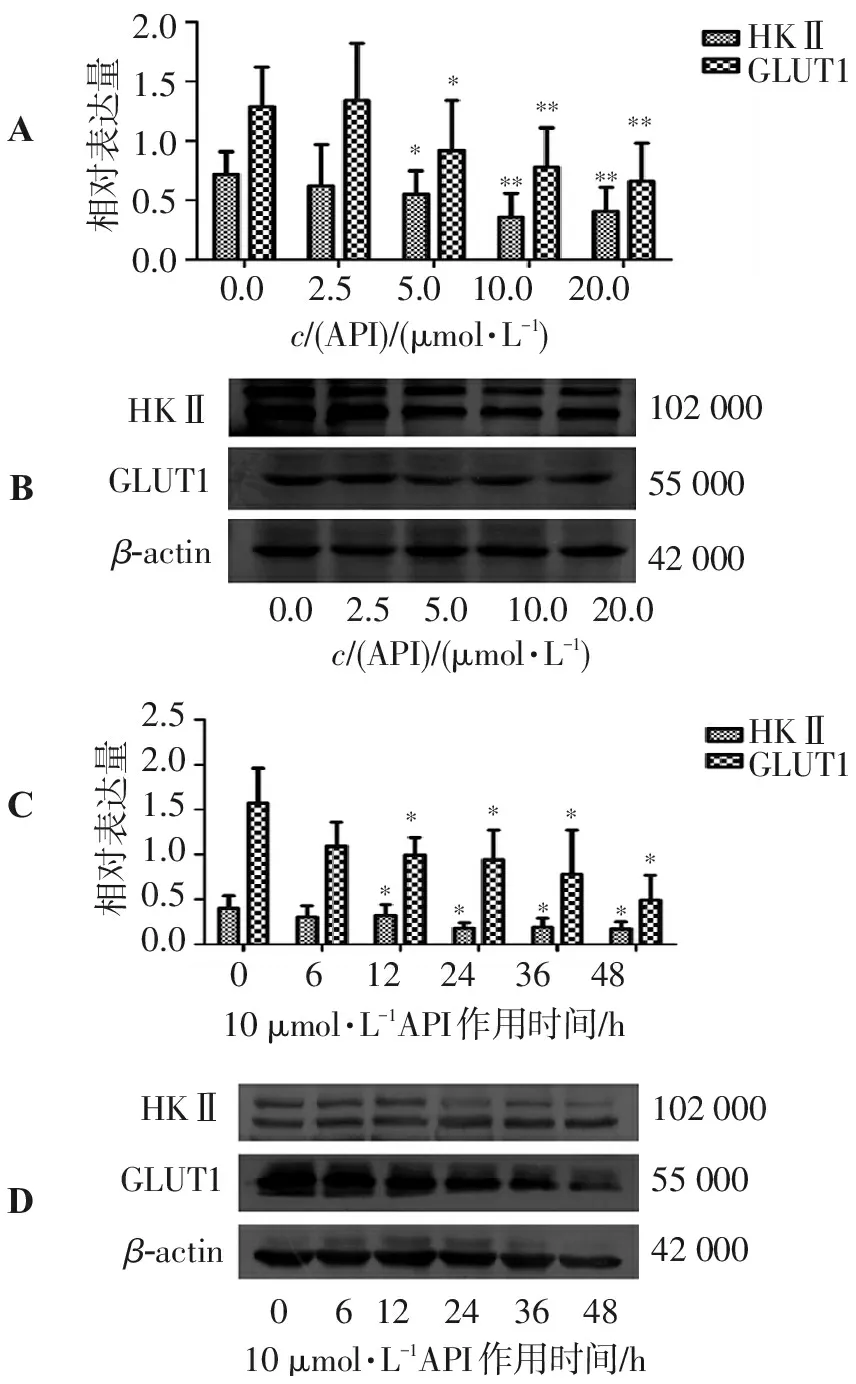
A、B. 不同浓度芹菜素对SGC-7901细胞株的HKⅡ、GLUT1蛋白表达的影响; C、D. 10 μmol/L芹菜素作用SGC-7901细胞株不同时间HKⅡ、GLUT1蛋白表达的变化;与阴性对照组比较:*P<0.05,**P<0.01。
图2 芹菜素对SGC-7901细胞株HKⅡ、GLUT1蛋白表达的影响
Figure 2 Effect of apigenin on the expression of GLUT1 and HKⅡ in SGC-7901 cells
4 讨论
在能量代谢方面,正常细胞所需的能量主要是由线粒体氧化磷酸化产生ATP提供,而肿瘤细胞主要以糖酵解途径供能[10]。同时,肿瘤细胞对于葡萄糖的摄取利用十分活跃,肿瘤细胞的能量异常代谢称为瓦伯格效应。抑制瓦伯格效应可以有效地抑制肿瘤细胞的生长,近年来能量代谢方面已经成为抗肿瘤药物研究的热点备受关注。
与糖代谢相关的酶类则成为糖代谢靶向抗肿瘤治疗的重要靶点之一,其中在肿瘤细胞和正常细胞中差异表达的有GLUT1、HK Ⅱ等。肿瘤细胞对于葡萄糖的大量摄取主要依赖于葡萄糖转运体的高表达,而己糖激酶是糖酵解途径中重要的限速酶[11]。有文献报道GLUT1、HK Ⅱ在胃癌组织的表达高于癌旁组织,且在中晚期癌症存在高于早期[12]。这些蛋白在癌症的发展、侵袭、转移过程中发挥着重要的作用。
芹菜素是一种黄酮类单体,近年来国内外大量研究表明其具有抗肿瘤作用。在胰腺癌、卵巢癌、肺癌等癌症中,芹菜素均具有下调GLUT1蛋白表达水平的作用[13-15]。而关于芹菜素抑制胃癌细胞GLUT1、HKⅡ蛋白表达的研究甚少。本实验MTT结果显示芹菜素具有明显抑制胃癌细胞SGC-7901增殖作用,与报道芹菜素具有选择性抑制胃癌细胞活性并诱导细胞凋亡结果一致,表明芹菜素具有潜在的治疗胃癌的价值。葡萄糖含量检测结果表明芹菜素能明显抑制胃癌细胞SGC-7901的葡萄糖摄取量,且随着剂量增加和作用时间延长,抑制作用越明显,上述结果与芹菜素影响肝癌细胞株HepG2的葡萄糖摄取的结果相似[16]。故推测芹菜素可能通过影响胃癌细胞SGC-7901的葡萄糖摄取及代谢从而抑制细胞的增殖。有研究指出,肿瘤增加的葡萄糖摄取及代谢主要依赖于GLUT1的表达及活性增加,其次是HKⅡ在内的糖酵解途径限速酶表达及活性的增加。蛋白免疫印迹实验结果显示芹菜素能抑制SGC-7901细胞的葡萄糖代谢相关蛋白GLUT1和HK Ⅱ蛋白的表达水平,这可能是细胞葡萄糖摄取量及代谢减少的重要原因。本研究主要表明了芹菜素通过抑制胃癌细胞SGC-7901糖代谢相关蛋白的表达来抑制葡萄糖的摄取及代谢,从而抑制胃癌细胞的增殖,其具体的作用机制还需进一步研究。
[1] FERLAY J,SOERJOMATARAM I,DIKSHIT R,et al. Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):E359-E386.
[2] QUERO L,GUILLERM S,HENNEQUIN C. Neoadjuvant or adjuvant therapy for gastric cancer[J]. WJGO,2015,7(8):102.
[3] MACDONALD J S,SMALLEY S R,BENEDETTI J,et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroeso-phageal junction[J]. New Engl J Med,2001,345(10):725-730.
[4] 杨子鑫,刘巍. 晚期胃癌内科治疗的研究进展[J]. 中华肿瘤防治杂志,2011,18(19):1572-1576.
[5] 孙斌,瞿伟菁,张晓玲. 芹菜素的药理作用研究进展[J]. 中药材,2004,27(7):531-534.
[6] MOHAMMAD N S,HABTEMARIAM S,DAGLIA M,et al. Apigenin and breast cancers:from chemistry to medicine[J]. Anti Cancer Agent Me,2015,15(6):728-735.
[7] SHI M D,SHIAO C K,LEE Y C,et al. Apigenin,a dietary flavonoid,inhibits proliferation of human bladder cancer T-24 cells via blocking cell cycle progression and inducing apoptosis[J]. Cancer Cell Int,2015,15(1):1-12.
[8] WANG X,WANG G,LI X,et al. Suppression of rat and human androgen biosynthetic enzymes by apigenin:possible use for the treatment of prostate cancer[J]. Fitoterapia,2016,111:66-72.
[9] 苑林宏,夏薇,赵秀娟,等. 芹菜素对人胃癌细胞的生长抑制和凋亡诱导作用的研究[J]. 营养学报,2007,29(4):381-384.
[10] 刘启梁,黄庆愿. 肿瘤细胞能量代谢特点及其意义[J]. 生命的化学,2015,35(3):387-391.
[11] SALANI B,DEL R A,MARINI C,et al. Metformin,cancer and glucose metabolism[J]. Endocr-Relat Cancer,2014,21(6):R461-R471.
[12] 张鹏飞,吴继锋,张红,等. 胃癌中 HIF-1a,VEGF 及 Glut1 的表达[J]. 安徽医科大学学报,2010,45(1):86-89.
[13] MELSTROM L G,SALABAT M R,DING X Z,et al. Apigenin down-regulates the hypoxia response genes:HIF-1 ɑ,GLUT-1,and VEGF in human pancreatic cancer cells[J]. J Surg Res,2011,167(2):173-181.
[14] FANG J,ZHOU Q,LIU L Z,et al. Apigenin inhibits tumor angiogenesis through decreasing HIF-1ɑ and VEGF expression[J]. Carcinogenesis,2006,28(4):858-864.
[15] LIU L Z,FANG J,ZHOU Q,et al. Apigenin inhibits expression of vascular endothelial growth factor and angiogenesis in human lung cancer cells:implication of chemoprevention of lung cancer[J]. Mol Pharmacol,2005,68(3):635-643.
[16] 陈婷,王桂香,潘雪刁,等. 芹菜素对人肝癌细胞Hepg2增殖与葡萄糖摄取的影响[J]. 中国实验方剂学杂志,2015,21(23):106-109.
(责任编辑:幸建华)
Effect and mechanism of apigenin on cell proliferation of human gastric cancer SGC-7901 cells
LIU Huan1,YANG Zhouping2,JIN Guifang1,WANG Guixiang1,PAN Xuediao1
(1.CollegeofPharmacy,GuangdongPharmaceuticalUniversity,Guangzhou510006,China; 2.DepartmentofPharmacy,Guangdong999BrainHospital,Guangzhou510510,China)
Objective To investigate the inhibitory effect of apigenin on cell proliferation and glucose uptake in human gastric cancer SGC-7901 cells and its underlying mechanism. Methods MTT assay was used to detect the influence of apigenin on cell proliferation of SGC-7901 cells with different times and concentrations. Amplex Red Glucose/Glucose Oxidase Assay Kit was applied to explore the effect of apigenin on glucose uptake of SGC-7901 cells. The relative expression of GLUT1 and HKⅡ proteins in SGC-7901 cells treated with or without apigenin was measured by western blot. Results Treatment with apigenin significantly suppressed cell proliferation of SGC-7901 cells in a time- and concentration-dependent manner (P<0.05,P<0.01). The glucose uptake of SGC-7901 cells treated with apigenin was decreased and there was a statistical?difference when apigenin at 10 or 20 μmol/L in comparison with the control group (P<0.01). The expression of GLUT1 and HKⅡ was decreased in SGC-7901 cells when treated with apigenin in a time- and concentration-dependent manner. Conclusion Apigenin could inhibit the cell proliferation and glucose uptake of SGC-7901 cells,the mechanism of which may be related to modulation of the expression of GLUT1 and HKⅡ.
apigenin; human gastic cancer SGC-7901 cell; cell proliferation; glucose uptake
2016-08-26
国家自然科学基金项目(81102465)
刘欢(1990—),女,2014级硕士研究生,Email:18825171098@163.com;通信作者:潘雪刁,女,硕士,副教授,主要从事肿瘤药理及多肽药物的研究,Email:panxuediao@126.com。
时间:2016-12-07 15:36
http://www.cnki.net/kcms/detail/44.1413.R.20161207.1536.001.html
R965
A
1006-8783(2016)06-0743-05
10.16809/j.cnki.1006-8783.2016082601
