天山雪莲sikFBA1基因克隆定位及表达分析
2017-01-04穆建强梁文洁张芳松祝建波
穆建强,梁文洁,张芳松,熊 意,祝建波
(石河子大学 生命科学学院,石河子大学农业生物技术重点实验室,新疆石河子 832000)
天山雪莲sikFBA1基因克隆定位及表达分析
穆建强,梁文洁,张芳松,熊 意,祝建波*
(石河子大学 生命科学学院,石河子大学农业生物技术重点实验室,新疆石河子 832000)
果糖-1,6-二磷酸醛缩酶FBA家族(fructose-l,6-bisphosphate aldolase)在植物响应逆境调控中具有重要的意义。该研究基于天山雪莲低温转录组研究,采用RT-PCR方法克隆了1个sikFBA1基因, ORF长度为1 077 bp,共编码358个氨基酸,含有1个保守的Glycolytic结构域,具有典型的FBA家族特征。系统进化分析发现,sikFBA1蛋白分类上属于Ⅰ型FBA,与来自四叶参(Codonopsislanceolata)的同源蛋白亲缘关系最近。亚细胞定位结果表明,sikFBA1蛋白定位于细胞质,属于胞质型同工酶,与预测一致。实时定量PCR结果显示,天山雪莲经过不同低温(4 ℃/-2 ℃)处理,sikFBA1基因的表达水平整体下调,但该基因在冷胁迫与冰冻胁迫、冷驯化与非冷驯化下呈现出不同的表达模式。研究表明,sikFBA1基因参与了天山雪莲低温胁迫的响应。
果糖-1,6-二磷酸醛缩酶;基因克隆;亚细胞定位;表达分析
果糖-1,6-二磷酸醛缩酶(Fructose-l,6-bisphosphate aldolase, FBA, EC4.1.2.13)在碳、氮代谢及糖代谢等过程中起着极为重要的作用[1],同时也是卡尔文循环中必不可少的一个关键调控酶[2],催化甘油醛-3-磷酸(GAP)、磷酸二羟丙酮(DHAP)和果糖-1,6-二磷酸(FBP)的可逆反应。Rutter等[3]依据作用机制不同将其分为Ⅰ类和Ⅱ类FBA。Ⅰ类FBA主要存在于真核生物中,由同源四聚体构成共价“schiff”中间体,作为酶的活性中心[4]。Ⅱ类FBA主要存在于细菌、真菌物和某些原生生物中[5],其催化作用需要依赖二价金属离子作为辅酶因子,主要是Zn2+和Fe2+。高等植物中的FBA又存在2种亚型,即胞质型FBA和质体型FBA[6-7]。前者参与糖酵解和糖异生途径,催化果糖-1,6-二磷酸的裂解[8-10];后者则参与卡尔文循环中1,5-二磷酸核酮糖的再生,与淀粉合成有关[11-12]。
FBA基因通常以基因家族形式存在,通过对已发布的植物基因组分析发现,拟南芥基因组中含有8个FBA编码基因,水稻基因组中含有7个,杨树中有9个,番茄中有8个,而大量证据也表明FBA家族参与了植物的冷调控。Yamada等[13]研究发现超表达CpFBA基因的烟草植株与其对照相比具有更强的低温耐受性;而冷胁迫下四叶参[14]体内果糖-1,6-二磷酸醛缩酶的mRNA水平也发生了变化。通过对拟南芥的表型分析及基因芯片检测发现,在3个低温致死突变体中,果糖-1, 6-二磷酸醛缩酶基因表达水平都发生了明显上调[15]。通过蛋白质组学方法,Abbasi等[16]发现水稻中果糖二磷酸醛缩酶LSY206能够被低温诱导,而果糖二磷酸醛缩酶LSY248并不受低温影响。郭玉琼等[17]在龙眼球形胚低温预培养时,分析发现新诱导的蛋白质LLT4可能是果糖-1,6-二磷酸醛缩酶,推测与龙眼的抗冻性有关。他认为果糖二磷酸醛缩酶催化糖酵解产生丙酮酸,通过三羧酸循环生成酮戊二酸改变代谢途径,催化合成新的适应抗寒力提高的物质脯氨酸。果糖-1,6-二磷酸醛缩酶的活性与脯氨酸的含量提高有关[18]。在番茄中,发现SIFBA3基因随着低温处理时间的增加表达量是逐渐降低的,而SlFBA4基因刚好相反,这和其他几个FBAs基因低温表达模式不同[19]。
温度是植物正常生长的必要条件。低温胁迫几乎影响植物生命活动的全过程。Bruggemann等[20]对栽培番茄和高海拔的野生番茄进行低温低光强处理,发现栽培番茄质体果糖-1,6-二磷酸酶和核酮糖-1,5-二磷酸羧化酶/加氧酶的活性大幅度降低,而高海拔的野生番茄这2种酶活性几乎不受影响。不同生境、不同遗传背景植物的酶,动力学特性不同,来源于抗寒植物的酶具有更好的低温适应性[21]。天山雪莲(SaussureainvolucrataKar. et Kir ),属菊科(Compositae)凤毛菊属(Saussurea),属于典型的耐极端低温的多年生高山植物[22],经过长期的自然选择,产生了适应极端环境条件的独特生存机制[23]。结合天山雪莲生境特点,本研究从天山雪莲中克隆得到天山雪莲sikFBA1基因,通过对其进行生物信息学、亚细胞定位以及低温响应表达谱变化的分析,以期为sikFBA1基因的功能研究提供参考。
1 材料和方法
1.1 材 料
天山雪莲(S.involucrataKar. et Kir)由石河子大学农业生物技术重点实验室组培繁殖。本氏烟(Nicotianabenthamiana)种子由石河子大学农业生物技术重点实验室保存。
1.2 sikFBA1基因克隆
天山雪莲RNA提取依据Easypure Plant RNA Kit试剂盒,逆转录cDNA过程参照EasyScript®One-Step gDNA Removaland Synthesis SuperMix反转录试剂盒说明书完成。根据转录组测序获得的序列设计引物sikFBA1-1F(5′-AGATTCGGGGCGATGATAC-3′)和sikFBA1-1R(5′-CAGAGAAGAATTACCCAACGGA-3′),以上述合成cDNA为模板,扩增天山雪莲FBA基因的开放阅读框(ORF)。PCR反应体系为:cDNA 1.0 μL,上、下游引物各(10 μmol/L) 0.5 μL,dd H2O 8 μL,2×Easy TapPCR SuperMIX 10 μL;反应程序:94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火45 s,72 ℃延伸90 s,共30个循环,此后72 ℃延伸7 min,4 ℃保温。PCR产物经1.0%琼脂糖凝胶电泳检测后,将目的条带纯化回收。回收产物通过TA克隆连入pMD19-T载体,热激法转化大肠杆菌DH5α。筛选阳性菌落,摇菌提取质粒,测序,获得纯化质粒pMD19-T-sikFBA1。
1.3 sikFBA1蛋白生物信息相关分析
利用NCBI(http://www.ncbi.nlm. nih. gov)提供的Blast在线进行同源序列分析,采用ORF Finder在线查找克隆基因开放阅读框;利用DNAMAN进行序列分析,ExPASy Proteomics Server上(http:// web. expasy. org/prot-param/)提供ProtParam在线对编码蛋白的理化性质进行分析;ProtScale分析该蛋白的疏水性,采用SOMPA(http://www.expasy.ch/tools)对sikFBA1编码蛋白进行二级结构分析;SWISS-MODEL(https:// www.swissmodel.expasy.org/)对该蛋白的三级结构进行预测;蛋白定位信号预测分析使用SignalP 4.0 Server(http:// www.cbs.dtu.dk/services/SignalP-4.0/)。利用Clustal X 1.83进行多序列比对,结合MEGA 5.0软件构建系统进化树。
1.4 sikFBA1蛋白亚细胞定位
1.4.1 载体构建 根据天山雪莲FBA基因测序结果,设计引物sikFBA1-2F(5′-gaattcCGATGATACCGATGGCTCT-3′)和sikFBA1-2R(5′-atcgatGTACTTGTAGTCCTTCACGTGG-3′),并分别引入EcoRⅠ与Bsu151(ClaⅠ)酶切位点。从天山雪莲cDNA扩增FBA基因去终止密码子的编码区,TA克隆连入pMD19-T载体,测序后提取阳性克隆的质粒,EcoRⅠ与Bsu151(ClaⅠ)双酶切得到目标基因片段,构建GFP融合表达载体,将GFP与天山雪莲FBA蛋白的C端连接,得到sikFBA1-GFP融合载体。
1.4.2 转化烟草叶片试验方法 转化烟草实验参照Blatt等的方法[24],略有改动。
将构建好的融合载体转入农杆菌GV3101中,鉴定之后,划线、挑单克隆于5 mL Luria-Bertani (LB) 培养基,加入相应抗生素,28 ℃,200 r/min过夜培养;将过夜培养的菌液按1∶25比例接种含相应抗生素的LB培养基中,同样条件下培育OD为0.5左右;接着3 000 g离心15 min,弃上清,用AS培养基(10 mmol/L MgCl2, 10 mmol/L MES-KOH, pH 5.6, 150 μmol/L乙酰丁香酮)重悬,调整OD为0.8左右;室温静置1 h,用不加针头的1 mL注射器进行注射。将含sikFBA1-GFP侵染液注射到4~5周龄的本氏烟草远轴下表皮,完成瞬时表达。以不连接目的基因的空载体为阳性对照,处理方法与sikFBA1-GFP相同,使用激光扫描共聚焦荧光显微镜LSM 710(CarlZeiss,Oberkochen)观察绿色荧光定位结果。
1.5 实时荧光定量PCR反应与基因表达分析
利用本实验室天山雪莲组培苗,对莲座叶伸展至5叶期(下同)的雪莲幼苗进行4 ℃/-2 ℃低温处理,正常生长条件(19 ℃)下的雪莲组培苗为对照,处理时间分别为1、3、6、12和24 h。为研究冷驯化对天山雪莲sikFBA1基因表达的影响,将雪莲在4 ℃冷驯化7 d,之后对其进行-2 ℃的处理,处理时间同上。所有处理材料采样后迅速用液氮处理,并保存在-80 ℃,直到使用。
根据sikFBA1基因cDNA序列设计实时荧光定量引物q-sikFBA1-F(5′-GTGGCGTGCGGTCCTAAAT A-3′)和q-sikFBA1-R(5′-CCGTTCTCCTGGCAGATGATG-3′)。以天山雪莲GAPDH基因为内参,引物序列参照郭新勇等[25]。提取不同温-时组合下天山雪莲的RNA,根据SYBR GreenⅠMaster Mix (Roche) 进行qRT-PCR,分析sikFBA1基因的相对表达量。反应程序:94 ℃预变性5 min;94 ℃变性15 s;60 ℃退火30 s,72 ℃延伸30 s,35个循环。每个样品3个重复,采用2-ΔΔCt分析结果。
2 结果与分析
2.1 天山雪莲sikFBA1基因 ORF的克隆与序列分析
基于天山雪莲转录组测序获得的序列,RT-PCR回收得到1 262 bp条带(图1)。测序结果显示,天山雪莲sikFBA基因的开放阅读框(ORF)长度为1 077 bp,并将该cDNA序列命名为sikFBA1。

M1. 250 bp DNA Ladder; 1. PCR扩增产物;M2. Marker 3;2. 双酶切产物图1 sikFBA1基因ORF扩增结果(A)和sikFBA1-GFP重组质粒酶切鉴定(B)M1. 250 bp DNA Ladder; 1. Product of PCR; M2. Marker 3; 2. Double digestion productFig.1 ORF amplification production of sikFBA1(A) and restriction digestion analysis of recombinant plasmids of sikFBA1(B)

下划线部分为醛缩酶型的TIM barrel结构域;*表示终止密码子图2 sikFBA1的ORF序列及其预测的编码蛋白质的氨基酸序列The underlined represents the TIM barrel domain of aldolase; * Stop codonFig.2 ORF sequence of sikFBA1 and predicted amino acid sequence of the coding protein
ProtParam在线软件分析sikFBA1氨基酸序列理化性质表明:该基因编码358个氨基酸(图2),相对分子质量约38 kD,理论等电点6.91。CDD(Conserved Domain Datebse)数据库检索结果(图3,A)显示,sikFBA1蛋白含有一个果糖-1,6-二磷酸酸缩酶结构域FBP_aldolase_I_a,属于I型醛缩酶;存在一个典型且十分保守的结构域,称为TIM barrel结构域,属于TIM-phosphate-binding 超家族[26]。SOPMA软件对sikFBA1 蛋白的二级结构分析发现,α螺旋所占比例大,为43.85%;不规则卷曲结构次之,为27.37%;β转角最少,仅为10.34%。此外,ProtScale软件对sikFBA1蛋白进行亲/疏水性分析 (图3,B)显示,该蛋白为亲水性蛋白。目前,人类肌肉中的果糖-1,6-二磷酸醛缩酶(PDB ID: 4ALD)已报道其二级结构及蛋白其他的结构特点[27],与sikFBA1的氨基酸序列相似度为61.06%。以4ALD蛋白为模型,用SWISS-MODEL对sikFBA1进行同源建模,获得sikFBA1单体的三级结构(图3,C)。对sikFBA1氨基酸序列进行BlastP检索,下载与sikFBA1高度相似的9个氨基酸序列(4ALD为同源建模参考序列),利用Clustal W2进行序列比对,结合建模获得的三级结构数据,ESORIPT3.0作图[28]。结果(图5)显示:参与比对的氨基酸都含有一个保守赖氨酸(Lys)残基,该位点为催化活性位点,可以与底物形成“schiff”结构,从而形成反应中间体。
2.2 sikFBA1系统发育分析
NJ法构建系统进化树结果(图4)显示,果糖-1,6-二磷酸醛缩酶家族成员可清晰地分为两大分支,I型和Ⅱ型,I型在高等植物中又分为胞质型和质体型2种亚型。天山雪莲sikFBA1在进化分类上属于I型的胞质同工酶,并且该蛋白与四叶参(Codonopsislanceolata) ClAldC(BAE48790.1)蛋白亲缘关系最近,推测与其在结构和功能上有一定相似性。
2.3 天山雪莲sikFBA1亚细胞定位
sikFBA1蛋白信号肽分析结果显示无信号肽序列,亚细胞定位预测该蛋白定位分布在细胞质,这与其不含有信号肽结果相符,并且与进化发育分析结果相一致。通过本氏烟草表皮细胞瞬时转化,共聚焦激光扫描显微镜观察信号结果显示(图6):对照GFP可单独在烟草表皮细胞中大量表达,绿色荧光信号在细胞质、质膜和细胞核中均有分布,而sikFBA1-GFP融合蛋白的绿色荧光信号主要分布于细胞质中,细胞核中未检测到明显的信号,说明sikFBA1蛋白属于细胞质蛋白。

A. sikFBA1蛋白保守域;B. sikFBA1编码氨基酸的疏水性/亲水性分析;C. sikFBA1蛋白三级结构预测示意图图3 sikFBA1的序列分析A. Prediction conserved domain of sikFBA1; B. Prediction of the hydrophobicity and hydrophilicity of sikFBA1; C. Three-dimensional structure of deduced sikFBA1 proteinFig. 3 Sequence analysis of sikFBA1

节点上的数值表示bootstrap重复1 000次的置信度,括号内为氨基酸登录号图4 天山雪莲sikFBA1蛋白的系统进化分析Numbers on branches indicate the percentage of 1 000 bootstrap replicates that support the adjacent node and the accession number of each sequence is given in the bracketFig.4 Phylogenetic analysis of the sikFBA1 in S.involucrata
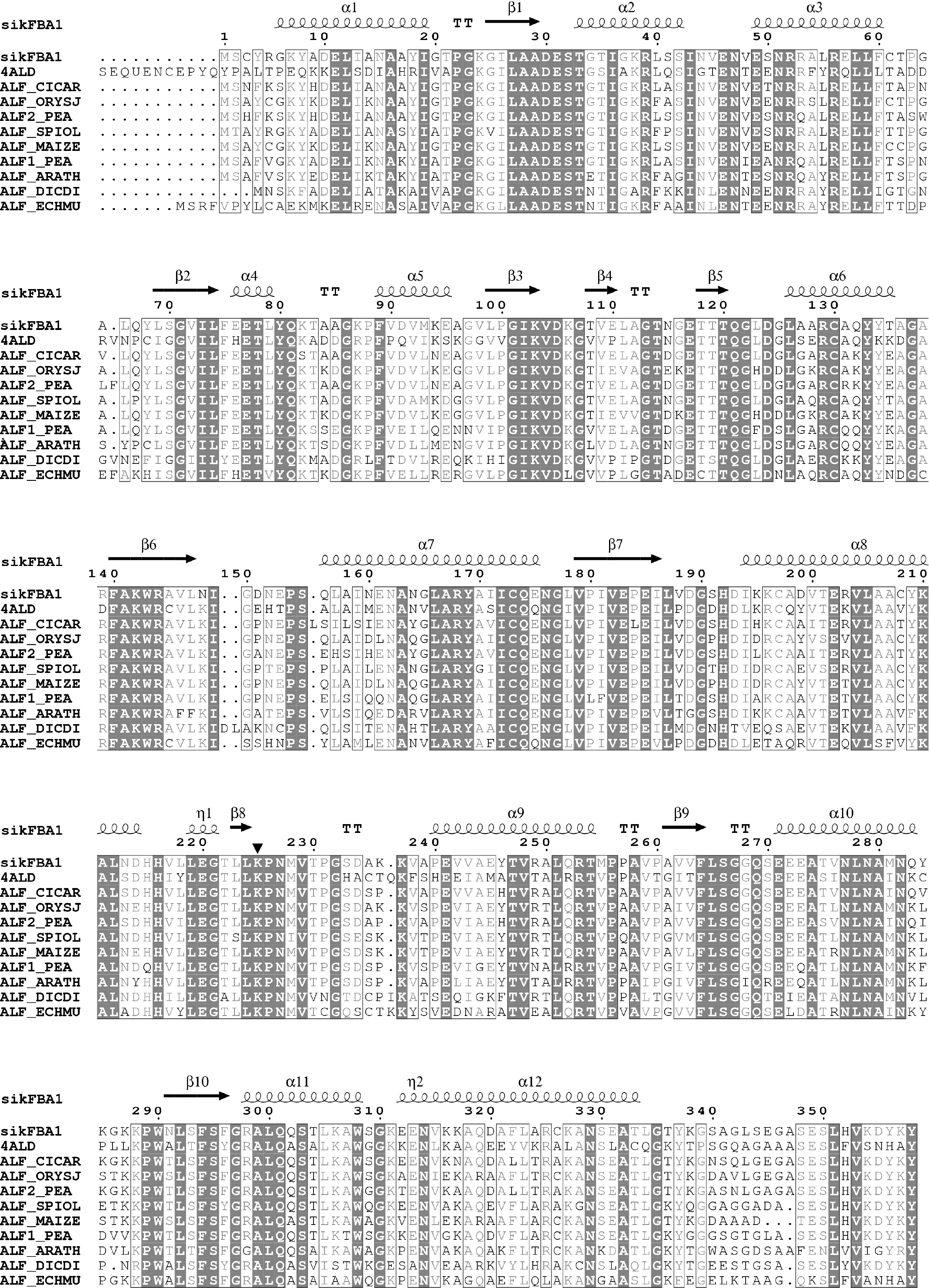
4ALD. 智人;ALF_CICAR. 鹰嘴豆;ALF_ORYSJ. 水稻;ALF2_PEA. 豌豆;ALF_SPIOL. 菠菜;ALF_MAIZE. 玉米;ALF1_PEA. 豌豆;ALF_ARATH. 拟南芥;ALF_DICDI. 盘基网柄菌. ALF_ECHMU. 多房棘球绦虫。螺旋线表示α-螺旋,箭头表示β-折叠,T表示β-转角,黑色三角为催化活性位点图5 sikFBA1氨基酸与其他物种氨基酸序列的对比4ALD. Homo sapiens; ALF_CICAR.; Cicer arietinum; ALF_ORYSJ. Oryza sativa Japonica; ALF2_PEA . Pisum sativum; ALF_SPIOL. Spinacia oleracea; ALF_MAIZE. Zea mays; ALF1_PEA. Pisum sativum; ALF_ARATH. Arabidopsis thaliana; ALF_DICDI. Dictyostelium discoideum; ALF_ECHMU. Echinococcus multilocularis; α-helices are rendered as helical lines; β-strands are rendered as arrows; T are rendered as β-turn. The dark triangle denotes active site amino residuesFig.5 Multialignment of the deduced amino acid sequences of sikFBA1 and other FBA proteins
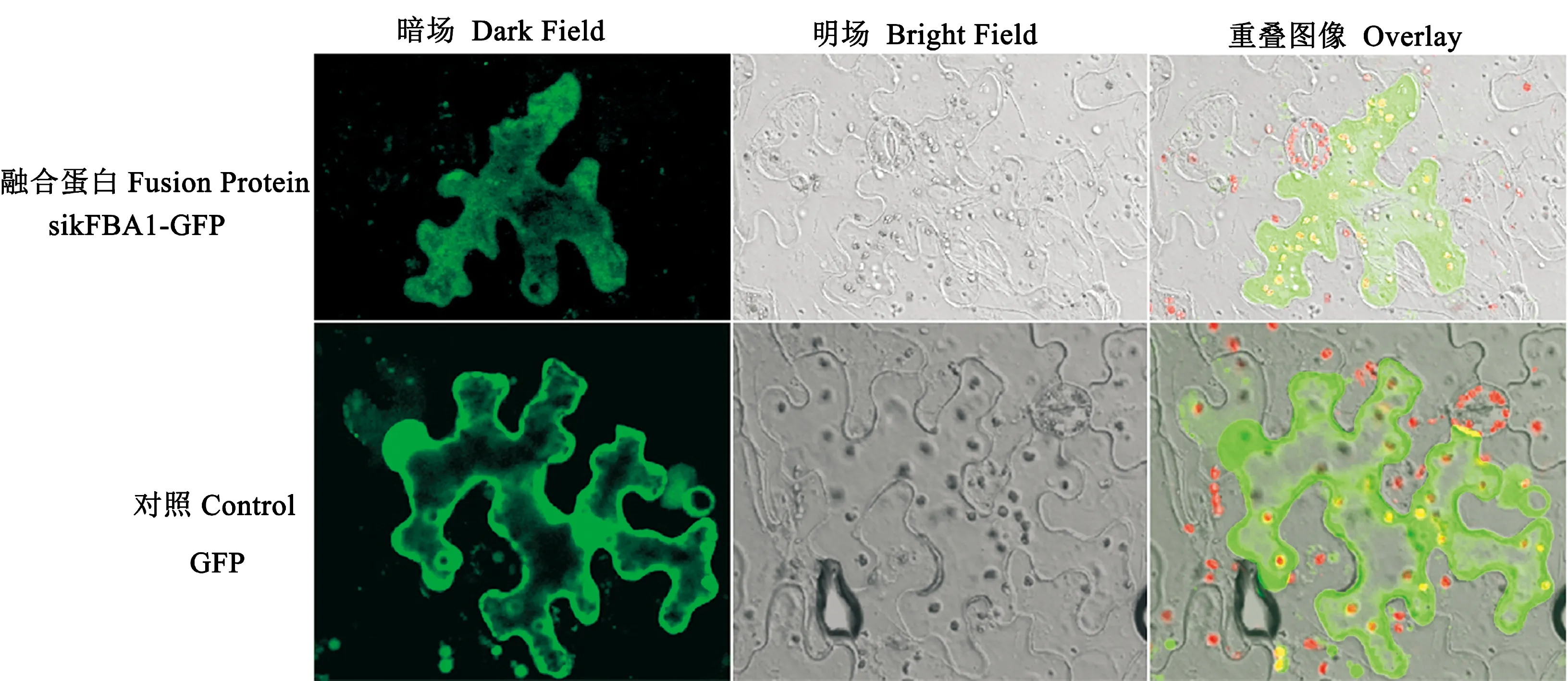
图6 本氏烟表皮细胞中sikFBA1蛋白的定位Fig.6 Subcellular localization of sikFBA1 fused with GFP in the epidermal cells of N. benthamiana

Ⅰ. 4 ℃处理;Ⅱ. -2 ℃处理; Ⅲ.经4 ℃驯化7d后, -2 ℃处理;对照组的相对表达量均为1.0,不同小写字母表示同一温度处理不同处理时间差异显著性(P<0.05, LSD检验)图7 sikFBA1的低温表达分析Ⅰ. 4 ℃; Ⅱ. -2 ℃; Ⅲ. -2 ℃ after cold acclimation with 7-day at 4 ℃;The relative expression level of the control group defined as 1.0. Different normal letters refer to significant differences among different time points of the same treatment (P<0.05, LSD test)Fig.7 Expression analysis of sikFBA1 under low temperature
2.4 sikFBA1低温表达分析
本实验以不同低温(4 ℃/-2 ℃)处理天山雪莲,研究sikFBA1基因在不同低温下的表达模式。qRT-PCR结果(图7)显示:正常培养条件(19 ℃)的天山雪莲经过低温处理,sikFBA1基因表达水平整体下调,但该基因在不同低温胁迫下其响应模式又表现出差异性。在 4 ℃处理1 h后该基因表达量呈现先升高后下降的变化趋势,3 h时达到最高,随后逐渐下降,12 h后趋于稳定。而-2 ℃处理1 h后其表达水平的变化趋势与4 ℃刚好相反,在1~6 h期间,sikFBA1基因表达没有明显变化,到12 h表达量显著下调,24 h时又显著的上升。推测sikFBA1基因对冷胁迫和冻胁迫的应答机制是不同的。有趣的是经过冷驯化的雪莲在-2 ℃处理1 h后,sikFBA1表达量变化趋势却与4 ℃处理相似,表达量均在处理3 h处达到最大值,且发现除1 h处理之外,其它处理时间下未经冷驯化的雪莲在-2 ℃处理下sikFBA1基因的表达量均是最低的。也表明冷驯化使sikFBA1基因对于冰冻胁迫的响应模式发生改变,该基因可能参与了天山雪莲的低温响应。
3 讨 论
FBA作为一类重要的糖代谢酶,处于6C糖可逆地转化为3C糖的关键部位,具有承上启下的作用,而且越来越多的证据表明这一家族在许多代谢和发育过程中扮演着重要的作用[29-31]。自Meyethof等[32]首次发现果糖-1,6-二磷酸醛缩酶以来,相继在不同的物种中展开了研究,如玉米[33]、拟南芥[7]、番茄[19]等,以及细菌[34-35]和脊椎动物[36-37]中都有大量的报道,但是未发现该酶在天山雪莲中的报道。本研究结合天山雪莲生境特点,并基于低温转录组数据分析结果,从天山雪莲中成功的克隆到sikFBA1基因。序列分析发现该基因编码的氨基酸序列具有果糖-1,6-二磷酸醛缩酶家族的基本特征,与其他物种FBA家族成员有较高一致性。sikFBA1蛋白的第225个氨基酸是赖氨酸(Lys),是该酶的催化活性位点,可以与底物反应形成“schiff”结构。系统进化分析结果表明该蛋白与四叶参ClAldC蛋白的进化关系最近。同时该结果与亚细胞定位结果一致,表明FBA家族成员亚细胞定位与其在进化树上的分布存在一定对应关系[38]。
之前的研究表明,FBA基因家族参与了植物的冷调控。天山雪莲经过不同低温处理,sikFBA1基因表达水平整体下调,但不同温度处理下表达量变化趋势又有所不同。天山雪莲在4 ℃冷处理前期,外界冷信号激发雪莲的冷防御机制,机体产生应激反应,sikFBA1基因参与到糖代谢途径以增加能源需求和供应中间体来适应低温胁迫[39],其表达量在3 h时迅速上升,经过短期适应或者sikFBA1基因产物的反馈调节,其表达量在6 h显著下降,12 h后趋于稳定。这与四叶参ClAldC基因4 ℃处理时的表达模式相似[14]。天山雪莲从19 ℃骤然进入-2 ℃,温度变化落差大,sikFBA1基因在胁迫前期并没有做出快速响应,推测在冻胁迫前期由sikFBA基因家族的其他冻敏感型同工酶发挥作用,与sikFBA1基因功能互补。胁迫后期,sikFBA1基因表达开始恢复。同工酶分工合作现象在多种研究中也有表现。盐胁迫处理下烟草的果糖-1,6-二磷酸醛缩酶NpAldP1和NpAldP2基因表达量变化也不一致,后者表达量发生明显的上调而前者的表达量却是下调[13]。Lu等[7]在对拟南芥中FBA基因家族进行研究时也发现,4 ℃处理时地上部分AtFBA3、AtFBA4、AtFBA5 和AtFBA8 基因表达上调,而AtFBA1、AtFBA2和AtFBA7基因表达则被抑制。而在番茄FBA基因家族的研究中也有类似结论[19]。低温驯化可以提高植物的抗寒应力,植物通过调节抗寒相关基因发生变化对低温做出响应[40],这可能是sikFBA1基因在冷驯化前后的表达模式不同的原因之一,同时也表明参与糖酵解的酶有足够程度的灵活性来适应胁迫[39]。
天山雪莲在温差极大的环境下,如果较少的同工酶以及单一的表达模式,很难满足机体在剧烈变化的环境中的代谢能力。那么选择不同温度酶学特性的混合群体,就能满足这种需要。本研究发现sikFBA1基因在冷胁迫和冰冻胁迫下表达模式存在差异,且冷驯化前后该基因对冰冻胁迫的响应也不同。这为揭示该基因家族的抗寒机制研究奠定了基础,对进一步研究天山雪莲的抗冻性具有的重要意义。但本实验仅获得1个sikFBA基因,不利于对该基因家族进行深入研究,后期实验进一步发掘更多的sikFBA基因,深入研究该基因家族在天山雪莲冷胁迫下的调节机制。
[1] 王镜岩,朱圣庚,徐长发. 生物化学[M]. 北京:高等教育出版社, 2002: 63-90.
[2] STRACQUADANIO G, UMETON R, PAPINI A,etal. Analysis and Optimization of C3 Photosynthetic Carbon Metabolism[C]//Bioinformatics and Bioengineering(BIEE), 2010 IEEE International Conference on. IEEE, 2010: 44-51.
[3] RUTTER W J. Evolution of Aldolase[J].FederationProceedings, 1964,23(23): 1 248-1 257.
[4] SCHNARRENBERGER C, PELZER-REITH B, YATSUKI H,etal. Expression and sequence of the only detectable aldolase inChlamydomonasreinhardtii[J].ArchivesofBiochemistry&Biophysics, 1994,313(1): 173-178.
[5] ZGIBYS M, THOMSON G J, QAMAR S,etal. Exploring substratebinding and discrimination in fructose-1,6-bisphosphate and tagatose-1,6-bisphosphate aldolases[J].EuropeanJournalofBiochemistry, 2000,267(6): 1 858-1 868.
[6] LEBHERZ H G, LEADBETTRE M M, BRADSHAW R A. Isolation and characterization of the cytosolic and chloroplast forms of spinach leaf fructose diphosphate aldolase[J].JournalofBiologicalChemistry, 1984,259(2): 1 011-1 017.
[7] LU W, TANG X, HUO Y,etal. Identification and characterization of fructose 1,6-bisphosphate aldolase genes in Arabidopsis reveal a gene family with diverse responses to abiotic stresses[J].Gene, 2012,503(1): 65-74.
[8] WEBSTER D, JONDORF W R, DIXON H B. Phosphonomethyl analogues of hexose phosphates[J].TheBiochemicalJournal, 1976,155(2): 433-441.
[9] GROSS W, BAYER M G, SCHNARRENBERGER C,etal. Two distinct aldolases of class Ⅱ type isolain the cyanoplast and in the cytosol of the alga Cyanophora paradoxa[J].PlantPhysiology, 1994,105(4): 1 393-1 398.
[10] KONISHI H, YAMANE H, MAESHIMA M,etal. Characterization of fructose-bisphosphate aldolase regulated by gibberellin in roots of rice seedling[J].PlantMolecularBiology, 2004,56(6): 839-848.
[11] HAAHE V,ZRENNER R,SONNERWALD U,etal. A moderate decrease of plastid aldolase activity inhibits photosynthesis, alters the levels of sugars and starch, and inhibits growth of potato plants[J].PlantJournal, 1998,14(2): 147-157.
[12] STRAND, HURRRY V, HENKES S,etal. Acclimation ofArabidopsisleaves developing at low temperatures. Increasing cytoplasmic volume accompanies increased activities of enzymes in the Calvin cycle and in the sucrose-biosynthesis pathway[J].PlantPhysiology, 1999,119(4):1 387-1 398.
[13] YAMADA S, KOMORI T, HASHIMOTOA,etal. Differential expression of plastidic aldolase genes inNicotianaplants under salt stress[J].PlantScienceAnInternationalJournalofExperimentalPlantBiology, 2000,154(1): 61-69.
[14] PUREV M, KIM M K, SAMDAN N,etal. Isolation of a novel fructose-1,6-bisphosphate aldolase gene fromCodonopsislanceolataand analysis of the response of this gene to abiotic stresses[J].MolecularBiology, 2007,42(2): 179-186.
[15] PROVART N J, GIL P, CHEN W,etal. Gene expression phenotypes ofArabidopsisassociated with sensitivity to low temperatures[J].PlantPhysiology, 2003,132(2):893-906.
[16] ABBASI F M, KOMATSU S. A proteomic approach to analyze salt-responsive proteins in rice leaf sheath[J].Proteomics, 2004,4(7): 2 072-2 081.
[17] 郭玉琼. 龙眼、荔枝胚性培养物超低温保存研究[D]. 福州:福建农林大学, 2007.
[18] 张晓宁, 林长发, 王 昊, 等. 受NaCl诱导的盐藻果糖-1,6-二磷酸醛缩酶cDNA的克隆及其在烟草中的表达[J].中国科学,2002(5): 392-398.
ZHANG X N, LIN C F, WANG H,etal. Cloning and tobacco expression of the fructose-1,6-diphosphate aldolase full-length: cDNA of dunaliella salina induced by NaCl[J].ScienceChina,2002(5): 392-398.
[19] CAI B, LI Q, XU Y,etal. Genome-wide analysis of the fructose-1,6-bisphosphate aldolase (FBA) gene family and functional characterization of FBA7 in tomato[J].PlantPhysiologyandBiochemistry, 2016, 108: 251-265.
[20] BRUGGENMANN W, LINGER P. Long-term chilling of young tomato plants under low light. IV. differential responses of chlorophyll fluorescence quenching coefficients in Lycopersicon Species of different chilling sensitivity[J].Planta, 1994,194(2): 160-168.
[21] PEREZ-TORRES E, BASCUNAN L, SIERRA A,etal. Robustness of activity of Calvin cycle enzymes after high light and low temperature conditions in Antarctic vascular plants[J].PolarBiology, 2006,29(11): 909-916.
[22] 陈发菊,杨映根,赵德修,等. 我国雪莲植物的种类、生境分布及化学成分的研究进展[J].植物学通报, 1999,16(5): 561-566.
CHENG F J,YANG Y G, ZHAO D X,etal. Advances in studies of species, habitats distribution and chemical composition of Snow Lotuses (Saussurea)in China[J].ChineseBulletinofBotany, 1999,16(5): 561-566.
[23] 郭新勇, 程 晨, 王 重, 等. 转天山雪莲冷调节蛋白基因烟草的获得及其抗寒性鉴定[J]. 西北植物学报, 2012,32(1): 1-10.
GUO X Y, CHENG C WANG Z,etal. Obtained and cold resistance identification of tobacco plants transformed by siCOR ofSasussureainvolucrataKar.etKir[J].ActaBotanicaBoreali-OccidentaliaSinica. 2012,32(1): 1-10.
[24] BLATT M R, GREFEN C. Applications of fluorescent marker proteins in plant cell biology[J].MethodsinMolecularBiology, 2014, 1 062:487-507.
[25] 郭新勇, 程 晨, 王爱英, 等. 天山雪莲冷调节蛋白基因siCOR转化烟草植株的抗旱性分析[J]. 植物学报, 2012,47(2): 111-119.
GUO X Y, CHENG C, WANG A Y,etal. Drought-tolerance analysis of tobacco plant transformed withsasussureainvolucratasiCORgene[J].ChineseBulletinofBotany. 2012,47(2): 111-119.
[26] LORENTZEN E, POHL E, ZWART P,etal. Crystal structure of an archaeal class I aldolase and the evolution of (betaalpha) 8 barrel proteins[J].JournalofBiologicalChemistry, 2003,278(47): 47 253-47 260.
[27] DALBDY A, DAUTER Z, LITTLECHILD J A. Crystal structure of human muscle aldolase complexed with fructose 1,6-bisphosphate: mechanistic implications[J].ProteinScience, 1999,8(2): 291-297.
[28] ROBERT X, GOUET P. Deciphering key features in protein structures with the new ENDscript server[J].NucleicAcidsResearch, 2014,42(W1): 320-324.
[29] MA K, XIAO J, LI X,etal. Sequence and expression analysis of the C3HC4-type RING finger gene family in rice[J].Gene, 2009,444(1-2): 33-45.
[30] NURUZZAMAN M, MANIMEKALAI R, SHARONI A M,etal. Genome-wide analysis of NAC transcription factor family in rice[J].Gene, 2010,465(1-2): 30-44.
[31] XING H, PUDAKE R N, GUO G,etal. Genome-wide identification and expression profiling of auxin response factor (ARF) gene family in maize[J].BmcGenomics, 2011,12(1): 178.
[32] MEYETHOF O, LOHMANN K. Enzymic equilibrium reaction between hexosediphosphate and dihydroxyacetonephosphate[J].Biochem.Z, 1934, 271: 89-110.
[33] KELLY P M, TOLAN D R. The complete amino acid sequence for the anaerobically induced aldolase from maize derived from cDNA clones[J].PlantPhysiology, 1986,82(4): 1 076-1 080.
[34] RODAKI A, YOUNG T, BROWN A J. Effects of depleting the essential central metabolic enzyme fructose-1,6-bisphosphate aldolase on the growth and viability of Candida albicans: implications for antifungal drug target discovery[J].EukaryoticCell, 2006,5(8): 1 371-1 377.
[35] SAY R F, FUCHS G. Fructose 1, 6-bisphosphate aldolase/phosphatase may be an ancestral gluconeogenic enzyme[J].Nature, 2010,464(7 291): 1 077-1 081.
[36] DU S, GUAN Z, HAO L,etal. Fructose-bisphosphate aldolase a is a potential metastasis-associated marker of lung squamous cell carcinoma and promotes lung cell tumorigenesis and migration[J].PlosOne, 2014,9(1): e85 804-e85 804.
[37] OPPELT S A, SENNOT E M, TOLAN D R. Aldolase-B knockout in mice phenocopies hereditary fructose intolerance in humans[J].MolecularGenetics&Metabolism, 2015,114(3): 445-450 .
[38] 张 宇. 水稻果糖-1,6-二磷酸醛缩酶基因ALD Y的功能研究[D]. 武汉:华中农业大学, 2014.
[39] MINHAS D, GROVER A. Transcript levels of genes encoding various glycolytic and fermentation enzymes change in response to abiotic stresses[J].PlantScience, 1999,146(1): 1-51.
[40] KALBERER S R, WISNIEWSKI M, ARORA R. Deacclimation and reacclimation of cold-hardy plants: current understanding and emerging concepts[J].PlantScience, 2006,171(1): 3-16.
(编辑:宋亚珍)
Cloning, Subcellular Localization and Expression Analysis ofsikFBA1 fromSaussureainvolucrataKar. et Kir
MU Jianqiang,LIANG Wenjie,ZHANG Fangsong,XIONG Yi,ZHU Jianbo*
(Key Laboratory of Agricultural Biotechnology, College of Life Science, Shihezi University, Shihezi, Xinjiang 832000, China)
The fructose-1, 6-bisphosphate aldolase (FBA) family plays an important role in plants stress-response. AsikFBA1 gene was cloned based on the sequencing results of theSaussureainvolucrataKar. et Kir transcriptome with RT-PCR method. The open reading frame (ORF) of thesikFBA1 gene is 1 077 bp which encoded a deduced protein including 358 amino acids residues. The protein sequence of sikFBA1 possesses the conserved Glycolytic domain, the typical family characteristic of FBA. Phylogenetic analysis exhibitied that sikFBA1 ofS.involucrataKar. et Kir showed the closest genetic relationship with that ofCodonopsislanceolataand they are all belonged to the FBA class I .When fused to green fluorescent protein (GFP) in the subcellular localization assay, we found that sikFBA1 protein was present in the cytoplasm, which was consistent with the predicted results. sikFBA1 is cytoplasmic isoenzyme. Quantitative real-time PCR (qRT-PCR) was performed to determine the expression pattern in 4 ℃ and -2 ℃ during the low temperature treatment. The results showed that the expression level ofsikFBA1 gene was generally down-regulated after treatment. Interestingly, thesikFBA1 gene showed different expression patterns between the different stress conditions of cold and freeze, cold acclimation and unacclimation respectively. These results indicated thatsikFBA1 had the potential function inS.involucrataKar. et Kir response to low temperature stress.
fructose- l, 6- bisphosphate aldolase;gene cloning;subcellular localization;expression analysis
1000-4025(2016)11-2137-09
10.7606/j.issn.1000-4025.2016.11.2137
2016-09-15;修改稿收到日期:2016-11-08
国家自然科学基金(31360053)
穆建强(1991-),男,在读硕士研究生,主要从事基因资源的研究与评价。E-mail:jianqiangmshz@163.com.
*通信作者:祝建波,研究员,博士生导师,主要从事植物抗逆基因工程和环境生物技术研究。E-mail:zjbshz@163.com.
Q785;Q786
A
