干旱和盐胁迫对马铃薯试管苗亚细胞结构及生理生化指标的影响
2017-01-04白江平王晓斌高慧娟胡开明张俊莲
白江平,王晓斌,高慧娟,胡开明,张俊莲,王 蒂
(1 甘肃省作物遗传改良与种质创新重点实验室/甘肃省干旱生境作物学重点实验室,兰州 730070; 2 甘肃农业大学 农学院,兰州 730070;3 甘肃农业大学 园艺学院,兰州 730070)
干旱和盐胁迫对马铃薯试管苗亚细胞结构及生理生化指标的影响
白江平1,2,王晓斌1,2,高慧娟1,2,胡开明1,2,张俊莲1,3,王 蒂1,2
(1 甘肃省作物遗传改良与种质创新重点实验室/甘肃省干旱生境作物学重点实验室,兰州 730070; 2 甘肃农业大学 农学院,兰州 730070;3 甘肃农业大学 园艺学院,兰州 730070)
以‘陇薯3号’脱毒试管苗为材料,研究了不同浓度PEG-4000(0、2%、4%、6%、8%)和NaCl(0、25、50、100、200 mmol/L)对马铃薯2周大小试管苗根系生长、叶肉细胞超微结构及部分生理生化指标的影响,为筛选耐盐抗旱马铃薯种质提供理论依据。结果显示:(1)随着PEG-4000和NaCl浓度的增加,马铃薯试管苗根总长、根体积、根数均呈现下降趋势,并且胁迫浓度越高时间越长其下降趋势越明显,而盐胁迫处理的下降幅度明显大于PEG胁迫处理。(2)随着PEG-4000和NaCl浓度的增加,马铃薯试管苗叶肉细胞细胞壁明显变厚,发生明显的质壁分离,嗜锇颗粒显著增加,出现大量囊泡,叶绿体损害逐渐加剧,直至完全解体。(3)随着PEG-4000和NaCl浓度的增加,马铃薯试管苗脯氨酸(Pro)含量显著增加,过氧化氢(CAT)和超氧化物歧化酶(SOD)活性显著增强,而其丙二醛(MDA)含量迅速增加,但叶片叶绿素含量持续下降。研究表明,在PEG-4000模拟干旱和NaCl胁迫条件下,马铃薯试管苗叶片叶绿体结构受到严重损害,叶绿素含量显著降低,且胁迫程度越强损害越严重、下降幅度越大;同时,干旱和高盐胁迫也诱导马铃薯试管苗脯氨酸含量和抗氧化酶CAT和SOD活性显著上调,一定程度上缓解了干旱和高盐胁迫的伤害。
马铃薯;干旱胁迫;NaCl胁迫;叶片亚细胞结构;生理指标
逆境胁迫是影响植物生长发育的重要因素之一,尤其是非生物胁迫中的干旱和土壤盐碱化严重影响植物生长发育,最终导致农作物减产[1-3]。世界范围内有多达33%土地集中在干旱半干旱地区,而中国干旱半干旱土地占可耕地土地面积的51%[4]。长期干旱和高盐环境会严重抑制植物细胞的各种代谢活动,如影响物质吸收与运输,降低代谢途径中酶活性,抑制呼吸作用,降低光合作用,改变组织器官的超微结构等[5-6]。在干旱胁迫下,植物体内脯氨酸和丙二醛含量明显增高[7-20],活性氧大量积累;盐胁迫会引起细胞失水,发生质壁分离,并且细胞间距也随之减少[21,22],限制气体扩散,抑制光合作用,影响植物生长与发育;在逆境胁迫情况下,植物细胞通过各种抗氧化酶和有机溶质的积累形成复杂的生理生化机制来维持植物体内内环境的稳定[11-13,22],进而来提高植物抗逆性。
马铃薯(Solanumtuberosum)是世界上第四大主要粮食作物 ,起源于南美洲安第斯山脉,含有较高的淀粉、维生素、矿质元素以及较低的脂肪[23]。中国马铃薯主要种植在西北干旱半干旱地区,甘肃省是中国马铃薯主要产区,干旱和土壤盐碱化严重制约着该区马铃薯的生产,因此开展马铃薯抗旱和耐盐性的研究显得十分有意义。目前关于马铃薯抗旱和耐盐碱的研究主要集中在代谢活动(光合作用、呼吸作用、蛋白质合成和能量代谢)[5-6]和渗透调节物质[7]方面,而对PEG模拟干旱和不同浓度NaCl胁迫下马铃薯试管苗叶片超微结构、抗氧化酶及根系的研究鲜有报道。因此,本研究选用‘陇薯3号’马铃薯品种为试验材料,利用PEG-4000和NaCl模拟不同程度干旱和盐胁迫,考察马铃薯试管苗根系生长、叶肉细胞超微结构及部分生理生化指标对逆境胁迫响应特征;旨在从细胞和生理层面为探明马铃薯耐旱和耐盐机理提供更多的理论依据,并为选育耐旱和耐盐的马铃薯种质提供更多的技术支撑。
1 材料和方法
1.1 材料培养及处理
试验材料“陇薯3号”马铃薯品种在中国西北地区广泛种植。本试验设置盐胁迫和干旱胁迫2类处理,盐胁迫又设置0 (CK)、25、50、100、200 mmol/L NaCl等5个水平,干旱胁迫设置0 (CK)、2%、4%、6%和8% PEG-4000等5个水平。试验先在MS固体培养基上培养马铃薯幼苗,每个三角瓶转接6~8株小植株,于光周期16 h/8 h (光/暗)、(23±2) ℃下培养一段时间后,将至少带有2片叶的植株茎秆分别转移到含有不同浓度NaCl和PEG-4000胁迫处理(每个处理20瓶)的MS培养基上,待植株生长2周之后收取根与叶片,进行相关指标观测和测定。
1.2 指标测定与观察
1.2.1 叶片超微结构观测 选取马铃薯试管苗完全展开的第3片叶,避开大叶脉,切成0.3 cm×0.3 cm 的方块,浸泡于2%戊二醛(pH 7.4的磷酸缓冲液配制)中,在室温下固定3 h[24];然后用0.1 mmol/L磷酸漂洗液漂洗3次,1%锇酸室温下固定6 h,再次用漂洗液漂洗;再用不同浓度梯度的乙醇逐级脱水;最后进行包埋,加热过夜。样品在LKBV超薄切片机上切片,获得的切片在铀酰乙酸酯和磷酸铅溶液中双染色。最后在电镜(JEM-1230 JEOL,日本)下观察叶片超微结构并拍照。
1.2.2 叶片生理生化指标测定 MDA含量测定采用硫代巴比妥酸比色法[25],脯氨酸(Pro)含量测定用磺基水杨酸提取法[26],SOD活性测定根据氮蓝四唑(NBT)法[27],CAT活性测定根据紫外吸收法[28],叶片叶绿素含量测定用丙酮提取法[29]。以上指标均重复3次进行测定。
1.2.3 根系形态指标的测定 用根系扫描仪(EPSON EXPRESSION 10000XL 1.0) 和根系形态与结构分析仪(WinRHIZO Pro2005b)对马铃薯试管苗根系长度、根系体积和根尖等主要根系参数进行分析。
1.3 数据分析
试验数据分析在Origin8.5中进行。
2 结果与分析
2.1 干旱和盐胁迫对马铃薯试管苗叶肉细胞与叶绿体结构的影响
PEG模拟干旱胁迫试验观察结果如图1所示。其中,马铃薯试管苗对照植株叶片的叶肉细胞结构完整,细胞膜紧贴细胞壁,细胞之间有间距;叶绿体呈椭圆形,紧贴细胞壁;叶绿体形态结构完整,含有少量较小的嗜锇颗粒,基粒和基质片层排列与叶绿体长轴方向平行,基质均匀,类囊体排列整齐紧凑,片层垛叠整齐;另外,膜系统完整,叶绿体片层排列整齐,类囊体结构完整。试管苗经2% PEG处理生长2周后,叶肉细胞内有空泡化出现,大部分叶绿体仍紧贴细胞壁,但与细胞壁的接触面减少;叶绿体外膜消失,类囊体发生轻微肿胀。4% PEG处理诱导叶肉细胞超微结构发生变化,叶绿体数目增多,出现聚集,细胞内出现许多泡状结构,有二级液泡形成;叶绿体被膜消失,基粒片层仍排列整齐。在6% PEG处理下,叶肉细胞质壁分离发生,细胞内叶绿体连成一个圈,叶绿体垛叠在一起,细胞间无间隙,似连在一起;叶绿体被膜解体,片层排列絮乱,类囊体肿胀,松散;线粒体膜断裂,内嵴模糊。在8 % PEG处理下,叶肉细胞超微结构发生了显著的变化,质壁分离严重发生,膜成分几乎消失,叶绿体形状不规则,嗜锇颗粒增多,叶绿体间通过基质丝连在一起;叶绿体结构基本保持完整,片层排列不清晰,形成囊泡。
同时,在NaCl胁迫试验中(图2),马铃薯试管苗对照植株叶片的叶肉细胞及其叶绿体超微结构表现与上述PEG模拟干旱处理对照相同。在25 mmol/L NaCl 处理2周后,组培苗叶肉细胞大部分叶绿体仍紧贴着细胞壁,但与细胞壁接触面减少了;细胞膜开始受损,类囊体轻微膨胀,液泡内有囊泡出现。50 mmol/L NaCl处理诱导了许多叶绿体超微结构变化,叶绿体数目减少,质膜部分内陷形成囊泡,叶绿体被膜外凸,形成大量复杂的囊泡。在100 mmol/L NaCl处理下,叶肉细胞发生质壁分离,细胞膜内陷导致大量的囊泡产生,一些叶绿体镶嵌在一起,叶绿体内膜变化较为明显,外膜解体,出现些许嗜锇颗粒,基粒片层松散,类囊体膨胀加剧。在200 mmol/L NaCl处理下,观察到了最显著的结构变化,如叶肉细胞质壁分离严重发生,细胞膜结构严重破坏,出现了大量囊泡;叶绿体数目急剧减少,并向细胞中央移动;叶绿体内膜消失,基粒类囊体扭曲,松散;片层间距加大,基粒垛叠数减少。

ch.叶绿体;w.细胞壁;g.基粒;s.淀粉粒; 下同图1 PEG模拟干旱处理下马铃薯叶肉细胞(A)和叶绿体(B)超微结构ch. Chloroplast; w. Cell wall ;g. Granum; s. Starch grain; The same belowFig.1 Ultrastructure changes of mesophyll cell (A) and chloroplast (B) of potato plantlets under PEG treatment
以上结果说明,在不同浓度PEG4000和NaCl胁迫处理2周后,马铃薯试管苗叶肉细胞及其叶绿体超微结构均受到不同程度伤害,且有随胁迫浓度加剧的趋势。
2.2 干旱和盐胁迫对马铃薯试管苗叶片生理生化指标的影响
在各浓度PEG和NaCl处理2周后,马铃薯试管苗叶片叶绿素含量均比对照显著降低,降幅分别为22.8%~63.8%和24.8%~70.8%(图3,A、B);随着胁迫程度的增强,试管苗叶片叶绿素含量呈逐渐降低趋势,且处理间存在显著差异(P<0.05)。同时,试管苗叶片脯氨酸含量却比对照不同程度增加,且大多达显著水平,并随胁迫强度有增加趋势,PEG和NaCl处理组增幅分别为2%~8%和60%~350%(图3,C、D)。

图2 NaCl处理下马铃薯组培苗叶肉细胞(A)和叶绿体(B)超微结构Fig.2 Ultrastructure changes of mesophyll cell (A) and chloroplast (B) of potato plantlets under NaCl treatment

图3 PEG和盐胁迫下马铃薯组培苗叶片叶绿素和脯氨酸含量含量变化Fig.3 The chlorophyll and proline contents in leaves of potato plantlets under PEG or NaCl treatments
另外,2组处理试管苗叶片的SOD和CAT活性也比对照显著增加(图4,A~D),但随胁迫浓度增加表现出先升高后降低的趋势,并在6%PEG和100 mmol/L NaCl处理时分别达到最大值,此时,SOD活性分别比对照显著增加47.1%和38.4%,CAT活性则分别显著增加100%和46.6%;试管苗叶片MDA含量在各浓度PEG和NaCl处理下呈逐渐上升趋势,且大多与对照差异显著,2组处理MDA含量比对照增幅分别为70%~240%和80%~200%(图4,E、F)。可见,干旱处理和盐胁迫处理诱导马铃薯试管苗叶片脯氨酸含量和保护酶活性显著增加,以增强其自身抗逆性,但其仍受到不同程度过氧化伤害,叶绿素合成受阻,分解增加,生长受到明显抑制。
2.3 干旱和盐胁迫对马铃薯试管苗根系生长的影响
在干旱胁迫和盐胁迫2周后,马铃薯试管苗根系生长发育(包括根总长、根体积、根数)也受到显著抑制,且抑制程度均呈现出随胁迫浓度增加而逐渐增强的趋势(图5)。其中,马铃薯试管苗根总长、根体积、根数在各PEG浓度胁迫下分别比对照显著减少了17.9%~72.5%、18.7%~74.7%和22.7%~84.1%(图5,A~C),而其在各浓度盐胁迫下分别比相应对照显著减少了35.2%~79.2%、8.3%~77.1% 和33.3%~91.1%(图5,D~F)。可见,盐旱胁迫显著抑制了马铃薯试管苗根系的生长,且呈现出明显的剂量效应,各指标中又以根数受到抑制更强。
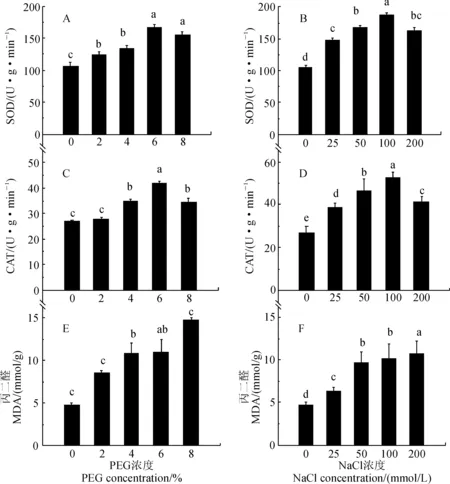
图4 PEG和盐胁迫下马铃薯组培苗叶片丙二醛含量和抗氧化酶活性的变化Fig.4 The malondialdehyde content and enzymatic activities in leaves of potato plantlets under PEG or NaCl treatments
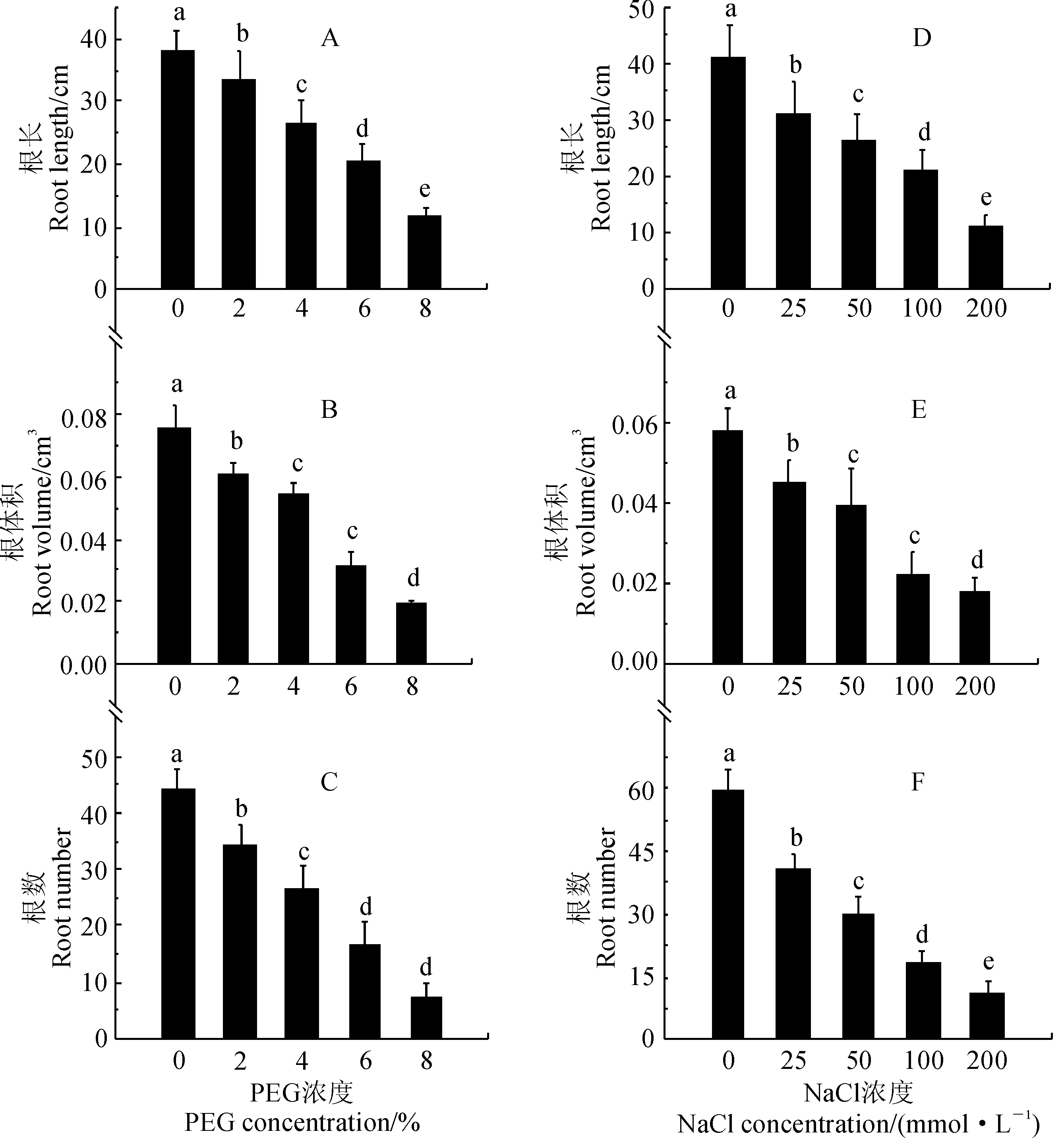
图5 PEG和盐胁迫下马铃薯组培苗根系生长发育的变化Fig.5 The growth of potato plantlet roots under PEG or NaCl treatments
3 讨 论
植物体遭受干旱胁迫时,其叶片叶绿体在形态和结构上会发生一系列变化来适应干旱胁迫对其造成的损害,如Yamane等[30]报道干旱胁迫可以严重损坏水稻叶片叶绿体被膜,而类囊体并不膨胀;Xu等[31]研究表明干旱胁迫下植物叶绿体被膜和类囊体先受到损害,随着胁迫时间延长和强度增加,类囊体才会有所膨胀。本实验中,不同浓度PEG-4000模拟干旱胁迫下马铃薯试管苗叶片叶绿体被膜和类囊体均受到不同程度的破坏。首先,叶绿体数目增多,细胞质壁分离发生,叶绿体被膜消失;其次,囊泡形成,二级液泡出现,细胞间距变小,叶绿体变形,类囊体开始膨胀,片层扭曲,间距变大;随后,细胞壁增厚,膜组织严重受损,嗜锇颗粒增多,部分类囊体消失,叶绿体类囊体的解体,产生的脂类聚集,就在受损伤的叶绿体内形成了嗜锇颗粒,叶绿体结构变得模糊;最后,淀粉粒增多且变大,脱离叶绿体充满整个细胞,叶绿体降解为条状物。
盐碱逆境是影响植物生长发育的另一个主要环境因素,植物长时间处于此环境中会引起植物体内钠钾离子失衡,导致植物细胞膜的结构和功能发生改变[31]。在本实验中,盐胁迫后马铃薯试管苗叶肉细胞出现明显扭曲,质壁分离发生,细胞膜内陷出现大量囊泡;植物体内细胞器会发生不同程度改变,而叶绿体是盐胁迫之下变化最为敏感的细胞器[32],首先叶绿体数目减少,且向细胞中央移动,与此同时,类囊体膨胀扭曲,这是盐胁迫下叶绿体的典型反应,在胡瓜[33]中也可以观察到,随着胁迫浓度的不断增大,细胞壁明显加厚,Krzesowska[34]报道增厚的细胞壁可以作为一个屏障,保护细胞免受金属元素毒害,质壁分离发生,细胞间距变小;接着,片层结构变得无序混乱,松散,甚至不清晰,基粒垛叠也减少,可能是因为蛋白质合成受到抑制。这些现象在以前马铃薯耐逆性研究中有过报道[32-35]。另外,植物体依靠光合作用制造有机物,为机体提供能量维持生命活动。叶绿素是植物进行光合作用所必须的,叶绿素含量高低能反映植物光合作用的强弱。在本实验中,随着PEG和盐浓度的不断增大,叶片叶绿素含量逐渐减少,主要是由于逆境胁迫使得叶绿体类囊体解体而抑制了叶绿素的合成,这与Su等[36]的研究结果一致。
植物体内活性氧的产生与清除在正常条件下处于动态平衡状态,而在逆境中会失衡,植物体内常积累大量的活性氧[15],造成氧化损害,影响植物的生长,而较高的CAT和SOD活性可以提高植物的耐逆能力;脯氨酸作为渗透保护剂, 是植物细胞重要的可溶性调节物质,参与植物抗旱、耐盐过程,主要通过维持细胞膨压,调节渗透势,提高植物应对渗透胁迫的能力。随着PEG和盐浓度的增加,本实验中马铃薯试管苗CAT和SOD活性呈现先增加后减小的趋势,而其脯氨酸和丙二醛的含量呈现逐渐显著上升的趋势。一方面,随着PEG和盐胁迫处理浓度的增加,造成的过度失水对植物细胞造成严重损害,使得其生理机能紊乱,抑制了脯氨酸的合成;另一方面,在缺水和高盐胁迫的环境下,体内SOD和CAT活性的增加还不足以消除过量ROS,从而诱发植物叶片活性氧的积累,造成氧化胁迫,引起膜质过氧化反应,致使膜质过氧化作用的主要产物MDA大量产生。
综上所述,马铃薯试管苗在遭受干旱和高盐胁迫时叶片叶绿体被膜和类囊体受到不同程度的损害、渗透调节物质脯氨酸含量明显增加、丙二醛含量减少、超氧化物歧化酶和过氧化氢酶大量积累,以及马铃薯试管苗根长、根体积和根数量减少。即马铃薯试管苗也通过一系列生理和形态上的改变来适应干旱和高盐的逆境,使得干旱和高盐对马铃薯的损害降到最低,表现出一定程度的干旱和高盐胁迫耐性。今后,在本项研究结果的基础上,我们将进一步探讨旱盐胁迫下马铃薯试管苗叶片超微结构、生理生化指标以及根长、根体积、根数量等指标间的相关性,以期为抗旱和耐盐性马铃薯种质资源筛选提供理论依据,也为马铃薯抗逆体系的建立提供参考。
[1] 王淑妍,郭九峰,那 日, 等.非生物胁迫下植物表观遗传变异的研究进展[J].西北植物学报,2016, 36(6):631-640.
WANG S Y, GUO J F, NA R,etal. Research progress of abiotic stress epigenetic variation in plants [J].ActaBot.Boreal-Occident.Sin,2016,36(6):631-640.
[2] 王尊欣,张树珍. 作物抗旱性及抗旱育种研究进展[J].作物杂志, 2014, 2:26-32.
WANG Z X, ZHANG S Z. Progress in crop breeding drought resistance and drought [J].Crops, 2014,2:26-32.
[3] 程媛媛, 苏孝良.植物抗旱机制研究进展[J].贵州师范大学学报(自然科学版),2014, 12(2):113-120.
CHENG Y Y, SU X L. Research progress on plant drought resistance mechanism [J].JournalofGuizhouNormalUniversity(Natural Sciences),2014,12(2):113-120.
[4] 宋志荣.马铃薯对旱胁迫的反应[J].中国马铃薯, 2004, 18(6):330-333.
SONG Z R.Response of potatos drought stress [J].ChinesePotato,2004,18(6):330-333.
[5] 苏日古嘎,孙铁军,武菊英, 等.干旱胁迫对禾草苗期抗旱性特征的影响[J].中国草地学报,2007, 29(3):56-60.
SU R G G, SUN T J, WU J Y,etal. Effect of drought stress on characteristics of drought resistance of grasses during seedling stage [J].ChineseJournalofGrassland, 2007,29(3):56-60.
[6] 祁 雪, 张丽莉, 石 瑛, 等.盐碱胁迫对马铃薯生理和叶片超微结构的影响[J].作物杂志,2014, 4:125-129.
QI X, ZHANG L L, SHI Y,etal. Influence of salt-alkali stress on physiological index and leaf ultrastructure of potato [J].Crops, 2014,4:125-129.
[7] 杜金友,靳占忠,张洪亮, 等.不同玉米自交系干旱胁迫条件下的生理变化[J].张家口农学专报,2003, 19(3):4-6.
DU J Y, JIN Z Z,ZHANG H L,etal.Physiological alteration of different maize inbred in drought stress [J].JournalofZhangjiakouAgriculturalCollege,2003,19(3):4-6.
[8] HAN Q Q, LÜ X P, BAI J P,etal. Beneficial soil bacteriumBacillussubtilis(GB03) augments salt tolerance of white clover [J].Front.PlantSci, 2014, 5: 525.
[9] SERRAJ R, SINCLAIR T. Osmolyte accumulation: can it really help increase crop yield under drought conditions? [J].PlantCellEnviron.2002, 25(2): 333-341.
[10] VIJ S, TYAGI A.K. Emerging trends in the functional genomics of the abiotic stress response in crop plants [J].PlantBiotechnol.J. 2007, 5(3): 361-380.
[11] WANG Z Q, YUAN Y Z. Glutamine synthetase and glutamate dehydrogenase contribute differentially to proline accumulation in leaves of wheat (Triticumaestivum) seedlings exposed to different salinity[J].Plantphysiol., 2007, 164(6): 695-701.
[12] GUPTA B, HUANG B. Mechanism of salinity tolerance in plants: physiological, biochemical, and molecular characterization [J].Int.J.Genomics, 2014, 2014: 701596.
[14] NOUNJAN N, NGHIA P T. Exogenous proline and trehalose promote recovery of rice seedlings from salt-stress and differentially modulate antioxidant enzymes and expression of related genes [J].Plantphysiol. 2012, 169: 596-604.
[15] MISHRA P, BHOOMIKA K, DUBEY R. Differential responses of antioxidative defense system to prolonged salinity stress in salt-tolerant and salt-sensitive Indica rice (OryzasativaL.) seedlings [J].Protoplasma, 2011, 250(1): 3-19.
[16] ABDULLAHIL-BAQUE M, LEE E J, PAEK K Y. Medium salt strength induced changes in growth, physiology and secondary metabolite content in adventitious roots ofMorindacitrifolia: the role of antioxidant enzymes and phenylalanine ammonia lyase [J].PlantCellRep, 2010, 29(7): 685-694.
[18] KOCA H, OZDEMIR F, TURKAN I,etal. Effect of salt stress on lipid peroxidation and superoxide dismutase and peroxidase activities ofLycopersiconesculentumandL.pennellii[J].Biol.Plant, 2006, 50(4): 745-748.
[19] YAZICI I, TUERKAN I. Salinity tolerance of purslane (PortulacaoleraceaL.) is achieved by enhanced antioxidative system, lower level of lipid peroxidation and proline accumulation [J].Environ.Exp.Bot, 2007, 61(1): 49-57.
[20] BORUCKI W, SUJKOWSKA M. The effects of sodium chloride-salinity upon growth, nodulation, and root nodules structure of pea (PisumsativumL.) plants [J].ActaPlantPhysiol., 2008, 30: 293-301.
[21] PAREEK A, SINGLA SL, GROVER A.etal.Short-term salinity and high temperature stress-associated ultrastructural alterations in young leaf cells ofOryzasativa[J].AnnBot(Lond), 1997, 80: 629-639.
[22] SHABALA S, BOSE J, HEDRICH, R. Salt bladders: do they matter? [J].TrendsPlantSci., 2014, 19(11): 687-691.
[23] TEPER-BAMNOLKER P, FISCHER N D R, BELAUSOV E,etal. Mint essential oil can induce or inhibit potato sprouting bydifferential altelation of apical meristem[J].Planta, 2010, 232: 179-186.
[24] KOBAYASHI Y, MURATA M, HATTORI T,etal. Abscisic acid-activated SNRK2 protein kinases function in the gene-regulation pathway of ABA signal transduction by phosphorylating ABA response element-binding factors[J].PlantJournal, 2005, 44(6): 939-949.
[25] 毛 娟,白江平,王 蒂,等.水分胁迫下马铃薯SnRK2基因的表达模式与生理响应[J].中国沙漠, 2014, 34(2):481-487.
MAO J, BAI J P, WANG D,etal.SnRK2 gene expression in responses to physiological characteristics under water stress inSolanumtuberosum[J].JournalofDesertResearch, 2014,34(2):481-487.
[26] KOJI Y, MICHIO K, MITSUTAKA T,etal. Differential effect of NaCl and polyethylene glycol on the ultrastructure of chloroplasts in rice seedlings[J].PlantPhysiol., 2003, 160(5): 573- 575.
[27] SABATINI D D, BENSCH K, BARRNETT R J,etal. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation[J].TheJournalofCellBiology,1963,17: 9-58.
[28] HODGES D M, JOHN M D, ROBERT K P,etal. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds [J].Planta, 2014, 207: 604-611.
[29] DELAUNEY A J, HU C A, VERMA D P,etal. A bifunctional enzyme (delta 1-pyrroline-5-carboxylate synthetase) catalyzes the first two steps in proline biosynthesis in plants [J].ProceedingsofTheNationalAcademyofSciencesofTheUnitedStatesofAmerica,1992, 89(19): 9 354-9 358.
[30] YAMANE K, RAHMAN M. S, KAWASAKI M. Pretreatment with antioxidants decreases the effects of salt stress on chloroplast ultrastructure in rice leaf segments (Oryza sativa L.) [J].PlantProd.Sci, 2004, 7: 292-300.
[31] 许桂芳. PEG胁迫对2种过路黄抗性生理生化指标的影响[J].草业学报, 2008, 17(1):66-70.
XU G F. Effects of PEG stress on resistance physiological and biochemical indexes of adversity of two Lysimachiaspecies [J].ActaPrataculturaeSinica,2008,17(1):66-70.
[33] ARNON D I. Copper enzymes in isolated chloroplasts[J].PlantPhysiol.,1949, 24: 1-15.
[35] BRUNS S, HECHT-BUCHHOLZ C. Light and electron microscope studies on the leaves of several potato cultivars after application of salt at various development stages[J].PotatoRes,1990, 33(1): 33-41.
[36] SUN J, DAI S, WANG R,etal.Calcium mediates root K/Na homeostasis in poplar speciesdiffering in salt tolerance[J].TreePhysiol., 2009, 29: 1 175-1 186.
(编辑:裴阿卫)
Effects of Drought and Salt Stress on Subcellular Structure and Physiological and Biochemistry Indicators of Potato Plantlets
BAI Jiangping1,2, WANG Xiaobin1,2, GAO Huijuan1,2, HU Kaiming1,2,ZHANG Junlian1,3, WANG Di1,2
(1 Gansu Key Lab of Crop Improvement&Germplasm Enhancement/Gansu Provincial Key Lab of Arid land Crop Science,Lanzhou 730070,China; 2 College of Agronomy, Gansu Agricultural University, Lanzhou 730070; 3 College of Horticulture, Gansu Agricultural University,Lanzhou 730070,China)
In this study, the detoxification potato plantlets plants of ‘Longshu No.3’ were cultivated under PEG-4000(0, 2%, 4%, 6% and 8% PEG) and gradient saline stress (0, 25, 50, 100 and 200 mmol·L NaCl) respectively. The root growth and the ultrastructure of mesophyll cell were observed two weeks later. The physiological and biochemical indices were measured to provided the theoretical basis for screening salt-tolerant and drought-resistant potato germplasm. The results showed that: with the increase of external PEG-4000 or NaCl concentration, (1) the total of root length, root volume and root number were decreased. With extension of time the decrease was obvious. This decline in salt stress obviously greater than that in drought stress, explained that roots were sensitive to salt stress; (2) potato plantlet cell wall obviously thickened and plasmolysis, plastoglobuli markedly increased, numerous vesicles, chloroplasts gradually damaged to a complete disorganization; (3) potato plantlet plants leaf proline content significantly increased, the activities of catalase (CAT) and superoxide dismutase (SOD) and malondialdehyde (MDA) content significantly increased, while chlorophyll content decreased. In conclusion, the PEG-4000 simulated drought and salt stress could cause serious damage of plant chloroplast structure and chlorophyll content significantly decreased. The more stress and the more serious damage. Simultaneously, drought and salt stress also induced that potato plantlet leaf proline content and the activities of catalase (CAT) and superoxide dismutase (SOD) significantly increased and alleviated the drought and high salt stress injury.
potato, drought stress, salt stress, subcellular structure, physiological indicators
1000-4025(2016)11-2233-08
10.7606/j.issn.1000-4025.2016.11.2233
2016-04-27;修改稿收到日期:2016-11-21
科技部国际科技合作项目(2014DEG31570);国家自然科学基金(31460369);兰州科技研究项目(2013-4-156);甘肃省财政专项课题(GSCZZX2014-1)
白江平 (1978-),男,副教授,硕士生导师,主要从事作物遗传育种研究。E-mail: baijp@gsau.edu.cn
Q945.78
A
