洗发、护发化妆品微生物检查方法学研究
2017-01-03周志云杨晓莉
闵 红, 周志云, 杨晓莉, 李 翠
( 陕西省食品药品检验所,陕西 西安 710065)
洗发、护发化妆品微生物检查方法学研究
闵 红, 周志云, 杨晓莉, 李 翠
( 陕西省食品药品检验所,陕西 西安 710065)
为提高化妆品潜在微生物的阳性检出率,建立洗发、护发类化妆品微生物限度和控制菌检查方法。采用常规法、培养基稀释法、薄膜过滤法对4种洗发、护发类化妆品进行微生物限度与控制菌方法学研究。结果显示,飘柔长效柔顺滋养洗发露、海飞丝去屑洗发露、飘柔人参滋养润发精华素、力士密集滋养修复-发膜级精华素菌落总数检测方法分别为0.2 mL/皿法、800 mL/膜法、0.5 mL/皿法和300 mL/膜法;霉菌及酵母菌检测方法分别为300 mL/膜法、300 mL/膜法、1 mL/皿法和1 mL/皿法;除海飞丝去屑洗发露采用培养基稀释法,其他均采用常规法进行控制菌检查。建议在化妆品微生物检验前应进行微生物方法研究,从而提高化妆品“潜在”病原菌的检出率。
洗发、护发类化妆品;抑菌性;微生物方法学
洗发、护发类化妆品是现代人生活不可缺少的日用品,含有丰富的蛋白质、脂肪、无机盐和水分,有些还含有水解胶原蛋白、植物提取物、多种氨基酸等,是微生物生长良好的培养基。化妆品中常被添加防腐剂用来有效防止化妆品的二次污染,即消费者使用过程中发生的污染[1]。我国卫生部颁布的《化妆品卫生规范》中允许使用的化妆品防腐剂有56种,其中,对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、凯松使用频率分别排名在前三位[2-3]。现行2007年版《化妆品卫生规范》[4]中微生物检验通过在培养基加入吐温-80或在稀释液加入卵磷脂来中和化妆品中的防腐剂等抑菌性物质。现实生活中化妆品所添加防腐剂种类繁杂,不同类化妆品防腐剂含量的差异也较大[5-7],很难确保其能否被有效中和,从而造成化妆品中潜在致病菌的“漏检”。广州市对241份化妆品留样进行复检,发现许多合格产品在复检中超标,其中存放3年内的产品微生物复检超标率为0.82%,3年以上的为5.88%[8]。该研究同样证明了现行2007年版《化妆品卫生规范》[4]中微生物检验方法会造成化妆品中微生物的“漏检”,化妆品污染的微生物受防腐剂抑菌作用不能成长繁殖,细胞受到损伤但并未死亡,随着时间延长,防腐剂抑菌效力逐渐降低,受损微生物逐渐复苏并进行生长繁殖,从而对人类健康造成危害。因此,本研究参考USP34版中防腐体系对微生物的抑杀效果试验[9]和中国药典2010年版中微生物限度检查方法学研究[10],选取4种常见洗发、护发类化妆品进行微生物检验方法学研究,以期通过有效减弱或消除化妆品中防腐剂等物质的抑菌作用,达到提高化妆品微生物阳性检出率的目的。
1 材料与方法
1.1 材料
1.1.1 试验菌 大肠埃希菌(Escherichiacoli)CMCC(B) 44102、金黄色葡萄球菌(Staphylococccusaureus)CMCC(B) 26003、枯草芽胞杆菌(Bacillussubtilis)CMCC(B) 63501、白色念珠菌(Candidaalbicans) CMCC(F) 98001、黑曲霉 (Aspergillusniger) CMCC(F) 98003、铜绿假单胞菌 (Pseudomonasaeruginosa)CMCC(B) 10104,均由中国医学细菌保藏中心提供。
1.1.2 供试品 A:飘柔长效柔顺滋养洗发露(批号:40141864F6);B:海飞丝去屑洗发露(批号:32441864GKJ);C:飘柔人参滋养润发精华素(批号:40350385DB);D:力士密集滋养修复-发膜级精华素(批号:20161008BP4I)。
1.1.3 培养基 营养琼脂培养基、玫瑰红钠琼脂培养基、卵磷脂吐温80营养琼脂、孟加拉红培养基、SCDLP液体培养基、含中和剂双料胆盐乳糖、十六烷三甲基溴化铵琼脂、Baird-Parker培养基,均由北京陆桥技术有限责任公司生产。
1.1.4 仪器 HFSafe-1200LC生物安全柜(上海力申科学仪器公司)、 FC752型HTY一次性薄膜过滤器(杭州泰林生物技术设备有限公司)、LRH-250生化培养箱(上海一恒科技有限公司)、WGP-600隔水式电热恒温培养箱(重庆四达实验仪器厂)。
1.2 方法
1.2.1 菌液制备 根据中国药典微生物限度检查法[10]进行菌液制备,采用10倍稀释法将6种试验菌稀释至50~100 cfu/mL。
1.2.2 供试液制备 根据2007年版《化妆品卫生规范》[4]进行供试品制备,首先称取样品10 g,加入90 mL灭菌生理盐水,充分振荡混匀,静置15 min,取其上清液作为1∶10的供试液。
1.2.3 微生物限度方法验证 ①常规法(1 mL/皿法):取1 mL供试液和50~100 CFU的大肠埃希菌加入培养皿,立即倾注20 mL营养琼脂培养基,待凝固后35 ℃培养48 h,记录菌落数作为试验组;测定供试品本底菌落数,作为供试品对照组;测定相应加入的大肠埃希菌菌落数,作为菌液组。回收率(%)=((试验组菌落数-供试品对照组菌落数)/菌液组菌落数)×100%。根据公式计算供试品大肠埃希菌回收率,同法计算供试品金黄色葡萄球菌、枯草芽胞杆菌、白色念珠菌和黑曲霉的回收率。加入大肠埃希菌、金黄色葡萄球菌和枯草芽胞杆菌的培养皿倾注营养琼脂培养基,白色念珠菌和黑曲霉倾注玫瑰红钠琼脂培养基。供试品5种试验菌的回收率均需进行3次重复试验。若大肠埃希菌、金黄色葡萄球菌和枯草芽胞杆菌3次重复试验所得回收率均高于70%,可采用常规法对供试品进行菌落总数检查;若白色念珠菌和黑曲霉的回收率均高于70%,可采用常规法对供试品进行霉菌及酵母菌数检查。若供试品任意试验菌任意一次回收率低于70%,需采用培养基稀释法继续对供试品此试验菌进行微生物方法研究。②培养基稀释法(包括0.5 mL/皿法和0.2 mL/皿法):试验组:分别向培养皿加入供试液0.5 mL和0.2 mL,再加入各50~100 CFU试验菌,其余操作同常规法。若供试品任意试验菌任意一次回收率低于70%,需采用薄膜过滤法继续对供试品此试验菌进行微生物方法研究。③薄膜过滤法(包括300 mL/膜法与800 mL/膜法): 试验组:将供试液以500 r/min离心3 min,取上清液10 mL加入100 mL稀释液中,再加入50~100 CFU试验菌,用1%蛋白胨缓冲液进行冲洗过滤,冲洗量分别为300 mL/膜与800 mL/膜,滤干后取出滤膜贴于培养基,测定其菌落数,作为试验组。其余操作同常规法。
1.2.4 控制菌检查方法学验证 ①常规法(大肠埃希菌:10 mL/管法,金黄色葡萄球菌和铜绿假单胞菌:90 mL/瓶法):大肠埃希菌:取1∶10供试液10 mL,分别接入2管(10 mL/管)双倍乳糖胆盐(含中和剂)培养基,其中1管接种50~100 CFU大肠埃希菌作为试验组,另一管作为阴性对照组;金黄色葡萄球菌:取1∶10供试液10 mL,分别接入2瓶(90 mL/瓶)SCDLP液体培养基,其中1瓶接种50~100 CFU金黄色葡萄球菌作为试验组,另一管作为阴性对照组;铜绿假单胞菌:取1∶10供试液10 mL,分别接入2瓶(90 mL/瓶)SCDLP液体培养基,其中1瓶接种10~100 CFU铜绿假单胞菌作为试验组,另一管作为阴性对照组。试验组与阴性对照组均置规定温度下培养24 h后按照2007年版《化妆品卫生规范》规定[4]进行后续鉴定试验。②培养基稀释法(大肠埃希菌:10 mL/管法和50 mL/管法,金黄色葡萄球菌和铜绿假单胞菌:90 mL/瓶法和400 mL/瓶法):大肠埃希菌:取1∶10供试液10 mL,分别接入2管(20 mL/管)和2管(50 mL/管)双倍乳糖胆盐(含中和剂)培养基;金黄色葡萄球菌:取1∶10供试液10 mL,分别接入2瓶(200 mL/瓶)和2瓶(400 mL/瓶)SCDLP液体培养基;铜绿假单胞菌:取1∶10供试液10 mL,分别接入2瓶(200 mL/瓶)和2瓶(400 mL/瓶)SCDLP液体培养基,其余操作同常规法。
2 结果与分析
2.1 微生物限度方法学
飘柔长效柔顺滋养洗发露(样品A)采用1 mL/皿法进行菌落总数方法学研究时(表1),大肠埃希菌、枯草芽胞杆菌回收率高于70%,而金黄色葡萄球菌平均回收率仅为29%,当采用0.5 mL/皿法与0.2 mL/皿法时,金黄色葡萄球菌平均回收率分别为52%和89%,应采用培养基稀释法(0.2 mL/皿法)对样品A进行菌落总数检查;飘柔长效柔顺滋养洗发露采用1、0.5和0.2 mL/皿法进行霉菌及酵母菌方法学研究时,黑曲霉回收率均为0,直到采用300 mL/膜法时,平均回收率为86%,应采用薄膜过滤法(300 mL/膜)对样品A进行霉菌及酵母菌检查。海飞丝去屑洗发露(样品B)采用1、0.5和0.2 mL/皿法进行微生物方法学研究时,5种试验菌的回收率均为0,当采用300 mL/膜法时,金黄色葡萄球菌、枯草芽胞杆菌、白色念珠菌和黑曲霉回收率均高于70%,大肠埃希菌回收率为0,当采用800 mL/膜法时,回收率为96%,应采用薄膜过滤法(800 mL/膜)对样品B进行菌落总数检查,采用薄膜过滤法(300 mL/膜)进行霉菌及酵母菌检查。飘柔人参滋养润发精华素(样品C)采用1 mL/皿法进行微生物方法学研究时,除大肠埃希菌的回收率为61%,其他4种试验菌回收率均高于70%,直到采用0.5 mL/皿法时,大肠埃希菌回收率才高于70%,应采用培养基稀释法(0.5 mL/皿)对样品C进行菌落总数检查,采用常规法(1 mL/皿)进行霉菌及酵母菌检查。力士密集滋养修复-发膜级精华素(样品D)采用1 mL/皿法进行微生物方法学研究时,除金黄色葡萄球菌外,其他4种试验菌回收率均高于70%,采用0.5和0.2 mL/皿法时,金黄色葡萄球菌回收率分别为44%和61%,直到采用300 mL/膜法时,金黄色葡萄球菌回收率才高于70%,应采用薄膜过滤法(300 mL/膜)对样品D进行菌落总数检查,采用常规法(1 mL/皿)进行霉菌及酵母菌检查。

表1 微生物限度方法研究回收率Table 1 Recovery rate of microbial limit methodology
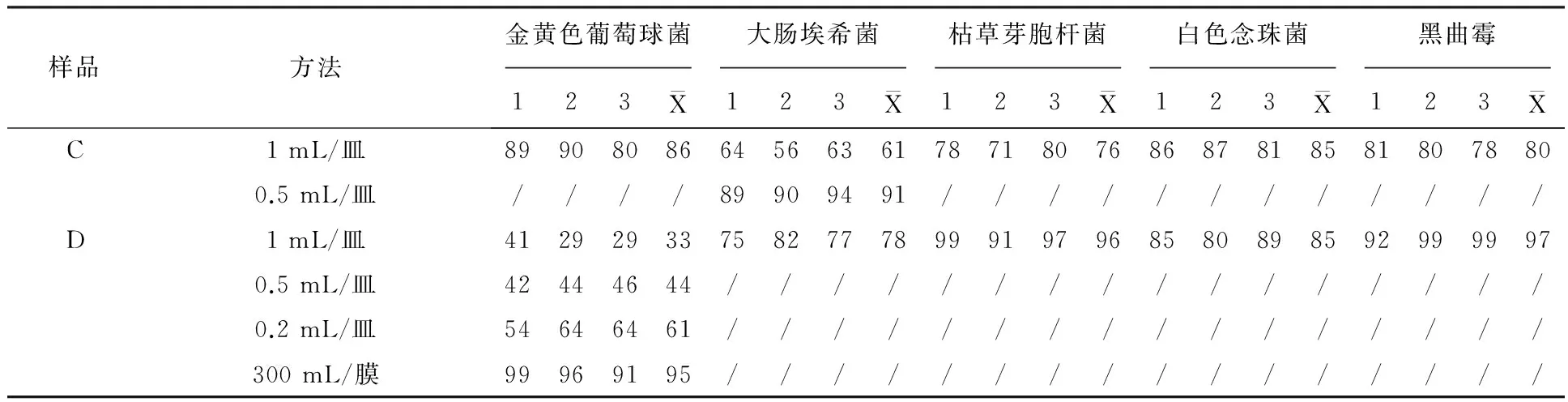
续表1
注:“/”表示由于供试品回收率已经高于70%,未进行方法学研究试验
2.2 控制菌检查方法学
飘柔长效柔顺滋养洗发露(样品A)、飘柔人参滋养润发精华素(样品C)与力士密集滋养修复-发膜级精华素(样品D)采用常规法(粪大肠菌群10 mL/管、铜绿假单胞菌90 mL/瓶、金黄色葡萄球菌90 mL/瓶)进行控制菌方法学研究时(表2~4),试验组均检出粪大肠菌群、铜绿假单胞菌和金黄色葡萄球菌,阴性对照无菌生长,可采用常规法对样品A、C、D进行控制菌检查。海飞丝去屑洗发露(样品B)采用10 mL/管法与20 mL/管法进行粪大肠菌群方法学研究时,试验组无菌生长,采用50 mL/管法时,试验组均检出粪大肠菌群,阴性对照无菌生长,可采用培养基稀释法(50 mL/管)对样品B进行粪大肠菌群检查;样品B采用90 mL/瓶法与200 mL/瓶法分别进行铜绿假单胞菌和金黄色葡萄球菌方法学研究时,试验组均无菌生长,采用400 mL/瓶法时,试验组分别检出铜绿假单胞菌和金黄色葡萄球菌,阴性对照无菌生长,可采用培养基稀释法(400 mL/瓶)对样品B进行铜绿假单胞菌和金黄色葡萄球菌检查。

表2 洗发、护发类化妆品粪大肠菌群方法学研究Table 2 Research result on methodology of fecal coliforms for shampoo and hair conditioner
注:“/”表示由于无菌落生长,未进行方法学研究试验,下表同

表3 洗发、护发类化妆品铜绿假单胞菌方法学研究结果Table 3 Research result on methodology of Pseudomonas aeruginosa for shampoo and hair conditioner
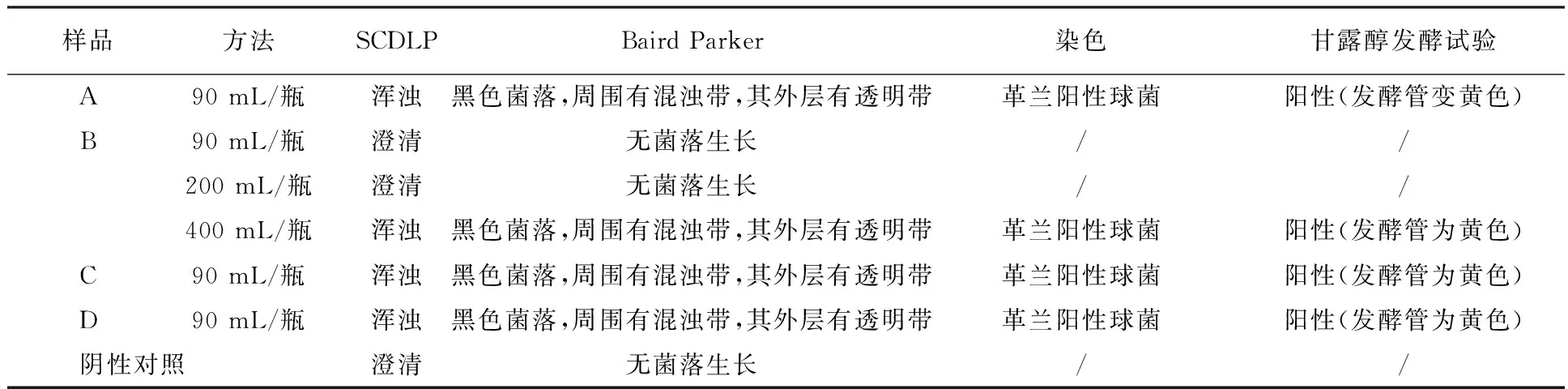
表4 洗发、护发类化妆品金黄色葡萄球菌方法学研究结果Table 4 Research result on methodology of Staphylococccus aureus for shampoo and hair conditioner
3 讨 论
在微生物限度方法学研究中,金黄色葡萄球菌代表革兰阳性菌,大肠埃希菌代表革兰阴性菌,枯草芽胞杆菌代表芽胞杆菌,白色念珠菌代表酵母菌,黑曲霉代表霉菌[11]。对抑菌物质含量低的供试品,可通过培养基稀释法减少供试品抑菌物质的浓度,从而消除其对微生物生长的影响[12]。对抑菌物质含量高的供试品,可通过薄膜过滤法将抑菌物质冲洗过滤,微生物截留在滤膜上,再将滤膜贴到适宜的培养基培养,进行微生物限度检查[13]。
试验结果表明,采用常规法对4种洗发、护发类化妆品进行微生物方法学研究时,均存在试验菌的回收率低于70%的现象,如果飘柔长效柔顺滋养洗发露金黄色葡萄球菌的平均回收率为29%,黑曲霉为0,表明其对霉菌有较强的抑菌作用,对革兰阳性菌有较弱的抑菌作用;海飞丝去屑洗发露所有试验菌的回收率均为0,表明其对所有菌群均表现较强的抑菌作用,其中对革兰阴性菌抑菌作用最强;飘柔人参滋养润发精华素大肠埃希菌的平均回收率为61%,表明其对革兰阴性菌表现较弱的抑菌作用;力士密集滋养修复-发膜级精华素金黄色葡萄球菌的平均回收率为33%,表明其对革兰阳性菌有较强的抑菌作用。
如果采用常规法(即化妆品卫生规范(2007)中微生物检验方法)进行微生物检验,势必造成“漏检”现象。因此,建议参考USP34版中防腐剂体系对微生物的抑菌效能试验[9]和中国药典2010年版中微生物限度方法学试验[10],在化妆品微生物检验前应进行微生物方法学研究,即通过培养基稀释法、薄膜过滤法结合加中和剂等方法对化妆品检验方法进行有效性验证;以准确消除化妆品中防腐剂等抑菌物质的抑菌作用,提高化妆品潜在微生物的阳性检出率。
本研究对市场常见4种洗发、护发类化妆品进行微生物方法学研究,分析了化妆品中防腐剂等抑菌物质对特定微生物菌群的抑制作用,提出了化妆品微生物方法学验证理论。下一步将开展化妆品中防腐剂抑菌效力与微生物污染之间关系研究,希望通过对化妆品中防腐剂类型与含量的测定,得出微生物限度与控制菌的检查方法。
[1] 谢小保, 欧阳友生, 陈仪本, 等. API系统鉴定化妆品及一次性卫生用品微生物种类的研究[J]. 微生物学杂志, 2002, 22(1): 7-9.
[2] 邓志方, 刘毅, 杜达安, 等. 广东省化妆品用防腐剂调查分析[J]. 环境与健康杂志, 2001, 18(2): 89-91.
[3] 冯士清, 赵华. 从使用频率看化妆品防腐剂走势[J]. 日用化学品科学, 2006, 29(11): 30-33.
[4] 中华人民共和国卫生部. 2007版化妆品卫生规范[M]. 北京: 军事医学科学出版社, 2007: 265-280.
[5] 聂西度, 谢花林, 彭书萍, 等.高效液相色谱法测定化妆品中防腐剂的研究[J]. 分析科学学报, 2005, 21(2): 231-232.
[6] 李洁, 赵金辉.高效液相色谱法测定化妆品中凯松和布罗波尔[J].中国卫生检验杂志, 2000, 10(5): 520-521.
[7] 武婷, 王超, 王星, 等. 反相高效液相色谱法测定化妆品中的24种防腐剂[J].分析化学, 2007, 35(10): 1439-1443.
[8] 江思力, 刘守芝, 钟嶷, 等. 广州市不同存放期化妆品微生物复检结果动态分析[J]. 中国公共卫生杂志, 2000, 16(4): 345.
[9] The United States Pharmacopeia Convention.United States Pharmacopeia[M]. 34 th Edition. NF29. Maryland: USP Press, 2011: Appendix. Antimicrobial effectiveness testing.
[10]中华人民共和国卫生部药典委员会, 编. 中华人民共和国药典 2010版[M].北京: 中国医药科技出版社, 2010: (附录) 107-116.
[11]苏德模, 马绪荣. 药品微生物学检验技术[M]. 北京: 华龄出版社, 2007:218-220.
[12]李秋菲, 唐振宏, 徐长根, 等. 5种外用制剂微生物限度检查法中菌落计数方法验证[J]. 中国药业, 2008, 17(22): 39.
[13]宫继鹏, 姚湧, 谈超, 等. 硝酸咪康唑栓微生物限度检查方法的验证[J]. 安徽医药, 2011, 15(3): 313-315.
Microbial Limit and Microbe-Controlling Method for Shampoos and Hair Conditioners
MIN Hong, ZHOU Zhi-yun, YANG Xiao-li, LI Cui
(ShaanxiInst.forFood&DrugControl,Xi’an710065)
In order to improve the positive detection rate of potential microbe in cosmetics, a microbial limit and microbe-controlling method for shampoos and hair conditioners was established. Routine method, medium diluting method, membrane filtration method was adopted for the study of microbial limit and microbe-controlling method. The results showed that bacterial count of Rejoice Long-lasting Soft Nourishing Shampoo, Head and Shoulders Anti-dandruff Shampoo, Rejoice Ginseng Nourishing Essence, Lux Intensive Nourishing Repairment Essence should be tested by the method of 0.2 mL/dish method (dm), 800 mL/membrane method (mm), 0.5 mL/dm and 300 mL/mm, respectively. Yeast and mold count were 300 mL/mm, 300 mL/mm, 1 mL/dm and 1 mL/dm; by routine method and routine method. Microbe-controlling except for Head and Shoulders Anti-dandruff Shampoo was tested by medium diluting method, the other were all using routine method to carry out the detection of micro-controlling. Therefore, it is suggested that before verifying microbial method, study on microbial method should be carried out, thus improving detection rates of potential microbe in cosmetics.
cosmetics of shampoos and hair conditioners; microbial inhibition; microbial methodology
陕西省食品药品检验所博士科研启动基金项目(SBSjj-201201)
闵红 女, 主管药师,博士。主要从事食品、药品与化妆品微生物检测与研究。
Tel: 029-62288452,E-mail: hong-min518@163.com
2016-01-08;
2016-02-18
Q93-332
B
1005-7021(2016)05-0103-05
10.3969/j.issn.1005-7021.2016.05.018
