天蚕素A-马盖宁杂合肽对耐甲氧西林金黄色葡萄球菌生理代谢影响的研究
2017-01-03刘二强陈香君回丽媛朱明星王秀青
刘二强, 陈香君, 回丽媛, 朱明星, 王秀青*
(1.兵器工业北京北方医院,北京 100089;2.宁夏医科大学 临床医学院,宁夏 银川 750004;3.宁夏医科大学 科技中心,宁夏 银川 750004)
天蚕素A-马盖宁杂合肽对耐甲氧西林金黄色葡萄球菌生理代谢影响的研究
刘二强1, 陈香君2, 回丽媛2, 朱明星3, 王秀青2*
(1.兵器工业北京北方医院,北京 100089;2.宁夏医科大学 临床医学院,宁夏 银川 750004;3.宁夏医科大学 科技中心,宁夏 银川 750004)
研究天蚕素A-马盖宁杂合肽作用耐甲氧西林金黄色葡萄球菌(MRSA)后对细胞生理代谢的影响。利用全波长酶标仪测定杂合肽作用MRSA后对DNA、RNA、总蛋白、β-半乳糖苷酶、碱性磷酸酶的影响,利用溶氧电极测定杂合肽对细胞呼吸作用的影响,通过生物发光分析仪检测杂合肽作用细胞后ATP生产的变化。结果显示,杂合肽作用MRSA后对细胞DNA、RNA、总蛋白的合成能力均出现抑制作用。β-半乳糖苷酶、碱性磷酸酶的表达活性同样受到了明显的抑制。杂合肽作用细胞后呼吸作用明显下降,ATP生产能力受到抑制。杂合肽作用细胞后抑制了胞内部分生物大分子的合成能力、胞内酶的表达活性及细胞的能量代谢功能,通过胞内机制发挥了抑菌作用。
天蚕素A-马盖宁;耐甲氧西林金黄色葡萄球菌;生理代谢;生物大分子;抗菌肽
抗菌肽(antimicrobial peptides, AMPs)是广泛存在于自然界生物体内的一类小分子多肽,由特定基因编码产生,作为生物机体天然免疫防御系统的重要组成部分,能够抵御病原体的侵害[1-2]。抗菌肽对细菌、真菌、病毒以及癌细胞等具有良好的生物活性。因其不易产生耐药性,具有热稳定性和较好的水溶性,对高等动物正常细胞几乎无毒害作用而显示出强大的抗菌应用前景,有望作为新一代抗菌药物替代传统抗生素。自20世纪70年代瑞典科学家Boman等[3]首次在天蚕血淋巴中发现抗菌肽以来,抗菌肽一直成为生命科学研究的热点之一[4],并在各种生物中发现了大量的抗菌肽。耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcusaureus,MRSA)在金黄色葡萄球菌(Staphylococcusaureus,SA)感染中所占的比例越来越高,据相关报道,部分地区高达70%以上[5],目前已经成为医院感染的重要致病菌之一。由于MRSA对于常用抗菌药物存在较高的耐药率,临床治疗MRSA感染成为目前感染治疗的难点之一。因此越来越多的科研工作者寻求更为有效的抗菌肽,研究抗菌肽对MRSA的作用机制,以期能够尽早应用于临床感染治疗领域。天蚕素A-马盖宁(CecA-Mag)是由抗菌作用较强的两种阳离子小肽天蚕素A(CecropinA)和马盖宁(Magainin)杂合而成。研究者前期选用了天蚕素A成熟肽段1~7以及马盖宁2~12的氨基酸序列(GenBank上序列号分别为X06672和J03193),选用酵母偏爱密码子设计CecA-Mag杂合肽基因。杂合肽体外试验显示,其对G+及G-菌均具有良好的抑菌效果[6],对临床分离出的MRSA菌株亦有良好的抑杀活性。课题组前期在杂合肽杀伤MRSA机制研究中,发现杂合肽可以改变细胞膜的通透性[7],并且能够进入胞内,在细胞内累积,同时可以与核酸分子结合。大量研究结果表明,多数抗菌肽存在胞内杀伤机制,抗菌肽在细胞内累积,并干扰细胞正常代谢,通过抑制DNA、RNA、蛋白质合成,或抑制胞内酶活性,达到抑制、杀灭细菌的目的。本研究在杂合肽处理MRSA后,通过对DNA、RNA、总蛋白合成能力的测定,胞内酶表达活性的变化,以及细胞呼吸作用、ATP生产能力的变化测定,研究了杂合肽存在的情况下对胞内物质代谢的影响情况,探讨了杂合肽对MRSA胞内物质的影响作用机制,进一步明确了杂合肽通过引起MRSA胞内生物大分子的表达变化,发挥胞内抑菌机制,进而导致细菌死亡。
1 材料与方法
1.1 材料
1.1.1 天蚕素A-马盖宁杂合肽 杂合肽由上海楚肽生物科技有限公司采用固相化学合成法合成,Purity(HPLC)纯度≥95%。ddH2O作为溶解杂合肽的溶剂,0.22 μm滤器过滤[8]。
1.1.2 菌种来源 耐甲氧西林金黄色葡萄球菌(MRSA)菌株为临床菌株,由宁夏医科大学总医院实验中心提供。
1.1.3 培养基 ①MH培养基(青岛海博生物技术有限公司);②M9乳糖诱导培养基:Na2HPO4·7H2O 1.28 g,KH2PO40.3 g,NaCl 0.05 g,NH4Cl 0.1 g,MgSO40.05 g,CaCl20.001 g,乳糖 0.5 g,溶于100 mL超纯水。
1.1.4 主要试剂和仪器 细菌DNA提取试剂盒,美国Omega公司;细菌RNA提取试剂盒,北京天根公司;BCA蛋白定量试剂盒,北京康为世纪公司;邻硝基苯-β-D-吡喃半乳糖苷(ONPG)、对硝基苯磷酸二钠(PNPP),美国Amersco公司;溶葡萄球菌素、虫荧光素(luciferin)与虫荧光素酶(luciferase)、5′-三磷酸腺苷(ATP)二钠盐水合物,美国sigma公司;Multiskan GO全波长酶标仪,美国Thermo Fisher公司;O2微电极(OX50),丹麦Unisense公司;滨松生物发光分析仪,北京滨松光子公司。
1.2 方法
1.2.1 杂合肽作用MRSA后对细胞DNA合成能力的影响 将培养至对数生长期的MRSA菌液4 000×g离心5 min,PBS洗涤离心后,用新鲜的 MH培养基重悬至 1×108cfu/mL,每个实验组设5个平行。35 ℃、220 r/min培养8 h后,分别加入 100 μL经ddH2O稀释的杂合肽溶液,混匀后,使杂合肽的终浓度分别为1×MIC和3×MIC。以加入100 μL纯水作为阴性对照。继续培养30、60、90、120、150、180、210 min后,4 000×g离心5 min,去上清[9]。利用Omega 细菌DNA提取试剂盒提取MRSA基因组DNA,用全波长酶标仪测量提取DNA样本的OD260及OD280[10],OD260值为1相当于大约50 μg/mL双链 DNA,OD260/OD280比值为1.7~1.9时,表示DNA纯度较高。实验重复3次,数据取其平均值。
1.2.2 杂合肽作用MRSA后对细胞RNA合成能力的影响 取培养至对数生长期的MRSA菌液4 000 g离心5 min,用PBS洗涤离心后,用新鲜的MH培养基重悬菌体至1×108cfu/mL,每个实验组设5个平行。35 ℃、220 r/min培养8 h后,分别加入100 μL杂合肽溶液,混匀后,使杂合肽的终浓度分别为1×MIC和3×MIC。以加入100 μL纯水作为阴性对照。继续培养0、30、60、90、120、150、180、210 min后,4 000×g离心5 min,去上清。利用Omega 细菌RNA提取试剂盒提取MRSA 总RNA。提取出的RNA溶液用全波长酶标仪测OD260及OD280,OD260/OD280比值在 1.8~2.0 视为抽提的 RNA 纯度较高。实验重复3次,数据取其平均值[11]。
1.2.3 杂合肽作用MRSA后对细胞总蛋白合成能力的影响 取25 μL蛋白标准品用PBS稀释至100 μL,使终浓度为0.5 mg/mL。将标准品按0、1、2、4、8、12、16、20 μL加到96孔板的蛋白标准孔中,加PBS补足到20 μL,用全波长酶标仪测定A562,绘制标准曲线。参照试剂盒说明书,配制适量BCA工作液。杂合肽处理0、30、60、90、120、150、180、210 min后的菌液离心,弃上清,PBS洗涤。分别加入100 μL TE缓冲液和5 μL溶葡萄球菌素(1 mg/mL),37 ℃温育10 min。取出置冰浴中,分别加入400 μL冰纯水和500 μL冰冷的20%三氯乙酸(TCA),混匀冰浴5 min。离心,去上清,加入200 μL冰冷的PBS重悬。分别取20 μL重悬液各3管到96孔板的样品孔中,各孔加入200 μL BCA工作液,37 ℃放置30 min,冷却至室温,用全波长酶标仪测定A562。根据标准曲线计算出样品的蛋白浓度[12]。
1.2.4 杂合肽作用MRSA后对β-半乳糖苷酶表达活性的影响 取培养至对数期的MRSA菌液,用PBS洗涤4 000 g离心5 min,M9乳糖诱导培养基重悬,转移至加入25 mL M9 乳糖诱导培养基的100 mL锥形瓶中,35 ℃振荡诱导5 h后离心。用M9 乳糖诱导培养基重悬至1×108cfu/mL,加入100 μL杂合肽溶液,使肽终浓度分别为1×MIC和3×MIC。以加入100 μL ddH2O作为阴性对照。35 ℃诱导培养0、30、60、90、120、150、180、210 min后,离心收集,用500 μL TE缓冲液重悬后加入2 μL溶葡萄球菌素(1 mg/mL),37 ℃温浴10 min,再置于超声波细胞粉碎机中,冰浴,15 kHz超声波处理3 min,4 ℃离心,取上清液400 μL,加入800 μL β-半乳糖苷酶反应缓冲液(NaCl 0.8 g,KCl 0.02 g,Na2HPO4·12H2O 0.29 g,KH2PO40.024 g,MgSO4·7H2O 0.025 g,β-硫基乙醇 0.39 g,超纯水溶解至100 mL),再加入400 μL 10 mg/mL 邻硝基苯-β-D-吡喃半乳糖苷(ONPG)充分混匀后,37 ℃温浴30 min,加入400 μL 1 mol/L Na2CO3终止反应,用全波长酶标仪测定405 nm 处的OD值[13]。实验重复3次,数据取其平均值。
1.2.5 杂合肽作用MRSA后对碱性磷酸酶表达活性的影响 将处于对数生长期MRSA菌悬液4 000 g离心5 min,PBS洗涤,新鲜MH培养基重悬菌沉淀至1×108cfu/mL。取菌悬液,加入杂合肽溶液50、180、210 min后,离心收集,用500 μL TE缓冲液重悬后加入2 μL溶葡萄球菌素(1 mg/mL),37 ℃温浴10 min,再置于超声波细胞粉碎机中,冰浴,15 kHz超声波处理3 min,4 ℃离心,取上清液400 μL,加入800 μL 2 mol/L乙二醇胺缓冲液(乙二醇胺10 mL,MgCl2·6H2O 102 mg,50 mL超纯水溶解,浓盐酸调pH至10.0),再加入400 μL 10 mg/mL对硝基苯磷酸二钠(pNPP),充分混匀后,37℃温浴30 min,加入400 μL 1 mol/L NaOH终止反应,用全波长酶标仪测定405 nm 处的OD值[14]。实验重复3次,数据取其平均值。
1.2.6 杂合肽作用MRSA后对细胞呼吸作用的影响 将处于对数生长期MRSA菌悬液4 000 g离心5 min,用PBS洗涤后,新鲜的MH培养基重悬菌沉淀至1×108cfu/mL。在菌悬液中加入100 μL杂合肽溶液,使肽终浓度分别为1×MIC和3×MIC,37 ℃振荡培养。以加入100 μL ddH2O作为阴性对照。本研究采用O2微电极(OX50)测量菌液中0、10、20、30、40、50、60 min时溶氧率的变化[15]。将初始时刻菌悬液中的溶氧率作为100%,空气测定值为0%,实验重复3次,数据取其平均值。
1.2.7 杂合肽作用MRSA后对细胞ATP生产的影响 ATP标准曲线的测定:ddH2O稀释ATP标准品,在96孔板中加入10 μL终浓度为0、20、40、60、80、100 pmol/L的ATP标准品,再加入50 μL 虫荧光素-虫荧光素酶混合物(50 mmol/L甘氨酸,0.15 mmol/L虫荧光素,0.2 mg/mL虫荧光素酶,1 mmol/L tris,0.55 mmol/L EDTA, 0.1% BSA,0.1%叠氮化钠,pH 7.6),滨松生物发光分析仪检测发光度值,绘制标准曲线。取对数生长期MRSA菌液,PBS洗涤,新鲜MH培养基重悬菌沉淀至1×108cfu/mL。在菌悬液中加入100 μL的杂合肽溶液,使肽终浓度分别为1×MIC和3×MIC。以加入100 μL ddH2O作为阴性对照。37 ℃处理0、10、20、30、40、50、60 min后,离心收集菌体,ddH2O重悬后加入0.05%苯扎溴铵和1 mmol/L MgCl2,室温作用3 min后置冰上备用。取荧光素-荧光素酶混合液150 μL于96孔板中,加入50 μL 苯扎溴铵处理的样本,滨松生物发光分析仪检测发光值,计算ATP量[16]。实验重复3次,数据取其平均值。
1.2.8 数据分析 所得数据用SPSS 13.0统计软件进行单因素方差分析,采用Duncan氏法进行多重比较。
2 结果与分析
2.1 杂合肽作用MRSA后对细胞DNA合成能力的影响
杂合肽对MRSA DNA合成的影响如图1所示。以纯水作为阴性对照组的结果显示,随着时间的延长DNA的合成量总体呈上升趋势,说明胞内DNA正常合成,细菌正常繁殖。在菌液中加入杂合肽后,基因组DNA合成量在30 min内继续升高,30 min后总体呈下降趋势,90 min后DNA的合成被明显抑制。与1×MIC浓度相比,3×MIC浓度的杂合肽对DNA合成的抑制作用更强。

图1 杂合肽对MRSA DNA合成能力的影响Fig.1 The influence of peptides on the synthesis of bacterial DNA *与对照组比较P<0.05~0.01;**与对照组比较P<0.01;下图同 *compared with control group, P<0.05~0.01;**compared with control group, P<0.01;Same figure
2.2 杂合肽作用MRSA后对细胞RNA合成能力的影响
杂合肽作用MRSA后对RNA合成能力的影响如图2所示。以纯水作为阴性的对照组中,RNA的合成量随时间呈稳定上升趋势,说明细菌正常繁殖代谢,RNA的量也在不断增多。加入杂合肽后,细菌RNA合成量明显降低。3×MIC浓度的杂合肽组,30 min后明显受到抑制 ,1×MIC浓度的杂合肽处理组60 min后同样能够明显抑制RNA的合成。3×MIC浓度的杂合肽组对RNA合成能力的抑制作用比1×MIC浓度的抑制效果更强。
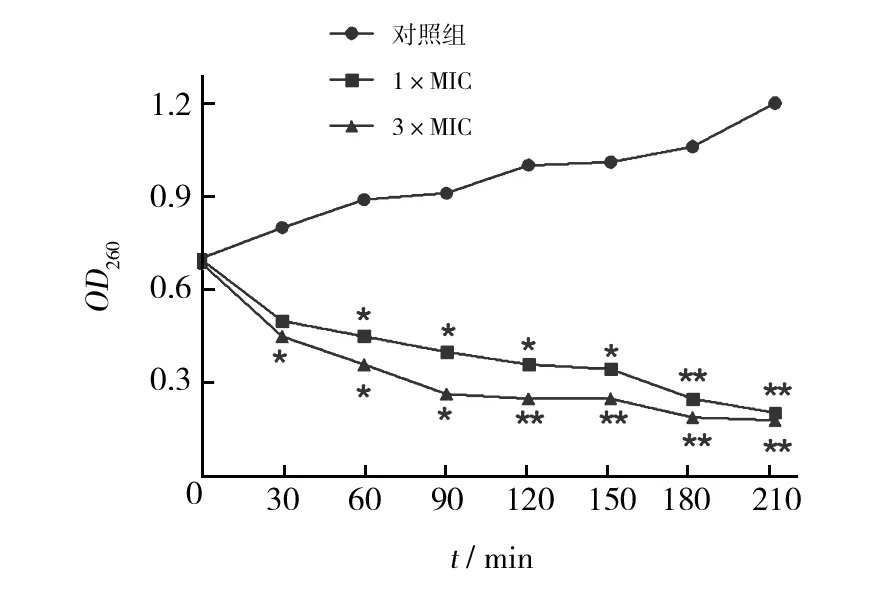
图2 杂合肽对MRSA RNA合成能力的影响Fig.2 The influence of peptides on the synthesis of bacterial RNA
2.3 杂合肽作用MRSA后对细胞总蛋白合成能力的影响
杂合肽作用MRSA后对细菌总蛋白合成能力的影响如图3所示。在纯水作为阴性对照的对照组中,蛋白的合成量呈现稳步上升趋势,细菌胞内基因转录翻译过程是正常的进行。加入杂合肽后,不同浓度组的蛋白合成量均出现明显下降,并没有像DNA组出现滞后期,并且下降速度更快,尤其是3×MIC浓度组在30 min后即明显抑制了蛋白质的合成(P<0.01)。1×MIC浓度组同样能够明显抑制总蛋白的合成能力。

图3 杂合肽对MRSA总蛋白 合成能力的影响Fig.3 The influence of peptides on the synthesis of bacterial total protein
2.4 杂合肽作用MRSA细菌后对β-半乳糖苷酶表达活性的影响
乳糖存在的条件下诱导细菌产生β-半乳糖苷酶,该酶可水解邻-硝基苯-β-D-半乳糖苷(ONPG),生成黄色的邻-硝基苯酚(ONP),ONP在波长405 nm处有最大吸收峰,可以根据OD405值的变化反映碱性磷酸酶的表达活性。由图4所示OD405的变化可以看出,以纯水作为阴性对照的对照组中,β-半乳糖苷酶的表达活性随时间呈稳步上升趋势。杂合肽处理组,无论是1×MIC还是3×MIC组,均随着时间的延长β-半乳糖苷酶表达活性逐步下降,3×MIC浓度组在60 min时出现明显的抑制酶活现象并随着时间的延长抑制作用更加强烈,1×MIC浓度组在120 min内没有出现明显的抑制效果,但120 min后同样出现了对β-半乳糖苷酶表达活性明显的抑制作用。
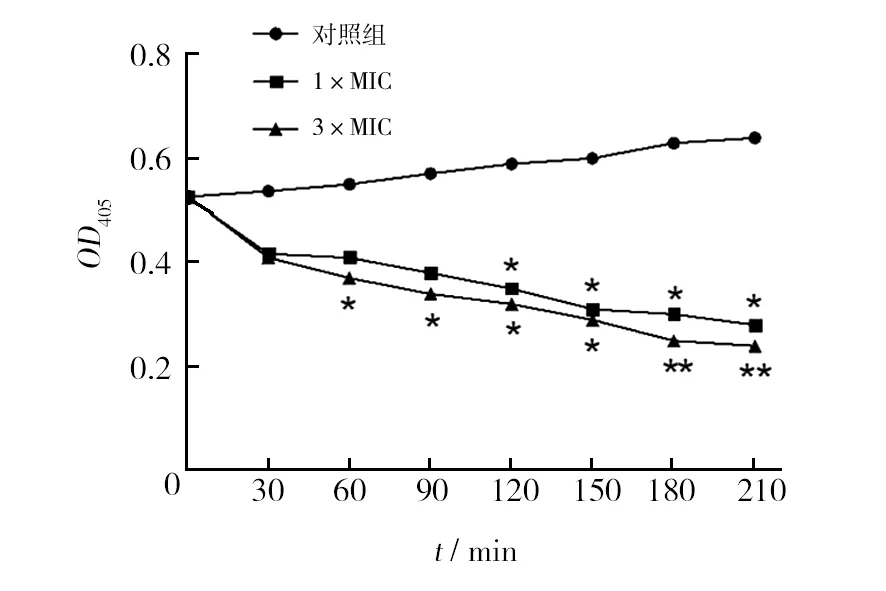
图4 杂合肽对MRSA β-半乳糖苷酶表达活性的影响Fig.4 nhibition of β-galactosidase activities of MRSA cells by antibacterial peptides
2.5 杂合肽作用细菌后对碱性磷酸酶表达活性的影响
碱性磷酸酶可以催化对硝基苯磷酸二钠(pNPP)水解产生黄色的对硝基苯酚(pNP),pNP在波长405 nm处有最大吸收峰,可以根据OD405的值反映碱性磷酸酶的表达活性。杂合肽处理MRSA后对碱性磷酸酶的表达活性影响如图5所示,以纯水作为阴性对照的对照组,碱性磷酸酶的表达持续增加。与β-半乳糖苷酶的实验结果类似,杂合肽抑制了碱性磷酸酶的表达,3×MIC组较1×MIC组抑制程度更强。杂合肽抑制了胞内两个重要酶β-半乳糖苷酶和碱性磷酸酶的表达活性,同时这与杂合肽抑制蛋白合成能力的结果是一致的。
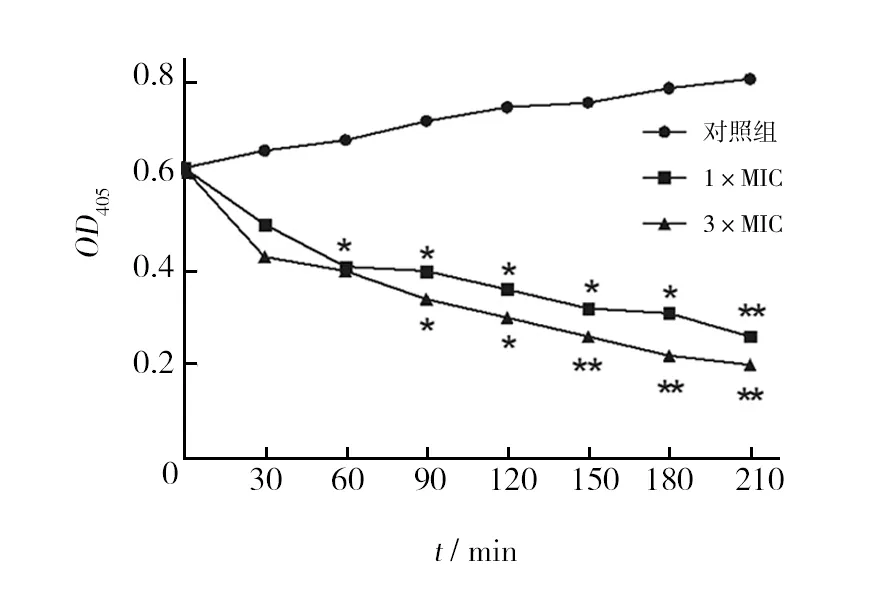
图5 杂合肽对MRSA碱性磷酸酶表达活性的影响Fig.5 Inhibition of alkaline phosphatase activities of MRSA cells by antibacterial peptides
2.6 杂合肽作用细菌后对细胞呼吸作用的影响
杂合肽作用细菌后对细胞呼吸作用的影响如图6所示,与以纯水作为对照的对照组相比,3×MIC浓度组处理的菌悬液中溶氧率明显高于对照组,而且从20 min开始即出现了明显的差异,说明3×MIC浓度组的杂合肽显著的抑制了细胞的呼吸作用,使菌悬液中溶解的氧消耗减慢。1×MIC浓度组处理的菌悬液中溶氧率与对照组相比,前50 min内未出现明显的统计学差异,60 min时则出现明显差异。杂合肽在更高的浓度范围对细胞呼吸作用的抑制作用更为强烈。
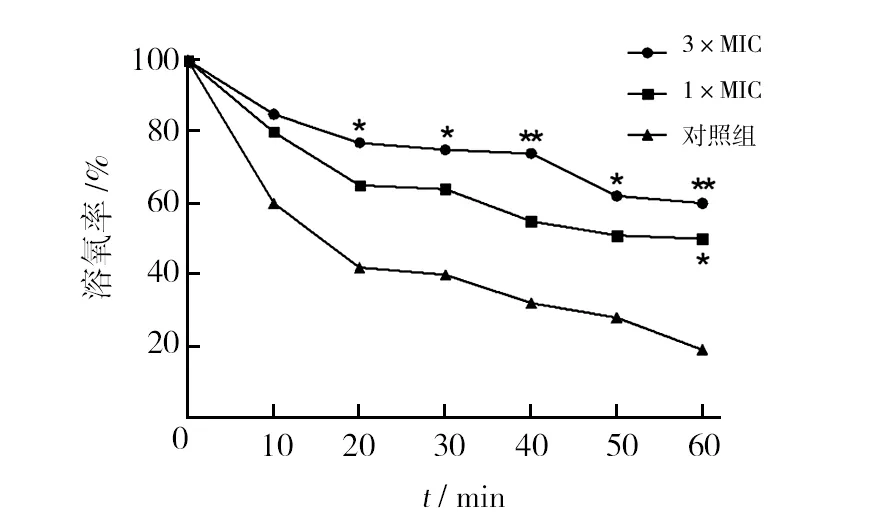
图6 杂合肽对MRSA呼吸作用的影响Fig.6 The effect of antimicrobial peptides on oxygen consumption of MRSA
2.7 杂合肽作用细菌后对细胞ATP生产的影响
ATP生物发光法的原理就是在荧光素酶和Mg2+的作用下,荧光素与ATP发生腺苷酰化被活化,活化后的荧光素与荧光素酶相结合,化学能转化成光能,检测的荧光值强度与ATP浓度成一定比例关系。杂合肽处理MRSA后对碱性磷酸酶的表达活性影响如图7所示,与对照组相比,3×MIC浓度组在处理细菌20 min后ATP的生产量即出现明显的抑制,40 min后抑制作用更为明显。1×MIC浓度组则在30 min时出现对ATP的生产明显抑制。不同浓度组对ATP的生产均出现不同程度的抑制,且高浓度组受到的抑制更明显。

图7 杂合肽对MRSA ATP生产的影响Fig.7 The effect of antimicrobial peptides on the ATP content of MRSA
3 讨 论
目前研究证明大部分抗菌肽通过破坏靶细胞膜的完整性而导致微生物死亡[17],但在某些情况下,微生物在抗菌肽造成细胞膜膜渗漏的同时,仍能长期生存,说明膜的破坏并不是靶细胞死亡的全部机制[18-19]。越来越多的研究结果证明抗菌肽还存在胞内作用机制[20],抗菌肽能够穿透细胞膜进入胞内,通过抑制胞内正常的生理代谢功能,导致细菌死亡。Hao等[21]研究发现,抗菌肽buforinⅡ并不引起大肠埃希菌细胞质膜破裂,而是穿透细胞膜后进入胞内,与DNA和RNA结合,导致细菌死亡。抗菌肽indolicidin及其衍生物能够完全抑制大肠埃希菌DNA和RNA的合成,对总蛋白合成能力则没有造成影响[22-23],而在更高的抗菌肽浓度下则显著抑制蛋白质的合成,而且观察到细菌细胞膜的变化和胞内容物的泄漏[24]。抗菌肽PR-39能够抑制大肠埃希菌DNA、RNA和总蛋白的合成。本研究表明,天蚕素A-马盖宁杂合肽能够抑制MRSA的DNA、RNA和总蛋白的合成能力。杂合肽没有首先抑制DNA的合成功能可能是因为杂合肽与DNA的特殊结合方式,也可能是杂合肽首先影响到DNA复制相关的酶类或者其他与复制相关的分子,导致DNA可以继续完成部分的复制功能[20];另外杂合肽与DNA的结合有可能类似于抗原抗体反应,存在最佳计量结合状态。杂合肽迅速抑制了RNA的合成,一方面是杂合肽与RNA结合,另一方面可能是杂合肽结合到了影响转录的功能区域上。杂合肽对蛋白的合成表现出明显的抑制作用,高浓度的肽抑制蛋白合成的能力比低浓度的肽强。杂合肽结合核糖体RNA后会首先影响到总蛋白的合成,这能够解释杂合肽处理细菌后总蛋白合成的下降。
抗菌肽可与细菌的胞内酶结合,通过抑制胞内酶的活性,达到抑菌的效果。Vincent等[25]研究表明,细菌素Microcin J25能够与胞内的RNA聚合酶结合,进而导致底物不能与酶的活性中心结合,抑制RNA聚合酶的活性。又有研究表明,富含脯氨酸的抗菌肽L-pyrrhocoricin、Drosocin可以降低大肠埃希菌中β-半乳糖苷酶和碱性磷酸酶的表达活性,通过胞内机制发挥抑菌作用[26]。天蚕素A-马盖宁杂合肽作用MRSA后,胞内酶β-半乳糖苷酶和碱性磷酸酶的表达活性均下降,这可能是杂合肽抑制了酶的表达量或抑制了酶的活性中心,以发挥抑菌效果。
抗菌肽死亡素thanath可以通过抑制细菌的呼吸作用导致细菌死亡[18]。也有研究表明,Microcin J25可以改变氧的消耗速率[25]。人唾液抗菌蛋白富组蛋白histatin能够导致白色念珠菌非溶菌性的ATP损失,进而抑制呼吸作用,产生活性氧自由基,最终导致其死亡[27]。MRSA细胞呼吸链在细胞质膜上,前期研究证明天蚕素A-马盖宁杂合肽可以引起细胞膜通透性的改变[7],但杂合肽可以在细胞膜发生破坏之前或同时,通过作用于细胞质膜,破坏质膜上呼吸链电子传递的完整性,阻断内膜上的氧化酶系统氧化磷酸化过程,而抑制细菌的呼吸作用。细菌的呼吸作用可能是细菌代谢过程中抗菌肽发挥抑菌作用的重要靶点,其深入的抑菌机制也将是我们下一步研究的方向。抗菌肽可以通过阻断胞内的多条代谢途径,发挥杀伤作用,从而抑制、杀灭细菌。由于抗菌肽对细菌存在多个作用靶点,使其不易产生耐药性,而有望成为新一代抗菌药物或辅助治疗药物。
天蚕素A-马盖宁杂合肽作用于MRSA后可以抑制细胞DNA、RNA、总蛋白的合成能力,抑制胞内酶的活性和细胞能量代谢功能,通过阻断细菌胞内多条代谢途径,干扰细胞的正常生理代谢,发挥胞内杀伤作用,从而抑制细菌生长、杀灭细菌。
[1] Taitt C R, North S H, Kulagina N V. Antimicrobial peptide arrays for detection of inactivated biothreat agents[J]. Methods in molecular biology, 2009, 570: 233-255.
[2] da Silva B R, de Freitas V A, Nascimento-Neto L G, et al. Antimicrobial peptide control of pathogenic microorganisms of the oral cavity: a review of the literature[J]. Peptides, 2012,36(2):315-321.
[3] Boman H G, Nilsson I, Rasmuson B. inducible antibacterial defense system in Drosophial[J]. Nature, 1972, 237(5352):232-235.
[4] Jenssen H,Hamill P,Hancock R E.Peptide antimicrobial agents[J]. Clinical microbiology reviews,2006,19(3):491-511.
[5] 胡付品,朱德妹,汪复,等.2013年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2014,8(5):365-374.
[6] Wang X Q,Zhu M X,Zhang A J, et al.Synthesis and secretory expression of hybrid antimicrobial peptide CecA-mag and its mutants inPichiapastoris[J]. Experimental biology and medicine, 2012, 237(3):312-317.
[7] 于龙魅,杨田田,王秀青.新型天蚕素A-马盖宁杂合肽对耐甲氧西林金黄色葡萄球菌杀菌作用的机制研究[J].四川大学学报:医学版, 2015,46(2):218-221.
[8] Sarukhanyan E, Milano G, Roccatano D. Cosolvent, ions, and temperature effects on the structural properties of cecropin A-Magainin 2 hybrid peptide in solutions[J]. Biopolymers, 2015,103(1):1-14.
[9] 奥斯伯,金斯顿,赛得曼,等.马学军,舒跃龙,等译.精编分子生物学实验指南(第4版)[M].北京:科学出版社,2002:192-201.
[10]郝刚,施用晖,唐亚丽,等.抗菌肽BuforinⅡ衍生物与大肠杆菌基因组DNA的作用机制[J].微生物学报,2010,50(3):328-333.
[11]Hwang J,Kim Y.RNA interference of an antimicrobial peptide,gloverin, of the beet armyworm, Spodoptera exigua, enhances susceptibility toBacillusthuringiensis[J]. Journal of invertebrate pathology, 2011,108(3):194-200.
[12]刘焕明,孙力军,王雅玲,等.纳豆菌脂肽对金黄色葡萄球菌抑菌机理的研究[J].食品工业科技,2012,33(11):109-112.
[13]周晓辉.β-D-半乳糖苷酶活性测定方法的研究[J].河北工业科技,2004,21(5):16-18.
[14]Kragol G, Lovas S, Varadi G, et al. The Antibacterial Peptide Pyrrhocoricin Inhibits the ATPase Actions of DnaK and Prevents Chaperone-Assisted Protein Folding[J]. Biochemistry,2001,40:3016-3026.
[15]Wu G, Ding J, Li H, et al. Effects of cations and pH on antimicrobial activity of thanatin and s-thanatin againstEscherichiacoliATCC25922 andB.subtilisATCC 21332[J]. Current microbiology, 2008,57(6):552-557.
[16]崔璐璐.ATP生物发光法快速测定天然水体细菌总数的研究[D].上海:华东师范大学,2013.
[17]李冠楠,夏雪娟,隆耀航,等.抗菌肽的研究进展及其应用[J].动物营养学报,2014,26(1):17-25.
[18]苏琦,孙燕,李治,等.抗菌肽对细菌胞内杀伤作用的分子机制[J].中国生物制品学杂志,2010,23(3):325-328.
[19]Brogden K A.Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria?[J].Nature reviews. Microbiology,2005, 3(3):238-250.
[20]Senyürek I,Paulmann M,Sinnberq T, et al. Dermcidin-derived peptides show a different mode of action than the cathelicidin LL-37 againstStaphylococcusaureus[J].Antimicrob Agents Chemother, 2009, 53(6):2499-2509.
[21]Hao G, Shi Y, Tang Y, et al. The intracellular mechanism of action onEscherichiacoliof BF2-A/C, two analogues of the antimicrobial peptide BuforinⅡ[J]. Journal of microbiology, 2013,51(2):200-206.
[22]Subbalakshmi C, Sitaram N. Mechanism of antimicrobial action of indolicidin[J]. FEMS microbiology letters, 1998, 160(1):91-96.
[23]Prado Montes de Oca E. Antimicrobial peptide elicitors: new hope for the post-antibiotic era[J]. Innate immunity, 2013, 19(3):227-241.
[24]Ghosh A, Kar R K, Jana J. Indolicidin targets duplex DNA: structural and mechanistic insight through a combination of spectroscopy and microscopy[J]. ChemMedChem, 2014, 9(9):2052-2058.
[25]Vincent P A, Morero R D. The structure and biological aspects of peptide antibiotic microcin J25[J]. Current Medicinal Chemistry, 2009,16960:538-549.
[26]Chesnokova L S, Slepenkov S V, Witt S N. The insect antimicrobial peptide, L-pyrrhocoricin, binds to and stimulates the ATPase activity of both wild-type and lidless DnaK[J]. FEBS letters, 2004,565(1-3):65-69.
[27]Koshlukova S E, Araujo M W, Baev D, et al. Released ATP is an extracellular cytotoxic mediator in salivary histatin 5-induced killing of Candida albicans[J].Infection and immunity,2000,68(12):6848-6856.
Effect of CecropinA-Magainin Hybrid Peptide in Physiological Metabolism of Methicillin-ResistantStaphylococcusaureus
LIU Er-qiang1, CHEN Xiang-jun2, HUI Li-yuan2, ZHU Ming-xing3, WANG Xiu-qing2
(1.BeijingNorthernHosp.ofWeaponryIndust,Beijing100089; 2.Inst.ofClinic.Lab.ofMed.,3.Sci. &Technol.Ctr.,NingxiaMed.Uni.,Yinchuan750004)
The effect of cecropin A-magainin heterozygous peptide in physiological metabolism of methicillin-resistantStaphylococcusaureus(MRSA) was studied. The effect of DNA, RNA, total protein, β-galactosidase, alkaline phosphatase after the reaction of the heterozygous peptide were determined with holo-wave length ELISA instrument. The respiration of the cell was determined using dissolve oxygen electrode. The variation of the cell ATP production was examined with bioluminescence analyzer. The results showed that the synthetic abilities of DNA, RNA, total protein decreased after treated with heterozygous peptide were inhibited. And the expression ability of β-galactosidase, alkaline phosphatase was significantly inhibited. Therefore, after treated with heterozygous peptide the intracellular synthetic abilities of macro-molecules, the expression activities of intracellular enzymes, and the energy metabolism of the cell was inhibited of biological, and play the inhibition role through intracellular mechanism.
cecropin A-magainin; methicillin-resistantStaphylococcusaureus(MRSA); physiological metabolism; biomacromolecule; antimicrobial peptides
国家自然科学基金项目(31360622)
刘二强 男,硕士研究生。研究方向为临床病原微生物与分子诊断学。E-mail:kku6666@163.com
* 通讯作者。女,博士,硕士生导师。研究方向为临床病原微生物与分子诊断学。Tel:0951-4083334,E-mail:xiuqingwang1979@163.com
2015-09-07;
2015-09-28
Q936
A
1005-7021(2016)05-0044-07
10.3969/j.issn.1005-7021.2016.05.008
