苯肼对实验性脑疟模型DC亚群及功能的影响
2017-01-03冯永辉曹雅明朱晓彤
冯永辉, 曹雅明, 朱晓彤*
(1.中国医科大学附属第一医院 检验科,辽宁 沈阳 110001;2.中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122)
苯肼对实验性脑疟模型DC亚群及功能的影响
冯永辉1,2, 曹雅明2, 朱晓彤2*
(1.中国医科大学附属第一医院 检验科,辽宁 沈阳 110001;2.中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122)
探讨苯肼(Phenylhydrazine,PHZ)对实验性脑疟模型DC亚群及功能的影响。采用伯氏疟原虫(PlasmodiumbergheiANKA,PbANKA)感染C57BL/6小鼠建立实验性脑疟模型,并在感染前第5天和感染第0天进行苯肼处理。动态监测小鼠网织红细胞数量、原虫血症和生存期;采用FACS检测感染后第3天和第5天小鼠脾脏中DC亚群(mDCs和pDCs)及相关功能分子(CD86、MHC II和IL-2)的变化水平。结果显示,PHZ处理能显著升高血液中网织红细胞比例,同时会升高小鼠原虫血症水平,缩短生存期;在感染后第3天和第5天,PHZ处理能促进PbANKA感染小鼠mDCs和pDCs的增殖分化,并能增强MHC II类分子和胞内IL-12的表达水平。PHZ引起的贫血能促进DCs的分化,同时促进功能分子的表达升高来启动适应型免疫应答,促进脑疟发生。
实验性脑疟; 苯肼;树突状细胞
2014年WHO疟疾全球报告[1]指出:在2013年,全球有33亿人受到疟疾威胁,其中1.98亿人发病,约58万人死亡,绝大多数是5岁以下儿童。脑疟(Cerebral Malaria, CM)作为5岁以下儿童死亡的主要原因之一,如果不能有效治疗,死亡率高达89%[2]。尽管CM发生的具体机制仍未完全清楚,但宿主免疫应答的失调在CM发生中发挥重要作用:过度的前炎症免疫应答(包括Th1型细胞因子如IFN-γ和TNF-α)增加血管内皮细胞黏附分子(如VCAM-1、ICAM-1、CD36)的表达[3-4],促进炎性细胞(CD4/CD8+T细胞和中性粒细胞)的聚集和红细胞、血小板的粘附聚集,引起脑组织微血管的堵塞和脑组织缺血,从而诱发中枢神经系统产生一系列症状[5]。而树突状细胞作为桥接宿主固有免疫和适应性免疫应答的重要免疫细胞,在CM中发挥重要作用。伯氏疟原虫(PlasmodiumbergheiANKA,PbANKA)感染C57 BL/6小鼠所建立的实验性脑疟(Experimental Cerebral Malaria, ECM)模型能模拟脑疟发生过程中的宿主免疫应答,有助于研究脑疟的病理进程。苯肼(Phenylhydrazine,PHZ)作为一种网织红细胞(Reticulocyte)诱导剂,能显著增强小鼠网织红细胞数量[6],常用于建立贫血模型。本研究采用PHZ贫血模型和ECM模型来探讨贫血对ECM中树突状细胞(Dendritic Cells,DCs)数量及相关功能分子的变化水平,从而为流行区网织红细胞增多的疟疾患者的治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周龄,雌性C57 BL/6小鼠,购自中国科学院上海实验动物中心;PbANKA由日本爱嫒大学分子寄生虫学教研室惠赠。
1.1.2 主要试剂 苯肼(PHZ,购自Sigma),以下抗体均购自BD Biosciences:FcγⅢ/Ⅱ封闭抗体(clone 2.4G2)、FITC-anti-CD11c(clone HL3)、PE-anti-CD11b(clone H1.2F3)、PE-anti-CD86(clone GL1)、PerCP-anti-CD45R/B220(clone RA3-6B2)、PE-IL-12p40/70(clone C15.6)、APC-anti-MHC II(clone M5/114.15.2)。
1.2 方法
1.2.1 实验模型建立及处理 雌性C57 BL/6小鼠随机分为4组:正常组(NC)、正常对照组(Pb)、Pb+PHZ组和PHZ组。Pb+PHZ组和PHZ组小鼠在感染前第5天和第0天经腹腔注射60 mg/kg PHZ。Pb组和Pb+PHZ组小鼠在第0天分别经腹腔感染1×106PbANKA寄生红细胞,建立ECM模型,NC组小鼠不做任何处理。感染前后不同时间小鼠尾静脉取血,镜检计数网织红细胞数量和细胞感染率,并每日观察生存率。
1.2.2 脾脏流式细胞术 无菌取出感染后第3天和第5天小鼠脾脏,常规方法制备脾细胞悬液,用0.17 mol/L NH4Cl裂解红细胞。以含10%胎牛血清(FCS)的RPMI 1640调整脾细胞终浓度为1×107/mL。每份样品用抗-CD11c-FITC单克隆抗体、抗-CD11b-PE单克隆抗体、抗-CD45R/B220-PerCP、抗-MHCⅡ-APC单克隆抗体进行四色分析,另设阴性对照管。在预先加入FcγⅢ/Ⅱ封闭抗体的流式细胞仪专用染色管中加入脾细胞悬液0.1 mL,再加入抗-CD11c-FITC单克隆抗体、抗-CD11b-PE单克隆抗体、抗-CD45R/B220-PerCP单克隆抗体和抗-MHCⅡ-APC单克隆抗体进行表面染色。离心去上清后,用0.5 mL细胞染色缓冲液重悬浮细胞,流式细胞仪进行检测。每份样品用抗-CD11c-FITC单克隆抗体和抗CD86-PE单克隆抗体进行双色分析,另设阴性对照管。每份样品用抗-CD11c-FITC单抗进行双色分析, 另设阴性对照管。在预先加入FcγⅢ/Ⅱ封闭抗体的流式细胞仪专用染色管中加入脾细胞悬液0.1 mL,按试剂说明书所示,进行固定和透膜后,再分别加入生物素标记的抗-TLR9单抗和PE-streptavidin。在预先加入FcγⅢ/Ⅱ封闭抗体的流式细胞仪专用染色管中加入脾细胞悬液0.1 mL,刺激5 h后,再加入抗-CD11c-FITC单克隆抗体,固定透膜后加入IL-12-PE单克隆抗体,染色30 min。离心去上清后,用0.5 mL细胞染色缓冲液重悬浮细胞,流式细胞仪进行检测。采用FACS Calibur流式细胞仪进行检测,用Flowjo v7.6.2进行分析。
1.2.3 统计学分析 使用SPSS17.0统计软件对数据进行处理,标本采用独立样本t检验比较分析组内和组间均值差异,采用Kaplan-Meyer方法进行生存期分析。P<0.05为显著差异。
2 结果与分析
2.1 PHZ处理对ECM模型小鼠感染率和生存期的影响
如图1所示,PHZ处理后,C57小鼠血液中的网织红细胞会显著诱导网织红细胞的生成,之后会有显著下降,而Pb组小鼠在感染后网织红细胞有轻微上升,随着感染进程会逐渐下降。C57BL/6小鼠在感染PbANKA后,原虫血症随着感染时间不断升高,在感染后第10天达到峰值,Pb组小鼠在感染后第7~10天全部死亡;Pb+PHZ组小鼠感染率在第8天达到峰值,小鼠在感染后第7~8天全部死亡(与Pb组相比,P<0.05)。尽管Pb+PHZ组小鼠死亡时间提前,但与Pb组小鼠生存期相比,无显著性差异(P>0.05)。
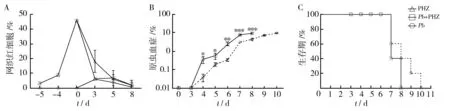
图1 PHZ处理对ECM模型小鼠感染率和生存期的影响Fig.1 Effects of PHZ treatment on the parasitemia and survival rate of C57BL/6 mice infected with Pb ANKA 与Pb组相比,*:P< 0.05,**:P< 0.01,***:P< 0.001,下图同 *, ** and*** represent P< 0.05, P< 0.01 and P< 0.001 compared with Pb group, respectively
2.2 PHZ处理对DC亚群数量的影响
DC在固有免疫和适应性免疫的桥接中发挥重要作用。检测了PHZ处理对ECM模型DC亚群(髓样树突状细胞(myeloid DCs,mDCs)和浆样树突状细胞(plasmacytoid DCs,pDCs))数量的影响。如图2所示,PHZ提前处理能显著增强小鼠脾脏中mDCs和pDCs的比例(与正常鼠相比,P<0.05);在感染后第3天和第5天,PHZ处理能促进Pb ANKA感染小鼠mDCs(P>0.05)和pDCs(P<0.05)亚群的扩增,提示PHZ处理能刺激小鼠脾细胞中DCs的分化。
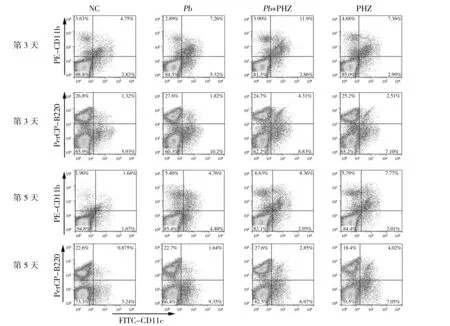
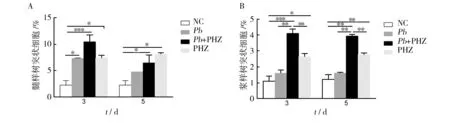
图2 PHZ处理对DC亚群数量的影响Fig.2 Effects of PHZ treatment on DCs subsets of C57BL/6 mice infected with Pb ANKA
2.3 PHZ对DC表面功能分子表达水平的影响
DC表面分子的表达水平对DCs的活化及功能发挥具有重要作用。在感染后第5天检测了DC表面分子MHC II和CD86分子的表达水平。从图3中可以看出,PHZ处理对MHC II类分子的表达没有显著影响,但会增强CD86分子的表达水平。
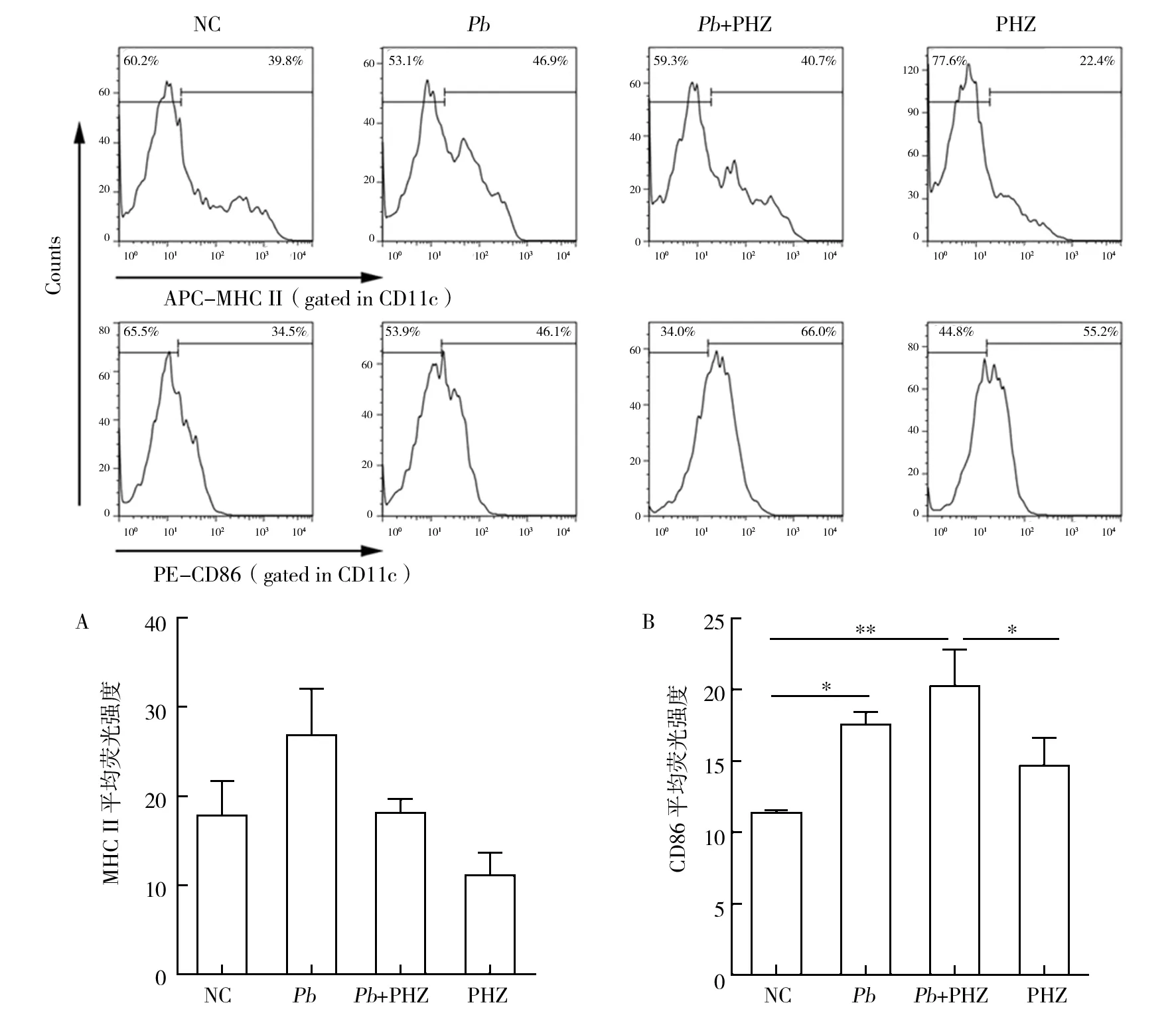
图3 PHZ对DC表面功能分子表达水平的影响Fig.3 Effects of PHZ treatment on DCs functional molecular of C57BL/6 mice infected with Pb ANKA
2.4 PHZ对分泌IL-12的DC影响
从图4中可以看出,在感染后第3天和第5天,PbANKA感染会诱导脾细胞中CD11c+IL-12+DCs升高,但与正常鼠相比,没有显著区别(P>0.05);而PHZ和Pb+PHZ处理均能显著升高宿主脾细胞中CD11c+IL-12+DCs的比例(P<0.05),从而促进DCs的功能活化。

图4 PHZ对分泌IL-12的DC影响Fig.4 Effects of PHZ treatment on DC secreting IL-12 of C57BL/6 mice infected with Pb ANKA
3 讨 论
PHZ作为一种化疗药物,能够破坏红细胞膜,造成红细胞裂解,引起贫血,进而刺激机体血液循环中的网织红细胞数量增加[7]。缺铁性贫血患者给予铁离子补充后也会引起网织红细胞短暂的升高[8-9]。在非洲疟疾流行区,贫血会使疟疾患者原虫血症升高,加重临床重症疟疾的发生[10-11]。本研究中PHZ预处理会显著升高血液中网织红细胞的比例,这为研究缺铁性贫血对脑疟免疫应答的影响提供了一个非常好的实验模型。
DCs在活化T细胞以及随后的适应性免疫应答过程中发挥重要作用,主要有两种亚群,包括mDCs和pDCs[12]。DCs的数量与功能决定Th1免疫应答的强度[13]。MHC II类分子和共刺激分子CD86的表达上调是DCs成熟的标志[14],在ECM模型中,我们发现PHZ处理对DCs表面MHC II类分子的表达水平没有影响,但会显著上调CD86的表达水平,DCs表面的CD86分子表达升高能够启动并活化Th1免疫应答。DCs分泌的IL-12能增强Th1和Th2适应性免疫应答,尤其是Th1型免疫应答的强度[13],从而加重ECM的进程。本研究结果显示PHZ处理能显著增强分泌IL-12的DCs数量。这些结果说明PHZ处理引起的贫血能显著促进DCs的分化并增强DCs的功能,因此推测贫血引起的DCs数量增加和活化会启动Th1免疫应答,从而加重ECM的发生,缩短C57BL/6小鼠的生存期。
综上所述,本研究揭示了PHZ引起的贫血与DCs之间的关系:PHZ引起的贫血能促进DCs的分化,同时促进功能分子的表达升高来启动适应型免疫应答,加重脑疟进程,提示在研发抗疟药物时应考虑贫血对宿主免疫应答的影响。
[1] WHO.World Malaria Report 2014[R].World Health Organiz-ation, 2014.
[2] Bangirana P, Opoka R O, Boivin M J, et al. Severe malarial anemia is associated with long-term neurocognitive impairment[J]. Clin Infect Dis, 2014, 59(3): 336-344.
[3] Wu J J,Chen G,Liu J,et al.Natural regulatory T cells mediate the development of cerebral malaria by modifying the pro-inflammatory response[J]. Parasitol Int, 2010, 59(2): 232-241.
[4] Liu Y,Chen Y,Li Z,et al.Role of IL-10-producing regulatory B cells in control of cerebral malaria in Plasmodium berghei infected mice[J]. Eur J Immunol, 2013, 43(11): 2907-2918.
[5] Villegas-Mendez A, Greig R, Shaw T N, et al. IFN-gamma-producing CD4+T cells promote experimental cerebral malaria by modulating CD8+T cell accumulation within the brain[J]. J Immunol, 2012, 189(2): 968-979.
[6] Cromer D, Evans K J, Schofield L, et al. Preferential invasion of reticulocytes during late-stage Plasmodium berghei infection accounts for reduced circulating reticulocyte levels[J]. Int J Parasitol, 2006, 36(13): 1389-1397.
[7] Mcmillan D C, Powell C L, Bowman Z S, et al. Lipids versus proteins as major targets of pro-oxidant, direct-acting hemolytic agents[J]. Toxicol Sci, 2005, 88(1): 274-283.
[8] Gwamaka M, Kurtis J D, Sorensen B E, et al. Iron deficiency protects against severe Plasmodium falciparum malaria and death in young children[J]. Clin Infect Dis, 2012, 54(8): 1137-1144.
[9] Jonker F A, Calis J C, Van Hensbroek M B, et al. Iron status predicts malaria risk in Malawian preschool children[J]. PLoS One, 2012, 7(8): e42670.
[10]Clark M A, Goheen M M, Fulford A, et al. Host iron status and iron supplementation mediate susceptibility to erythrocytic stage Plasmodium falciparum[J]. Nat Commun, 2014, 5: 4446.
[11]Sangare L, Van Eijk A M, Ter Kuile F O, et al. The association between malaria and iron status or supplementation in pregnancy: a systematic review and meta-analysis[J]. PLoS One, 2014, 9(2): e87743.
[12]Gilliet M, Boonstra A, Paturel C, et al. The development of murine plasmacytoid dendritic cell precursors is differentially regulated by FLT3-ligand and granulocyte/macrophage colony-stimulating factor[J]. J Exp Med, 2002, 195(7): 953-958.
[13]Langhorne J, Albano F R, Hensmann M, et al. Dendritic cells, pro-inflammatory responses, and antigen presentation in a rodent malaria infection[J]. Immunol Rev, 2004, 201: 35-47.
[14]Wykes M N, Liu X Q, Beattie L, et al. Plasmodium strain determines dendritic cell function essential for survival from malaria[J]. PLoS Pathog, 2007, 3(7): e96.
Effect of Phenylhydrazine on DC Subgroup Mechanical Function on Experimental Cerebral Malaria Model
FENG Yong-hui1, 2, CAO Ya-ming2, ZHU Xiao-tong2
(1.Dept.ofMed.Lab,Affil. 1stHosp.ofChinaMed.Uni.,Shenyang110001;2.Teach&Res.Div.Immunol.,Coll.ofBasicMed.Sci.,ChinaMed.Uni.,Shenyang110122)
The effect of phenylhydrazine (PHZ) on DCs’ subgroups and mechanical function in experimental cerebral malaria model was investigated. An experimental cerebral malaria model was established adopted C57BL/6 mice infected withPbANKA and treated with PHZ on d 5 before infection and d 0 on the infection processing. Dynamic monitoring the variation level of reticulocyte number, parasitemia and survival time; DCs’ subgroups (mDCs and pDCs) and related functional molecules (CD86, MHC II and IL-2) in the spleen were detected adopting FACS on d 3 and d 5 post infection. The results showed that PHZ treatment could markedly increase the proportion of reticulocyte in blood, at the same time raise the parasitemia level in mice, shorten the survival time. On d 3 and d 5 after the infection, the PHZ treatment could promote the amplification of mDCs and pDCs, and strengthen the expression levels of MHC II and intracellular IL-12 in thePbANKA infected mice. Therefore, anemia caused by PHZ could promote the differentiation of DCs, at the same time promote the expression of functional molecules to initiate the adaptive immune response, and aggravate the cerebral malaria.
experimental cerebral malaria; phenylhydrazine (PHZ); dendritic cells
国家自然科学青年基金项目(81301455)
冯永辉 男,主管技师。主要从事抗感染免疫研究。E-mail:yonghui_feng@hotmail.com
* 通讯作者。女,副教授,硕士生导师。主要从事抗感染免疫研究。E-mail:zhu.xt918@gmail.com
2016-03-08;
2016-04-12
Q939.91;R392.3+1
A
1005-7021(2016)05-0051-06
10.3969/j.issn.1005-7021.2016.05.009
