TLR4激活剂对约氏疟原虫感染早期免疫应答的影响
2017-01-03吕衍民郁春云曹雅明
吕衍民, 郁春云, 刘 飞, 刘 军, 曹雅明
(中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122)
TLR4激活剂对约氏疟原虫感染早期免疫应答的影响
吕衍民, 郁春云, 刘 飞, 刘 军, 曹雅明*
(中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122)
通过外源性给予LPS,探讨TLR4在疟疾感染早期免疫应答的作用特点及其免疫调节作用。通过Plasmodiumyoelii17XL 感染的BALB/c小鼠建立鼠疟模型并在感染前给予LPS,于感染第0、3和5 天制备脾细胞悬液,通过流式细胞术检测脾细胞悬液中TLR4+DCs和Tregs百分含量;ELISA方法检测脾细胞培养上清中IFN-γ和IL-10水平。结果显示,LPS处理能够显著延长宿主生存期,降低原虫血症水平,同时显著提升脾上清中的IFN-γ水平,降低抑炎性细胞因子IL-10水平。在感染早期,LPS处理可诱导 Th1 型免疫应答的有效建立,明显遏制P.y17XL红内期疟原虫的感染进程。
TLR4;Th1型免疫应答;致死型约氏疟原虫;保护性免疫
疟疾是由疟原虫感染引起的一种严重危害人类健康的寄生原虫疾病,流行于102个国家和地区,每年约有3~5亿疟疾感染病例,100多万人因其死亡,死亡患者多为5岁以下儿童[1-2]。目前迫切需要解决的关键问题是抗疟疾疫苗的研制开发和免疫治疗策略的确定,而明确疟原虫感染引起的保护性免疫应答机制是疟疾疫苗研发的前提。树突状细胞(dendritic cells,DCs)作为机体功能最强的专职抗原递呈细胞,能够活化初始T细胞,连接固有和适应性免疫应答建立。在疟原虫感染早期,DCs可通过分泌IL-12诱导Th1型细胞活化,产生炎症性细胞因子,如IFN-γ,以达到清除疟原虫的目的[3-5];随后Th2型细胞活化,分泌细胞因子辅助B细胞产生特异性抗体,有效清除疟原虫,防止复发和再燃[6-7]。在这一过程中,DCs通过Toll样受体(Toll like receptor,TLR)对于病原相关分子模式(PAMPs)进行识别,向T细胞提呈抗原。其中,TLR4是DCs识别疟原虫抗原的主要模式识别受体,其表达水平或功能状态可能对DCs的活化和功能产生影响。进而干扰DCs对CD4+T细胞不同亚群应答模式的调控作用,影响正常的免疫应答过程。研究显示,TLR4可识别脂多糖(LPS)、酵母甘露聚糖以及热休克蛋白等病原相关的分子模式。LPS是革兰阴性菌细胞壁的主要成分,可作为TLR4的激活剂,通过My88途径诱导炎性细胞因子的产生[8-9]。本研究以Plasmodiumyoelii17XL(P.y17XL)感染BALB/c小鼠建立疟疾感染模型,外源给予TLR4激动剂LPS,诱导DCs活化,观察DCs表面TLR4分子表达水平的变化以及对感染后促炎性和抗炎性细胞因子分泌水平的影响,探讨疟疾感染早期TLR4在保护性免疫应答中的作用。
1 材料与方法
1.1 材料
1.1.1 小鼠疟原虫感染 BALB/c雌性小鼠6~8周龄,购自中国医学科学院实验动物研究所,经腹腔接种1×106个P.y17XL疟原虫寄生的红细胞(日本爱媛大学分子寄生虫学教研室惠赠)。部分正常小鼠于感染前一天分别注射TLR4激动剂LPS。小鼠经尾静脉采血,制备薄血膜,吉姆萨染色,光学显微镜镜检计数红细胞感染率。
1.1.2 脾细胞的培养 杀鼠留取血清,无菌情况取出正常和处理组小鼠的脾脏,采用200目筛网研磨后,用10 mL含10%热灭活小牛胎血清(FCS)的RPMI 1640 培养基制成细胞悬液。收集细胞悬浮液 350×g,室温离心10 min,采用冷藏0.17 mol/L NH4Cl裂解红细胞,RPMI 1640 清洗2次。采用含10% FCS的RPMI 1640将脾细胞终浓度调整至1×107/mL,接种到24孔培养板中,每孔加入 500 μL细胞悬液,设3个复孔,37 ℃温箱培养48 h,收集上清,-80 ℃保存,检测细胞因子。
1.2 方法
1.2.1 细胞因子的检测 采用双抗体夹心ELISA 试剂盒,分别检测脾细胞培养上清中IFN-γ及IL-10的分泌水平。酶标仪测定 450 nm 处OD值。结果以试剂盒提供的标准品绘制标准曲线,应用 SoftMaxPro 4.3.1L s 软件分析,计算细胞因子含量(pg/mL)。
1.2.2 DCs亚群分化与功能分析 抗CDllc-FITC mAb(clone HL3,BD Pharmigen)与TLR4-PE mAb(cloneMTS510,eBioscience)分析TLR4的表达水平。
1.2.3 调节性T细胞(Tregs) 0.1 mL的脾细胞悬液中加入抗CD4-FITC mAb(clone GK1.5,BD Pharmingen)与抗CD25-PE mAb(clone PC61, BD Pharmingen),4 ℃避光染色30 min,细胞经洗涤后,固定透膜1 h,加入抗Foxp3-APC mAb(clone FJK16s, eBioscienc),4 ℃避光染色30 min。上述染色的脾细胞最终经200 μL 2%多聚甲醛PBS溶液固定悬浮,流式细胞分析仪检测,利用FlowJ07.6对数据结果进行分析。
1.2.4 统计学处理 应用SPSS11.5统计学分析软件,Student’st检验和单因素方差分析法比较各组均值的差异性,α=0.05。
2 结果与分析
2.1 LPS处理对小鼠原虫血症水平和生存率的影响
对照组小鼠在感染后3 d原虫血症水平迅速上升高达60%,并于5~8 d左右死亡。与对照组相比,感染前给予LPS的BALB/c小鼠,原虫血症水平缓慢上升,于9~11 d达峰值,在感染后15 d左右开始下降。生存时间明显延长,生存率可达60%以上(图1)。结果表明,外源性给予LPS可显著降低小鼠原虫血症水平并提高生存率。
2.2 LPS处理对感染小鼠脾脏中TLR4+DCs百分率的影响
感染后,对照组和实验组小鼠脾脏中TLR4+DCs表达量均明显增高,其中,LPS处理组显著高于对照组(P<0.01),表明在疟原虫侵入小鼠体内后,作为启动初始T细胞免疫应答的唯一的抗原提呈细胞——DCs发生活化增殖。 经LPS处理后,DCs表达TLR4明显增加(图2)。
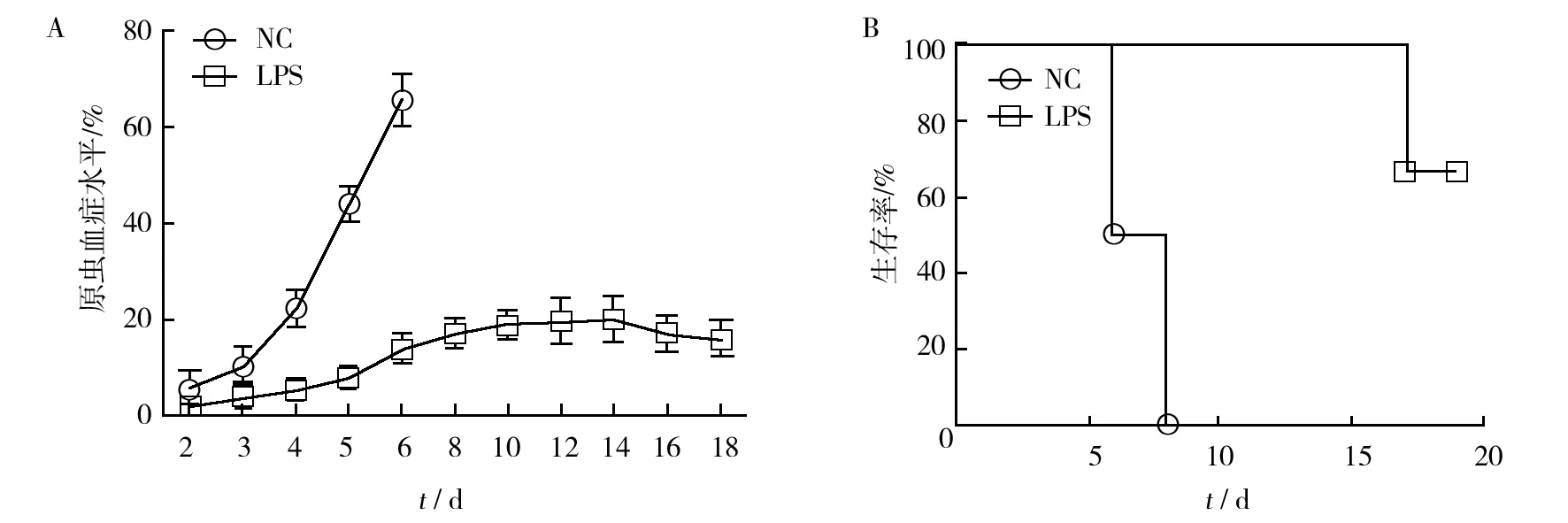
图1 P.y 17XL 感染后不同时间的原虫血症水平(A)和生存率(B)Fig.1 The parasitemia(A) and survival rate (B) at different time points after P.y 17XL infection #:组间数据相比P< 0.05,下图同 #: P <0.05 when compared with the other group,same the follow
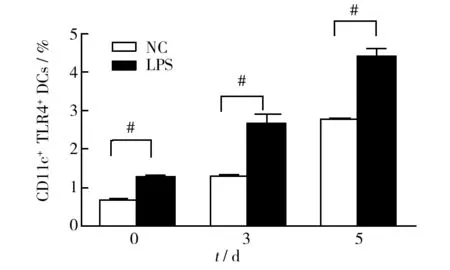
图2 P.y 17XL 感染后不同 时间的TLR4 DCs百分比Fig.2 The percentage of TLR4 DCs at different time points after P.y 17XL infection
2.3 LPS处理对小鼠脾脏中炎症应答的影响
在小鼠感染后第 0、3、5 天,检测LPS组和对照组脾细胞培养上清(图3)中 IFN-γ水平。研究发现,在感染后第3 天,对照组和LPS组脾上清中 IFN-γ水平显著升高,LPS组IFN-γ水平明显高于对照组,具有统计学差异(P<0.01)。在感染后第5 天,对照组与LPS组脾细胞培养上清中 IFN-γ水平同时下降,但LPS组水平仍高于对照组(P<0.01)。实验表明,给予LPS后,感染P.y17XL 的 BALB/C小鼠促炎症性细胞因子显著增加,进而诱导保护性免疫应答的发生。

图3 LPS可增强感染P.y 17XL的BALB/c 小鼠炎症应答Fig.3 LPS enhances pro-inflammatory immune responses in P.y 17XL infected BALB/C mice
2.4 LPS处理对感染疟疾小鼠脾 Tregs和 IL-10 的影响
在鼠疟模型中 Tregs通过分泌 IL-10 对Th1型免疫应答具有抑制作用[16]。因此本实验进一步检测了 Tregs 和 IL-10 的水平。研究发现,对照组在感染后3 d Tregs的百分含量和IL-10的水平明显上升,于第5 天下降,LPS处理组与对照组趋势一致但LPS组Tregs和 IL-10的水平明显低于对照组(图4)。结果表明,LPS处理可显著降低Tregs和 IL-10的水平。

图4 LPS对感染P.y 17XL 的BALB/C 小鼠 Treg 细胞(A)以及脾培养上清中 IL-10(B)的影响Fig.4 Percentage of Treg gated in CD4+ T cells and concentration of IL-10 in spleen culture supernatant at various time points
3 讨 论
TLR作为模式识别受体, 突出的生物学功能是促进细胞因子的合成与释放,引发炎症应答,并且促进抗原提呈细胞的成熟,从而诱导机体的获得性免疫应答[10-11]。本研究结果显示通过外源性给予TLR4激动剂明显延长了小鼠的生存时间,同时降低了原虫血症水平,上调DCs和IFN-γ水平,降低Treg的数量以及IL-10的分泌,从而增强了疟疾感染早期的保护性免疫应答。DCs可以通过TLR识别病原体相关的分子模式,目前在哺乳动物体内共发现13种TLR,其中人类表达有10种。TLR4表达于细胞表面,主要识别一些细菌特有成分,如脂多糖、脂蛋白、肽聚糖等脂类物质。啮齿类动物研究表明,TLR4可识别疟原虫表达的过氧化还原蛋白和糖基磷脂酰肌醇等成分。而LPS作为TLR4的激动剂,可以与TLR4结合,通过MyD88依赖途径和MyD88非依赖途径传导活化信号,从而介导炎症性免疫应答;可以增强DCs吞噬抗原的能力,诱导协同刺激分子,如CD80、CD86和CD40等的表达,可促进DCs分泌IL-12和I型干扰素,诱导DCs的成熟[12-13]。因此,在本研究中给予感染小鼠TLR4激动剂后,可增加DCs表面TLR4的表达,从而利于DCs的成熟和分化。
在感染早期,Th1型细胞免疫应答发挥了极其重要的作用。DCs提呈疟原虫抗原诱导Th1细胞活化,促进IFN-γ等前炎症细胞因子的释放。这在抑制疟原虫的爆发性增殖、控制疟原虫血症水平中发挥了至关重要的作用[12]。因此,在感染早期宿主建立有效的细胞免疫应答是控制疟原虫增殖的关键。在本研究中,给予感染小鼠LPS后,通过促进DCs的活化,进而增强Th1型免疫应答的发生,引起IFN-γ水平的升高。保护性免疫应答的增强,抑制了原虫血症水平的剧增。
Tregs是机体内具有抑制功能的免疫细胞,对Th1型免疫应答和促炎性细胞因子的产生具有抑制作用。在疟疾感染中,可通过接触抑制和分泌抑制性细胞因子如IL-10等发挥负向调控作用,从而促进疟原虫的免疫逃逸[14-16]。我们的研究发现,P.y17XL感染BALB/c小鼠后,LPS组的脾中Tregs百分含量和IL-10水平均低于对照组,进一步表明LPS增强了抗疟原虫的保护性免疫应答。
综上所述,TLR4激动剂可通过促进有效的Th1型免疫应答的建立,对宿主具有保护性免疫作用。TLR家族作为天然免疫系统识别受体,在研究感染性疾病发病机制和临床治疗方面都具有十分重要的意义,可根据需要抑制或增强机体对外界微生物感染的应答能力,以减少感染后的免疫病理损伤。在此基础上也为药物和新疫苗的研发提供了新的理论依据。
[1] WHO, The World malaria report 2014[J]. Geneva: WHO 2015.
[2] Kotlyar S,Nteziyaremye J,Olupot-Olupot P,et al.Spleen volume and clinical disease manifestations of severe Plasmodium falciparum malaria in African children [J].Trans R Soc Trop Med Hyg,2014,108(5): 283-289.
[3] Walther M, Jeffries D, Finney O.C, et al. Distinct roles for Foxp3 and Foxp3 CD4+T cells in regulating cellular immunity to uncomplicated and severe Plasmodium falciparum malaria [J]. PLoS Pathog, 2009,5(4):364.
[4] Wang Q. H. , Liu Y. J. , Liu J. , et al. Plasmodium yoelii: assessment of production and role of nitric oxide during the early stages of infection in susceptible and resistant mice [J].Exp Parasitol, 2009, 121(3):268-273.
[5] Zheng W. , Wang Q. H. , Feng H. , et al. CD4+CD25+Foxp3+regulatory T cells prevent the development of Th1 immune response by inhibition of dendritic cell function during the early stage of Plasmodium yoelii infection in susceptible BALB/c mice [J]. Folia Parasitol(Praha),2009, 56(4): 242-250.
[6] Cella M, Facchetti F, Lanzavecchia A, et al. Plasmacytoid dendritic cells activated by influenza virus and CD40L drive a potent Th1 polarization[J]. Nat Immunol, 2000, 1(4):305-310.
[7] Wykes MN, Good MF. What really happens to dendritic cells during malaria?[J].Nat RevMicrobiol,2008,6:864-870.
[8] Zhu X.T, Pan Y.Y., Li Y., et al. Targeting Toll-like receptors by chloroquine protects mice from experimental cerebral malaria[J]. International Immunopharmacology, 2012,13:392-397.
[9] Komi Gbédandé,Stefania Varani,Samad Ibitokou,et al.Malaria modifies neonatal and early life Toll-Like receptor cytokine responses[J]. Infection and Immunity, 2013,8(81):2686-2696.
[10]W Zheng, Qh wang, Y.J.1iu, et al. Distinct host related dendritic cell responses during the early stage of Plasmodium yoelii infection in susceptible and resistant mice[J].Parasite Immunology, 2010, 3(2):324-334.
[11]Trinchieri G.,Sher A. Cooperation of Toll-like receptor signals in innate immune defence[J].Nat Rev Immunol, 2007, 7(3):179-190.
[12]Gazzinelli RT, Denkers EY. Protozoan encounters with Toll-like receptor signaling pathway:Implications for host parasitism[J].Nat Rev Immunol, 2006, 6(12):895-906.
[13]Lundie RJ. Antigen presentation in immunity to murine malaria[J]. Curt Opin Immunol,2011, 23(1):119-123.
[14]Banchereau J, Steinman RM. Dendritic cells and the control of immunity[J]. Nature,1998, 392:245-252.
[15]Basu M, Maji AK, Chakraborty A, et al. Genetic association of Toll-like-receptor 4 and tumor necrosis factor-alpha polymorphisms with Plasmodium falciparum blood infection levels[J]. Infect Genet Ev,2010,10(5):686-696.
[16]Wojciech L, Ignatowicz L.Tregs strip dendritic cells of CD70 to regulate Th1 differentiation[J].EMBO,2015,34(10):1290-1292.
[17]杨志蕃, 庞维, 杜云婷.L-精氨酸对实验性脑型疟疾的免疫调控机制研究[J].微生物学杂志,2014,34(6): 65-69.
Effect of TLR4 against Early Immune Response duringPlasmodiumyoeliiInfection
LYU Yan-min, YU Chun-yun, LIU Fei, LIU Jun, CAO Ya-ming
(Dept.ofImmunol.,Schl.ofBasicMed.Sci.,ChinaMed.Uni.,Shenyang110122)
The effective characteristics and the role of TLR4 in early immune response and immune regulation were investigated during plasmodium infection by exogenous administration of LPS, Malaria model was established byPlasmodiumyoelii17XL infected BALB/c mice and the LPS was administered prior to the infection. Spleen cell suspension was prepared on day of 0, 3 and 5 after the infection. The percentages of TLR4+DCs and Tregs were detected by flow cytometry. The concentration of IFN-γ and IL-10 were tested by Enzyme-Linked Immuno Sorbent Assay (ELISA). The results showed that LPS treatment could reduce the parasitaemia level and prolong the survival time. At the same time the IFN-γ levels in spleen supernatant were significantly increased and reduced the levels of inflammation-inhibitory cytokines. In the early stages of infection, the treatment of LPS could effectively establish Th1 immune response and significantly contain theP.y17XL infection process during endoerythrocytic stage.
TLR4; Th1 immune response; lethalPlasmodiumyoelii17XL; protective immunity
2011年度高等学校博士学科点专项科研基金项目(20112104110018)
吕衍民 女,硕士。主要从事抗感染免疫研究。E-mail:995740393@qq.com
* 通讯作者。男,教授,博士生导师。主要从事抗感染免疫研究。E-mail: ymcao@mail.cmu.edu.cn
2015-12-28;
2016-02-03
Q939.91;R392
A
1005-7021(2016)05-0057-05
10.3969/j.issn.1005-7021.2016.05.010
