金黄色葡萄球菌超抗原肠毒素临床应用研究进展
2017-01-03胡风庆
胡风庆, 彭 雪
(辽宁大学 轻型产业学院,辽宁 沈阳 110036)
·大家专版·
金黄色葡萄球菌超抗原肠毒素临床应用研究进展
胡风庆, 彭 雪
(辽宁大学 轻型产业学院,辽宁 沈阳 110036)
金黄色葡萄球菌肠毒素(staphylococcal enterotoxins, SEs)是由金黄色萄萄球菌产生的一类典型超抗原(Superantigen, SAg)。与传统抗原不同,超抗原无须经抗原提呈细胞(Antigen presenting cell, APC)加工处理,可直接与主要组织相容性复合体II类分子(Major histocompatibility complex class II molecules, MHC II)及T细胞受体Vβ区(Variable pacts of the T cells receptor, TCR Vβ)特异性结合,极低浓度即可刺激大量T细胞增殖,产生大量有生物学活性的细胞因子(如TNF-α、TNF-β、IFN-γ、IL-2等)和抗肿瘤效应。本文综述了近年来超抗原金葡球菌肠毒素在恶性肿瘤的临床应用、存在问题和解决策略等的进展,针对Trousseau综合征利用超抗原开发新药进行了展望,并介绍了SEC2在临床用于骨病治疗的情况。
超抗原;肠毒素;恶性肿瘤;Trousseau综合征
超抗原(Superantigen, SAg)是一些细菌的外毒素或逆转录病毒的产物,是一类具有多种免疫活性的蛋白分子[1]。根据来源,分为细菌性、病毒性、支原体性和寄生虫性SAg[2-3];根据与宿主关系,分为外源性和内源性SAg,外源性SAg是某些细菌毒素,主要源于金黄色葡萄球菌(Staphylococcusaureus,简称金葡球菌)和链球菌(Streptococcuspyogenes),内源性SAg如鼠类乳腺肿瘤病毒的MLs-1;根据作用细胞类型,分为T细胞和B细胞SAg。
1 金黄色葡萄球菌肠毒素超抗原
金葡球菌所产生的肠毒素(Staphylococcal enterotoxins, SEs)是典型的细菌外毒素SAg,因主要作用于胃肠道,故称为肠毒素。根据血清学特征,SEs可分为A、B、C等10余个毒素血清型,C型又可分为C1、C2和C3三亚型。通常一株金葡球菌产毒株能产生一型或两型以上SEs,在混合型中,常以一型肠毒素为主[4-9]。
研究表明,超抗原SEs在极低浓度(1~10 ng/mL)下即可刺激机体产生强的初次免疫应答反应,激活大量T淋巴细胞(是普通抗原的103~105倍)。这一过程不需抗原提呈细胞(Antigen presenting cells,APC)处理,SAg是以完整蛋白形式与APC膜上主要组织相容性复合体II类分子(Major histocompatibility complex class II molecules, MHC II)和T细胞受体Vβ区(Varibale pacts of the T cells receptor, TCR Vβ)特异性结合,与抗原肽不同,是结合在沟槽外(图1)[10]。此外,对超抗原反应不受MHC II类别限制的T淋巴细胞在大量增殖的同时,会产生有生物学活性细胞因子,如肿瘤坏死因子(TNF-α、TNF-β)、干扰素(IFN-γ)、白细胞介素(IL-2、IL-6和IL-12)等,以及免疫调节和抗肿瘤等药性效应[11-16]。
SEs活化T淋巴细胞,形成的MHC II类分子SEs-TCRVβ复合物可对表达MHC II分子的肿瘤细胞起直接杀伤作用,这被称为超抗原依赖的细胞介导的细胞毒作用(Superantigen dependent cell-mediated cytotoxicity, SDCC )[17-19]。 同时, 对不表达MHC II类分子肿瘤细胞可产生间接作用。被激活的T淋巴细胞所表达的MHC II类分子又可与SEs结合,从而进一步激活其他T淋巴细胞,产生级联放大效应。SDCC是SAg发挥抗肿瘤作用的主要方式。
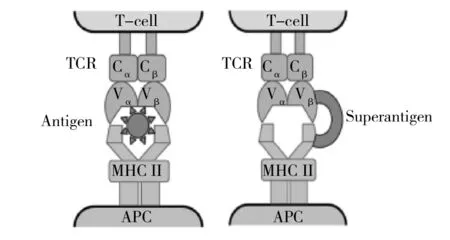
图1 抗原、超抗原与MHC II和TCR 结合差异示意图[10]Fig.1 The difference of antigen and superantigen binding to MHC II and TCR[10]
SAg激活T细胞可分泌多种、大量的细胞因子,包括TNF-α、TNF-β、IFN-γ、IL-2、IL-6和IL-12等。这些细胞因子又进一步激活自然杀伤性(NK)细胞,使其成为淋巴因子激活的杀伤(Lymphokine activated killer, LAK)细胞,杀伤对NK细胞不敏感肿瘤细胞,从而产生LAK样细胞毒作用,抑制肿瘤生长,被称为SAg强化的杀伤(Superantigen argumented killer, SAK)作用。此外,TNF-α、TNF-β和IFN-γ具有明显抗肿瘤作用,TNF-α和TNF-β有协同抗肿瘤效应。IFN-γ和TNF可促进肿瘤细胞表达MHC II类分子及黏附分子,增强SEs抑瘤效果,从而对肿瘤细胞产生直接和间接的杀伤、抑制作用[20]。
除MHC II,SAg激活某些T细胞还需细胞间黏附分子(Intercellual adhesion molecule, ICAM)等共刺激信号的协同才能发挥抗肿瘤作用[21]。
2 超抗原肠毒素抗肿瘤的临床应用
随着分子生物学和免疫学的快速发展,超抗原临床抗肿瘤已成为新的肿瘤免疫治疗模式。正是利用SAg在极微量浓度下即可高效刺激T细胞增殖,产生大量细胞因子和SDCC作用这一特点,沈阳协合公司研制了高聚葡萄球菌素(highly agglutinative staphylococcin, HAS;商品名为“高聚生”),主要成分是SEC2。1996年被批准用于恶性肿瘤的临床治疗,是第一个应用于临床的超抗原类抗肿瘤药物。迄今为止,SEC2已被用于肺癌、食道癌、胃癌、晚期肝癌、大肠癌、血癌、膀胱癌、颈部恶性肿瘤以及难治性自发性气胸等的临床治疗,疗效显著,是一种很有前途的新型肿瘤免疫治疗剂[22]。
大量研究结果表明,SEC2作为超抗原,其独特的抑瘤机制为肿瘤的临床免疫治疗提供了新思路,开辟了新途径,抑瘤效果已得到广泛认同。但在临床应用中发现,其自身存在的一些问题还没有得到有效解决。SEC2作为肠道毒素,可引起食物中毒,伴随着呕吐、引发腹绞痛和严重腹泻,这严重影响了其临床应用[23]。此外,在临床应用中还发现其存在很多问题:①微量SEs即可激活大量T细胞并产生大量、多种细胞因子,应用剂量稍不准确即有可能导致机体免疫调节功能紊乱和一系列慢性疾病发生,如毒素中毒综合征、风湿性关节炎、风湿热、川崎病和非特异性皮炎等;②SEC2只对表达MHC II肿瘤细胞表现良好杀伤作用,对那些不表达或低表达MHC II肿瘤细胞无法产生明显杀伤作用。肿瘤细胞通常表达MHC II阳性率较低,SEC2临床抗肿瘤效果不甚明显,且对表达MHC II正常细胞有杀伤作用;③超抗原反复应用可引起免疫耐受问题;④局部和系统的免疫毒性;⑤使用剂量、疗程及与其他治疗方法的关系尚不清楚,等等。这些亟待解决的问题成为当前超抗原SEs研究热点。
针对SEC2在临床应用中存在问题,生命科学、药学等领域的科学家都在积极地采用不同方法试图解决超抗原临床应用中存在的问题。
2.1 靶向SAg抗肿瘤
化学方法制备的抗结肠癌相关抗原C215和C242的McAb与SEA偶联物,可有效介导T 细胞杀伤MHC II阳性C215或C242阳性结肠癌细胞,而单纯SEA对上述结肠癌细胞只能产生很弱的杀伤作用。但由于McAb与SAg化学偶联物的体内稳定性较差,“弹头”易脱落。人们尝试利用基因重组技术,制备SEA-McAb。重组融合蛋白与C215肿瘤细胞的融合力远大于与MHC II类抗原分子的融合力,形成了融合蛋白与肿瘤细胞单向而牢固的特异结合,消除了受MHC II表达限制的影响,有效地把T细胞导向C215结肠癌细胞并促使其溶解。
将SEA与干扰素-α融合,获得了肿瘤靶向的超抗原,可有效对实体瘤如肾细胞癌和恶性黑色素瘤发挥免疫调节作用[24]。SEC2与抗人表皮生长因子受体 HER-2 单链抗体(scFv-B1)通过短肽连接,构建了融合免疫毒素B-L-SEC2,在体外可特异性抑制HER-2过表达靶细胞SK-Br-3生长[25]。奥曲肽(octreotide,Oct)与SEC2构建的融合蛋白具有靶向胃癌细胞的功能,与SEC2相比,融合蛋白对人胃癌BGC-823细胞生长具有靶向作用和明显的抑制作用[26]。超抗原SEA与跨膜区(transmem-brane, TM) 编码序列融合,得到跨膜型超抗原TM-SEA融合蛋白,这扩大了其对小鼠黑素瘤抗肿瘤作用的范围[27]。SEB与转移生长因子α的第三环(TGFαL3)融合,得到可靶向乳腺癌细胞的融合蛋白。在注射TGFαL3的10~25 d后,14只乳腺癌荷瘤鼠中有5只肿瘤被清除[28]。
2.2 应用超抗原突变体抗肿瘤
超抗原不论单独使用还是锚定在细胞膜上,其抗肿瘤都具有一定的毒副作用,长期使用还会产生相应抗体。人们期望利用定向改造技术,对超抗原蛋白结构进行改造,以提高疗效、减少毒副作用。尽管各超抗原MHC II结合位点不同,但研究突变位点大多选择在MHC II结合位点附近,希望降低超抗原与MHC II结合能力,如SEA D227A等。所获得的各种突变超抗原(包括突变超抗原融合蛋白)毒副作用都有明显降低,表现为MHC II结合力下降了100~1 000倍,对表达MHC II正常细胞损伤明显降低[29-31]。尽管对T细胞激活能力有所降低,但对细胞毒T淋巴细胞(Cytotoxic T lymphocyte, CTL)靶向毒性仍具有良好的作用。
2.3 SEC2减毒突变体抗肿瘤
虽然SEC2引发呕吐的分子机制还不十分明确,但比较一致的观点认为,催吐效应与胱氨酸环和组氨酸有关。因此,研究人员试图利用定点突变技术对SEs实施减毒。Hui等[32]利用基因定点突变技术,对SEC2的Cys93、Cys110和His118分别进行了定点突变,得到的SEC2突变株C110S保持了很好的抗肿瘤活性且不具有催吐活性。Wang等[33]利用基因定点突变技术对SEC2组成胱氨酸环的Cys进行定点突变,也得到类似结果。
2.4 其他方面
Zhang等[34]发现,SEC2突变株活化人T细胞产生的肿瘤坏死因子(TNF-α)可诱导HepG2细胞凋亡。Thamm等[35]发现,含SEA与狗白细胞介素2(IL-2)基因的脂类复合物免疫基因可对狗的自发性软组织肉瘤进行治疗,每周一次,连续12周并逐步提高剂量,治疗后,狗16个软组织肉瘤中,有14个检测到质粒DNA,其中3个有特异性质粒mRNA,表明用含超抗原免疫基因联合治疗有很好的耐受性及抗肿瘤效果;还利用带有异种双功能交叉连接试剂的细菌超抗原修饰肿瘤细胞,取得一定的治疗效果。Xu等[36]构建了anti-Her-2-scFv-SEC2并实现其在大肠埃希菌中的表达。
此外,人们还试图采取一些新方法、新技术减少治疗时的SAg毒性,如纳米粒子包埋SAg给药。这种给药方式使SAg具有良好的抗肿瘤效果和较好的安全性。针对SAg基因疫苗研究也显示,SAg基因疫苗对原发性干细胞癌有较好的免疫增强效果。
2.5 超抗原利用新策略
超抗原抗肿瘤必须设法降低其两方面的毒性:①肠毒活性,即SEs引发的催吐活性;②SEs对MHC II正常细胞的杀伤作用。要从根本上解决SEC2在临床应用中存在的问题和副作用,有必要对SEC2进行针对性改造。改造标准:①对表达MHC II正常细胞的杀伤活力至少降低100~1 000倍(对正常细胞影响降低或者无影响),对肿瘤细胞杀伤应具有选择性;②能利用重组大肠埃希菌进行生产;③可避免超抗原激活全身大量T细胞进而引发疾病的危险。
通过对SEs建模分析和结构比对,人工设计一种具有超抗原活性、分子量更低、不再引发呕吐且可利用重组大肠埃希菌合成的多肽,称之为人工超抗原(man-made superantigen, MMS)。由于肿瘤细胞表面单克隆抗体或受体位点有助于实现对肿瘤细胞的选择性,为此,将依据肿瘤细胞表面特异抗原抗体重链的高度可变区(VH)设计合成单域抗体(single domain antibody, SDA)或其他多肽,如Oct。超抗原用于抗肿瘤的新策略将是利用SDA或其他多肽设计构建人工靶向超抗原(Artificial target superantigen, ATS)。同时,对ATS中MHC II结合附近位点进行定点突变,以获得对表达MHC II正常细胞结合能力降低100~1 000倍、对肿瘤细胞(不论表达MHC II与否)具有选择性杀伤作用且抗肿瘤效果突出的ATS,这一研究正在课题组实验室深入进行中。
3 超抗原肠毒素与Trousseau综合征
由于现代社会节奏快、竞争力强、工作压力大和环境恶化等原因,心脑血管疾病和恶性肿瘤已成为严重危害人类健康的重大疾病。据预测,到2020年全世界癌症发病率将比目前增加50%,且年轻化趋势日益显著。目前,全世界每年约新增癌症患者700万人,我国每年新增150万人。癌症患者每年静脉血栓栓塞(venous thromboembolism, VTE)发生率约1/200,是正常人群的5~6倍[36-40]。美国临床肿瘤学会(ASCO)主席认为:“恶性肿瘤的第一死亡原因是肿瘤本身和肿瘤复发,第二位死因就是血栓”[41-45],因此,临床上把恶性肿瘤相关性血栓称为Trousseau综合征[46-48]。
3.1 恶性肿瘤并发血栓种类
临床研究表明,最容易并发血栓的恶性肿瘤包括急性骨髓细胞性白血病、非霍杰金淋巴瘤、卵巢肿瘤、胰腺肿瘤、肾细胞肿瘤、肝脏肿瘤和腹膜后肿瘤等[49-52]。肾脏和肝脏恶性肿瘤血栓发病率分别为55%和32%,初期肾脏恶性肿瘤血栓发病率为8.8%,初期腹膜后恶性肿瘤血栓发病率为4.7%,初期肝脏恶性肿瘤血栓发病率为2.9%,中期肝脏恶性肿瘤血栓发病率为1.8%[53]。
恶性肿瘤并发血栓栓塞性疾病包括深静脉血栓(Deep venous thlmmbosis, DVT)、门静脉血栓(Portal vein thmrnbosis, PVT)、肺栓塞(Pulmonary embolism, PE)、弥散性血管内凝血(Disseminated intravascular coagulation, DIC)和动脉血栓栓塞(Arterial thromboembolism, AT)、游走性浅表血栓性静脉炎(Migratory thrombophlebitis superficial, MTS)等,其中下肢DVT最为常见[49]。VTE临床表现与DIC不同,VTE常见于恶性实体肿瘤中,DIC常见于血液系统恶性肿瘤。此外,PE检出率为13%~42%,DVT检出率超过50%[54-55]。PE是严重威胁患者生命的一种危重症,致残、致死率高,并发VTE可能导致肿瘤患者死亡率增加2~8倍。75%~90%PE患者血栓栓塞源于下腔静脉,10%~20%血栓栓塞源于上腔静脉。
3.2 恶性肿瘤并发血栓机制
恶性肿瘤并发血栓机制较为复杂多样,肿瘤的发生可能通过多种机制破坏机体平衡,使机体处于“易栓状态”,因此,抗癌治疗、肿瘤细胞释放物等原因都可引起肿瘤并发血栓。
某些抗癌治疗可明显增加恶性肿瘤患者血栓形成风险。恶性肿瘤患者在医院接受化疗和放疗,可诱发嗜中性粒细胞减少症,8%患者出现血栓。虽然目前对于化疗和放疗诱发血栓的机制尚不明确,但可能与抗癌治疗导致血管内皮细胞损伤、维生素K代谢异常、血小板激活、纤溶活性减弱、凋亡肿瘤细胞释放促凝物质等有关[56-57]。此外,肿瘤细胞可通过释放促凝因子,如组织因子(Tissue Factor, TF)、癌促凝物质(cancer procoagulant, CP)和丝氨酸蛋白酶(hepsin),或炎性因子(如IL-1、IL-6、TNF-β)来直接或间接地激活凝血级联反应。炎性因子亦可刺激肿瘤细胞释放更多的促凝因子,加剧血液的高凝状态[58-59]。机体的这种“易栓状态”促进肿瘤细胞生长、转移,形成恶性循环,最终导致血栓形成。
3.3 Trousseau综合征的临床治疗现状
与非肿瘤患者相比,肿瘤患者发生血栓栓塞率和死亡率均有增加,因此预防血栓形成和及时正确治疗血栓栓塞,对延长肿瘤患者生存期有重要意义。
肿瘤患者一旦发生血栓,其治疗方法与普通血栓治疗相比也存在一定的特殊性。肿瘤患者并发血栓或者疑似血栓发生,就应立即进行抗凝治疗。临床常用抗凝药物为普通肝素(UFH)、低分子量肝素(LMWH)、磺达肝素和华法林等。其中,LMWH 目前已成为VTE 患者初始抗凝治疗的首选药物,静脉注射治疗10~14 d,随后过渡到口服华法林3至6个月的维持抗凝治疗。然而,这存在很多问题,如多次使用肝素易产生抵抗作用、肝素易引起血小板减少而不能持续用药[60]、华法林治疗效果较慢,且在给药初期常常出现高凝状态,增加血栓复发率和出血发生率[61]、静脉通路有限难以支持治疗监测等,因此,目前尚无有效药物用于预防和治疗Trousseau综合征[62-66]。
3.4 治疗Trousseau 综合征的双功能蛋白构建
恶性肿瘤患者合并血栓不仅降低患者生存质量、减少生存期,还增加治疗难度。因此,如何为临床提供有效预防和治疗Trousseau综合征的药物备受关注。
金葡球菌能够产生具有广谱抗肿瘤活性的超抗原SEs和具有溶栓活力强、作用专一、过敏反应少、可有效避免出血反应等优点的葡激酶(staphylokinase, Sak)[67]。这给我们以启示,能否利用金葡球菌所特有的两种蛋白研发预防和治疗Trousseau综合征的新药呢?
Hui等[68]通过9-Ala-linker将SEC2和Sak基因连接,利用SOE-PCR方法,成功构建Sak-linker-SEC2和 SEC2-linker-Sak。体外生物学活性分析表明,二者即保持了Sak原有的体外溶栓活性,又保留了PBMC增殖活性和体外抑瘤活性,可明显抑制Hela细胞活性,抑制效果与SEC2基本一致。尽管所获得双功能蛋白具有很好的体外抗肿瘤和溶栓活性,但由于SEC2是潜在肠胃毒素,可引发催吐和严重胃肠反应、双功能蛋白的高分子量会影响生物利用度,限制其通过生物屏障以及His-tag 和 9-Ala-linker易增加免疫原性等问题[69-71],双功能蛋白的临床应用将受到严重制约。
据文献报道,SEC2截短肽可有效刺激T细胞增殖,抑制肿瘤细胞生长[72],删除Sak N端10个氨基酸不影响溶栓活性[73]。为此,Hui等[74]利用PCR构建了低分子量、无催吐反应、无His-tag和无linker的截短双功能嵌合蛋白(Δsec2-ΔSak和ΔSak-Δsec2)。体外生物学活性表明,ΔSak-ΔSEC2和ΔSEC2-ΔSak都具有与SEC2基本相同的PBMC增殖能力和抑瘤活性,且保留了Sak溶栓活性。ΔSak-ΔSEC2和ΔSEC2-ΔSak对胃癌、结肠癌、白血病等均具有抑制作用,在一定范围内,抑瘤率与蛋白浓度成正比。荷瘤小鼠体内抗肿瘤活性分析表明,ΔSak-ΔSEC2和ΔSEC2-ΔSak具有非常好的体内抑瘤活性(结果即将发表)。
由于Oct能与肿瘤细胞表面的生长抑素受体(somatostatin receptor,SSTR)特异性结合,Hui等[26]构建了具有靶向功能的双功能蛋白(OCT-ΔSEC2-ΔSak和OCT-ΔSak-ΔSEC2)。体外生物学活性证明,所构建融合蛋白既保持SEC2超抗原活性,可有效抑制肿瘤细胞生长,同时保持了Sak溶栓活性,且对高表达SSTR肿瘤细胞具有靶向亲和作用。
4 骨科疾病的超抗原治疗
骨折是临床常见疾病,但是骨折的后期治疗相当复杂,手术风险评估(特别是老年患者的手术救治)发现,56.7%骨科老年患者存在不同程度的并发症,术后死亡率为2.1%。 23.3%住院患者术后出现1个及以上并发症,如失血性休克、肺栓塞、心肺功能衰竭、脑血管意外和感染等[75-77],这都是临床难以避免的问题。
骨病患者(如骨折断端、骨不连接处、骨缺损、骨不连等)应用金葡液(主要活性成分是SEC2)治疗,疗效显著[78],局部注射金葡素注射液有利于骨折的愈合[78-88]。金葡液主要通过促进毛细血管增生,改善局部血供、促进成骨细胞分化成熟等两个途径加快骨代谢,促进骨的愈合。SEC2在体外可显著促进成骨细胞的矿化功能,联合应用抗坏血酸则会有更好的成骨作用,具体机制仍不详。此外,SEC2能促进骨髓间充质干细胞向成骨细胞分化和成熟,促进成骨细胞生成,加速骨折愈合[89-92]。因此,SEC2在骨科应用前景广阔,但其机制还有待进一步研究。
综上所述,金葡球菌超抗原SEs具有非常强的免疫调节能力,在临床抗肿瘤等已有深入的应用,尽管还存在一定的问题,但相信随着现代分子生物学等技术的迅速发展,通过对SEs精确改造,利用超抗原SEs针对恶性肿瘤、Trousseau 综合征等疾病开发高效、安全、无毒副作用的生物药物,对实现以T细胞为基础的肿瘤免疫治疗具有一定的推动作用和重要意义。随着对SEC2治疗骨科疾病研究的深入了解,超抗原也必将在骨病治疗中发挥更为重要的作用。
[1] White J, Herman A, Pullen A, et al. The Vβ-specific superantigen staphylococcal enterotoxin: stimulation of mature T cells and clonal deletion in neonatal mice[J].Cell, 1989, 56: 27-35.
[2] Papageorgiou A C,Acharya K R.Microbial superantigens: from structure to function[J].Trends Microbiol, 2000, 8: 369-375.
[3] Liewelvn M, Cohen J. Superantigens: Microbial agents that corrupt immunity[J].Lancet Infect Dis, 2002, 2: 156-162.
[4] Omoe K, Hu D L, Takahashi-Omoe H, et al. Identification and characterization of a new staphylococcal enterotoxin-related putative toxin encoded by two kinds of plasmids[J].Infect Immun, 2003, 71(10): 6088-6094.
[5] Dinges M M, Orwin P M, Schlievert P M. Exotoxins ofStaphylococcusaureus[J].Clin Microbiol Rev, 2000, 13: 16-34.
[6] Jarraud S, Peyrat M A, Lim A, et al. Egc, a highly prevalent operon of enterotoxin gene, forms a putative nursery of superantigens inStaphylococcusaureus[J].J Immunol, 2001, 166: 669-677.
[7] Jarraud S, Mougel C, Thioulouse J, et al. Relationships betweenStaphylococcusaureusgenetic background, virulence factors, agr groups (alleles) and human disease[J].Infect Immun, 2002, 70: 631-641.
[8] Leung D Y M, Meissner H C, Fulton D R, et al. Superantigens in Kawasaki syndrome[J].Clin Immunol Immunopathol, 1995, 77: 119-126.
[9] Ren K, Bannan J D, Pancholi V, et al. Characterization and biological properties of a new staphylococcal exotoxin[J].J Exp Med, 1994, 180: 1675-1683.
[10]Macias E S, Pereira F A, Rietkerk W, et al. Superantigens in dermatology[J].J Am Acad Dermatol, 2011, 64(3): 455-472.
[11]Kotb M. Role of superantigens in the pathogenesis of infectious diseases and their sequelae[J].Curr Opin Infect Dis, 1992, 5: 364-374.
[12]Kotzin B L, Leung D Y, Kappler J, et al. Superantigens and their potential role in human disease[J].Adv Immunol, 1993, 54(1): 99-166.
[13]Schlievert P M. Role of superantigens in human diseases[J].J Infect Dis, 1993, 167(5): 977-1002.
[14]Balaban N, Rassooly A. Staphylococcal enterotoxins[J].Int J Food Microbiol, 2000, 61: 1-10.
[15]Dohlsten M, Hedlund G, Akerblom E, et al. Monoclonal antibody-targeted Superantigens: a different class of anti-tumor agent[J].Proc Natl Acad Sci USA, 1991, 88: 9287-9291.
[16]回晶. 具有潜在治疗Trousseau综合征的双功能融合蛋白构建研究[D]. 沈阳:沈阳药科大学, 2014.
[18]Dohlsten M, Lando P A, Hedlund G, et al. Targeting of human cytotoxic T lymphocytes to MHC class II-expressing cells by staphylococcal enterotoxins[J].Immunology, 1990, 71: 96-100.
[19]Dohlsten M, Sundstedt A, Bjorklund M, et al. Superantigen-induced cytokines suppress growth of human colon-carcinoma cells[J]. Int J Cancer, 1993, 54(3): 482-488.
[20]Matsushita K, Kawabe Y, Ochi A. HLA-DR antigen expression inColorectalcarcinomaas influence of expression by IFN-gamma in situ and its association with tumor progression[J].Br J cancer, 1996, 73: 644-652.
[21]Krakauer T. Costimulatory receptors for the superantigen staphylococcal enterotoxin B on human vascular endothelial cells and T cells[J].J Leukoc Biol, 1994, 56(4): 458-463.
[22]朱正中.高聚金葡素在肿瘤综合治疗中的作用[J].肿瘤防治研究, 1995, 22(6): 33.
[23]Wright A, Andrews P L R, Titball R W. Induction of emetic, pyrexic, and behavioral effects ofStaphylococcusaureusenterotoxin B in the ferret[J].Infect Immun, 2000, 68(4): 2386-2389.
[24]Sundstedt A, Celander M, Hedlund G. Combining tumor-targeted superantigens with interferon-alpha results in synergistic anti-tumor effects[J]. Int Immunopharmacol, 2008, 8: 442-452.
[25]Xu M K, Wang X G, Cai Y M, et al. An engineered superantigen SEC2 exhibits promising antitumor activity and low toxicity[J]. Cancer Immunol Immunother, 2011, 60:705-713.
[26]Hui J, Lin J S, Hu Y, et al. Expression and characterization of bifunctional fusion proteins possessing antitumor and thrombolytic function for targeting therapy[J]. Biotechnol App Biochem, 2016, 62(2): 170-177.
[27]马文学, 余海, 王青青, 等. 跨膜型超抗原金黄色葡萄球菌肠毒素A融合蛋白的抗肿瘤作用[J]. 中国药理学与毒理学杂志, 2003, 17( 6): 426-431.
[28]Yousefi F, Siadat S D, Saraji A A, et al. Tagging staphylococcal enterotoxin B (SEB) with TGFaL3 for breast cancer therapy[J]. Tumor Biol, 2015, 37(4):1-12.
[29]Newton D W, Dohlsten M, Lando P A, et al. MHC class II-independent, Vbeta-specific activation of T cells by superantigen mutants fused to anti-tumor Fab fragments: implications for use in treatment of human colon carcinoma[J].Int J Mol Med, 1998,1(1): 157-162.
[30]Kodama H,Suzuki M,Kaytayose Y,et al.Mutated SEA-D227A conjugated antibody enhance antitumor activity against MUC1-expressing bile duct carcinoma[J].Cancer Immunol Immunother,2001,50(10):539-548.
[31]Takemura S, Kudo T, Asano R, et al. A mutated superantigen SEA D227A fusion diabody specific to MUC1 and CD3 in targeted cancer immunotherapy for bile duct carcinoma [J].Cancer Immunol Immunother, 2002, 51(1): 33-44.
[32]Hui J, Cao Y, Xiao F, et al.Staphylococcusaureusenterotoxin C2 mutants: biological activity assay in vitro [J]. J Ind Microbiol Biotechnol, 2008, 35:975-980.
[33]Wang X G, Xu M K, Zhang H W, et al. Enhancement of superantigen activity and antitumor response of staphylococcal enterotoxin C2 by site-directed mutagenesis[J].Cancer Immunol Immunother, 2008, 58: 677-686.
[34]Zhang G J, Xu M K, Song Y B, et al. TNF-α produced by SEC2 mutant (SAM-3)-activated human T cells induces apoptosis of HepG2 cells[J].Appl Microbiol Biotechnol, 2016, 100:2677-2684.
[35]Thamm D H, Kuraman I D, Macewen E G, et al. Intralesional lipid-complexed cytokin/superantigen immunogene therapy for spontaneous canine tumors[J].Cancer Immunol Immunother, 2003, 52(8): 473-480.
[36]Xu M K, Zhang C G. Gene expression and function study of fusion immunotoxin anti-Her-2-scFv-SEC2 in Escherichia coli [J].Appl Microbiol Biotechnol, 2006, 70:78-84.
[37]RodriguesCA, Ferrarotto R, Filho RK, et al. Venous thromboembolism and cancer: a systematic review[J].J Thromb Thrombolysis, 2010, 30:67-78.
[38]Schulman S, Lindmarker P. Incidence of cancer afterprophylaxis with warfarin against recurrent venous thromboembolism.Duration of anticoagulation trial[J].N Engl J Med, 2000, 342: 1953-1958.
[39]Cook N, Thomas D M. Retrospective survey of unselectedhospital patients with and without cancer comparing outcomesfollowing venous thromboembolism[J].Intern Med J, 2002, 32:437-444.
[40]Lee A Y, Levine M N. Venous thromboembolism and cancer: Risks and outcomes[J].Circulation, 2003, 107: 117-121.
[41]Rickles F R, Falanga A. Molecular basis for the relationship between thrombosis and cancer[J].Thromb Res, 2001, 102: 215-224.
[43]Vestjens J, Sassen S, Prins M H. Blood coagulation and cancer: thrombosis and survival, clinical relevance and impact[J].Pathophysiol Haemo T, 2009, 36: 113-121.
[44]Khorana A A, Francis C W, Culakova E, et al. Risk factors for chemotherapy associated venous thromboembolism in a prospective observational study[J].Cancer, 2005, 104: 2822-2829.
[45]Stein P D, Beemath A, Meyers F A, et al. Incidence of venous thromboembolism in patients hospitalized with cancer[J].Am J Med, 2006, 119: 60-68.
[46]Prandoni P, Piccioli A, Girolami A. Cancer and venous thromboembolism: an overview[J].Haematologica, 1999, 84: 437-445.
[47]Agnelli G, Bolis G, Capussotti L, et al. A clinical outcome-based prospective study on venous thromboembolism after cancer surgery[J].Ann Surg, 2006, 243: 89.
[48]Elting L S, Escalante C P, Cooksley C, et al. Outcomes and cost of deep venous thrombosis among patients with cancer[J].Arch Intern Med, 2004, 164: 1653-1661.
[49]Murchison J T, Wylie L, Stockton D L. Excess risk of cancer in patients with primary venous thromboembolism: a national, populationbased cohort study[J].Br J Cancer, 2004, 91: 92-95.
[50]Ciancio G, Soloway M, Livingstone A S.The increasing use of liver transplantation surgical techniques in the management of renal and nonrenal cancer with or without Inferior vena cava tumor thrombus[J].World J Surg, 2009, 33:1328-1329.
[51]Chen L B, Shen Y, Wu X H, et al. Anatomic and metabolic imaging of venous thromboembolismmimicking thyroid carcinoma extension[J].J Thromb Thrombolysis, 2010, 29:358-360.
[52]White R H, Chew H K, Zhou H, et al. Incidence of venous thromboembolism in the year before the diagnosis of cancer in adults[J].Arch Intern Med, 2005, 165: 1782-1787.
[53]Engelbrecht M, Akin O, Dixit D, et al. Bland and tumor thrombi in abdominalmalignancies: magnetic resonance imagingassessment in a large oncologic patientpopulation[J].Abdom Imaging, 2011, 36:62-68.
[54]Ambrus J L, Ambrus C M, Mink I B, et al. Causes ofdeath in cancer patients[J].J Med, 1975, 6:61-64.
[55]Ogren M, Bergqvist D, Wahlander K, Eriksson H, Sternby NH. Trousseau’s syndrome-what is the evidence? A populationbasedautopsy study[J].Thromb Haemost, 2006, 95:541-545.
[56]Korte W. Cancer and thrombosis: an increasingly important association[J].Support Care Cancer, 2008,16: 223-228.
[57]Sarig G, Michaeli Y, Lanir N, et al. Mechanisms for acquired activated protein C resistance in cancer patients[J].J Thromb haemost, 2005, 3: 589-590.
[58]Hembrough T A, Swartz G M, Papathanassiu A, et al. Tissue factor/factor VIIa inhibitors block angiogenesis and tumor growth through a nonhemostatic mechanism[J].Cancer Res, 2003, 63: 2997-3000.
[59]Amirkhosravi A, Meyer T, Chang J Y, et al. Tissue factor pathway inhibitor reduces experimental lung metastasis of B16 melanoma[J].Thromb Haemost, 2002, 87: 930-936.
[60]Kovacs M J, Kahn S R, Rodger M, et al. A pilot study of central venous catheter survival in cancerpatients using low-molecular-weight heparin and warfarin without catheter removal for the treatmentof upper extremity deep vein thrombosis (The Catheter Study)[J].J Thromb Haemost, 2007, 5: 1650-1653.
[61]Schulman S, Kearon C, Kakkar A K, et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism[J].N Engl J Med, 2009, 361:2342-2352.
[62]Deitcher S R, Carman T L. Deep venous thrombosis andpulmonary embolism[J].Curr Treat Options Cardiovasc Med, 2002, 4:223-238.
[63]Steven R,Deitcher M D. Cancer and Thrombosis: Mechanisms and Treatment[J].J Thromb Thrombolys, 2003, 16: 21-31.
[64]Chen X P, Qiu F Z, Wu Z D,et al. Effects of location and extension ofportal veintumor thrombus on longtermoutcomes of surgical treatmentfor hepatocellularcarcinoma[J].Ann Surg Oncol, 2006, 13:940-946.
[65]Kamiyama T, Nakanishi K, Tahara H Y M, et al. Efficacy of preoperative radiotherapy to portal vein tumor thrombus in themain trunk or first branch in patients with hepatocellular carcinoma[J].Int J Clin Oncol, 2007, 12:363-368.
[66]Liu Z H, Shen F, Yan Z L, et al. Treatment of portal vein tumor thrombus of hepatocellularcarcinoma with percutaneous laser ablation[J].J Cancer Res Clin Oncol, 2009, 135:783-789.
[67]Lack C H. Staphylokinase: An activator of plasma protease[J].Nature, 1948,161: 559.
[68]Hui J, Dai Y J, Bian Y Y, et al. Construction of novel bifunctional chimeric proteins possessing antitumor and thrombolytic activities[J]. J Microbiol Biotechnol, 2012, 22(7): 894-901.
[69]Kenig M, Peternel S, Gaberc-Porekar V, et al. Influence of the protein oligomericity on final yield after affinity tag removal in purification of recombinant proteins[J].J Chromatogr A, 2006, 1101: 293-306.
[70]Arnau J, Lauritzen C, Petersen G E, et al. Current strategies for the use of affinity tags and tag removal for the purification of recombinant proteins[J].Protein Expr Purif, 2006, 48: 1-13.
[71]Wu Z Y, Pan J, Yuan Y, et al. Comparison of prediction models for blood brain barrier permeability and analysis of the molecular descriptors[J].Pharmazie, 2012, 67: 628-634.
[72]Hui J, Xiao F, Li H, et al. The novel truncated staphylococcal enterotoxin C2 mutant inhibit growth of tumor cells[J]. Chin J Biotechnol, 2011, 27(6):891-900.
[73]Schlott B, Gührs K H, Hartmann M, et al. Staphylokinase requires NH2-terminal proteolysis for plasminogen activation[J]. J Biol Chem, 1997, 272: 6067-6072.
[74]Hui J, Yu XJ, Cui XJ, et al. Construction of novel chimeric proteins through the truncation of SEC2 and Sak fromStaphylococcusaureus[J]. Biosci Biotechnol Biochem, 2014, 8(9):1514-1521.
[75]何静, 熊鸿雁, 陈方祥, 等. 4913例急性创伤住院患者输血的调查分析[J]. 重庆医学, 2006, 35(11):984-986.
[76]兰秀夫, 王爱民. Possum评分系统预测骨科高龄患者手术风险的研究进展[J]. 重庆医学, 2008, 37(5):535-538.
[77]兰秀夫, 王爱民, 孙红振, 等.760例骨科老年患者手术风险因素分析[J]. 重庆医学, 2008, 37(5):493-495.
[78]张秀梅. 局部注射金葡液治疗骨折延迟愈合[J].长春中医学院学报, 2003, 7(1):24-27.
[79]应跃斌, 孙红颖, 陈枢青, 等. 金黄色葡萄球菌肠毒素C2中缺口的形成及影响因素的研究[J].浙江大学学报(医学版), 2012, 54(3):505-510.
[80]Wei Z C, Cai D Z, Zhang J F. Repair of bone defect with compound ofcoralline hydroxyapatite porous, fibrin sealant andStaphylococcusaureusinjection[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi, 2003, 17(6):363-366.
[81]梁鹿章, 郭耀兴, 刘勇, 等. 金葡液预防四肢开放性粉碎性骨折骨不连[J].中国骨伤, 2001, 14(2):76.
[82]王晓斌, 罗胡生. 四肢长骨骨不连、骨缺损60 例治疗分析[J].中国医药导报, 2009, (29):153-154.
[83]朱亚军, 李森. Rt联合恩格菲治疗骨转移所致疼痛的效果[J].实用肿瘤杂志, 2004, 19(2): 178-封3.
[84]夏占强. 超抗原se-金葡菌肠毒素的研究进展[J].中国实用医药, 2009, 4(31): 235-236.
[85]刘明, 陈庄洪, 范清宇, 等. 超抗原金黄色葡萄球菌肠毒素A对大鼠骨肉瘤的免疫治疗[J]. 中华实验外科杂志, 2005, 22(2):141.
[86]余建平, 苏云星, 刘芳. 胶原-明胶海绵作为金葡液载体修复骨缺损的实验研究[J].山西医药杂志, 2008, 8(1):26-28.
[87]Tang Y W, Stratton C W.Staphylococcusaureus: an old pathogenwith new weapons[J].Clin Lab Med, 2010, 30(1):179-208.
[88]Ding D, Huang P, Sun H, et al. Identification of protein components and quantitative immunoassay for SEC2 in staphylococcin injection[J].J Pharm Biomed Anal, 2009, 50(1):79-85.
[89]董晨辉, 王子明, 杜全印, 等. 金黄色葡萄球菌肠毒素C2对兔骨髓间充质干细胞增殖和成骨分化的实验研究[J].创伤外科杂志, 2013, 15(5): 444-448.
[90]董晨辉,王子明,王爱民. 金黄色葡萄球菌肠毒素C的骨科应用研究进展[J].创伤外科杂志, 2013, 15(4): 372-374.
[91]万晓晨. 金葡液联合抗坏血酸在骨髓间充质干细胞向成骨细胞分化中的作用研究[D].杭州:浙江大学医学院, 2008.
[92]Fu W M, Zhu X, Wang H, et al. Staphylococcal enterotoxin C2 promotes osteogenesis and suppresses osteoclastogenesis of human mesenchymal stem cells[J].Exprement Cell Res, 2014, 322: 202-207.
Progress in superantigen staphylococcal enterotoxin in clinic
HU Feng-qing, PENG Xue
(CollegeofLightindustry,LiaoningUniversity,Shenyang110036)
The nature of the activity of staphylococcal enterotoxins (SEs) on cells of the immune system puts them in a class of molecules designated as superantigen (SAg). Unlike conventional antigens, they bind to histocompatibility complex (MHC) class II molecules outside the antigen-binding groove and are presented as unprocessed proteins to certain T cells expressing specific T-cell receptors (TCRs) Vβ genes. Very low concentrations of SAg are able to activate an amount of resting T cells, thereby inducing massive cytokine release, including interleukin (IL)-2, interferon (IFN)-γ, and tumor necrosis factor (TNF), which produce significant tumor inhibition in vivo and in vitro. In this paper, recent advances of SAg SEs, including cure of malignant tumors in clinic, existing problems and solving strategies were reviewed. Also, future emphases on utilizing SAg SEs to research and develop novel drugs, which will be used to cure Trousseau syndrome were discussed. Finally,clinical appliacation of SEC2 in orthopedics was also introduced.
Superantigen (SAg); staphylococcal enterotoxins (SEs); malignant tumors; Trousseau syndrome
沈阳市科技局创新专项(F13-219-9-00);辽宁省自然科学基金项目(2013020169);沈阳市科技局平台建设项目专项资金资助
胡风庆 男, 博士,教授,硕士生导师。主要从事于生物制药及食品领域的研究与开发工作。 E-mail:hfqing@lnu.edu.cn
2016-08-29
胡风庆,男,博士,教授。现任辽宁大学轻型产业学院副院长、院学术委员会副主任、辽宁大学农产品质量安全检测中心主任、硕士研究生导师。长期从事微生物制药、生物材料、新食品及食品质量安全等领域的研究与开发工作。曾作为访问学者,赴美国农业部东区研究中心(2008至2009年)和日本东京工业大学(2012)访问学习。先后主持国家、省部级、市级和企业等课题30余项,荣获各级政府奖励7项。国内外发表论文40余篇,参与出版译著《生物高分子》第3a卷一部,申请发明专利18项,授权专利5项,转让专利3项。现任辽宁省微生物学会常务理事、辽宁省预防医学会致病微生物专业委员会委员、辽宁省食品科学技术学会常务理事、辽宁省食用菌产品流通业协会常务理事及副秘书长、国家农药兽药残留及海洋生物毒素检测重点实验室技术领衔专家、铁岭出入境检验检疫局技术专家、《沈阳药科大学学报》编委、《微生物学杂志》编委,省市经济与信息化委员会工业项目评审专家。
Q939.9
A
1005-7021(2016)05-0001-08
10.3969/j.issn.1005-7021.2016.05.001
