抗菌肽Lfcin15-Me8 分子设计及对老年呼吸道致病菌铜绿假单胞菌的抑菌性能分析
2017-01-03赵春雨赵晓宇袁海峰郑艳贺
赵春雨, 赵晓宇, 李 响, 袁海峰 , 郑艳贺
(1.哈尔滨医科大学 附属第四医院,黑龙江 哈尔滨 150001;2.黑龙江省科学院 自然与生态研究所,黑龙江 哈尔滨 150040;3.黑龙江省科学院 高技术研究院,黑龙江 哈尔滨 150020;4.黑龙江省科学院 微生物研究所,黑龙江 哈尔滨 150010)
抗菌肽Lfcin15-Me8 分子设计及对老年呼吸道致病菌铜绿假单胞菌的抑菌性能分析
赵春雨1, 赵晓宇3,4*, 李 响1, 袁海峰2, 郑艳贺1
(1.哈尔滨医科大学 附属第四医院,黑龙江 哈尔滨 150001;2.黑龙江省科学院 自然与生态研究所,黑龙江 哈尔滨 150040;3.黑龙江省科学院 高技术研究院,黑龙江 哈尔滨 150020;4.黑龙江省科学院 微生物研究所,黑龙江 哈尔滨 150010)
探讨人工设计合成的Lfcin15-Me8分子对老年病患者中铜绿假单胞菌抑菌活性研究。从老年病患痰液中分离鉴定铜绿假单胞菌(Pseudomonasaeruginosa)感染情况,截取牛乳铁蛋白素(LfcinB)1-15和蜂毒素(Melittin)1-8核心氨基酸序列,固相合成新型抗菌肽分子,采用微量肉汤稀释法,测定新型抗菌肽分子对临床分离菌株的抑菌活性。结果显示,铜绿假单胞菌占院内感染的32.2%,位列致病菌第二位。合成的新型抗菌肽分子Lfcin15-Me8,为阳离子型抗菌肽,并富含α-螺旋。对临床铜绿假单胞菌抑菌MIC值均达到128 μg/mL以下,其中最低达到32 μg/mL,具有良好抗菌活性。铜绿假单胞菌在老年呼吸道感染中占较大比重,需注意防控,人工合成的Lfcin15-Me8分子可抑制临床铜绿假单胞菌的生长繁殖。
老年病;呼吸系统;铜绿假单胞菌;抗菌肽
目前,感染性疾病是全球第二致死的疾病[1],铜绿假单胞菌可导致患者发生呼吸道感染,甚至导致患者死亡[2]。铜绿假单胞菌出现的多重感染,临床治疗极为困难[3],研发区别于传统抗菌机制的药物,来控制微生物耐药性的问题迫在眉睫[4]。2009年全球销售的抗生素比过去5年年均增长4%[5],抗生素滥用,耐药菌株不断涌现,而新抗生素的发现却越来越少[6-7]。抗菌肽(AMPs)是保守的具有天然免疫功能的活性分子[8-9],具有靶向作用细胞的特殊杀菌机制[10-12],使微生物更难产生耐药性。因此,抗菌肽具有替代传统抗生素成为新一代抗菌物质的潜力[13]。牛乳铁蛋白活性多肽(Lfcin B)是Bellamy等从牛乳铁蛋白酶解后产物中分离的多肽,其抗菌活性比牛乳铁蛋白高400多倍[14-15]。蜂毒素(Melittin)是含有26个氨基酸的抗菌肽,有广谱的抗菌活性[16-17]。将已知抗菌肽的氨基酸组成进行相应的取代和缺失,以及应用不同抗菌肽保守核心序列杂交构建新型抗菌肽是一种有效提高抗菌肽生物活性的方法[18-19]。本研究截取了LfcinB和Melittin的核心序列,构建了新型抗菌肽,并验证其对老年呼吸道铜绿假单胞菌的抑制活性,为抗菌物质的筛选提供参考。
1 材料与方法
1.1 材料
2015年1月至2015年10月,以哈尔滨医科大学附属第四医院老年病病房65~95岁年龄区间患者为目标,采集痰液98例。
1.2 方法
1.2.1 抗菌肽设计 根据牛乳铁蛋白素与蜂毒素的核心区氨基酸序列组成,选取牛乳铁蛋白素(Lfcin B)的1~15 位氨基酸和蜂毒肽(Melittin)的1~8位氨基酸,将牛乳铁蛋白素(Lfcin B)C端的A(丙氨酸)与蜂毒素(Melittin)N端的R(精氨酸)进行连接,设计一种新型杂合肽分子,分子定名为Lfcin15-Me8,分子序列为FKCRRWQWRWKKLGARLKVLTTG。前15个氨基酸为LfcinB的部分分子组成,后8个氨基酸为蜂毒素部分氨基酸序列。利用生物信息学软件ProtParam(http://us.expasy.org/tools/prot-param.html)计算杂合肽分子的分子量、电荷数、等电点以及α-螺旋含量等指标,并利用Psipred软件(http://bioinf.cs.ucl.ac.uk/psipred/)进行抗菌肽二级结构的预测。
1.2.2 抗菌肽的合成与鉴定 杂合肽序列提交吉尔生化(上海)有限公司进行化学合成。合成后的杂合肽通过反相高效液相色谱(RT-HPLC)鉴定其纯度并通过ESI-MS测定合成杂合肽蛋白分子量,色谱检测条件参考文献[16]进行检测。通过ddH2O溶解稀释合成后的抗菌肽Lfcin15-Me8,0.22 μm 滤器过滤保存[20]。
1.2.3 病原菌菌株的分离和鉴定 菌株分离鉴定方法参考文献[21]进行操作。
1.2.4 抗菌肽抑菌性能测定 采用微量肉汤稀释法[22]测定Lfcin15-Me8的MIC值。将目标菌接种于MHA培养基中过夜培养活化。用MHB培养基将测试菌的过夜培养物稀释至2×105~7×105cfu/mL。将稀释好的目标菌分别加到含有抗菌肽的96孔细胞培养板的1孔至11号孔中,每孔100 μL,12 号孔加入100 μL 新鲜MHB培养基作为空白对照。将溶解后的抗菌肽进行2倍系列稀释(2 560、1 280、…、10、5 μg/mL),加入96孔细胞培养板中的1至10号孔中,每孔11 μL,11号孔不加抗菌肽,作为阳性对照。37 ℃摇床120 r/min恒温培养18 h,在490 nm波长检测吸光值。吸光值比11号孔低50%以上的孔内杂合肽浓度定义为该肽对该测试菌的MIC值。
2 结果与分析
2.1 抗菌肽设计与合成
设计的杂合肽Lfcin15-Me8由23个氨基酸组成如表1所示,其中含有赖氨酸、精氨酸各4个,含有亮氨酸、色氨酸各3个,含有苏氨酸、甘氨酸各2个,含有结氨酸、半胱氨酸、丙氨酸、苯丙氨酸、谷氨酰胺各1个。通过生物信息学软件工具ProtParam计算获得了杂合肽基本分子性质信息如表2所示。杂合肽分子质量为2 918.5 u,带有8个正电荷,等电点为12.2,含有12个α-螺旋,α-螺旋占二级结构的65.22%。通过对设计杂合肽理化性质、二级结构等方面的预测及推断显示,设计的杂合肽Lfcin15-Me8分子属于典型的α-螺旋阳离子型抗菌肽,符合抗菌肽的一般结构特征,具备成为优质抗菌肽的潜力。并用Psipred软件对杂合肽蛋白进行二级结构预测,结果如图1所示。
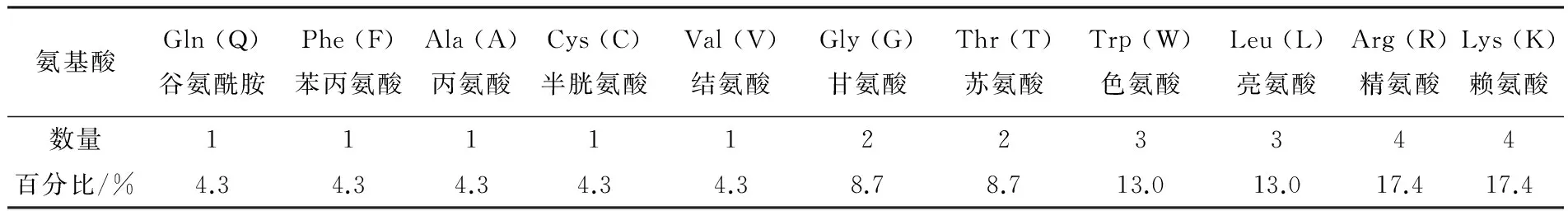
表1 Lfcin15-Me8分子氨基酸所占比例Table 1 Amino acid ratio of Lfcin15-Me8

表2 杂合肽的分子性质Table 2 Molecular characters of the hybrid peptide Lfcin15-Me8
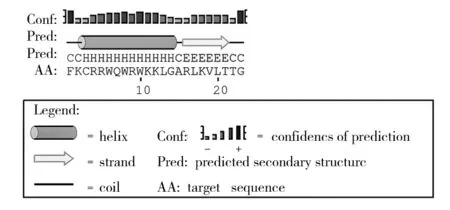
图1 Lfcin15-Me8的二级结构预测Fig.1 Secondary structure prediction of Lfcin15-Me8
为保证合成的杂合肽纯度,利用RT-HPLC对其纯度进行分析。采用C18柱进行测定,Lfcin15-Me8的纯度用RP-HPLC在ASB-C18柱(150 mm×4.6 mm,5 μm),预平衡的0.1%三氟乙酸(TFA)来确定。洗脱液-A(含0.1% TFA的乙腈溶液),在26 min内线性地从22%提高到47%,而洗脱液-B为含有0.1% TFA的水溶液,检测波长为220 nm。纯度检测结果如图2所示,可见合成的杂合肽在26 min内全部洗脱下来,主峰出现在13与15 min之间,为13.793 min,并且整个检测过程几乎没有其他多余的杂峰,仅在9.190 min和11.076 min时刻出现两个小杂峰。由峰面积计算,合成纯化的Lfcin15-Me8纯度达到95%以上,为98.89%,纯度很高,完全能够满足抗菌活性测定的要求。如图3所示,合成的Lfcin15-Me8蛋白经质谱检测,测定合成的杂合肽的分子质量为2 981.57 u,检测结果与设计之初杂合肽的理论分子质量2 981.5 u的数值基本一致,因此证明所合成的Lfcin15-Me8杂合肽氨基酸序列与设计序列完全相同。
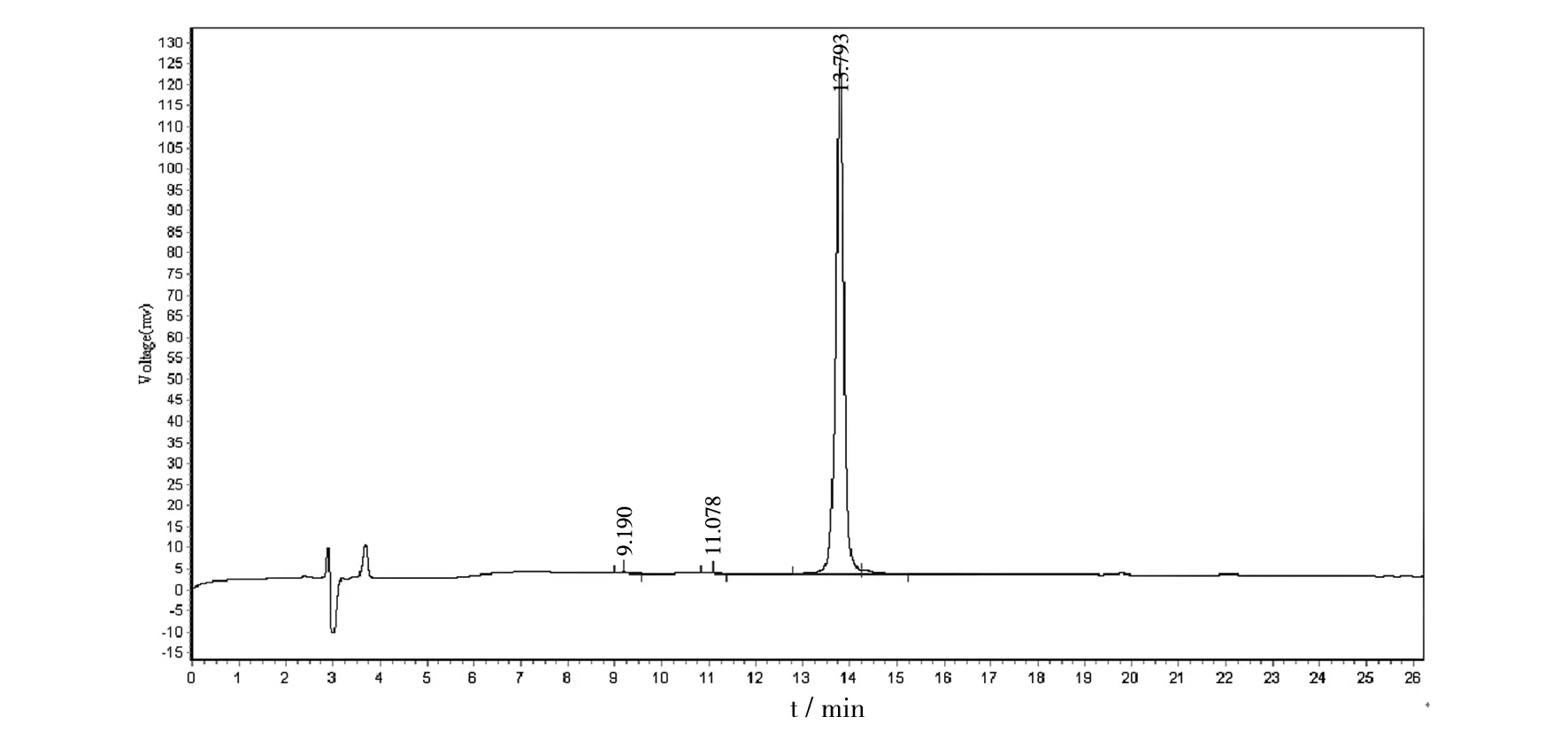
图2 Lfcin15-Me8分子RP-HPLC分析图Fig.2 Analysis of Lfcin15-Me8 purity by RP-HPLC
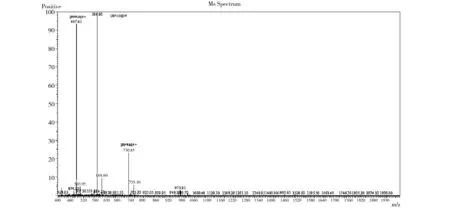
图3 Lfcin15-Me8分子质谱检测图Fig.3 Molecular weight analysis of Lfcin15-Me8 by ESI-MS
2.2 铜绿假单胞菌病原菌分离分布情况
2015年1月至2015年10月共计10个月期间,从65~95岁98例老年病患者的痰液样品中共分离出病原细菌115株。其中主要分离获得肺炎克雷伯菌42株,占36.5%;铜绿假单胞菌37株,占32.2%;鲍曼不动杆菌18株,占15.7%;金黄色葡萄球菌11株,占9.6%。将分离获得铜绿假单胞菌保藏编号分别为TL1~37。菌株分布具体情况见表3。
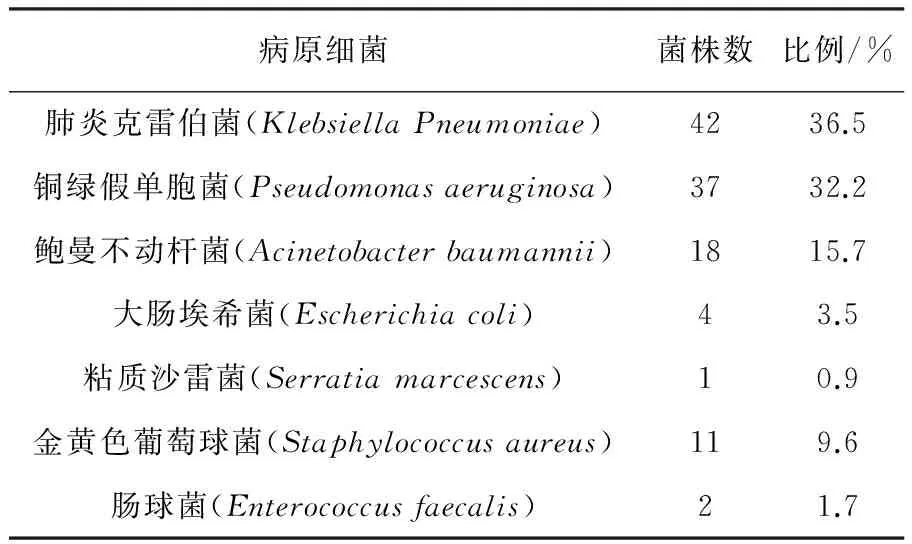
表3 病原菌分布情况Table 3 Distribution of pathogenic bacteria
2.3 抑菌活性测定
利用微量肉汤稀释法测定Lfcin15-Me8对临床分离获得的37株铜绿假单胞菌进行MIC测定。试验结果表明,随着抗菌肽浓度的增加,分离获得的37株铜绿假单胞菌的生长均受到不同程度的抑制。根据MIC的定义,测得Lfcin15-Me8对所分离的铜绿假单胞菌抑制程度有所区别,其中1、8、10、29、32号菌株的MIC值达到32 μg/mL,占所分离菌株的13.51%。而5、21、25、27号菌株为128 μg/mL,占分离菌株的10.81%。其余菌株MIC值为64 μg/mL,占75.68%。绝大多数菌株的MIC值维持在这一水平。

表4 杂合肽对铜绿假单胞菌MIC值Table 4 The MICs of Lfcin15-Me8 on the tested strains
3 讨 论
呼吸道感染在老年人感染性疾病中最为常见,也是主要死亡原因。由于铜绿假单胞菌繁殖能力强,对生长条件要求低,是引起院内感染的主要病原菌,老年人住院治疗后加大其感染的几率,尤其肺部感染最为常见广泛,因此成为最凶险的并发症[23-26]。本研究在呼吸道感染的老年患者中所分离到的铜绿假单胞菌排在致病菌的第二位,占32.2%。可见,铜绿假单胞菌的感染占较大的比重,若在特定条件下爆发,将极大威胁老年人健康。铜绿假单胞菌耐药机制包括药物作用靶位的改变、酶的修饰钝化作用、外膜通透性降低、主动泵出作用等。铜绿假单胞菌携带一种或几种耐药基因均可造成对抗生素的耐药性[27],急需进行新型抗菌物质的筛选研究。
随着对抗菌肽结构、功能与杀菌机理研究的深入,人们开始尝试设计杀菌活力更强、抗菌谱更广的新型抗菌肽。杂合肽的设计主要是基于结构与功能关系,通过一系列生物信息学方法,定向改造或全新设计,将两种或多种抗菌肽的部分肽链杂合以获得具有高抗菌活性、低溶血性、低细胞毒性的新型多肽[28-29]。结构决定其功能的发挥,研究表明:阳离子性、疏水性、α-螺旋结构、肽链长度、端基结构、自组装抗菌肽纳米形貌等是影响其功能发挥的主要因素。目前对抗菌肽进行分子设计策略主要体现在:一是改变抗菌肽天然构效[30];二是改变α-螺旋结构域及其带的正电荷量、肽链长度,增强肽链的两亲性质[31]。另外就是将不同抗菌肽分子杂合获得新型抗菌肽分子、提高抗菌肽活性[32]。有报道天蚕素A-马盖宁杂合肽对革兰阳性菌和革兰阴性菌均具有良好的抑菌作用[33]。
本研究以哈尔滨医科大学附属第四医院老年病房中罹患呼吸道感染患者的痰液为研究对象,所分离获得的铜绿假单胞菌占32.2%的比重,排在各类致病菌的第二位。将LfcinB(1~15)的氨基酸和Melittin(1~8)氨基酸连接起来,设计一种新的抗菌肽分子Lfcin15-Me8,利用生物学软件分析预测其分子性质与结构特征。利用固相合成与高效液相色谱及质谱检测技术,获得了高纯度的Lfcin15-Me8蛋白。其对老年呼吸系统致病菌铜绿假单胞菌具有抑菌活性,最高达到32 μg/mL。本研究为研究开发新型抑菌活性抗菌肽分子提供了新的研究思路,但杂合肽Lfcin15-Me8的结构、生物学功能、构效关系、抗菌机制、以及其他生物学功能等方面还需进一步的研究。抗菌肽分子可以在细菌细胞质膜上穿孔而形成离子孔道,引起膜通透性增加而致细胞快速死亡。也可通过其他机制发挥抗菌作用,包括①抑制细胞呼吸作用;②抑制蛋白的合成;③干扰DNA的合成等。目前,抗菌肽作用机制的研究还没有一个定论,但形成细胞膜通道被认为是抗菌肽的最主要作用途径,Lfcin15-Me8分子的抗菌机制推测也与其有关。
[1] Lam, K.S.New aspects of natural products in drug discovery[J]. Trends Microbiol,2007,15(6): 279-289.
[2] 范珊红.医院感染现患率调查及危险因素分析[J].中国感染控制杂志,2013,12(5):351-355.
[3] 姚芬,王佩芬,彭青,等.汕头地区耐亚胺培南铜绿假单胞菌耐药分析[J].四川生理科学杂志,2009,31(1):4-6.
[4] Carlet J, Pulcini C, Piddock LJ. Antibiotic resistance:a geopolitical issue[J].Clin Microbiol Infect,2014,20(10):949-953.
[5] Hamad, B.The antibiotics market[J]. Nat. Drug Discov. Rev,2010,9(9): 675-676.
[6] Freire-Moran L, Aronsson B, Manz C, et al.Critical shortage of new antibiotics in development against multidrug-resistant bacteria-time to react is now[J]. Drug Resist Updat,2011,14(2):118-124.
[7] Aoki W,Kuroda K,Ueda M.Next generation of antimicrobial peptides as molecular targeted medicines[J]. J Biosci Bioeng,2012,114(4):365-370.
[8] Zasloff M.Antimicrobial peptides of multicellular organisms[J].Nature,2002,415(6870):389-395.
[9] Boman H G. Peptide antibiotics and their role in innate immunity[J]. Annu Rev Immunol,1995,13:61-92.
[10]Schneider T, Kruse T, Wimmer R, et al.Plectasin,a fungal defensin,targets the bacterial cell wall precursor Lipid II[J]. Science,2010,328(5982):1168-1172.
[11]Mihajlovic M,Lazaridis T.Antimicrobial peptides bind more strongly to membrane pores[J]. Biochim Biophys Acta,2010,1798(8):1494-1502.
[12]Andra J, Jakovkin I, Grotzinger J,et al.Structure and mode of action of the antimicrobial peptide arenicin[J]. Biochem J,2008,410(1):113-122.
[13]Pálffy R, Gardlík R, Behuliak M,et al.On the physiology and pathophysiology of antimicrobial peptides[J]. Mol Med,2009,15(1-2): 51-59.
[14]赵晓宇,冯兴军,孟利强,等.抗菌肽Lactoferricin B的原核表达及其纯化[J].东北农业大学学报,2001,41(9):67-71.
[15]Wakabayashi H,Uchida K,Yamauchi K,et al.Lactoferrin given in food facilitates dermatophytosis cure inguinea pig models[J]. J Antimicro Chemothera,2000,46(4):595-601.
[16]冯兴军,李静,赵晓宇,等.牛乳铁蛋白素-马盖宁杂合抗菌肽的设计、合成及抑菌活性[J].东北农业大学学报,2011,42(3):105-109.
[17]G. Kreil, H. Bachmayer, Biosynthesis of melittin, a toxic peptide from bee venom. Detection of a possible precursor[J].Eur J Biochem,1971,20(3):344-350.
[18]Park SC, Kim JY, Shin SO,et al.Investigation of toroidal pore and oligomerization by melittin using transmission electron microscopy[J].Biochem Biophys Res Commun,2006,343(1):222-228.
[19]Kim YM,Kim NH, Lee JW,et al.Novel chimeric peptide with enhanced cell specificity and antiinflammatory activity[J]. Biochem Biophys Res Commun, 2015,463(3):322-328.
[20]Sarukhanyan E, Milano G, Roccatano D. Cosolvent, ions, and temperature effects on the structural properties of cecropin A-Magainin 2 hybrid peptide in solutions[J]. Biopolymers, 2015,103(1): 1-14.
[21]刘鸿翔,南勇,石斌.慢性阻塞性肺疾病急性加重期合并呼吸衰竭患者的痰病原菌学分析[J].实用医学杂志,2013,29(8):1347-1349.
[22]Andrews JM.Determination of minimum inhibitory concentrations[J].J Antimicrob Chemother, 2001, 48(Suppl) 1:5-16.
[23]陈慧清,周春莲.医院感染现患率与医院感染管理[J].临床和实验医学杂志,2013,12(19):1565-1569.
[24]胡春华.2010-2012年医院感染现患率调查[J].中国感染控制杂志,2013,9(12):370-372 .
[25]陈海滨,周光.呼吸科病房铜绿假单胞菌耐药性分析[J].中国药业,2008,17(23):47-48.
[26]刘荣华,马建伟.老年下呼吸道感染患者铜绿假单胞菌耐药性分析[J].当代医学,2010,16(34):28-29.
[27]杨启文,徐英春,陈民钧,等.2005 年中国十五家教学医院院内获得革兰阴性病原菌耐药性分析[J].中华医学杂志,2007,87(39):2753-2758.
[28]S. Ji, W. Li, L. Zhang, et al.Cecropin A-melittin mutant with improved proteolytic stability and enhanced antimicrobial activity against bacteria and fungi associated with gastroenteritisinvitro[J].Biochem Biophys Res Commun, 2014,451(4):650-655.
[29]张庆华,王青.抗菌肽的活性机制及其分子设计研究进展[J].中国畜牧兽医,2014,41(5):163-166.
[30]Sawai MV,Waring AJ, Kearney WR,et al.Impact of single-residue mutations on the structure and function of ovispirin/novispirin antimicrobial peptides[J].Protein Eng,2002,15(3):225-232.
[31]Nadal A,Montero M,Company N,et al.Constitutive expression of transgenes encoding derivatives of the synthetic antimicrobial peptide BP100:impact on rice host plant fitness[J]. BMC Plant Biol,2012,12(1):159.
[32]Jenkins RJ,Dotson GD.Dual targeting antibacterial peptide inhibitor of early lipid abiosynthesis[J].ACS ChemBiol,2012,7(7):1170-1177.
Molecular Design of Antimicrobial Peptide Lfcin15-Me8 and Its Inhibition Performance Analysis on Respiratory Tract PathogenicPseudomonasaeruginosain Senile
ZHAO Chun-yu1, ZHAO Xiao-yu3, 4, LI Xiang1, YUAN Hai-feng2, ZHENG Yan-he1
(1. 4thAffil.Hosp.HarbinMed.Uni.,Harbin150001; 2.Inst.ofNat. &Ecol.HelongjiangProv.Acad.ofSci.,Harbin150040; 3.Inst.ofHi-Tech.HelongjiangProv.Acad.ofSci.,Harbin150020;4.Inst.ofMicrobiol.HelongjiangProv.Acad.ofSci.,Harbin150010)
Antibacterial activity of artificially designed, synthesized antimicrobial peptide (AMP) Lfcin15-Me8 againstPseudomonasaeruginosaisolated from geriatric patients was investigated. Infection status ofP.aeruginosaisolated and identified from sputum of geriatric patients was carried out. A novel antimicrobial peptide (AMP) Lfcin15-Me8 was designed base on cut-out core amino acid sequence of bovine lactoferricin (Lfcin 1-15) and mellitin (mellitin 1-8), and obtained by solid phase synthesis. The inhibition activity of the novel AMP molecule on clinical isolated strains was determined adopting trace broth dilution method. The results showed that the specific gravity of infection within the hospital ofP.aeruginosaaccount for 32.2%, located at the second place among the pathogens. The synthetic novel AMP molecule Lfcin15-Me8 was classified as cationic AMP and rich in α-helix. The minimum inhibition concentration (MIC) against clinicalP.aeruginosawas all below 128 μg/mL, among them the lowest was at 32 μg/mL, possessing fine antibiotic activity.P.aeruginosaoccupied fairly high specific gravity among respiratory tract infection in geriatric patients, it needs prevention and control, the artificial synthetic Lfcin15-Me8 could inhibit the growth and propagation of clinicalP.aeruginosa.
geriatric disease; respiratory system;Pseudomonasaeruginosa; antimicrobial peptides
黑龙江省教育厅基金面上项目(12541402)
赵春雨 女,副主任医师,硕士。主要从事老年病防治临床研究。E-mail:zhaochunyu856@sohu.com
* 通讯作者。男,副研究员,硕士。主要从事抗菌肽的生物技术研究。Tel:0451-84613825,E-mail:zhao1612@163.com
2016-06-06;
2016-06-17
Q939.93;R453
A
1005-7021(2016)05-0062-06
10.3969/j.issn.1005-7021.2016.05.011
