芦竹素对人前列腺癌细胞系细胞凋亡及bcl-2/bax表达的影响
2017-01-03陈大可
陈大可
芦竹素对人前列腺癌细胞系细胞凋亡及bcl-2/bax表达的影响
陈大可
目的:研究芦竹素对人前列腺癌细胞系LNCap细胞凋亡的影响及其作用机理。方法:取对数生长期的LNCap细胞,分别用不同浓度的芦竹素处理48 h后,用MTT细胞增殖法检测细胞活力,Hoechst染色观察细胞形态学变化,流式细胞仪检测细胞凋亡和周期,并用Western blot检测LNCap细胞中Bcl-2和casepase家族蛋白表达情况。结果:芦竹素能以剂量依赖性方式降低LNCap细胞的活力,浓度为20、40、80 μg/mL的芦竹素作用LNCap细胞48 h后,细胞凋亡率分别增加至11.3%、25.2%、57.1%,明显高于对照组(0.5%);不同浓度的芦竹素处理LNCaP细胞48 h后,G0/G1期细胞的比例增加,而G2/M期和S期的比例减少;芦竹素处理组LNCap细胞Cleaved-caspase 3及Cleaved-caspase 9表达量增加,同时促凋亡蛋白Bax表达量增加,而抗凋亡蛋白Bcl-2表达量降低,且呈剂量依赖性。结论:芦竹素能抑制LNCap细胞增殖并诱导其凋亡,其作用机制与上调Cleaved-Csepase 3,Cleaved-Casepase 9和Bax表达、下调Bcl-2的表达有关。
前列腺癌;芦竹素;凋亡;Bcl-2家族蛋白
前列腺癌是男性泌尿系统最常见的恶性肿瘤之一,近年发病率上升并呈年轻化的趋势[1]。前列腺癌治疗的传统模式为外科手术加术后局部或全身的放疗,但无论是手术技术和方法的改善或放射治疗设备和技术的进步,都没有显著提高前列腺癌患者的五年生存率。在临床上前列腺癌的药物治疗主要用于不能手术治疗或晚期患者的姑息治疗,现有化学药品如氟他胺片等对前列腺癌的临床疗效并不理想[2],因此从天然产物中寻找抗癌活性成分是近年来研究的热点[3-5]。
芦竹素是中药白茅根中特有的五环三萜类化合物(其化学结构如图1所示)[6],其生物活性研究较少。本研究旨在明确芦竹素对前列腺癌LNCap细胞活力、凋亡及与细胞凋亡有关的半胱氨酸天冬氨酸蛋白酶家族和Bcl-2家族蛋白表达的影响,为揭示芦竹素的抗肿瘤活性、作用机理以及临床应用前景提供扎实的理论依据。

图1 芦竹素的化学结构
1 材料与方法
1.1 材料 芦竹素购于上海羽朵生物科技有限公司(纯度≥95%);人前列腺癌细胞系LNCap细胞购于中国科学院上海细胞库;细胞培养所用的胎牛血清、青霉素、链霉素购于美国Invitrogen公司;细胞培养液RPMI1640购自上海元龙生物技术有限公司;噻唑蓝(MTT)试剂盒购于上海哈灵生物科技有限公司;Hoechst 33258核酸染料购自北京泛博生化有限公司;AnnexinV-FITC/PI细胞凋亡检测试剂盒与细胞浆蛋白抽提试剂盒购于上海元龙生物技术有限公司;半胱氨酸天冬氨酸蛋白酶(caspase)活性检测试剂盒购于上海华雅思创生物科技有限公司;Bcl-2、Bax、casepase-3、casepase-9、GAPDH等抗体均购于上海哈灵生物科技有限公司;DMSO及其它化学试剂(分析纯)购于北京试剂厂。
1.2 方法
1.2.1 细胞培养 LNCap细胞培养于为含100 U/mL青霉素、100 μg/mL链霉素、10%胎牛血清的PMI 1640培养液中。细胞培养箱条件:37℃,5%CO2,湿度饱和。取对数生长期的细胞用于实验。
1.2.2 细胞活力抑制实验 取浓度为1×105/mL的LNCap细胞,接种于96孔板,每孔200 μL,继续培养至贴壁后实验组每孔分别加入终浓度为20、40、60、80、100、120 μg/mL的芦竹素,以同体积PMI 1640培养液为空白对照孔。每一浓度下均设置6个复孔,继续培养48 h后,以MTT法检测细胞活力。
1.2.3 Hoechst 33258染色法检测细胞形态学变化
取浓度为1×105/mL的LNCap细胞,接种于96孔板,每孔200 μL,细胞贴壁后,分别加入终浓度为20、40、80 μg/mL的芦竹素,以同体积PMI 1640培养液为空白对照,继续培养48 h后,以磷酸盐缓冲液清洗2次,先加入4%多聚甲醛室温下固定15 min,以磷酸盐缓冲液清洗2次,再加入1 mmol/L Hoechst 33258室温下染色15 min,封片,置于荧光显微镜下,在波长340 nm处观察。
1.2.4 细胞凋亡及细胞周期的检测 取浓度为1× 106/mL的LNCap细胞,接种于6孔板,待细胞贴壁后加入终浓度分别为0、20、40、80 μg/mL的芦竹素培养48 h,细胞经过离心、固定后,加入Annexin V-FITC和PI,过滤后送流式细胞仪进行细胞凋亡及细胞周期的检测。
1.2.5 细胞内蛋白表达量的检测 LNCap细胞培养和处理同1.2.4。收集细胞,按照试剂盒说明书的方法提取胞浆总蛋白、测定浓度行Western blot分析。主要步骤如下:LNCap细胞用预冷的PBS洗涤三次,用变性裂解液将细胞在冰上裂解30 min,收集裂解液离心20 min,取上清,测定并调整蛋白浓度。将蛋白样品95℃水浴15 min,使蛋白质充分变性后于相应泳道中加入相同体积的样品分别进行12%的SDS-聚丙烯酰胺凝胶电泳。电泳后将蛋白电转至预先用甲醇活化的PVDF膜上。之后用5%(w/v)脱脂奶粉4℃封闭2~3 h,加入用封闭液稀释好的一抗4℃孵育过夜。经TBST洗3次,每次10 min后, PVDF膜用封闭液稀释好的二抗室温孵育1 h后,洗涤,在膜上滴加ECL发光液在暗室中进行X光胶片曝光。以GAPDH作为内参来比较目的蛋白Bcl-2、Bax、casepase-3,casepase-9含量。所有实验均重复三次。
1.3 数据统计 SPSS 19.0软件进行数据分析,计量数据用平均数±标准差±s)表示,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 芦竹素对LNCap细胞增殖的影响 用不同浓度的芦竹素处理LNCap细胞48 h,可以降低LNCap细胞的活力,且表现出剂量依赖性(图2)。
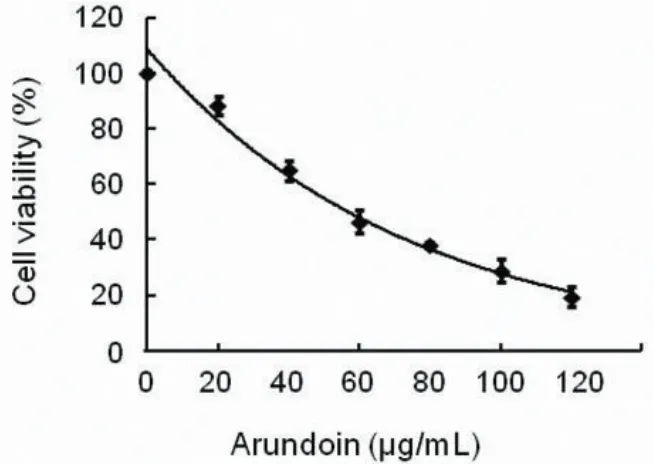
图2 芦竹素处理48 h后对LNCap细胞生长的抑制率
2.2 芦竹素对LNCap细胞形态的影响 Hoechst 33258核酸染料是一种非嵌入性细胞核复染剂,活细胞或固定细胞均可从低浓度溶液中摄取该染料,从而使细胞核着色。显微镜下可见Hoechst 33258在与dsDNA结合后激发蓝色的荧光。Hoechst 33258染色结果显示:经不同浓度的芦竹素处理后,LNCap细胞核浓缩聚集、碎裂,发出蓝色荧光,且呈浓度依赖性(图3)。由于Hoechst 33258具有膜通透性,因此正常细胞和凋亡细胞均可被Hoechst 33258着色,但是正常细胞核染色后为淡蓝色,形态呈圆形;而凋亡细胞的细胞核呈亮蓝色,碎片状。经过芦竹素处理后,LNCap细胞内蓝色荧光明显增强,这说明芦竹素使细胞膜的通透性增加,细胞出现凋亡现象。

图3 Hoechst33258染色显示芦竹素可引起LNCap细胞凋亡(×200)
2.3 芦竹素对LNCap细胞的凋亡作用 通过Annexin V-FITC和PI染色,我们发现芦竹素能诱导LNCap细胞凋亡。如图4所示,20、40、80 μg/mL的芦竹素处理LNCap细胞48 h后,细胞凋亡比例(早期凋亡+晚期凋亡)分别为(11.3±2.6)%、(25.2± 6.4)%、(57.1±6.1)%,明显高于对照组凋亡率(0.5± 0.1)%,且诱导凋亡的作用具有明显浓度依赖性。
2.4 芦竹素对LNCap细胞周期的影响 如表1所示,LNCap细胞经过不同浓度芦竹素(20、40、80 μg/ mL)处理48 h后,G0/G1期细胞比例增加,而G2/M期与S期细胞比例减少。其中,80 μg/mL芦竹素处理后,G0/G1期细胞比例由48.02%大幅度增至75.44%(P<0.01),而S期细胞比例由37.73%降低至20.82%(P<0.01),G2/M期细胞比例由14.36%降低至3.17%(P<0.01)。结果说明芦竹素使LNCap细胞周期阻滞在G0/G1期,正常的细胞增殖周期被抑制。

图4流式细胞术Annexin V-FITC和PI双染色显示芦竹素可诱导细胞凋亡

表1 芦竹素处理后LNCap细胞周期的变化
2.5 芦竹素对LNCap细胞内caspase家族蛋白表达量的影响 如图5所示,未用芦竹素处理的LNCap细胞中cleaved caspase-3、cleaved caspase-9表达量很低。而经过芦竹素(浓度分别为20、40、80 μg/ mL)处理48 h后,LNCap细胞cleaved caspase-3、cleaved caspase-9表达量呈浓度依赖地增加。
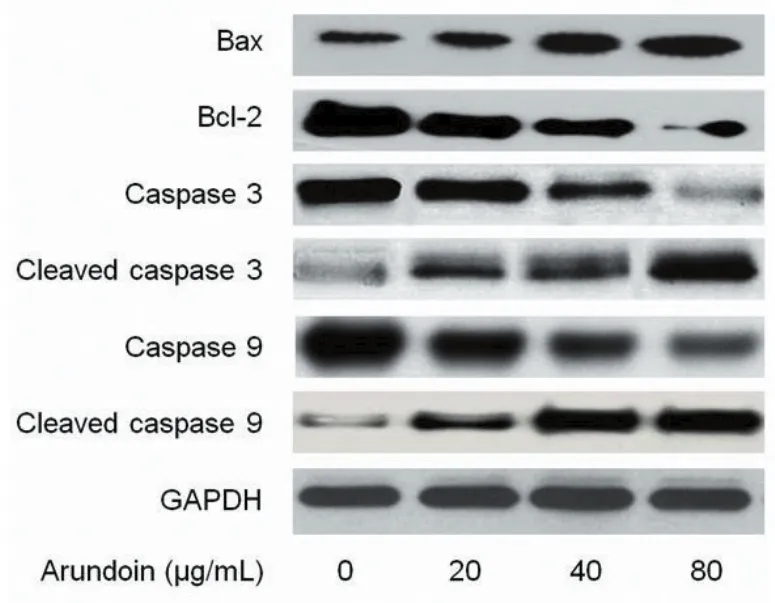
图5 芦竹素对LNCap细胞中与细胞凋亡相关的蛋白表达量的影响
2.5 芦竹素对LNCap细胞Bcl-2家族蛋白表达量的影响 如图5所示,芦竹素处理LNCap细胞48 h后,随着芦竹素浓度的升高,促凋亡蛋白Bax的表达量增加,而抗凋亡蛋白Bcl-2的表达量下调。因此芦竹素处理后的细胞中Bcl-2/Bax的比例显著降低。
3 讨论
前列腺癌过去一直被认为是西方人特有的癌症,其发病率和死亡率居西方社会老年男子的前一、二位。但是随着平均寿命的提高和检查设备的进步,近年来国内的病例也呈迅速增加的趋势[7]。中药白茅根具有凉血止血,清热利尿的功效,临床用于冶疗血热吐血,衄血,尿血,热病烦渴,肺热咳嗽,胃热呕吐,湿热黄疸,水肿尿少,热淋涩痛,是泌尿系统疾病的常用药之一[8-9]。近年来对白茅根的化学成分研究主要集中在五环三萜类化合物上,其中芦竹素是代表性的化合物,但是对其生物活性特别是抗肿瘤活性的研究较少[4]。本文首次报道了芦竹素对前列腺癌细胞的作用及其可能的作用机理。
细胞凋亡是细胞维持稳定的内部环境的机制之一,诱导肿瘤细胞凋亡已成为抗肿瘤研究的热点,也是评价抗癌药物有效性的重要指标之一[10-11]。本研究发现芦竹素在20~120 μg/mL浓度范围能剂量依赖地降低人前列腺癌LNCap细胞的活力,且通过流式细胞术发现芦竹素处理LNCap细胞48 h后可诱导细胞凋亡,且显著量效关系。
caspase家族蛋白是一组存在于细胞质中的半胱氨酸蛋白酶,它们的一个重要共同点是活性位点都含有半胱氨酸,并特异地断开天冬氨酸残基后的肽键。caspase家族蛋白的激活被公认为是诱发凋亡的直接效应物[12-13]。本研究发现,芦竹素剂量依赖性地增加LNCaP细胞中caspase-3和caspase-9活性的表达和活化的caspase-9和caspase-3裂解。caspase-9裂解可能参与细胞凋亡的启动、caspase-3裂解可能参与细胞凋亡的执行,他们可以降解poly ADP-ribose polymerase(PARP),导致DNA修复和DNA降解的抑制作用。本研究结果表明,芦竹素可能通过增强caspase的活性,抑制细胞增殖,促进细胞凋亡。
Bcl-2蛋白家族是一个特殊的蛋白家族,成员中有一些(如Bad、Bid、Bax)可以促进细胞凋亡,有些成员(如Bcl-2、Bcl-w)则可以阻止细胞产生凋亡。Bcl-2是一种内膜蛋白,在多种肿瘤细胞中表达,可以阻止细胞色素C的释放,增强线粒体膜电位,抑制钙离子释放,阻止核酸内切酶活化,进而发挥抗凋亡作用;Bax的作用与Bcl-2相反,可促进细胞色素C的释放,激活细胞凋亡效应因子caspase,改变细胞膜通透性进而促进细胞凋亡[14-15]。细胞中Bcl-2和Bax比例的改变可调节细胞凋亡,本研究发现经过芦竹素处理48 h后,抗凋亡蛋白Bcl-2表达下调,而促凋亡蛋白Bax表达上调,因此Bcl-2与Bax的比值增加,这与芦竹素的凋亡作用是正相关的。
综上所述,芦竹素能以剂量依赖性方式抑制LNCap细胞增殖并诱导细胞凋亡,其作用机制可能与上调Bax蛋白表达并下调Bcl-2蛋白表达,活化caspase-3和caspase-9有关。本研究为临床应用芦竹素及白茅根制品治疗前列腺癌提供了新的线索。
[1]Capogrosso P,Salonia A,Briganti A,et al.Postprostatectomy Erec⁃tile Dysfunction:A Review[J].World J Mens Health,2016,34(2): 73-88.
[2]Nakai Y,Tanaka N,Anai S,et al.A Randomized Control Trial Comparing the Efficacy of Antiandrogen Monotherapy:Flutamide vs.Bicalutamide[J].Horm Cancer,2015,6(4):161-167.
[3]Gee A,Challapalli A,Bahl A.Health-related quality of life in men with metastatic castration-resistant prostate cancer[J].Expert Rev Pharmacoecon Outcomes Res,2015,15(6):941-949.
[4]Amin AR,Kucuk O,FR Khuri,et al.Perspectives for cancer pre⁃vention with natural compounds[J].J Clinical Oncol,2009,27 (16):2712-2725.
[5]Gullett NP,Amin A,Bayraktar S,et al.Cancer prevention with nat⁃ural compounds[J].Semin Oncology,2010,37(3):258-281.
[6]Nishimoto K,Ito M,Natori S,et al.The structure of arundoin,the triterpene methyl ether from Imperata cylindrica var.media and Arundo conspicua[J].Tetrahedron Lett,1965,27(7):2245-2251.
[7]Stephan C,Jung K,Ralla B.Current biomarkers for diagnosing of prostate cancer[J].Future Oncol,2015,11(20):2743-2755.
[8]Keshava R,Muniyappa N,Gope R,et al.Anti-Cancer Effects of Imperata cylindrica Leaf Extract on Human Oral Squamous Carci⁃noma Cell Line SCC-9 in Vitro[J].Asian Pac J Cancer Prev, 2016,17(4):1891-1898.
[9]Zhou XR,Wang JH,Jiang B,et al.A study of extraction process and in vitro antioxidant activity of total phenols from Rhizoma Im⁃peratae[J].Afr J Tradit Complement Altern Med,2013,10(4): 175-178.
[10]Hackshaw-McGeagh LE,Perry RE,Leach VA,et al.A systematic review of dietary,nutritional,and physical activity interventions for the prevention of prostate cancer progression and mortality[J].Can⁃cer Causes Control,2015,26(11):1521-1550.
[11]Wang Y,Nie F,Ouyang J,et al.Inhibitory effects of sea buck⁃thorn procyanidins on fatty acid synthase and MDA-MB-231 cells [J].Tumor Biol,2014,35(10):9563-9569.
[12]García de la Cadena S,Massieu L.Caspases and their role in in⁃flammation and ischemic neuronal death.Focus on caspase-12[J]. Apoptosis,2016,21(7):763-777.
[13]Balaşescu E,Ion DA,Cioplea M,et al.Caspases,Cell Death and Diabetic Nephropathy[J].Rom J Intern Med,2015,53(4):296-303. [14]Kollek M,Müller A,Egle A,et al.Bcl-2 proteins in development, health,and disease of the hematopoietic system[J].FEBS J,2016, 283(15):2779-2810.
[15]Gross A.BCL-2 family proteins as regulators of mitochondria me⁃tabolism[J].Biochim Biophys Acta,2016,1857(8):1243-1246.
(收稿:2016-09-26 修回:2016-10-20)
(责任编辑 张淑坤)
Effects of Arundoin on Cell Apoptosis and Expression of Bcl-2/Bax in Prostate Cancer Cells
CHEN Da-ke
Department of Urinary Surgery,Wenzhou Municipal People’s Hospital,Wenzhou(325000),China
Objective To explore the effect of arundoin on cell apoptosis in human prostate cancer LNCap cells and the mechanism.MethodsLNCap cells were treated with arundoin in different concentration.The relative cell viabilities were determined by the MTT method,the morphological changes of cells were observed using Hoechst 33258 staining,and the apoptosis and cell cycle were analyzed by flow cytometry.At thesame time,the protein expressions of Bcl-2,Bax,caspase-3 and caspase-9 were detected by Western blot.Re⁃sultsArundoin(20-120 μg/mL)significantly inhibited the viabilities of LNCap cells in a dose-dependent man⁃ner.Hoechst 33258 staining showed that arundoin increased the membrane permeability of LNCap cells.Flow cy⁃tometry results showed that arundoin could induce apoptosis in LNCap cells,the apoptotic ratios were 11.3%(20 μg/mL),25.2%(40 μg/mL),57.1%(80 μg/mL),significantly higher than that of control group 0.5%(0 μg/mL). After different concentrations of arundoin treatment for 48 h,the proportion of LNCap cells in G0/G1 phase was increased,while the proportion of the G2/M phase and S phase were reduced.In 80 μg/mL arundoin treatment group,the proportion of cells in G0/G1 phase was increased significantly.The data of Western blot showed that arundoin(20,40,80 μg/mL)up-regulated the expression levels of cleaved caspase-3,cleaved caspase-9,and Bax,but down-regulated Bcl-2,in a dose-dependent manner.ConclusionArundoin could inhibit the prolif⁃eration of LNCap cells and promote apoptosis,which may be associated with the down regulation of Bcl-2 ex⁃pression and up regulation of Bax expression,as well as the increase of relative activity of caspases.
Prostate cancer;arundoin;apoptosis;Bcl-2 family protein
R329.2+5;R737.25
A
1007-6948(2016)06-0575-05
10.3969/j.issn.1007-6948.2016.06.016
温州市人民医院泌尿外科(温州 325000)
陈大可,E-mail:cdk11777@163.com
