非肥胖多囊卵巢综合征患者的代谢评估
2016-12-28殷冬梅阮祥燕AlfredOMu
殷冬梅+阮祥燕++Alfred+O+Mueck

[摘要] 目的 研究非肥胖多囊卵巢综合征(PCOS)患者的临床特征及糖脂代谢的特点。 方法 选择2014年11月~2016年3月在首都医科大学附属北京妇产医院妇科内分泌门诊就诊的74例非肥胖PCOS患者作为研究组,同期45例年龄和体重指数相匹配的健康女性作为对照组。测量所有受试者的临床特征;测定血清性激素水平及代谢参数;采用稳态模型评估的胰岛素抵抗指数;比较两组上述各项指标的差异。 结果 PCOS组患者腰臀比、血清总睾酮、促黄体生成素水平、促黄体生成素/卵泡刺激素比值及血清低密度脂蛋白胆固醇均高于对照组(P < 0.01或P < 0.05);载脂蛋白A浓度低于对照组,差异有高度统计学意义(P < 0.01)。 结论 非肥胖PCOS患者同样存在代谢异常,临床上应引起重视。
[关键词] 多囊卵巢综合征;非肥胖;腰臀比;胰岛素抵抗;脂代谢
[中图分类号] R711.7 [文献标识码] A [文章编号] 1673-7210(2016)10(c)-0103-04
[Abstract] Objective To investigate the clinical features and metabolism characteristics of patients with non-obese polycystic ovary syndrome. Methods From November 2014 to March 2016, 74 patients with non-obese PCOS who visited the Department of Endocrinology of Beijing Obstetrics and Gynecology Hospital, Capital Medical University were enrolled as the study group, and 45 age-matched healthy women in the same period were included as the control group. Clinical characteristics, serum sex hormone levels and metabolic parameters were measured in all subjects and analyzed statistically. The insulin resistance index was evaluated by steady-state model and comparisons of all the hormone indicators mentioned above were conducted between the two groups. Results In PCOS group waist-hip ratio, serum total testosterone, luteinizing hormone, LH/FSH ratio and serum low density lipid protein were higher (P < 0.01 or P < 0.05), and apolipoprotein A concentration was lower than those of control group, the differences were statistically significant (P < 0.01). Conclusion Non-obese PCOS patients may also have metabolism disorder, so more attention should be paid in clinic work.
[Key words] Polycystic ovary syndrome; Non-obese; Waist-hip ratio; Insulin resistance; Lipid metabolism
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄女性常见的妇科内分泌疾病,以月经失调、高雄激素血症/表现及卵巢多囊泡为特点,临床表现呈高度异质性。常伴随胰岛素抵抗及脂代谢异常等,因此PCOS患者发生肥胖、胰岛素抵抗、2型糖尿病、冠心病的风险较高。病因尚不明确,发病机制复杂,是一种涉及内分泌、代谢和遗传等许多因素的内分泌与代谢紊乱的疾病[1]。许多研究证明,肥胖型PCOS患者多伴随糖脂代谢异常[2-4],而PCOS患者中有一部分属非肥胖型,关于非肥胖PCOS患者的糖脂代谢的研究却少见报道,此项研究旨在评估非肥胖PCOS患者的代谢状况,以期为PCOS的诊断、治疗、预后及疾病预测提供临床循证依据和参考。
1 对象与方法
1.1 对象
选择2014年11月~2016年3月在首都医科大学附属北京妇产医院(以下简称“我院”)妇科内分泌门诊就诊的,体重指数<25 kg/m2的非肥胖PCOS患者74例(PCOS组),年龄16~35岁,平均(26.32±4.33)岁。另纳入同期门诊体检,年龄及体重指数相匹配的月经规律的健康女性45例作为对照组,年龄23~33岁,平均(27.38±2.53)岁。多囊卵巢综合征的诊断根据2003年欧洲人类生殖和胚胎与美国生殖医学学会的(ESHRE/ASRM)鹿特丹专家会议[5]推荐的标准:①稀发排卵或无排卵。②高雄激素的临床表现和/或高雄激素血症。高雄激素的临床表现:痤疮、多毛或脂溢性脱发;高雄激素血症实验室标准:55.07 ng/dL(依据北京妇产医院实验室标准)。③卵巢多囊性改变(一侧或双侧卵巢内直径2~9 mm的卵泡数≥12个)。符合上述3项中任何两项,即可诊断PCOS。排除标准:①其他原因引起的雄激素过多如:先天性肾上腺皮质增生、库欣综合征、产生雄激素的卵巢肿瘤等。②近3个月使用任何可能影响观察指标的药物包括口服避孕药、激素类药、降糖药、影响脂代谢药等。③合并急慢性心血管及肝肾疾病。本研究获得我院医学伦理委员会批准,受试者充分了解研究内容并签署知情同意书。
1.2 研究方法
1.2.1 基本临床特征的测量方法 所有患者均测量基本参数,包括:年龄、身高、体重、腰围、臀围。身高、体重的测量要求:赤脚、脱帽,穿单衣裤,双手自然下垂;腰围的测量方法:取站位,双脚分开至25~30 cm,平稳呼吸状态下,在髂前上棘和第12肋下缘连线中点水平测量周径;臀围的测量方法:臀部最突出部位测量周径。计算体重指数(body mass index,BMI)和腰臀比(waist hip ratio,WHR):BMI=体重/身高2;BMI<25 kg/m2,属非肥胖范围(参照国际卫生组织2000年国际肥胖工作组提出的亚太地区指南的标准[6]);WHR=腰围/臀围。
1.2.2 性激素及代谢指标的标本检测方法 所有患者于清晨空腹状态下抽取静脉血检测总胆固醇(Cholesterol,CHO)、三酰甘油(Triglycerides,TG)、低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(High-density lipoprotein cholesterol,HDL-C)、载脂蛋白A(AplipoproteinA,ApoA)、载脂蛋白B(AplipoproteinB,ApoB)、脂蛋白a[Lipoprotein(a),Lp(a)]、空腹血糖(Fasting blood glucose, FBG)、空腹胰岛素(Fasting serum insulin,FINS);月经规律者于月经周期的第2~4天或PCOS患者闭经超过3个月未使用孕激素撤血情况下,空腹采血检测卵泡刺激素(Follicle stimulating hormone,FSH)、黄体生成素(Luteinizing hormone,LH)、睾酮(Testosterone,T)、催乳素(Prolactin,PRL)、雌二醇(estrogen 2,E2)。采用稳态模型评估胰岛素抵抗指数(HOMA-IR)=(FBG×FINS)/22.5;计算LH/FSH比值。双人独立录入数据,交叉核对。性激素及FINS的测定采用西门子公司生产的电化学发光免疫分析仪(型号:CENTAUR XP);血脂及脂蛋白指标由Beckman公司生产的全自动生化分析仪(型号:DXC 800)检测。
1.3 统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验,非参数检验采用秩和检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 两组观察对象临床特征及性激素水平比较
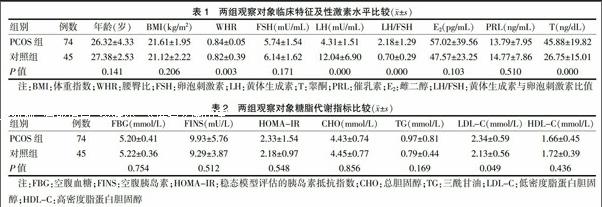
两组年龄及BMI比较差异均无统计学意义(P > 0.05);PCOS组的WHR、LH、T及LH/FSH比值均显著高于对照组,差异均有高度统计学意义(均P < 0.01);两组PRL、E2、FSH水平比较差异均无统计学意义(P > 0.05)。见表1。
2.2 两组观察对象临床空腹血糖、胰岛素及血脂水平比较
PCOS组的LDL-C水平较对照组增高,差异有统计学意义(P < 0.05);虽然PCOS组TG水平较对照组高,HDL-C较对照组低,但差异无统计学意义(P > 0.05)。两组FBG、FINS、HOMA-IR、CHO比较,差异均无统计学意义(P > 0.05)。见表2。
2.3 两组观察对象脂蛋白及载脂蛋白浓度比较
PCOS组患者的ApoA浓度显著低于对照组,差异有高度统计学意义(P < 0.01);两组Apo、ApoB/ApoA、Lp(a)比较,差异均无统计学意义(P > 0.05)。见表3。
3 讨论
PCOS属多器官疾病,涉及许多内分泌器官如卵巢、垂体、肾上腺、脂肪细胞及胰腺等,临床表现呈多样性。其病理生理机制主要是下丘脑-垂体-卵巢轴调节功能紊乱,常伴随脂代谢异常及胰岛素抵抗。本研究发现,PCOS患者的血清T、LH及LH/FSH比值均高于健康女性,与其他学者的研究结果一致[7]。Zhao等[8]根据美国国立卫生研究院(National Institutes of Health,NIH)最新指南推荐的分型标准将647例PCOS患者分成4组,其中A组为排卵障碍+高雄+卵巢多囊样改变;B组为排卵障碍+高雄;C组为高雄+卵巢多囊样改变;D组为排卵障碍+卵巢多囊样改变。87.8%的患者有高雄表现或血清总睾酮升高,四组患者均存在LH及LH/FSH比值的增高。该研究还发现,具备高雄激素的3组较非高雄组的BMI、WHR及胰岛素抵抗指数明显升高,并出现血脂异常。
PCOS最常见的代谢紊乱是腹型肥胖、脂代谢异常及胰岛素抵抗,这已经被许多研究所证实[9-10]。Lim等[11]进行的一项Meta分析显示,超重或肥胖的PCOS患者的性激素结合球蛋白(sex hormone-binding globulin,SHBG)降低,总睾酮、游离雄激素指数、LDL-C、空腹血糖、FINS及HOMA-IR增高。与正常体重的PCOS患者比较,肥胖型PCOS患者存在严重的代谢异常和低生育能力。高金金等[12]也认为,肥胖型PCOS患者与PCOS合并代谢综合征(Metabolic syndrome,MetS)的患者具备相似的临床特征和性激素水平,都存在胰岛素抵抗。
那么非肥胖的PCOS患者其代谢状态如何?Romano等[13]发现,肥胖型PCOS患者胰岛素抵抗和代谢综合征的发病率高于非肥胖PCOS患者,但是后者也存在代谢异常。本研究结果显示:正常体重的PCOS组患者LDL-C高于对照组,而ApoA水平显著低于对照组。LDL-C主要含胆固醇,是导致动脉粥样硬化的脂蛋白,ApoB是LDL-C的主要载脂蛋白,识别LDL-C受体;而ApoA是HDL-C的主要载脂蛋白,识别HDL-C受体,HDL-C是血管保护因子,具有清除血管中脂质的作用。与健康女性比较,PCOS患者的血清LDL-C浓度增高,而ApoA则常常表现为低水平[14]。结合本研究结果,可以认为:正常体重的PCOS患者发生心血管疾病的风险也会较健康女性增高。
本研究还发现:体重正常的PCOS患者,与年龄及体重相匹配的健康女性比较,其WHR值呈显著性增高。有研究认为[15]:WHR能较准确地预测胰岛素抵抗和MetS的发生,因其具备敏感性高、简单经济、无创性以及易操作性等优势,推荐用它来作为PCOS患者发生胰岛素抵抗和MetS的风险评估工具。Dumesic等[16]将正常体重的PCOS患者和无高雄、排卵正常的女性分为两组,做了一项前瞻性队列研究,检测了所有研究对象的性激素和代谢指标、糖耐量试验、全身双能X线吸收骨密度、腹部核磁共振成像及腹部皮下脂肪活检。结果显示:PCOS组患者LH和雄激素水平明显高于对照组,而FINS水平、胰岛β细胞对葡萄糖的反应及全腹部脂肪质量和腹内脂肪质量也明显增高;且与雄性激素、FINS、TG和非高密度胆固醇呈正相关。得出结论:在体重正常的高雄激素PCOS患者,可能存在脂肪结构-功能的改变,其腹部内脂肪更容易发生沉积,小腹的皮下脂肪比例更高,成为潜在的代谢功能异常的发病因素。血清同型半胱氨酸水平与血管内皮功能损伤相关,被认为是心血管疾病的独立危险因素。伊拉克学者Al-Gareeb等[17]研究了肥胖和正常体重PCOS患者的血清同型半胱氨酸浓度,分别比肥胖和正常体重的对照组明显增高(P < 0.01)。即,正常体重的PCOS患者比正常体重的健康女性同型半胱氨酸水平明显增高,其结论是:体重增加并不是同型半胱氨酸水平增高的独立危险因子,非肥胖的PCOS患者同样存在心血管疾病的发病风险。
由于PCOS临床及生化表现呈多样性,有30%~50%的患者体重在正常范围[18]。Glintborg等[19]认为,无论是肥胖型还是体重正常的PCOS,都存在腹型肥胖和炎性反应的增加。可能的机制是腹型肥胖和胰岛素抵抗刺激卵巢和肾上腺分泌雄性激素,雄激素的升高反过来又加重腹型肥胖和炎性反应,进一步可能导致脂代谢异常、糖尿病及心血管疾病的发生[20]。PCOS像一个恶性循环,需要从多方面调理和治疗才能打破这个恶性循环的链条,如重视生活方式调整、加强运动、合理饮食等,在此基础上酌情选择胰岛素增敏剂及口服避孕药,体重正常的PCOS患者也应如此。
本研究显示非肥胖PCOS患者同样存在脂代谢异常及心血管疾病的发病风险,提示PCOS可能存在某种利于MetS发生发展的潜在因素与机制。临床应关注PCOS患者的代谢指标,如BMI、WHR、IR及血脂和载脂蛋白等。重视BMI在正常范围,但可能已存在代谢功能失调的PCOS患者,做到早预测、早干预、早治疗。由于本研究样本量较小,对体重正常的PCOS患者的中远期代谢参数的变化有待深入研究。
[参考文献]
[1] 丰有吉,沈铿.妇产科学[M].北京:人民卫生出版社,2011:256-258.
[2] Reyes-Munoz E,Ortega-González C,Martínez-Cruz N,et al. Association of obesity and overweight with the prevalence of insulin resistance,pre-diabetes and clinical-biochemical characteristics among infertile Mexican women with polycystic ovary syndrome: a cross-sectional study [J]. BMJ Open,2016,6(7):e012107.
[3] Barber TM,Dimitriadis GK,Andreou A,et al. Polycystic ovary syndrome:insight into pathogenesis and a common association with insulin resistance [J]. Clin Med (Lond),2016,16(3):262-266.
[4] Ollila MM,Piltonen T,Puukka K,et al. Weight gain and dyslipidemia in early adulthood associate with polycystic ovary syndrome: prospective cohort study [J]. J Clin Endocrinol Metab,2016,101(2):739-747.
[5] Fauser B. Rotterdam ESHRE/ASRM-sponsored PCOS Consensus on diagnostic criteria and long term health risks related to polycystic ovary syndrome [J]. Hum Reprod,2004, 19:41-47.
[6] Geetha L,Deepa M,AnjanaRM,et al. Prevalence and clinical profile of metabolic obesity and phenotypic obesity in Asian Indians [J]. J Diabetes Sci Technol,2011,5(2):439-446.
[7] 赵赟,徐晶晶,朱铭伟,等.青春期多囊卵巢综合征患者临床、内分泌代谢紊乱特征及诊断初探[J].中华医学杂志,2010,90(25):1729-1734.
[8] Zhao Y,Ruan X,Mueck AO. Clinical and laboratory indicators of polycystic ovary syndrome in Chinese Han nationality with different Rotterdam criteria-based phenotypes [J]. Gynecol Endocrinol,2016,32(2):151-156.
[9] Ganie MA,Marwaha RK,Dhingra A,et al. Observation of phenotypic variation among Indian women with polycystic ovary syndrome (PCOS) from Delhi and Srinagar [J]. Gynecol Endocrinol,2016,32(7):566-570.
[10] Techatraisak K,Wongmeerit K,Dangrat C,et al. Measures of body adiposity and visceral adiposity index as predictors of metabolic syndrome among Thai women with PCOS [J]. Gynecol Endocrinol,2016,32(4):276-280.
[11] Lim SS,Norman RJ,Davies MJ,Moran LJ. The effect of obesity on polycystic ovary syndrome:a systematic review and meta-analysis [J]. Obes Rev,2013,14(2):95-109.
[12] 高金金,侯丽辉,李妍,等.多囊卵巢综合征合并代谢综合征患者的临床及生化特征[J].中国医药导报,2016, 13(18):105-121.
[13] Romano LG,Bedoschi G,Melo AS,et al.Metabolic abnormalities in polycystic ovary syndrome women:obese and non obese [J]. Rev Bras Ginecol Obstet 2011,33(6):310-316.
[14] Kim JJ,Choi YM. Dyslipidemia in women with polycystic ovary syndrome [J]. ObstetGynecol Sci,2013,56(3):137-142.
[15] Behboudi-Gandevani S,RamezaniTehrani F,Cheraghi L,AziziF.Could "a body shape index" and "waist to height ratio" predict insulin resistance and metabolic syndrome in polycystic ovary syndrome? [J]. Eur J ObstetGynecolReprod Biol,2016,205(9):110-114.
[16] Dumesic DA,Akopians AL,Madrigal VK,et al. hyperandrogenism accompanies increased intra-abdominal fat storage in normal weight polycystic ovary syndrome women [J]. J Clin Endocrinol Metab,2016,29:jc20162586.
[17] Al-Gareeb AI,Abd Al-Amieer WS,Alkuraishy HM,et al. Effect of body weight on serum homocysteine level in patients with polycystic ovarian syndrome:a case control study [J]. Int J Reprod Biomed (Yazd),2016,14(2):81-88.
[18] González F. Nutrient-induced inflammation in polycystic ovary syndrome: role in the development of metabolic aberration and ovarian dysfunction [J]. Semin Reprod Med,2015,33(4):276-286.
[19] Glintborg D. Endocrine and metabolic characteristics in polycystic ovary syndrome [J]. Dan Med J,2016,63(4).pii: B5232.
[20] 李文翠,张吉才,谢飞,等.多囊卵巢综合征患者血清骨桥蛋白含量测定的临床价值[J].中国医药导报,2015, 12(16):161-164.
(收稿日期:2016-07-25 本文编辑:任 念)
