2—脱氧葡萄糖对人多囊肾囊肿衬里上皮细胞增殖的影响
2016-12-28赵静连晓英傅博
赵静+连晓英+傅博
[摘要] 目的 探讨2-脱氧葡萄糖(2-DG)对常染色体显性多囊肾病(ADPKD)囊肿衬里上皮细胞WT9-12增殖的影响及其可能的作用机制。 方法 将体外培养的细胞分为对照组、不同浓度2-DG处理组(5、10、20、40 mmol/L)。用CCK-8法筛选不同浓度2-DG处理多囊肾上皮细胞不同时间(12、24、36、48 h)后,抑制细胞增殖活力的最适浓度和最适时间。采用EdU核酸标记技术和Western blot检测2-DG最适浓度处理多囊肾上皮细胞48 h后细胞的增殖抑制情况及代谢相关磷酸化-AMPKα(P-AMPKα)及增殖相关mTOR信号通路分子磷酸化-mTOR、p70S6K、4E-BP1(P-mTOR、P-p70S6K、P-4E-BP1)的水平变化;流式细胞术及Caspase-3试剂盒检测不同浓度2-DG处理多囊肾上皮细胞48 h后细胞的凋亡率。 结果 与对照组比较,2-DG可明显抑制多囊肾上皮细胞的增殖,且呈浓度和时间的依赖性(P < 0.05);细胞代谢相关分子P-AMPKα的水平明显升高(P < 0.05),增殖相关mTOR信号通路分子P-mTOR、P-p70S6K、P-4E-BP1的活性明显抑制(P < 0.05);与对照组比较,各浓度2-DG处理组的多囊肾上皮细胞早期凋亡率均明显增加,差异均有统计学意义(P < 0.05)。 结论 2-DG可能通过调控AMPK-mTOR信号通路,促进细胞凋亡,共同抑制多囊肾上皮细胞增殖。
[关键词] 2-脱氧葡萄糖;常染色体显性多囊肾病;肾囊肿衬里上皮细胞;增殖
[中图分类号] R692 [文献标识码] A [文章编号] 1674-4721(2016)10(c)-0004-05
[Abstract] Objective To investigate the effect of 2-DG on the proliferation of cyst lining epithelial cells WT9-12 and its possible action mechanism. Methods Cyst lining epithelial cells WT9-12 in vitro were divided into control group and 2-DG treatment group with different concentrations (5, 10, 20, 40 mmol/L). CCK-8 method was used to screen the optimal concentration and the best time for the growth inhabition of polycystic kidney epithelial cells after drug treatment for different concentrations and different time (12, 24, 36, 48 h). EdU Imaging Kit and Western blot were used to observe the proliferation rate and the levels of metabolism-related phosphorylated AMPKα, and proliferation-related phosphorylated mTOR, phosphorylated p70S6K, phosphorylated 4E-BP1 in the mTOR signal pathway of cyst lining epithelial cells exposed to 15 mmol/L 2-DG for 48 h. Flow cytometry and Caspase-3/CPP32 Colorimetric Assay Kit were used to detect the apoptosis rate of cyst lining epithelial cells treated by 2-DG of different concentrations for 48 h. Results The results showed that 2-DG can significantly inhibit the proliferation of polycystic kidney epithelial cells, compared with the control group, and the anti-proliferative effects in time-dependent and dose-dependent modes (P < 0.05). The level of metabolic related molecule P-AMPKα was obviously increased (P < 0.05), but the expression activity of the proliferation related molecule P-mTOR, P-p70S6K and P-4E-BP1 were markedly decreased (P < 0.05). Compared with the control group, the early apoptosis rate of polycystic kidney cells was promoted by the different concentrations of 2-DG, the differences were statistically significant (P < 0.05). Conclusion 2-DG may inhibit the growth of WT9-12 cyst lining epithelial cells through regulate the AMPK-mTOR signal pathway and promote apoptosis.
[Key words] 2-deoxyglucose; Autosomal dominant polycystic kidney disease; Cystic lining epithelial cells;Proliferation
常染色体显性多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)是一种常见的遗传性肾脏疾病[1]。由于具体的发病机制仍未明确,目前尚无能够阻止囊泡形成和生长的有效药物[2]。研究发现,多囊肾上皮细胞与肿瘤细胞类似,主要通过糖酵解产生ATP,且细胞中ATP/AMP比值升高,能量感受器AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK)活性下降,雷帕霉素哺乳靶蛋白(mammalian target of rapamycin,mTOR)活性增加,细胞增殖显著增强[3]。2-脱氧葡萄糖(2-deoxyglucose,2-DG)是一种人工合成的葡萄糖类似物,可抑制糖酵解、减少ATP产生,已被用于肿瘤的治疗研究[4-5]。本研究观察了2-DG对多囊肾上皮细胞增殖的抑制作用及其可能的作用机制。
1 对象与方法
1.1 试剂
人ADPKD 囊肿衬里上皮细胞系WT9-12与DMEM完全培养基,购自ATCC公司;胎牛血清购自Gibco公司;2-脱氧葡萄糖购自Med Chem Express(MCE)公司;Cell Counting Kit-8购自DOJINDO公司;Click-iTEdU Imaging Kits购自InvitrogenTM Thermo Fisher Scientific公司;Caspase-3/CPP32 Colorimetric Assay Kit购自BioVision公司;Annexin V/PI双染色流式法细胞凋亡检测试剂盒购自Bender公司;抗Phospho-(AMPKα、mTOR、p70S6K、4E-BP1)抗体购自Cell Signaling Technology公司。
1.2 分组方法
配制含10%胎牛血清(FBS)的DMEM完全培养基。多囊肾上皮细胞复苏后,在37℃ 5% CO2的孵箱中培养,隔天换液,每2~3天传代,细胞呈贴壁生长状态。2-DG溶解于去离子水中配置为1 mol/L的终浓度。将传代好的细胞分为5组:对照组,2-DG处理组(5、10、20、40 mmol/L),行CCK-8细胞增殖检测实验和细胞凋亡检测实验。选取2-DG浓度为15 mmol/L进行EdU核酸标记实验及Western blot检测实验。
1.3. CCK-8法检测2-DG对多囊肾上皮细胞增殖的影响
将多囊肾上皮细胞悬液浓度调整为3×107/L,每孔100 μL接种于96孔板,分为6组:空白组、对照组和2-DG处理组(5、10、20、40 mmol/L),每组设6个复孔,培养24 h,换液为含0.1% FBS的完全培养基同步化24 h,之后每组给予不同浓度2-DG(空白对照无细胞只加培养基)培养12、24、36、48 h后,每孔加入10 μL Cell Couning Kit-8试剂,在37℃孵箱中孵育4 h,使用酶标仪读取 450 nm波长下每孔的吸光度值(A)。增殖抑制率(%)=(A对照-A实验)/(A对照-A空白)×100%。
1.4 EdU法检测2-DG对多囊肾上皮细胞增殖的影响
选择15 mmol/L浓度2-DG治疗的多囊肾上皮细胞作为处理组,培养48 h后,在培养基中加入0.02 μmol EdU,孵育4 h,按EdU核酸标记试剂盒实验步骤操作后用4,6-二脒基-2-苯基吲哚(DAPI,能够与DNA强力结合的荧光染料)试剂染细胞核,最后用激光共聚焦显微镜采集图片,其中蓝色代表所有细胞核,粉色代表新增殖的细胞核。
1.5 Western blot 检测蛋白表达
收集对照组与处理组(15 mmol/L 2-DG干预48 h的多囊肾上皮细胞)细胞的蛋白,用RIPA裂解液提取总蛋白,BCA法检测蛋白浓度,取50 μg样本蛋白按顺序加样,SDS-PAGE电泳后,I=250 mA恒流转移至NC膜,5%BSA封闭1 h,分别予以不同的一抗孵育24 h,HRP标记的二抗(1∶1000)常温孵育1.5 h,ECL显影,Image-J 凝胶图像分析软件对各组蛋白条带进行灰度分析。
1.6 流式细胞仪及Caspase-3试剂盒检测多囊肾上皮细胞的凋亡情况
1.6.1 Annexin V/PI双染色流式法 用0、5、10、20、40 mmol/L的2-DG处理多囊肾上皮细胞48 h后,收集细胞,制备为单细胞悬液,用细胞计数器调整每组细胞数为1×106/mL。每组取100 μL细胞悬液于流式小管,加入200 μL Annexin V/PI Binding Buffer、5 μL Annexin V-FITC和5 μL PI,混匀后室温避光孵育15 min后上机检测各药物处理组与对照组中细胞的坏死和晚期凋亡率(D1、D2:PI+/Annexin V-FITC+)、活细胞率(D3:PI-/Annexin V-FITC-)和早期凋亡率(D4:PI-/Annexin V-FITC+)。
1.6.2 Caspase-3比色测定法 不同浓度(0、5、10、20、40 mmol/L)的2-DG处理多囊肾上皮细胞48 h后收集蛋白,测定每组蛋白的浓度,调整各组蛋白为相同浓度,每组取50 μL蛋白,加入50 μL Reaction Buffer和5 μL DEVD-pNA(caspase-3探针)后在37℃孵箱内避光孵育2 h,使用酶标仪检测405 nm波长的吸光度值(A)。
1.7 统计学方法
所有实验均重复3次,采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
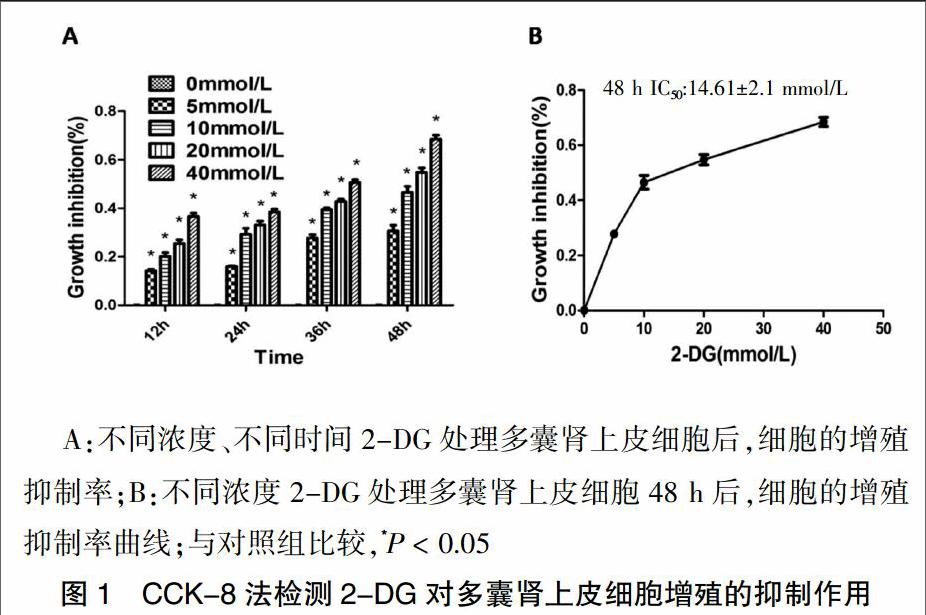
2.1 2-DG对多囊肾上皮细胞增殖的影响
CCK-8结果显示:在同一时间内,随着2-DG浓度的增加,存活细胞数逐渐减少(P < 0.05),提示2-DG对多囊肾上皮细胞增殖的抑制作用具有剂量依赖性,其中40 mmol/L浓度的2-DG对多囊肾上皮细胞增殖的抑制作用最强;对同一浓度而言,随着时间的延长,2-DG对多囊肾上皮细胞的增殖抑制效果也逐渐增强,具有时间依赖性,48 h的抑制率最高,与对照组比较,差异均有统计学意义(P < 0.05)(见图1A)。使用不同浓度(5、10、20、40 mmol/L)的2-DG处理细胞48 h后,细胞的增殖抑制率分别是(30.7±2.3)%、(46.5±2.5)%、(54.8±1.9)%、(68.5±1.7)%,计算得到半数抑制浓度(IC50)为(14.61±2.1)mmol/L。故在后续的增殖实验中设定2-DG的最适给药浓度为15 mmol/L(见图1B)。
EdU核酸标记技术检测结果显示:15 mmol/L 2-DG处理组中EdU阳性细胞率为(45.36±4.26)%,而对照组中EdU阳性细胞率为(16.12±1.26)%,两组比较差异有统计学意义(P < 0.05)。见图2(封三)。
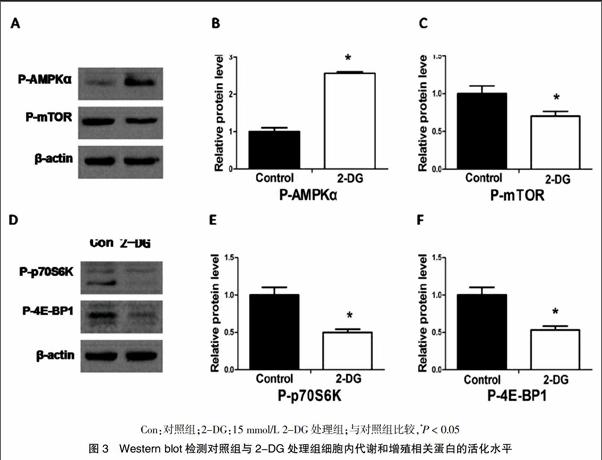
2.2 2-DG对多囊肾上皮细胞中代谢相关分子AMPK及增殖相关信号通路分子活化的影响
多囊肾上皮细胞内代谢相关信号通路活化型分子P-AMPKα的表达升高(P < 0.05);增殖相关信号通路活化型分子P-mTOR、P-p70S6K和P-4E-BP1的表达降低(P < 0.05)。见图3。
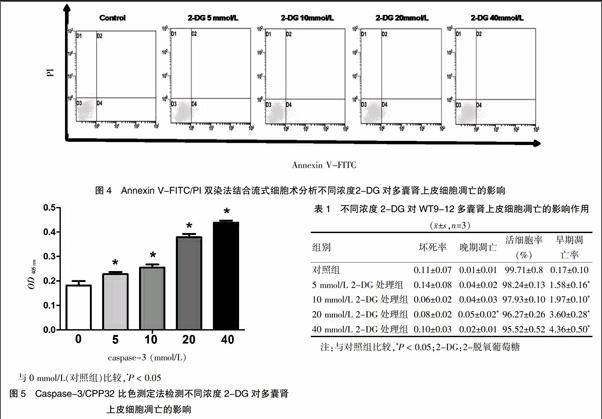
2.3 2-DG对多囊肾上皮细胞凋亡的影响
与对照组比较,各浓度2-DG处理组的多囊肾上皮细胞早期凋亡率(D4)均增加,差异均有统计学意义(P < 0.05);与对照组比较,20 mmol/L 2-DG处理组细胞晚期凋亡率(D2)明显增加,差异有统计学意义(P < 0.05)。各组坏死率及活细胞率比较,差异均无统计学意义(P > 0.05)。见表1、图4。
2.4 2-DG对多囊肾上皮细胞中凋亡执行酶caspase-3活性的影响
与对照组比较,2-DG各处理组中caspase-3酶活性均明显升高,差异有统计学意义(P < 0.05)。见图5。
3 讨论
ADPKD是人类常见的遗传性疾病,发病率为1/1000~1/500,85%的ADPKD由于PKD1基因突变导致,而15%的患者由于PKD2基因突变所致[6]。其病变特点为双肾充满多个进行性增长的液性囊泡,随着病变的进展,囊泡逐渐增多增大,压迫正常肾组织,最终发展为终末期肾脏病。临床中除对症治疗及应用肾移植和透析治疗终末期肾脏病外,尚无有效的靶向治疗药物[7-8]。近年来,在多种PKD啮齿动物模型中的研究发现,免疫抑制剂雷帕霉素、PPAR-γ激动剂罗格列酮、生长抑素类似物奥曲肽、加压素V2受体拮抗剂托伐普坦等药物可以抑制多囊肾上皮细胞异常增殖及囊液过度分泌,显示出良好的疗效。但是,之后的临床研究结果显示,雷帕霉素、奥曲肽和托伐普坦在人体中的治疗效果并不理想[9-12],因此急需新的治疗方法。
研究发现,PKD1突变小鼠模型中多囊肾上皮细胞的代谢方式与肿瘤细胞相似,存在瓦氏效应,即在氧气充足的条件下,也主要依赖有氧糖酵解途径产生ATP,而正常细胞主要通过线粒体氧化磷酸化产生ATP[3,13]。根据瓦氏效应学说,肿瘤细胞能量代谢调控失常影响了细胞增殖和凋亡等生物学过程[14]。AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK)是一种细胞内能量代谢感受器,是调节能量代谢的关键分子。当细胞内ATP/AMP比例降低时,可以激活AMPK,从而激活一系列能量代谢相关基因的表达,促进ATP合成。反之,当ATP升高时,可抑制AMPK的活性。在肿瘤细胞中,通过糖酵解途径大量消耗葡萄糖产生高水平ATP,AMP/ATP 比例下降,AMPK活性被明显抑制[15]。在多囊肾上皮细胞中发现,细胞内ATP/AMP的比例升高,AMP相对下降,AMPK的活性被明显抑制[3]。雷帕霉素哺乳靶蛋白(mammalian target of rapamycin,mTOR)不仅在调控能量代谢方面发挥重要作用,而且是调控细胞生长与增殖的一个关键性蛋白激酶,mTOR下游信号通路分子包括p70S6K和4E-BP1,可促进细胞增殖。研究表明AMPK可特异性抑制mTOR的活性[16-17]。
2-DG是一种可竞争性抑制糖酵解过程的新型化学药物,目前用于肿瘤的实验治疗研究。在多个肿瘤动物模型中发现2-DG都具有良好的抗增殖效应[18-20]。
本研究使用CCK-8及EdU核酸标记技术(DNA合成过程中,EdU可取代胸腺嘧啶整合到DNA链中,体外螯合荧光染料的叠氮化钠与EdU中乙炔基反应后,使新合成的DNA在激光照射下发出荧光)检测发现不同浓度的2-DG对多囊肾上皮细胞有明显的抗增殖作用,且抗增殖效应具有时间和剂量依赖性。Western blot结果显示在2-DG处理后的多囊肾上皮细胞内,P-AMPKα表达上调,P-mTOR、P-p70S6K和P-4E-BP1的表达均明显下调。
细胞凋亡是细胞的程序性死亡,其最终的共同途径都是激活凋亡执行酶Caspase-3。本研究通过Annexin V-FITC/PI双染法及Caspase-3/CPP32比色测定法,发现2-DG能促进多囊肾上皮细胞发生凋亡,提示凋亡也可能参与了多囊肾上皮细胞的生长抑制作用。
本研究提示,2-DG可能主要通过靶向抑制多囊肾上皮细胞的糖代谢,使多囊肾上皮细胞内ATP/AMP比值降低,AMP相对升高,激活能量感受器AMPK,从而抑制增殖相关的mTOR信号通路分子的活化,进而抑制多囊肾上皮细胞的增殖,提示2-DG今后可能作为多囊肾脏病的潜在治疗药物。
[参考文献]
[1] Tong A,Tunnicliffe DJ,Lopez-Vargas P,et al. Identifying and integrating consumer perspectives in clinical practice guidelines on autosomal-dominant polycystic kidney disease [J]. Nephrology (Carlton),2016,21(2):122-132.
[2] Rangan GK,Lopez-Vargas P,Nankivell BJ,et al. Autosomal dominant polycystic kidney disease:a path forward [J]. Semin Nephrol,2015,35(6):524-537.
[3] Rowe I,Chiaravalli M,Mannella V,et al. Defective glucose metabolism in polycystic kidney disease identifies a new therapeutic strategy [J]. Nat Med,2013,19(4):488-493.
[4] Fan LX,Liu CM,Gao AH,et al. Berberine combined with 2-deoxy-D-glucose synergistically enhances cancer cell proliferation inhibition via energy depletion and unfolded protein response disruption [J]. Biochim Biophys Acta,2013, 1830(11):5175-5183.
[5] Bost F,Decoux-Poullot AG,Tanti JF,et al. Energy disruptors:rising stars in anticancer therapy? [J]. Oncogenesis,2016, 5:e188.
[6] Simms RJ. Autosomal dominant polycystic kidney disease [J]. BMJ,2016,352:i679. doi: 10.1136/bmj.i679.
[7] Yuajit C,Chatsudthipong V. Nutraceutical for autosomal dominant polycystic kidney disease therapy [J]. J Med Assoc Thai,2016,99 Suppl 1:S97-S103.
[8] 李聪,吴寅,李鹏,等.常染色体显性多囊肾病治疗药物的研究进展[J].现代药物与临床,2015,30(9):1167-1171.
[9] Ruggenenti P,Gentile G,Perico N,et al. Effect of Sirolimus on disease progression in patients with autosomal dominant polycystic kidney disease and CKD stages 3b-4 [J]. Clin J Am Soc Nephrol,2016,11(5):785-794.
[10] Higashihara E,Nutahara K,Okegawa T,et al. Safety study of somatostatin analogue octreotide for autosomal dominant polycystic kidney disease in Japan [J]. Clin Exp Nephrol,2015,19(4):746-752.
[11] Kuhn WE,Walz G. The treatment of autosomal dominant polycystic kidney disease [J]. Dtsch Arztebl Int,2015, 112(51-52):884-890.
[12] Gansevoort RT,Arici M,Benzing T,et al. Recommendations for the use of tolvaptan in autosomal dominant polycystic kidney disease:a position statement on behalf of the ERA-EDTA working groups on inherited kidney disorders and european renal best practice [J]. Nephrology Dialysis Transplantation,2016,31(3):337-348.
[13] 罗湘建,曹亚.肿瘤能量代谢机制研究进展[J].生物化学与生物物理进展,2011,38(7):585-592.
[14] Xu XD,Shao SX,Jiang HP,et al. Warburg effect or reverse Warburg effect? A review of cancer metabolism [J]. Oncol Res Treat,2015,38(3):117-122.
[15] Rehman G,Shehzad A,Khan AL,et al. Role of AMP-activated protein kinase in cancer therapy [J]. Arch Pharm (Weinheim),2014,347(7):457-468.
[16] Dong LX,Sun LL,Zhang X,et al. Negative regulation of mTOR activity by LKB1-AMPK signaling in non-small cell lung cancer cells [J]. Acta Pharmacol Sin,2013,34(2):314-318.
[17] Chen S,Zhu X,Lai X,et al. Combined cancer therapy with non-conventional drugs:all roads lead to AMPK [J]. Mini Rev Med Chem,2014,14(8):642-654.
[18] Wang L,Wang J,Xiong H,et al. Co-targeting hexokinase 2-mediated Warburg effect and ULK1-dependent autophagy suppresses tumor growth of PTEN- and TP53-deficiency-driven castration-resistant prostate cancer [J]. E Bio Medicine,2016,7:50-61.
[19] Mediani L,Gibellini F,Bertacchini J,et al. Reversal of the glycolytic phenotype of primary effusion lymphoma cells by combined targeting of cellular metabolism and PI3K/Akt/mTOR signaling [J]. Oncotarget,2016,7(5):5521-5537.
[20] Kim EH,Lee JH,Oh Y,et al. Inhibition of glioblastoma tumorspheres by combined treatment with 2-deoxyglucose and metformin [J]. Neuro Oncol,2016. pii:now174. [Epub ahead of print]
(收稿日期:2016-07-10 本文编辑:任 念)
