卵巢癌组织中MAGE-A9、HER2的表达变化及其意义
2016-12-27徐云钊黄剑飞王旭东张玉泉沈宗姬
徐云钊,黄剑飞,王旭东,张玉泉,沈宗姬
(1 南通大学附属医院,江苏南通226001;2苏州大学附属第一医院)
卵巢癌组织中MAGE-A9、HER2的表达变化及其意义
徐云钊1,黄剑飞1,王旭东1,张玉泉1,沈宗姬2
(1 南通大学附属医院,江苏南通226001;2苏州大学附属第一医院)
目的 观察卵巢癌组织中黑色素瘤相关抗原A9(MAGE-A9)、人类表皮生长因子受体2(HER2)蛋白的表达变化,并探讨其意义。方法 选择240例行子宫、双侧输卵管卵巢切除术的患者,其中术后病理检查确诊为卵巢癌128例(观察组)、非卵巢癌112例(对照组)。采用免疫组化法检测观察组卵巢癌组织和对照组正常卵巢、输卵管组织中的MAGE-A9、HER2蛋白,分析MAGE-A9、HER2蛋白表达与卵巢癌临床病理参数及患者预后的关系。 结果 观察组51例(39.84%)患者卵巢癌组织中MAGE-A9蛋白高表达,对照组正常卵巢、正常输卵管组织中未见MAGE-A9蛋白高表达,两组相比,P均<0.05。观察组40例(31.25%)患者卵巢癌组织中HER2蛋白高表达,对照组4例(16.67%)患者正常卵巢组织中HER2蛋白高表达,未见正常输卵管组织中HER2蛋白高表达,两组相比,P均<0.05。卵巢癌组织MAGE-A9、HER2蛋白表达与FIGO分期、肿瘤分化程度、CA125水平以及淋巴结转移有关(P均<0.05)。MAGE-A9高表达以及MAGE-A9/HER2均高表达的卵巢癌患者5年生存率低(P<0.001)。结论 卵巢癌组织中MAGE-A9、HER2高表达。检测卵巢癌组织中MAGE-A9、HER2表达有助于判断病情及评估患者预后。
卵巢癌;卵巢肿瘤;黑素瘤相关抗原A9;人类表皮生长因子受体2
卵巢癌是女性常见的恶性肿瘤之一,其5年生存率低于30%[1]。黑色素瘤相关抗原(MAGE)基因是一组肿瘤相关抗原,首先从黑色素瘤中发现[2]。MAGE-A是一个多基因家族,由位于染色体Xq28位点上的12个同源基因MAGE-A1到MAGE-A12组成,MAGE-A9常表达于泌尿系肿瘤,已被发现在黑色素瘤、头颈部鳞状细胞癌、非小细胞肺癌、肝细胞癌等恶性肿瘤组织中存在异常表达[3]。越来越多的证据表明,MAGE-A基因家族的表达与恶性肿瘤的侵袭转移、临床不良预后相关[4]。人类表皮生长因子受体2(HER2)是表皮生长因子受体家族酪氨酸激酶受体的一个成员,在肿瘤细胞增殖和转移中起重要作用,研究表明在乳腺癌中HER2的扩增和蛋白的过表在15%~30%,包括一些其他恶性肿瘤[5]。但目前关于MAGE-A9和HER2在卵巢癌组织中的表达及其临床意义的相关报道较少,我们观察了卵巢癌组织中MAGE-A9、HER2的表达变化,并分析其与卵巢癌临床病理参数的关系。现将结果报告如下。
1 资料与方法
1.1 临床资料 选择2005年1月~2009年12月间南通大学附属医院妇产科行子宫、双侧输卵管卵巢切除术的240例患者,年龄24~78岁。均接受子宫、双侧输卵管卵巢切除术,术前患者均未行放疗、化疗和内分泌治疗等相关抗肿瘤治疗。根据术后病理检查确诊卵巢癌患者128例(观察组)均行卵巢癌全面分期手术包括全子宫、双侧输卵管卵巢切除术,盆腔淋巴结清扫和大网膜阑尾切除术,按国际妇产科学会(FIGO) 临床分期Ⅰ期60例,Ⅱ期14例,Ⅲ期40例,Ⅳ期14例;病理分级:高分化99例,低分化29例。留取术中切除卵巢癌组织标本。其余112例非卵巢癌患者(对照组)留取正常卵巢、输卵管组织标本。本研究经南通大学附属医院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 两组留取标本MAGE-A9 、HER2蛋白表达检测 采用免疫组化EnVision二步法。试剂盒购自北京中杉金桥生物技术提供,所有操作均严格按照按说明书进行。兔抗人MAGE-A9 单克隆抗体以1∶50稀释(Abcam, ab66904),兔抗人HER2抗体以1∶50稀释(Dako),生物素化山羊抗兔二抗和辣根过氧物酶标记的链酶卵白素(三抗)为试剂盒中的原液。DAB 显色后,苏木精复染,酒精梯度脱水,中性树胶封片。每张切片随机取5个400倍视野。按染色强度计分: 细胞无染色计0分、细胞染色为浅黄色计1分、细胞染色为棕黄色计2分、细胞染色为棕褐色计3分。按阳性细胞百分比计分为:阳性细胞百分比1%~20%计1分、阳性细胞百分比21%~50%计2分、阳性细胞百分比51%~75%计3分、阳性细胞百分比76%~100%计4分。将上述两分的乘积≥6判为高表达,<6判为低表达[6]。
1.3 统计学方法 采用SPSS20.0和STATA12.0统计软件。组间比较采用配对t检验,患者年龄、肿瘤直径、病理类型、分化程度、临床分期、淋巴结转移、术前血清CA125等计数资料间比较采用χ2检验,相关性分析采用Spearman等级相关分析法,生存分析采用Kaplan-Meier法,以COX回归模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
观察组51例(39.84%)患者卵巢癌组织中MAGE-A9蛋白高表达,对照组正常卵巢、正常输卵管组织中未见MAGE-A9蛋白高表达,两组相比,P均<0.05。观察组40例(31.25%)患者卵巢癌组织中HER2蛋白高表达,对照组4例(16.67%)患者正常卵巢组织中HER2蛋白高表达,未见正常输卵管组织中HER2蛋白高表达,两组相比,P均<0.05。
MAGE-A9、HER2蛋白表达与卵巢癌临床病理参数的关系见表1。卵巢癌组织MAGE-A9、HER2蛋白表达与卵巢癌FIGO分期、分化程度、CA125水平和淋巴结转移有关(P均<0.05)。
随访至患者确诊卵巢癌术后5年。MAGE-A9高表达、HER2高表达、MAGE-A9/HER2均高表达患者的5年生存率分别为31.37%(16/51)、37.50%(15/40)、35.29%(6/17),Cox 模型单因素和多因素分析结果显示MAGE-A9高表达的患者5年生存率低于MAGE-A9低表达者,MAGE-A9/HER2均高表达的患者5年生存率低于MAGE-A9、HER2均相对低表达及其他患者,差异有统计学意义 (HR=5.651,P=0.000;HR=2.383,P=0.005)。Kaplan-Meier法亦分析显示MAGE-A9高表达以及MAGE-A9/HER2均高表达提示卵巢癌患者5年生存率低(P<0.001)。不同HER2表达的患者5年生存率间比较差异无统计学意义(HR=1.380,P=0.351 1)。
3 讨论
MAGE基因是一组肿瘤相关抗原,首先从黑色素瘤中发现。MAGE基因被分为MAGE-I(MAGEA、MAGE-B、MAGE-C)和MAGE-Ⅱ(MAGE-D、MAGE-E、MAGE-F、MAGE-H、MAGE-L和NDN)两大亚组。MAGE-Ⅱ几乎普遍表达在正常组织及肿瘤细胞中,MAGE-Ⅰ被限制表达在少数正常组织中,如精母细胞、胎盘以及胚胎发育某些阶段[7],在正常成人组织中则沉默或低表达,但在某些肿瘤中重新表达[8]。由于MAGE-Ⅰ基因在除睾丸和胎盘以外的正常成人组织中不表达,并且在大量肿瘤性病变中表达,MAGE-Ⅰ基因被认为是肿瘤特异性抗原和癌症免疫治疗的理想靶标。同时由于它们出现在MHC-Ⅱ分子表面,可被细胞毒性T淋巴细胞(CTL)识别,因此是CTL介导的特异性免疫治疗的理想靶分子[9,10]。
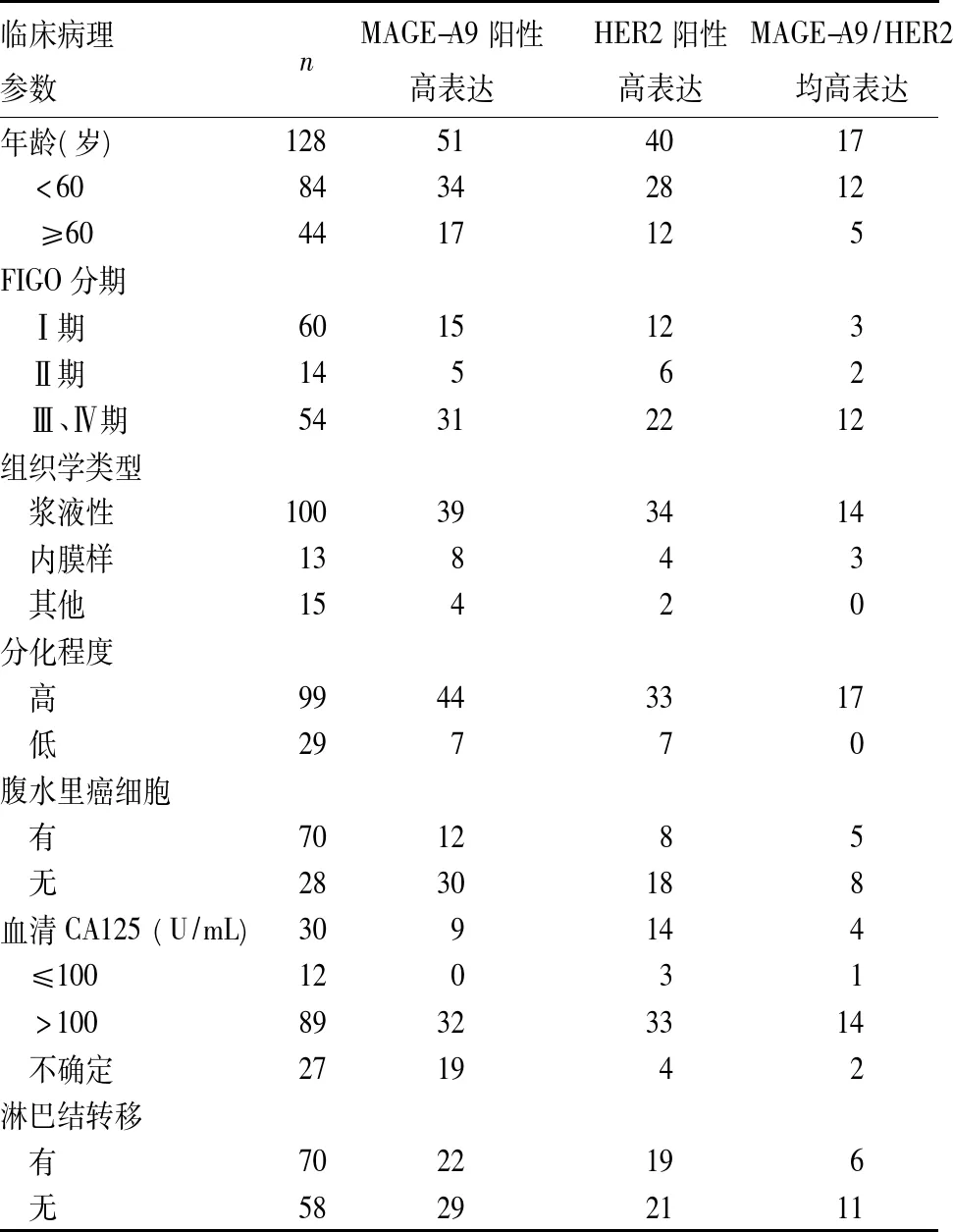
表1 MAGE-A9、HER2表达与卵巢癌临床病理参数的关系(例)
MAGE-A是一个多基因家族,由位于染色体Xq28位点上的12个同源基因MAGE-A1到MAGE-A12组成,一些表达在肺癌上的MAGE-A基因已成为免疫治疗的标靶[11]。作为MAGE-A家族中的重要一员,已有报道MAGE-A9常表达于泌尿系肿瘤,与肾癌和膀胱癌的预后有关,也过表达于T细胞淋巴瘤、食管腺癌、喉鳞状细胞癌和肝癌中[12~16]。本研究发现,卵巢癌组织中存在MAGE-A9高表达,卵巢癌中MAGE-A9的表达与临床分期、病理分级、CA125及转移相关;MAGE-A9高表达提示临床预后较差;MAGE-A9的过表达是一个独立的预后相关因素。本研究的结果与国内外一些恶性肿瘤研究结果相一致。
HER2基因位于17q21,其编码的细胞膜磷脂蛋白分子量为185 kD,是具有TPK 活性的细胞跨膜酪氨酸激酶受体糖蛋白。HER2作为原癌基因参与多种肿瘤(包括卵巢癌)的发生和发展[5], HER2基因扩增及其蛋白过表达引起细胞生长加速,DNA修复失衡等导致细胞癌变[17]。研究发现卵巢癌中HER2的过表达率与乳腺癌相似,卵巢癌中HER2阳性患者总生存期比阴性患者低。体外实验发现HER2单克隆抗体曲妥珠单抗可以抑制HER2 蛋白过表达细胞株的增殖[18,19]。
MAGE-A9和HER2作为癌基因,编码的蛋白在促进肿瘤侵袭和转移有一定的作用,同时这两种蛋白可以被认为是用于癌症免疫疗法的理想目标,两者之间在肿瘤的侵袭和转移中的相互作用未见有报道。Hou等[20]乳腺癌中发现MAGE-A9表达与HER2的表达呈正相关,在HER-2阳性乳腺癌中MAGE-A9表达频繁。MAGE-A9和HER2 都是肿瘤免疫治疗的靶点,所以卵巢癌术后患者组织标本检测MAGE-A9/HER2阳性高表达的患者预后就差,对卵巢癌患者的预后有一定的预测能力,且同时MAGE-A9/HER2阳性高表达的卵巢癌患者若术后再次复发无法承受二次手术或再次化疗,可选择的免疫治疗就有一定的针对性,可以选择针对HER2的,也可以选择针对MAGE-A9的,二者对晚期复发卵巢癌的患者都较敏感,此类患者选择新的治疗方法提供了理论依据。
综上所述,卵巢癌组织中存在MAGE-A9、HER2高表达。检测卵巢癌组织中MAGE-A9、HER2表达有助于判断病情及评估预后。
[1] Wang D, Zhu H, Ye Q,et al. Prognostic Value of KIF2A and HER2-Neu Overexpression in Patients With Epithelial Ovarian Cancer[J]. Medicine (Baltimore), 2016,95(8):e2803.
[2] Barker PA, Salehi A. The MAGE proteins: emerging roles in cell cycle progression, apoptosis, and neurogenetic disease[J]. J Neurosci Res, 2002,67(6):705-712.
[3] Hamai A, Memeo L, Colarossi C, et al. Expression of MAGE-A antigens is frequent in triple-negative breast cancers but does not correlate with that of basal-like markers[J]. Ann Oncol, 2011,22(4):986-987.
[4] Vansteenkiste J, Zielinski M, Linder A, et al. Adjuvant MAGE-A3 immunotherapy in resected non-small-cell lung cancer: phase II randomized study results[J]. J Clin Oncol, 2013,31(19):2396-2403.
[5] Engel RH, Kaklamani VG. HER2-positive breast cancer: current and future treatment strategies[J]. Drugs, 2007,67(9):1329-1341.
[6] Sun R, Wang X, Zhu H, et al. Prognostic value of LAMP3 and TP53 overexpression in benign and malignant gastrointestinal tissues[J]. Oncotarget, 2014,5(23):12398-12409.
[7] Osterlund C,Tohonen V ,Forslund KO, et al. Nordqvist, Mage-b4, a novel melanoma antigen (MAGE) gene specifically expressed during germ cell differentiation[J]. Cancer Res, 2000,60(23):1054-1061.
[8] Simpson AJ,Caballero OL, Jungbluth A , et al. Cancer/testis antigens, gametogenesis and cancer[J]. Nat Rev Cancer, 2005,47(5):615-625.
[9] Bao L ,Dunham K ,Lucas K.MAGE-A1, MAGE-A3, and NY-ESO-1 can be upregulated on neuroblastoma cells to facilitate cytotoxic T lymphocyte-mediated tumor cell killing[J]. Cancer Immunol Immunother, 2011,60(19):1299-1307.
[10] Lorenzi S, Forloni M ,Cifaldi L , et al. IRF1 and NF-kB restore MHC class I-restricted tumor antigen processing and presentation to cytotoxic T cells in aggressive neuroblastoma[J]. PLoS One, 2012,35(7): e46928.
[11] Karimi S , Mohammadi F,Porabdollah M , et al. Characterization of melanoma-associated antigen-a genes family differential expression in non-small-cell lung cancers[J]. Clin Lung Cancer, 2012,103(13): 214-219.
[12] Gu X ,Fu M,Ge Z , et al. High expression of MAGE-A9 correlates with unfavorable survival in hepatocellular carcinoma[J]. Sci Rep, 2014,4(14):6625.
[13] Bergeron A ,Picard V ,LaRue H , et al. High frequency of MAGE-A4 and MAGE-A9 expression in high-risk bladder cancer[J]. Int J Cancer, 2009,12(5):1365-1371.
[14] Hatiboglu G , PritschM, Macher-Goeppinger S , et al. Prognostic value of melanoma-associated antigen A9 in renal cell carcinoma[J]. Scand J Urol, 2013,47(4):311-322.
[15] van DuinM, Broyl A , de Knegt Y , et al. Cancer testis antigens in newly diagnosed and relapse multiple myeloma: prognostic markers and potential targets for immunotherapy[J]. Haematologica, 2011,96(13) :1662-1669.
[16] Han L , Jiang B , Wu H, et al. Expression and prognostic value of MAGE-A9 in laryngeal squamous cell carcinoma[J]. Int J Clin Exp Pathol, 2014,57(7):6734-6742.
[17] Bartsch R, Wenzel C, Zielinski CC. HER-2-positive breast cancer: hope beyond trastuzumab[J]. Bio Drugs, 2007,21(1):69-77.
[18] Verri E, Guglielmini P, Puntoni M, et al. HER2/neu oncoprotein overexpression in epithelial ovarian cancer: evaluation of its prevalence and prognostic significance[J].Oncology, 2005,132(68):154-161.
[19] Hellstrom I, Goodman G, Pullman J, et al. Overexpressing of HER-2 in ovarian carcinomas [J]. Cancer Res, 2001, 61(17):2420-2423.
[20] Hou SY , Sang MX, Geng CZ, et al. Expressions of MAGE-A9 and MAGE-A11 in breast cancer and their expression mechanism[J]. Arch Med Res, 2014,45(12):44-51.
沈宗姬(E-mail: shensuzhou@163.com)
10.3969/j.issn.1002-266X.2016.39.017
R737.31
B
1002-266X(2016)39-0053-03
2016-08-03)
