耐药人胃癌细胞UHRF1基因的表达变化及其与多药耐药的关系
2016-12-27周林李伟韩东升张伟
周林,李伟,韩东升,张伟
(中国人民解放军第八十八医院,山东泰安271000)
·论著·
耐药人胃癌细胞UHRF1基因的表达变化及其与多药耐药的关系
周林,李伟,韩东升,张伟
(中国人民解放军第八十八医院,山东泰安271000)
目的 观察耐药人胃癌细胞泛素样含PHD和环指域1(UHRF1)基因的表达变化,并探讨其与胃癌细胞多药耐药的关系。方法 取对数生长期人胃癌细胞SGC7901、耐长春新碱(VCR)的SGC7901(SGC7901/VCR)、耐阿霉素(ADR)的SGC7901(SGC7901/ADR),采用实时定量PCR法检测各细胞UHRF1 mRNA,采用Western blotting法检测各细胞UHRF1蛋白。 取对数生长期SGC7901/VCR、SGC7901/ADR细胞分别转染抑制UHRF1表达的小干扰RNA(siUHRF1)(SGC7901/VCR-siUHRF1、SGC7901/ADR-siUHRF1)、无意义空白质粒(SGC7901/VCR-UHRF1、SGC7901/ADR-UHRF1),另设空白对照,不做任何处理。取对数生长期SGC7901细胞,分别转染过表达的UHRF1质粒(SGC7901-UHRF1)、无意义空白质粒(SGC7901-NC),另设空白对照。转染48 h收集以上细胞备用。采用MTT法检测SGC7901/VCR、SGC7901/ADR细胞各干扰组和SGC7901细胞各干扰组对化疗药物[(VCR、ADR、5-氟尿嘧啶(5-FU)和顺氨氯铂(CDDP)]的药物敏感性,计算半数抑制浓度(IC50);取SGC7901/VCR、SGC7901/ADR细胞各干扰组和SGC7901空白对照,加入5-FU共培养,采用流式细胞仪观察细胞凋亡情况。结果 SGC7901细胞UHRF1 mRNA及蛋白的相对表达量均低于SGC7901/VCR、SGC7901/ADR细胞,P均<0.05。促进UHRF1表达可升高SGC7901细胞对VCR、ADR、5-FU、CDDP 的IC50,降低细胞凋亡率,P均<0.05。抑制UHRF1表达可降低VCR、ADR、5-FU、CDDP对SGC7901/VCR和SGC7901/ADR细胞的IC50,升高细胞凋亡率,P均<0.05。结论 耐药人胃癌细胞中存在UHRF1高表达。UHRF1高表达可降低胃癌细胞的药物敏感性、提高细胞多药耐药性,可能与UHRF1抑制胃癌细胞凋亡有关。
胃癌;泛素样含PHD和环指域1;多药耐药;药物敏感性;半数抑制浓度;细胞凋亡
化疗是进展期胃癌的主要治疗方式之一,但部分胃癌患者对化疗药物不敏感,研究认为胃癌细胞的多药耐药是其主要原因[1, 2]。胃癌细胞多药耐药的具体发生机制目前尚不明确[3, 4]。泛素样含PHD和环指域1(UHRF1)是表观遗传学的调控因子,是一种重要的促癌分子[5]。我们前期研究发现,UHRF1促进胃癌细胞的增殖和侵袭,并且UHRF1高表达提示预后较差[6~9],但其在胃癌细胞多药耐药中的作用机制尚不清楚。本研究观察了耐药人胃癌细胞UHRF1基因的表达变化,并探讨其与胃癌细胞多药耐药的关系。现将结果报告如下。
1 材料与方法
1.1 细胞、材料及试剂 人胃癌细胞系SGC7901和人耐长春新碱(VCR)SGC7901(SGC7901/VCR)、人耐阿霉素(ADR)SGC7901(SGC7901/ADR)均来自第四军医大学肿瘤生物学国家重点实验室,培养于含10%胎牛血清、1%青霉素和链霉素的RPMI1640培养基中,在37 ℃、5%CO2培养箱常规培养,培养过程中SGC7901/VCR和SGC7901/ADR分别加入终浓度1 μg /mL的长春新碱和0.5 μg /mL的阿霉素维持耐药性。RPMI1640培养基购自美国Gibco公司,胎牛血清购自美国Hyclone公司; RNA裂解液TRIzol购自美国Invitrogen公司;反转录试剂盒、RT-PCR试剂盒、UHRF1和GAPDH引物购自大连TaKaRa公司;总蛋白提取试剂盒购自上海碧云天公司,UHRF1和β-actin抗体购自北京中杉金桥公司;过表达的UHRF1质粒、抑制UHRF1表达的小干扰RNA(siUHRF1)及无意义空白质粒由上海吉凯基因公司合成;Annexin V/碘化丙啶(PI)检测试剂盒购自北京四正柏生物科技有限公司。
1.2 SGC7901、SGC7901/VCR、SGC7901SG/ADR细胞UHRF1 mRNA及蛋白检测 取对数生长期SGC7901/VCR、SGC7901/ADR、SGC7901细胞,采用实时定量PCR法检测各细胞UHRF1 mRNA,应用TRIzol 法提取总RNA,取5 μg RNA按反转录试剂盒说明书合成cDNA,以GAPDH基因作为内参。UHRF1上游引物5′-GTCGAATCATCTTCGTGGAC-3′,下游引物5′-AGTACCACCTCGCTGGCAT-3′;GAPDH上游引物5′-GGTGAAGGTCGGA-GTCAAC-3′ ,下游引物5′-AGAGTTAAAAGC-AGCCCTGGTG-3′。PCR 扩增条件:95 ℃预变性10 min,95 ℃变性20 s,60 ℃退火25 s,72 ℃延伸25 s,35 个循环;72 ℃延伸10 min;反应体系50 μL。用2-ΔΔCT表示目的基因的相对表达量。采用Western blotting法检测各细胞UHRF1蛋白,按照蛋白提取试剂盒说明裂解细胞后提取总蛋白,BCA法测定蛋白浓度,聚丙烯酰胺凝胶(SDS-PAGE)电泳50 min,半干法转膜17 min,5%脱脂奶粉室温封闭20 min,加入一抗( 鼠抗人UHRF1单克隆抗体,1∶400) ,4 ℃孵育过夜。TBST 洗涤, 加入HRP 标记的二抗(羊抗鼠UHRF1单克隆抗体,1∶2 000) ,室温孵育1 ~1.5 h,TBST 洗涤,ECL 显色,曝光,凝胶成像仪拍照(Biorad),Quantity One 软件进行定量分析。以β-actin为内参,以目的蛋白与β-actin灰度值之比作为UHRF1蛋白的相对表达量。实验重复3次,取平均值。
1.3 UHRF1对胃癌细胞药物敏感性及细胞凋亡的影响观察
1.3.1 细胞转染 取对数生长期SGC7901/VCR、SGC7901/ADR细胞分别用Lipofectamine 2000试剂转染siUHRF1(SGC7901/VCR-siUHRF1、SGC7901/ADR-siUHRF1)、无意义空白质粒(SGC7901/VCR-UHRF1、SGC7901/ADR-UHRF1),另设空白对照,不做任何处理。取对数生长期SGC7901细胞,分别转染SGC7901-UHRF1、无意义空白质粒(SGC7901-NC),另设空白对照。转染48 h收集以上细胞备用。
1.3.2 SGC7901、SGC7901/VCR、SGC7901SG/ADR细胞对化疗药物[VCR、ADR、5-氟尿嘧啶(5-FU)和顺氨氯铂(CDDP)]的敏感性观察 采用MTT法。取“1.3.1”中细胞,5×103/孔接种于96孔板,每组30个复孔,待细胞贴壁后吸弃培养液,分别加入0.005、0.05、0.5、5、50 mg /L的各种化疗药物(VCR、ADR、5-FU和CDDP)200 μL,将仅加细胞但不加药物干预作为阴性对照组,以不加细胞而仅加培养液作为空白组,各浓度5个复孔。常规培养48 h 后,每孔加入50 μL MTT 溶液,培养4 h ,吸弃上清,加入150 μL DMSO,振荡15 min,充分溶解结晶物。采用酶联免疫检测仪上测定490 nm 波长下各孔吸光度(A)值,重复测定3 次,计算各种化疗药物对各组细胞的半数抑制浓度(IC50) ,IC50反映细胞的药物敏感性。
1.3.3 SGC7901、SGC7901/VCR、SGC7901/ADR细胞凋亡情况观察 采用流式细胞术。取对数生长期“1.3.1”中细胞,接种于6孔板内。培养24 h加入终浓度为40 g/L的5-FU,37 ℃、5%CO2培养箱培养48 h。收集各组细胞,PBS 洗涤3次,按试剂盒说明书采用Annexin V-FITC/ PI 进行双标记,避光放置10 min,流式细胞仪观察各组细胞凋亡情况。计算细胞凋亡率。实验重复3 次。
1.4 统计学方法 采用SPSS19.0统计软件进行统计学分析。计量资料采用表示,结果比较采用t检验,多组均数间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1SGC7901、SGC7901/VCR、SGC7901/ADR细胞UHRF1mRNA及蛋白表达比较SGC7901/VCR、SGC7901/ADR、SGC7901细胞UHRF1mRNA的相对表达量分别为4.03±0.90、3.77±0.78、1.00±0.00,SGC7901细胞UHRF1mRNA的相对表达量明显低于SGC7901/VCR(t=4.75,P<0.05)、SGC7901/ADR(t=5.04,P<0.05),SGC7901/VCR、SGC7901/ADR细胞UHRF1mRNA的相对表达量间比较差异无统计学意义(t=2.22,P>0.05)。SGC7901/VCR、SGC7901/ADR、SGC7901细胞UHRF1蛋白的相对表达量分别为3.05±0.52、2.84±0.63、1.00±0.00,SGC7901细胞UHRF1蛋白的相对表达量明显低于SGC7901/VCR(t=6.83,P<0.01)、SGC7901/ADR(t=5.06,P<0.01),SGC7901/VCR、SGC7901/ADR细胞UHRF1蛋白相对表达量间比较差异无统计学意义(t=0.45,P>0.05)。
2.2VCR、ADR、5-FU、CDDP对SGC7901、SGC7901/VCR、SGC7901/ADR细胞的IC50比较VCR、ADR、5-FU、CDDP对SGC7901、SGC7901/VCR、SGC7901/ADR细胞的IC50见表1。
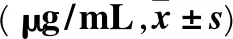
表1 VCR、ADR、5-FU、CDDP对SGC7901、SGC7901/VCR、SGC7901/ADR细胞的IC50比较
2.3 SGC7901、SGC7901/VCR、SGC7901/ADR细胞凋亡率比较 SGC7901、SGC7901-NC和SGC7901-UHRF1的细胞凋亡率分别为28.70%±3.03%、27.40%±2.81%和12.70%±1.43%,SGC7901-UHRF1细胞凋亡率明显高于其余两者(t分别为14.09、14.93,P均<0.05);SGC7901/VCR、SGC7901/VCR-NC和SGC7901/VCR-UHRF1的细胞凋亡率分别为8.90%±0.33%、8.77%±0.45%和37.63%±2.33%,SGC7901/VCR-siUHRF1细胞凋亡率明显高于其余两者(t分别为20.24、21.27,P均<0.05);SGC7901/ADR、SGC7901/ADR-NC和SGC7901/ADR-UHRF1细胞凋亡率分别为8.90%±0.33%、8.77%±0.45%和37.63%±2.33%,SGC7901/ADR-siUHRF1细胞凋亡率明显高于其余两者(t分别为16.95、15.43,P均<0.05)。
3 讨论
胃癌是最常见的消化道肿瘤,患者5年生存率极低[2]。胃癌细胞出现多药耐药性是胃癌患者5年生存率较低的主要原因[1,5],其发生机制包括药物排出增加、细胞内药物集聚再分配、药物解毒功能的增强、药物靶分子的改变、DNA损伤修复的增强及药物引起细胞凋亡受抑等[3,4,10]。UHRF1是UHRF超家族成员之一,作为转录因子可与拓扑异构酶Ⅱα基因的启动子结合,从而调控其表达水平[11]。研究表明UHRF1可通过表观遗传学机制,如DNA甲基化、组蛋白脱乙酰化、组蛋白甲基化和组蛋白泛素化等,来调控基因的表达[11,12]。UHRF1参与众多生理和病理活动,其中包括肿瘤的发生发展。UHRF1在多种肿瘤中表达增加,并且异常表达的UHRF1可导致BRCA1、CDKN2A、p73和RASSF1等抑癌基因的超甲基化[5,13~16]。近期研究表明,UHRF1在肿瘤的增殖、凋亡、侵袭、转移和耐药等进程发挥重要作用[13~16]。Jin等[17]的研究发现UHRF1可与多药耐药基因1(MDR1)的启动子结合,从而调控乳腺癌的耐药[17]。Fang等[18]进一步证明下调UHRF1表达可有效提高乳腺癌细胞对顺铂的敏感性。本课题组之前的研究证实,UHRF1在胃癌组织和细胞中均高表达,其表达水平可作为胃癌预后的重要指标,并且UHRF1参与胃癌的增殖与转移。然而,UHRF1在胃癌多药耐药中的作用尚未有研究报道。
本研究首先发现UHRF1在胃癌耐药细胞系SGC7901/VCR和SGC7901/ADR中的表达远远高于其相应亲本细胞系SGC7901,初步提示了UHRF1在胃癌耐药中发挥重要作用,是一种潜在的、耐药相关的癌基因。进一步改变细胞中UHRF1的表达水平发现,UHRF1表达下调,耐药细胞系对多种化疗药物的敏感性显著增加,并且细胞凋亡增加,而UHRF1表达上调,胃癌细胞系对众多化疗药物的敏感性明显减弱,细胞凋亡减少。本研究结果表明UHRF1基因促进胃癌多药耐药的发生,其可能机制是抑制胃癌细胞的凋亡,然而进一步具体分子机制仍不清。结合以往UHRF1在其他肿瘤中的研究,我们猜测有以下几种可能作用机制:①与MDR1基因的启动子结合调控胃癌的耐药;②调控胃癌凋亡相关基因。
综上所述,耐药人胃癌细胞中存在UHRF1高表达。UHRF1高表达可降低胃癌细胞的药物敏感性、提高多药耐药性,其机制可能与UHRF1抑制胃癌细胞凋亡有关。
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] Fodale V, Pierobon M, Liotta L, et al. Mechanism of cell adaptation: when and how do cancer cells develop chemoresistance[J]. Cancer J, 2011,17(2):89-95.
[3] Elkholi R, Renault TT, Serasinghe MN, et al. Putting the pieces together: How is the mitochondrial pathway of apoptosis regulated in cancer and chemotherapy[J]. Cancer Metab, 2014,48(2):16.
[4] Zhang D, Fan D. New insights into the mechanisms of gastric cancer multidrug resistance and future perspectives[J]. Future Oncol, 2010,6(4):527-537.
[5] Bronner C, Krifa M, Mousli M. Increasing role of UHRF1 in the reading and inheritance of the epigenetic code as well as in tumorogenesis[J]. Biochem Pharmacol, 2013,86(12):1643-1649.
[6] Zhou L, Zhao X, Han Y, et al. Regulation of UHRF1 by miR-146a/b modulates gastric cancer invasion and metastasis[J]. FASEB J, 2013,27(12):4929-4939.
[7] 类维振,耿亚楠,韩东升,等. UHRF1表达下调对胃癌细胞增殖的抑制作用及机制[J]. 山东医药,2016,56(21):7-9.
[8] 张伟,周林,李乃义,等. 胃癌组织UHRF1表达与预后相关性分析[J]. 中华肿瘤防治杂志,2015,22(2):109-112.
[9] 周林,张伟,李乃义,等. UHRF1在胃癌侵袭和转移中的作用及其机制[J]. 肿瘤防治研究,2016,43(4):14-18.
[10] Zhang D, Fan D. Multidrug resistance in gastric cancer: recent research advances and ongoing therapeutic challenges[J]. Expert Rev Anticancer Ther, 2007,7(10):1369-1378.
[11] Tauber M, Fischle W. Conserved linker regions and their regulation determine multiple chromatin-binding modes of UHRF1[J]. Nucleus, 2015,6(2):123-132.
[12] Zhang H, Liu H, Chen Y, et al. A cell cycle-dependent BRCA1-UHRF1 cascade regulates DNA double-strand break repair pathway choice[J]. Nat Commun, 2016,39(7):10201.
[13] Jin W, Chen L, Chen Y, et al. UHRF1 is associated with epigenetic silencing of BRCA1 in sporadic breast cancer[J]. Breast Cancer Res Treat, 2010,123(2):359-373.
[14] Matsushita R,Yoshino H,Enokida H,et al. Regulation of UHRF1 by dual-strand tumor-suppressor microRNA-145 (miR-145-5p and miR-145-3p): Inhibition of bladder cancer cell aggressiveness[J]. Oncorarget, 2016,7(19):28460-28487.
[15] Abu-Alainin W, Gana T, Liloglou T, et al. UHRF1 regulation of the Keap1-Nrf2 pathway in pancreatic cancer contributes to oncogenesis[J]. J Pathol, 2016,238(3):423-433.
[16] Zhu M, Xu Y, Ge M, et al. Regulation of UHRF1 by microRNA-9 modulates colorectal cancer cell proliferation and apoptosis[J]. Cancer Sci, 2015,106(7):833-839.
[17] Jin W, Liu Y, Xu SG, et al. UHRF1 inhibits MDR1 gene transcription and sensitizes breast cancer cells to anticancer drugs[J]. Breast Cancer Res Treat, 2010,124(1):39-48.
[18] Fang L, Shanqu L, Ping G, et al. Gene therapy with RNAi targeting UHRF1 driven by tumor-specific promoter inhibits tumor growth and enhances the sensitivity of chemotherapeutic drug in breast cancer in vitro and in vivo[J]. Cancer Chemother Pharmacol, 2012,69(4):1079-1087.
Expression of UHRF1 gene in gastric cancer resistant cells and its relationship with multidrug resistance
ZHOULin,LIWei,HANDongsheng,ZHANGWei
(The88thHospitalofPLA,Taian271000,China)
Objective To observe the expression changes of ubiquitin-like with PHD and ring finger domain 1 (UHRF1) in gastric cancer drug-resistance cells, and to explore the relationship with gastric cancer multidrug resistance. Methods We examined UHRF1 mRNA and protein expression in GC multidrug-resistant cell lines SGC7901/VCR and SGC7901/ADR and their parental cell line SGC7901 by RT-PCR and Western blotting. Small interfering RNA (siUHRF1) was transfected into SGC7901/VCR and SGC7901/ADR cells (SGC7901/VCR-siUHRF1, SGC7901/ADR-siUHRF1), respectively; and blank control group without any treatment was set. UHRF1 plasmid with overexpression (SGC7901-UHRF1) and empty blank plasmid (SGC7901-NC) were transfected into SGC7901 cells, and blank control group was also established. After 48-hour transfection, the cells were collected for further use. MTT assay was conducted to detect the GC cell line sensitivity to several chemotherapy drugs, including VCR, ADR, 5-FU and CDDP, and IC50was calculated. 5-FU was co-cultured with gastric cancer cell lines and the apoptosis was observed by flow cytometry (FCM). Results The relative mRNA and protein expression of UHRF1 in SGC7901 cell line was down-regulated as compared with that of SGC7901/VCR and SGC7901/ADR cells (allP<0.05). Promoting the expression of UHRF1 could increase the IC50of SGC7901 cells to VCR, ADR, 5-FU and CDDP and the apoptosis was decreased (allP<0.05). Silencing UHRF1 expression could reduce the IC50of SGC7901/VCR and SGC7901/ADR cells to VCR, ADR, 5-FU and CDDP, and the apoptosis rate was increased (allP<0.05).Conclusions UHRF1 is highly expressed in gastric cancer drug-resistance cell lines, and the high expression of UHRF1 may decrease drug sensitivity and improve multidrug resistance of gastric cancer, which may be related to the inhibition of UHRF1 on the apoptosis of gastric cancer cells.
gastric carcinoma; ubiquitin-like with PHD and ring finger domain 1; multidrug resistance; drug sensitivity; median inhibitory concentration; apoptosis
国家自然科学基金资助项目(81402337)。
周林(1988-),男,博士,主治医师,主要研究方向为胃肠道肿瘤的基础与临床。E-mail: zhoulin1105@163.com
简介:张伟(1967-),女,博士,副主任医师,主要研究方向为消化系统疾病的基础与临床。E-mail: chunll88@sohu.com
10.3969/j.issn.1002-266X.2016.39.001
R735.2
A
1002-266X(2016)39-0001-04
2016-07-22)
