雷贝拉唑钠肠溶片处方筛选及评价
2016-12-27卢会芬任军乐温占勇王瑞强
卢会芬,任军乐,温占勇,王瑞强
(石家庄以岭药业股份有限公司,河北石家庄 050035)
雷贝拉唑钠肠溶片处方筛选及评价
卢会芬,任军乐,温占勇,王瑞强
(石家庄以岭药业股份有限公司,河北石家庄 050035)
为优化雷贝拉唑钠肠溶片的处方,以释放曲线和稳定性结果为考察指标,考察了不同碱化剂及肠溶层增重对处方的影响。结果表明:以氢氧化钠和氧化镁作为碱化剂,肠溶层增重为11%时,制备的肠溶片在pH值为8.0的溶出介质中的释放曲线与原研制剂相似,加速稳定性试验结果也符合《中华人民共和国药典》要求。试验结果表明,筛选的雷贝拉唑钠肠溶片处方合理稳定。
药剂学;雷贝拉唑钠;肠溶片;处方;稳定性;释放曲线
雷贝拉唑是一种苯并咪唑类质子泵抑制剂,可以选择性地抑制H+/K+-ATP酶的活性。与其他同类产品相比,雷贝拉唑对质子泵的作用效果更快,作用时间更持久,抑酸效果也更好[1-3],临床上主要用于治疗活动性十二指肠溃疡、活动性良性胃溃疡、弥散性或溃疡性胃-食管反流[4-5]。雷贝拉唑钠是雷贝拉唑的钠盐,稳定性较差,在酸性条件下易降解,在碱性条件下较稳定,人体胃液中的酸性环境会导致雷贝拉唑钠的快速降解[6]。口服雷贝拉唑钠的绝对生物利用度在52%左右[7],如果再受到胃酸的影响,生物利用度会更低。肠溶制剂可以说是雷贝拉唑钠的最佳剂型,凭借延迟药物的释放,可使药物分子到达小肠后才被较快释放,从而提高生物利用度。
利用碱化剂提高质子泵抑制剂类药物的稳定性是药物开发中常用且有效的方法[8-12]。本研究主要以碱化剂为处方筛选对象,以稳定性和释放曲线为考察指标,以期获得一个合理稳定的处方,用于规模生产。
1 原料和仪器
1.1 原料
雷贝拉唑钠,印度NOSCH有限公司提供;雷贝拉唑钠对照品,自制标定;甘露醇,默克化工有限公司提供;交联聚维酮,美国国际特品公司提供;氧化镁,日本富田制药株式会社提供;羟丙基纤维素,日本曹达株式会社提供;无水乙醇,太仓新太酒精有限公司提供;硬脂酸镁,大连格莱汶化工有限公司提供;硬脂富马酸钠,德国JRS公司提供;乙基纤维素,陶氏化学公司提供;滑石粉,意大利IMERYS公司提供;氢氧化钠,默克化工有限公司提供;羟丙甲纤维素邻苯二甲酸酯,信越化学工业株式会社提供;黄色氧化铁,森馨香精色素科技(中国)有限公司提供;二氧化钛,森馨香精色素科技(中国)有限公司提供;柠檬酸三乙酯,凡特鲁斯功能化学品公司提供;原研制剂,日本卫材株式会社提供,批号为005742;高密度聚乙烯(HDPE)瓶,印度SHRIJI公司提供。
1.2 仪器
Mini-CG1/6湿法制粒机,创志机电科技发展有限公司提供;FLZB-1.5沸腾流化床,创志机电科技发展有限公司提供;HLS-30混合机,温州小伦包衣技术有限公司提供;ZP-10A旋转式压片机,北京国药龙立科技有限公司提供;BG1-5包衣机,中航工业北京航空制造工程研究所提供;TBH125硬度仪,ERWKA公司提供;ZT320崩解仪,ERWKA公司提供;FT2脆碎仪,SOTAX公司提供;ME303,ME3002电子天平,梅特勒-托利多公司提供;ELITE8溶出仪,HANSON公司提供;e2695高效液相色谱仪,WATERS公司提供。
2 方法和结果
2.1 雷贝拉唑钠含量、有关物质及释放度的测定[13]
2.1.1 含量测定
取本品,以0.1 mol/L盐酸溶液700 mL为溶出介质,转速为100 r/min,依法操作。120 min后,取上述各片,用水迅速洗去残余酸液后,按照含量测定方法进行测定,6片中每片含量均不得少于标示量的90%。若有1—2片小于标示量的90%,但平均含量不得少于标示量的90%。
2.1.2 有关物质测定
取本品细粉适量(约相当于雷贝拉唑钠100 mg),置于100 mL量瓶中,加入0.05 mol/L氢氧化钠溶液60 mL,超声使雷贝拉唑钠溶解,冷却,用乙腈稀释至刻度,摇匀,离心分离后取上清液(必要时过滤)作为供试品溶液。精密量取1 mL,置于100 mL量瓶中,用溶剂(0.05 mol/L氢氧化钠溶液-乙腈(二者体积比为60∶40),以下简称溶剂)稀释至刻度,摇匀,作为对照溶液。取对照溶液适量,用溶剂定量稀释制成每1 mL中约含0.5 μg的溶液,作为灵敏度溶液。按照雷贝拉唑钠有关物质项下的方法测定,供试品溶液色谱图中如有杂质峰,除相对保留时间约为0.44之前的辅料峰外,单个杂质峰面积不得大于对照溶液主峰面积(1.0%),各杂质峰面积的和不得大于对照溶液主峰面积的2倍(2.0%)。供试品溶液色谱图中小于灵敏度溶液主成分峰面积的色谱峰忽略不计。
2.1.3 释放度测定
取本品,按照溶出度与释放度测定法(参见《中华人民共和国药典》2015年版通则0931第二法方法1)测定,以0.1 mol/L盐酸溶液700 mL为溶出介质,转速为100 r/min,依法操作,经120 min时,供试片均不得有变色、裂缝或崩解现象。在操作容器中加入37 ℃浓度为0.6 mol/L的三羟甲基氨基甲烷溶液300 mL,用2 mol/L盐酸溶液或2 mol/L氢氧化钠溶液调节pH值至8.0,转速不变,继续依法操作,经30 min时,取出溶液过滤。精密量取续滤液3 mL,立即精密加入0.5 mol/L氢氧化钠溶液1 mL,摇匀,作为供试品溶液。另取雷贝拉唑钠对照品50 mg,精密称定,置于50 mL量瓶中,加入适量0.5 mol/L的氢氧化钠溶液使之溶解,用0.5 mol/L 氢氧化钠溶液稀释至刻度。摇匀后精密量取3 mL,置于50 mL(20 mg规格)量瓶中,用0.5 mol/L氢氧化钠溶液稀释至刻度。摇匀后精密量取1 mL,精密加入三羟甲基氨基甲烷缓冲液(700 mL 的0.1 mol/L盐酸溶液中加入0.6 mol/L三羟甲基氨基甲烷溶液300 mL,用2 mol/L盐酸溶液或2 mol/L氢氧化钠溶液调节pH值至8.0)3 mL,摇匀,作为对照品溶液。取对照品溶液与供试品溶液,按照含量测定项下的方法进行测定,计算每片的溶出量,限度为标示量的80%,应符合规定。
2.2 制备工艺和处方筛选
2.2.1 制备工艺
1)片芯制备
4 000片/批,原、辅料过0.250 mm(60目)筛备用,将交联聚维酮溶于无水乙醇后得到黏合剂。加入原、辅料,按照处方中的顺序分别加入到湿法制粒机锅中,在搅拌转速为200 r/min下混合10 min后,于搅拌转速150 r/min下3 min内加完黏合剂,再于搅拌转速为150 r/min、剪切转速为1 000 r/min条件下制粒2 min。将所得湿颗粒放入流化床中,于50 ℃干燥1 h,并用1.5 mm筛网整粒机整粒。将干整后的颗粒、硬脂酸镁、硬脂富马酸钠在混合机中于10 r/min下混合5 min,检测含量后,压片,然后分别包覆隔离层和肠溶层。
2)隔离层包衣
称取乙基纤维素,加入到处方量2/3的无水乙醇中,持续搅拌直至乙基纤维素完全溶解。称取氢氧化钠,加入到处方量1/3的无水乙醇中,持续搅拌直至氢氧化钠完全溶解后加入氧化镁,再加入到上述的乙基纤维素无水乙醇溶液中搅拌40 min,过0.150 mm(100目)筛后得到隔离层包衣液。将片芯置于包衣锅内,设置包衣锅转速为8 r/min,片床温度为30~33 ℃,雾化压力为1×106Pa,包衣液流量为10 g/min,锅体负压,按照处方要求控制隔离层包衣增重。
3)肠溶层包衣
称取无水乙醇,搅拌状态下加入羟丙甲纤维素邻苯二甲酸酯。称取纯化水置于烧杯中,加入滑石粉、二氧化钛、柠檬酸三乙酯和黄色氧化铁,高速均浆10 min后,加入到上述羟丙甲纤维素邻苯二甲酸酯无水乙醇溶液中,搅拌40 min,过0.150 mm(100目)筛后得到肠溶层包衣液。将隔离层包衣片置于包衣锅内,设置包衣锅转速为8 r/min,片床温度为30~33 ℃,雾化压力为1.2×106Pa,包衣液流量为20 g/min,锅体负压,按处方要求控制肠溶层包衣增重。
2.2.2 处方筛选
雷贝拉唑钠在碱性条件下较稳定,在处方中加入碱性物质可以维持碱性环境,提高产品的稳定性。本实验通过调整碱化剂用量或种类,设计了6个不同的片芯处方,详见表1。处方F4所得总混后颗粒的流动性较差,压片时压片机料斗中形成孔洞,片重差异较大,甚至无法压片。
隔离层、肠溶层包衣液处方见表2和表3,颗粒总混后颗粒物理性质检测结果见表4。处方F4总混后颗粒的卡尔系数和豪斯纳比值比其他处方数值略高,也证明其流动性较差[14-15]。根据压片所得片芯的测定结果,处方F5和F6片芯的崩解时间较长,超过10 min;处方F1,F2和F3片芯的崩解时间、硬度等指标均符合下一步工艺要求,片芯的检测结果详见表5。
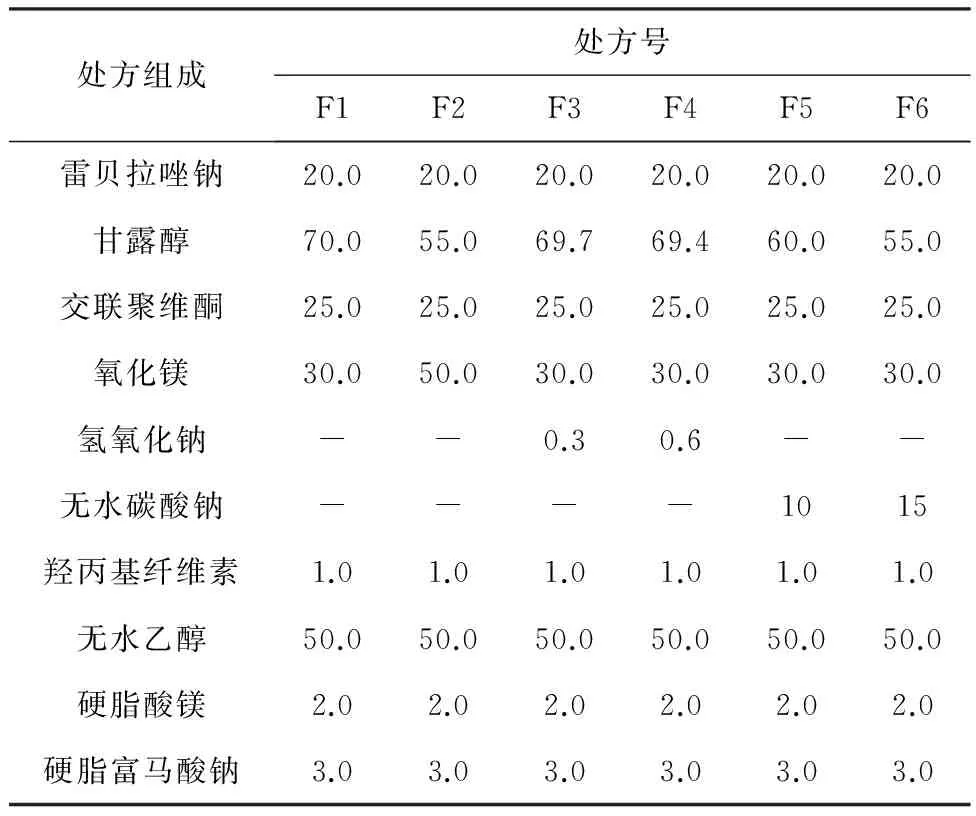
表1 片芯处方筛选表

表2 隔离层包衣液处方

表3 肠溶层包衣液处方
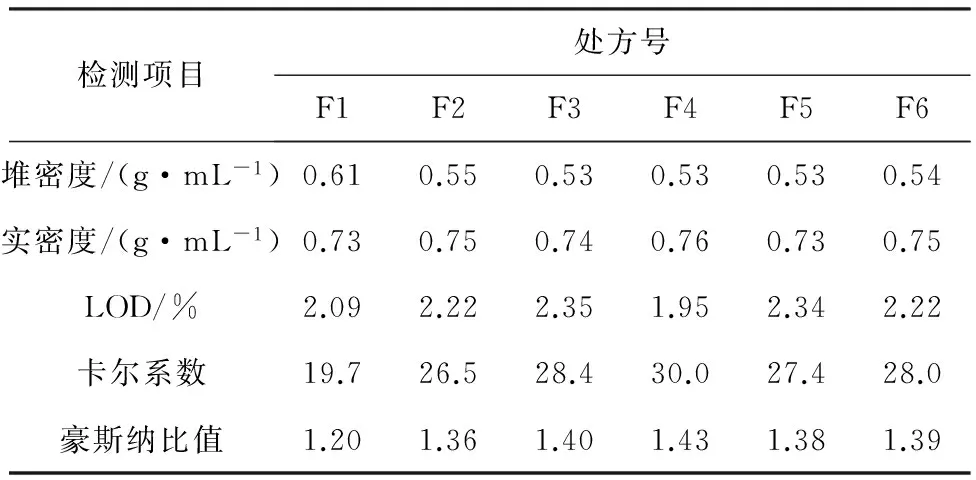
表4 总混后颗粒物理性质

表5 片芯性质测定
肠溶材料选择与原研制剂肠溶材料一致的羟丙甲纤维素邻苯二甲酸酯,羟丙甲纤维素邻苯二甲酸酯为包含羧酸基团的多聚物,片芯和肠溶层材料直接接触时可能会导致药物的降解[16-17]。因此,在片芯表面首先要包一层隔离层,隔离层增重3%后,再包肠溶层。考虑到肠溶材料为酸性材料,在存放过程中会产生酸性杂质,所以尽量不要将肠溶层包覆过厚,以利于产品的稳定。肠溶层分别增重7%,9%,11%后,考察肠溶片的耐酸力及释放度。
2.3 雷贝拉唑钠肠溶片的评价
2.3.1 肠溶片释放度测定
将处方F1,F2和F3分别增重7%,9%,11%的肠溶片置于pH值为1.2的盐酸溶液中,搅拌转速为100 r/min,120 min目测均无裂片,肠溶片外表完好;再于pH值为8.0的磷酸盐缓冲液中测定释放度。肠溶层增重7%时,自制样品释放均快于原研制剂;处方F1肠溶层增重11%时,释放稍快于原研制剂;处方F2肠溶层增重9%和处方F3肠溶层增重11%时,释放曲线与原研制剂相似。自制制剂F2和F3与原研制剂在pH值为8.0的磷酸盐缓冲液中5,10,15,20,30,45,60 min的释放曲线见图1。通过比较自制制剂与原研制剂的药物释放曲线发现,自制制剂的释放曲线与原研制剂相似性很高,其中处方F2的相似性最高。
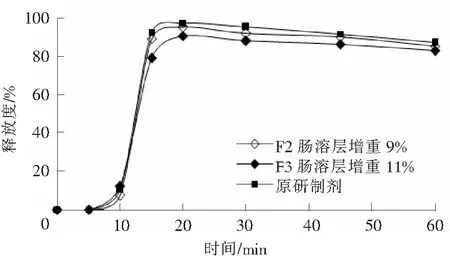
图1 肠溶片的释放曲线Fig.1 Release profile of enteric coating tablet
2.3.2 肠溶片的稳定性
将处方F1,F2和F3肠溶片装于HDPE瓶密封后(30片/50 mL),置于40 ℃/75% RH条件下放置6个月,分别在0,1,2,3,6个月时取样,考察稳定性,处方F3的稳定性结果最好,见表6。

表6 稳定性检测结果
结果表明,加速试验6个月,样品的性状基本无变化,有关物质符合《中华人民共和国药典》要求,其中处方F3的稳定性结果最好,F2的稳定性结果好于F1。这说明处方中氧化镁用量高,稳定性会变好;而采用氢氧化钠和氧化镁联合使用,比单独使用氧化镁作为碱化剂的稳定性要好。加速稳定性试验也表明该处方工艺制得的样品质量稳定。
3 讨 论
雷贝拉唑钠在碱性条件下较为稳定,碱化剂的筛选对处方非常关键。本研究采用乙醇制粒,对雷贝拉唑钠肠溶片的片芯处方及肠溶层包衣增重进行了筛选。片芯和肠溶层之间包有一层隔离层,其一方面可避免酸性肠溶材料对雷贝拉唑钠的破坏,另一方面也起到部分防潮的效果。
对制备的样品进行了释放曲线及稳定性的测定。结果表明:使用碱化剂,可以提高雷贝拉唑钠肠溶片的稳定性;控制肠溶层增重,可以控制药物释放速度。自制雷贝拉唑钠肠溶片与原研制剂的释放曲线基本一致,稳定性符合《中华人民共和国药典》要求。
[1] PACE F, PALLOTTA S, CASALINI S, et al. A review of rabeprazole in the treatment of acid-related diseases[J]. Therapeutics and Clinical Risk Management, 2007, 3(3): 363-366.
[2] PANTOFLICKOVA D, DORTA G, RAVIC M, et al. Acid inhibition on the first day of dosing: comparison of four proton pump inhibitors[J]. Alimentary Pharmacology & Therapeutics, 2003, 17(12): 1507-1514.
[3] CLAUDINE M, BALDWIN, SUSAN J K. Rabeprazole: A review of its use in the management of gastric acid-related diseases in adults[J]. Drugs, 2009, 69(10): 1373-1401.
[4] 陈新谦, 金有豫, 汤光. 新编药物学[M]. 17版. 北京: 人民卫生出版社, 2011.
[5] CARSWELL C I, GOA K L. Rabeprazole: An update of its use in acid-related disorders[J]. Drugs, 2001, 61(15): 2327-2356.
[6] RICHARDSON P, HAWKEY C J, STACK W A. Proton pump inhibitors[J]. Drugs, 1998, 56(3): 307-335.
[7] FUHR U, JETTER A. Rabeprazole: Pharmacokinetics and pharmacokinetic drug interactions[J]. Pharmazie,2002,57(9): 595-601.
[8] TURKOGLU M, VAROL H, CELIKOK M. Tableting and stability evaluation of enteric-coated omeprazole pellets[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2004, 57(2): 279-286.
[9] HE Wei, TIAN Zhiqiang, YANG Min, et al. A comparative study of the effect of different alkaline stabilizers on physicochemical properties of lansoprazole in formulation[J]. Asian Journal of Pharmaceutical Sciences, 2011, 6(3/4): 89-100.
[10]SENTHILKUMAR K L,MUTHUKUMARAN M, CHENCHURATNAM B. Formulation and evaluation of rabeprazole sodium enteric coated pellets[J]. IJAPBC, 2012(1): 7-14.
[11]刘振涛,金冲,叶迎九,等.银杏叶片薄膜包衣的生产工艺研究[J].河北工业科技,2004,21(3):29-30. LIU Zhentao,JIN Chong,YE Yingjiu,et al.Studies on production process of film coating of Yinxingye tablets[J].Hebei Journal of Industrial Science and Technology,2004,21(3):29-30.
[12]谢英花,胡易,马燕山,等.盐酸二甲双胍缓释骨架微丸的研制[J].河北科技大学学报,2013,34(3):224-229. XIE Yinghua, HU Yi, MA Yanshan, et al.Preparation of metformin hydrochloride sustained-release matrix pellets[J].Journal of Hebei University of Science and Technology,2013,34(3):224-229.
[13]国家药典委员会.中华人民共和国药典(二部)[M].北京: 化学工业出版社, 2015: 1479-1480.
[14]SCHULZE D. Powders and Bulk Solids: Behavior, Characterization, Storage and Flow[M]. Berlin Heidelberg: Springer Science & Business Media, 2007: 176-179.
[15]QIU Y, CHEN Y, ZHANG G G, et al. Developing Solid Oral Dosage Forms: Pharmaceutical Theory and Practice[M]. Burlington, MA: Academic Press, 2009: 169-170.
[16]WEN H, PARK K. Oral Controlled Release Formulation Design and Drug Delivery: Theory to Practice[M]. Hoboken, NJ: John Wiley & Sons, 2011: 205-208.
[17]RIEDEL A, LEOPOLD C S. Degradation of omeprazole induced by enteric polymer solutions and aqueous dispersions: HPLC investigations[J]. Drug Dev Ind Pharm, 2005, 31(2): 151-160.
Formula screening and evaluation of rabeprazole sodium enteric-coated tablet
LU Huifen, REN Junle, WEN Zhanyong, WANG Ruiqiang
(Shijiazhuang Yiling Pharmaceutical Company Limited, Shijiazhuang, Hebei 050035, China)
For optimizing the formula of rabeprazole sodium enteric-coated tablets, the effect of different alkaline agents and different weight gain of enteric coating on formulas are evaluated according to the release profile and stability data of the rabeprazole sodium enteric-coating tablets. The results show that with sodium hydroxide and magnesium oxide as alkaline agents, and the weight gain of enteric coating being 11%, the obtained rabeprazole sodium enteric-coated tablets in pH 8.0 medium has similar release profile compared to primary triturate, and accelerated stability study result conforms to the Chinese Pharmacopoeia. The experiment results indicate that the screened formula of rabeprazole sodium enteric-coated tablets is rational and stable.
pharmaceutics; rabeprazole sodium; enteric-coated tablet; formula; stability; release profile
1008-1534(2016)04-0314-05
2016-03-23;
2016-04-24;责任编辑:张士莹
卢会芬(1979—),女,河北行唐人,主管药师,主要从事药物制剂生产技术及研究方面的工作。
任军乐工程师。 E-mail: maysoler@163.com
R944.4
A
10.7535/hbgykj.2016yx04009
卢会芬,任军乐,温占勇,等.雷贝拉唑钠肠溶片处方筛选及评价[J].河北工业科技,2016,33(4):314-318. LU Huifen, REN Junle, WEN Zhanyong, et al.Formula screening and evaluation of rabeprazole sodium enteric-coated tablet[J].Hebei Journal of Industrial Science and Technology,2016,33(4):314-318.
