茶叶籽油中角鲨烯的定性与定量分析
2016-12-26肖义坡邓丹雯罗家星
肖义坡 邓丹雯 罗家星 单 艳 白 雪 张 彬
(南昌大学中德食品工程中心1,南昌 330047)(南昌大学中德联合研究院2,南昌 330047)(金佳谷物股份有限公司樟树油厂3,樟树 331200)
茶叶籽油中角鲨烯的定性与定量分析
肖义坡1邓丹雯1罗家星3单 艳2白 雪1张 彬1
(南昌大学中德食品工程中心1,南昌 330047)(南昌大学中德联合研究院2,南昌 330047)(金佳谷物股份有限公司樟树油厂3,樟树 331200)
采用GC-MS分析茶叶籽油中不皂化物的成分,并采用高效液相色谱法对茶叶籽油中的角鲨烯进行定量分析。结果表明:茶叶籽油不皂化物的主要成分为角鲨烯、α-生育酚,另外还有合金欢醇、香叶里拉醇、羊毛甾醇、茉莉酮、D12齐墩果烯、2,4-二叔丁基苯酚及2,5-二叔丁基-1,4-苯醌等物质。通过C18柱分离样品中的角鲨烯,当流动相为甲醇/乙腈(60+40,V/V)、检测波长210 nm、流速2 mL/min、柱温30 ℃时,能有效分离茶叶籽油样品中的各组分,再经HPLC测得茶叶籽油中角鲨烯含量为4.1 mg/kg。当角鲨烯质量浓度在20~500 mg/L之间时,峰面积和质量浓度的线性关系较好,线性相关系数(R2)为0.999 0;平均加标回收率为84.2%~90.1%,相对标准偏差(RSD)小于6.98%(n=4),此方法的测定低限( LOQ)为2.7 mg/kg。
茶叶籽油 不皂化物 GC-MS 角鲨烯 高效液相色谱法
角鲨烯又称鱼肝油萜、鲨烯[1],是一种高度不饱和的脂肪族烃类化合物,化学名称为2,6,10,15,19,23-六甲基-2,6,10,14,18,22-二十四碳六烯,属开链三萜烯类,常温状态为无色油状液体,最早是在黑鲨鱼的肝油中发现的,于1914年被命名为Squalene。角鲨烯不仅具有促进新陈代谢,抗疲劳、强化内脏的作用,还具有极强的供氧能力,可抑制癌细胞生成,能有效地防止细胞的老化,提高机体免疫力。角鲨烯主要来自深海鲨鱼肝油,占脂质总量90%以上,同时还少量存在于植物油脂不皂化物中,尤其是在橄榄油、棕榈油及其脱臭馏出物中含量较多,罗汉果种仁油、菜籽油、大豆油、米糠油、棉籽油等植物油也含有一定量角鲨烯[2]。
茶叶籽油属于新资源食品,不饱和脂肪酸含量超过82%,其中亚油酸与亚麻酸的比例为10∶1,是人体所需要的比例,同时还含有维生素E、植物甾醇、胡萝卜素、角鲨烯等多种强抗氧化成分,营养价值较高。对茶叶籽油中角鲨烯进行定性和定量分析,确定茶叶籽油中不皂化物成分及角鲨烯含量,对于茶叶籽油的研究、开发及利用有实际意义。
近年来,关于油料油脂中角鲨烯的分析,国内外均有报道,角鲨烯的分析方法主要有气相色谱法[3-5]、液相色谱法[6]以及气质联用法[7]等,其中以气相色谱法居多,也有采用高效液相色谱法进行测定。陈全斌等[8]在对罗汉果种仁油中的角鲨烯进行分析时,将样品油用氯仿溶解后采用高效液相色谱分析,测出罗汉果种仁油含角鲨烯12. 5%。钟冬莲等[5]建立了油茶籽油中角鲨烯含量测定的气相色谱检测方法,样品经氢氧化钾-乙醇溶液皂化,石油醚萃取净化,经HP-5色谱柱分离,气相色谱仪( GC-FID) 检测,外标法定量,测定出油茶籽油中角鲨烯含量为2.083 g/kg。目前,国内外关于茶叶籽油中角鲨烯的定性与定量研究鲜见报道。
本研究先采用GC-MS分析茶叶籽油不皂化物成分,对角鲨烯进行定性分析;然后采用高效液相色谱法对茶叶籽油中角鲨烯进行定量分析,为茶叶籽油中角鲨烯的测定提供参考。
1 材料与方法
1.1 材料与试剂
茶叶籽:江西茗果产业农业科技有限公司。
角鲨烯标准品:纯度≥98%,美国阿拉丁工业公司;95%乙醇、氢氧化钾、石油醚:沸程35 ~ 60 ℃,天津市大茂化学试剂厂;N,O-双(三甲基硅烷基)三氟乙酰胺:美国阿拉丁工业公司;正己烷:色谱纯、乙腈:色谱纯、甲醇:色谱纯,天津市永大化学试剂开发中心;水为超纯水。
1.2 主要仪器
RE52-98旋转蒸发仪:上海亚荣生化仪器厂;氮气吹扫仪:杭州瑞城仪器有限公司;HHS型电热恒温水浴锅:上海博讯实业有限公司医疗设备厂;BS224S型电子天平:赛多利斯科学仪器(北京)有限公司;6890N/5973i气相色谱-质谱联用仪:美国Agilent公司;超声波清洗机:上海精密仪器公司;LC-6A 高效液相色谱仪:日本岛津公司。
1.3 试验方法
1.3.1 茶叶籽油提取
将干燥后的茶叶籽进行脱壳处理,然后用小型粉碎机将茶叶籽仁粉碎,得到籽仁粉。取100 g籽仁粉,按4∶1(V/W)的料液比加入石油醚,在室温下搅拌浸提1 h,抽滤后的提取液经过脱溶得到茶叶籽毛油,将毛油存放在冰箱中备用。
1.3.2 茶叶籽油不皂化物提取
取5 g茶叶籽油于250 mL圆底烧瓶中,加入沸石及1 mol/L的氢氧化钾-乙醇水溶液50 mL,在沸腾条件下皂化1 h,然后加入50 mL蒸馏水;待皂化液冷却后转移至分液漏斗中,用50 mL石油醚重复萃取不皂化物3次;合并3次提取液,用体积分数为10%的乙醇溶液洗涤石油醚提取液,每次25 mL,以洗涤液中加入酚酞,完全不变色为准;旋转蒸发脱溶得到不皂化物。
1.3.3 GC-MS分析茶叶籽油不皂化物成分
茶叶籽油不皂化物烷基化:取50 mg茶叶籽油不皂化物溶解于5 mL正己烷中,过无水硫酸钠脱水后取600 μL于10 mL试管中,加入600 μL BSTFA-TMCS(三氟乙酰胺-三甲基硅烷),在60 ℃水浴中加热硅烷化1 h。吹氮脱溶,残留物用500 μL正己烷溶解,并用滤头过滤,取1 μL进行GC-MS检测。
色谱条件:色谱柱为安捷伦122-3832毛细管柱(DB-35 ms,0.25 mm×30 m×0.25 μm)。升温程序:初温60 ℃,维持2 min,升温至300 ℃,维持5 min;进样温度320 ℃,压力10.25 psi,载气是氦气(He),流速为1.0 mL/min,进样量1 μL,分流比50∶1。
质谱条件:接口温度为280 ℃,离子源温度220 ℃,MS四级杆温度140 ℃,溶剂延迟:3 min;质量扫描范围35~540m/z。
1.3.4 高效液相色谱法分析茶叶籽油中角鲨烯
标准溶液的配制:精确称取50 mg 角鲨烯标准品于50 mL 容量瓶中,用甲醇定容至刻度,摇匀,得到1.0 mg/mL角鲨烯标准储备液。
样品处理:称取茶叶籽油样品0.10 g于烧杯中(精确至0.001 g) ,加入甲醇溶解,倒入100 mL容量瓶中定容,混匀后超声30 s,功率300 W。用注射针吸取1 mL样品溶液,经过滤后转移到1mL进样小瓶中,待测。
液相色谱条件:色谱柱为Kromasil 100-5C18 柱( 4.6 mm×250 mm) ,甲醇/乙腈( 60+40,V/V) 作为流动相,紫外检测波长210 nm,柱温30 ℃,流速2.0 mL/min。
2 结果与分析
2.1 GC-MS测定茶叶籽油不皂化物成分
采用GC-MS测定茶叶籽油不皂化物成分,采用峰面积归一法来计算各成分的相对含量。茶叶籽油不皂化物总离子流色谱图见图1。
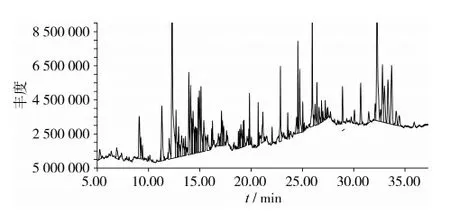
图1 茶叶籽油不皂化物总离子流(TIC)色谱图
GC-MS联用所得质谱信息经计算机用NIST02.L标准谱库检索对照分析,确认了其中部分化学成分。茶叶籽油不皂化物化学成分分析结果见表1。
结果表明:茶叶籽油不皂化物成分中主要有羊毛甾醇、角鲨烯、2,4-二叔丁基苯酚、正十六烷、正十八烷、1,1-双(吗啉)乙烯、D12齐墩果烯、2,5-二叔丁基-1,4-苯醌、5-丁基-6-己基-八氢化-1H-茚、合金欢醇、ɑ-生育酚、香叶里拉醇,含量分别为5.91%、3.63%、2.77%、2.60%、2.41%、2.29%、2.15%、1.92%、1.68%、1.31%、1.12%、1.03%。从其他草本植物中得到的油脂,如油茶籽油与橄榄油,与二者的不皂化物相比较同样是三萜醇含量较高[9]。茶叶籽油不皂化物中的α-生育酚含量相对较高,同时检测到了少量的γ-生育酚。检测出了D12齐墩果烯及1,1-双(吗啉)乙烯,但没有检测出汤富彬等[10]报导的β-谷甾醇以及朱晋萱等[11]报导的△7,22一麦角甾二烯醇。
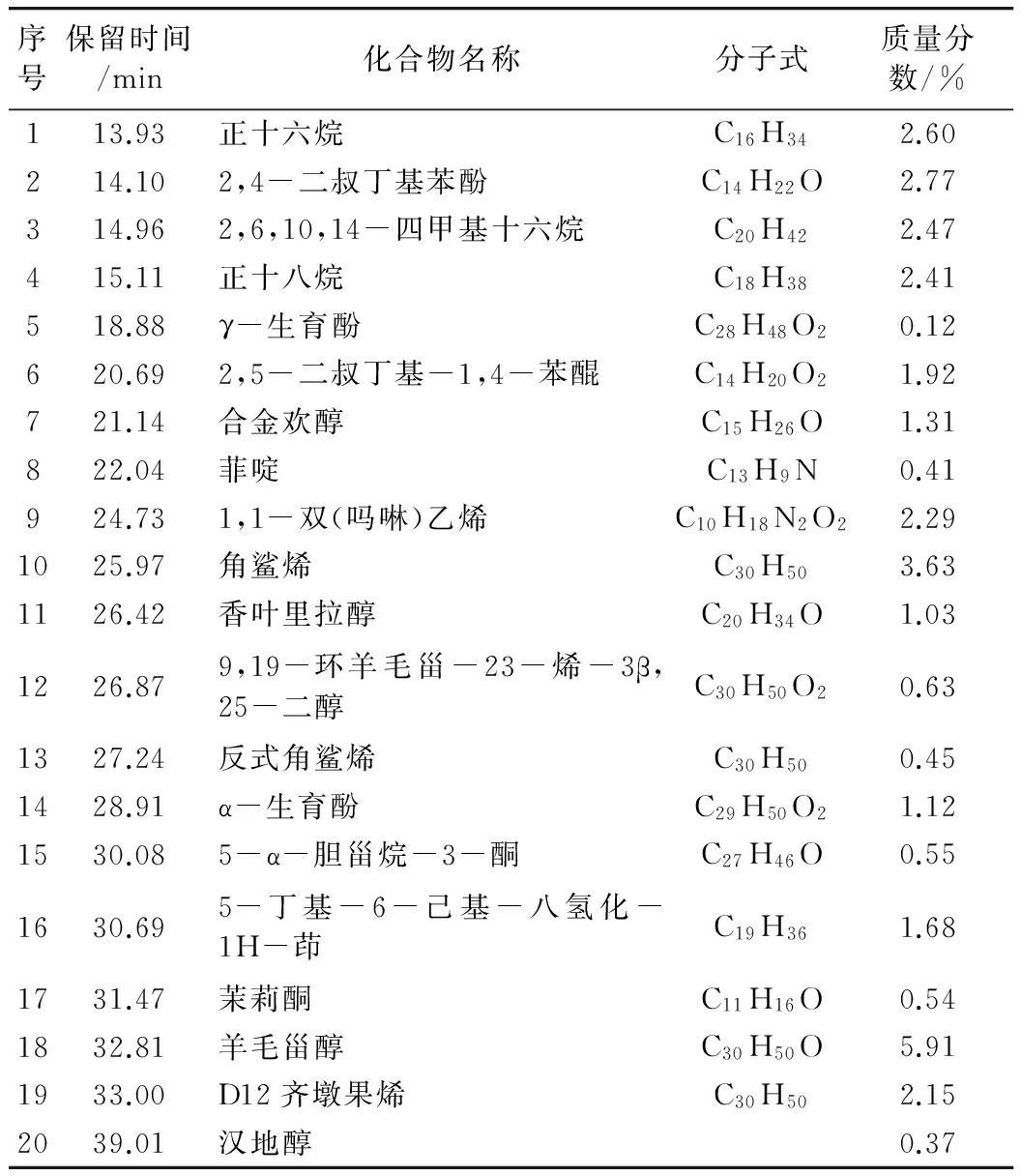
表1 茶叶籽油不皂化物成分
另外,还检测出了菲啶、香叶里拉醇、茉莉酮、羊毛甾醇[12]以及合金欢醇。菲啶存在于煤焦油高沸点馏分中,可用邻氯苯亚甲基苯胺与氨基钾在液氨中反应制得;香叶里拉醇又名香叶基芳樟醇,是链状二萜类药物和天然产物的重要中间体、生物活性化合物和香料定香成分;茉莉酮是存在于茉莉花胡椒、留兰香、长寿花、香柠檬、薄荷、茶叶和多种花中的天然物质;羊毛甾醇属四环三萜类化合物,可从链状的角鲨烯关环制备,羊毛甾醇是胆甾醇生物合成的中间体;合金欢醇是一种直链倍半萜物质,又名法尼醇、麝子油醇,具有甜香、花香、青香,存在于巴西檀木、晚香玉、黄葵子、依兰依兰、金合欢、茉莉及橙花的香精油中,主要用作香料,用于加强类似丁香及仙来花香味。
2.2 高效液相色谱法分析茶叶籽油中角鲨烯的含量
2.2.1 流动相的选择
选用反相色谱对角鲨烯进行分离,选择甲醇/乙腈作为流动相,通过改变甲醇与乙腈的体积比来调整角鲨烯的分离效果,结果显示,当流动相为甲醇/乙腈(60+40,V/V)、检测波长210 nm、流速2 mL/min、柱温30 ℃时,茶叶籽油样品中各组分间分离效果最好,色谱图如图2所示。
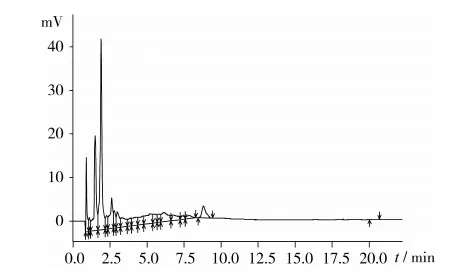
图2 茶叶籽油样品色谱图
取标准溶液20 μL进样,色谱图见图3。
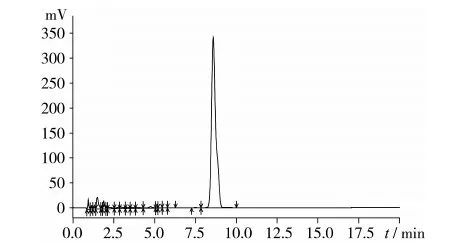
图3 角鲨烯标准溶液色谱图
综合图2、图3可知,样品待测液与标准溶液中的角鲨烯保留时间相同,为8.7 min,即选定的色谱条件能充分分离角鲨烯标准溶液和茶叶籽油样品溶液中的角鲨烯。
2.2.2 标准曲线的绘制
取1.0 mg/mL 角鲨烯标准储备液,用甲醇配制成质量浓度分别为0.02、0.05、0.1、0.25、0.50 mg/mL系列标准工作溶液。在选定的色谱条件下,取20 μL 进样,记录色谱图,以峰面积(y) 为纵坐标,质量浓度(x)为横坐标,进行线性回归,绘制出角鲨烯的标准曲线(见图4 ),结果表明在试验质量浓度范围内线性良好,回归方程为y=2.6×107x+2.0×105,线性相关系数为0.999 0。
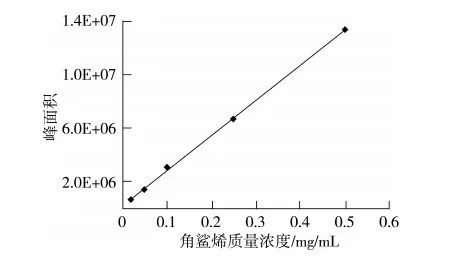
图4 角鲨烯的标准曲线图
2.2.3 回收率、精密度和检测限
茶叶籽油角鲨烯含量较少,加标回收试验样品中角鲨烯添加量分别为5.0、10、50和100 mg/kg,每一添加水平的试验次数为4次,样品处理和测定按1.3.4进行。先测定茶叶籽油样品中角鲨烯的本底含量,之后分别测定加入角鲨烯后样品中的角鲨烯含量,把样品中角鲨烯的本底含量扣除后,计算所添加角鲨烯的回收率。加标样品中角鲨烯的回收率和精密度结果见表2。由表2可见,平均添加回收率为84.2%~90.1%,相对标准偏差(RSD)<6.98%(n=4) 。以可以准确测定的最低质量浓度定性为测定低限(LOQ) ,依据GB/T 27404—2008中方法测定低限公式,此方法的LOQ为2.7 mg/kg。
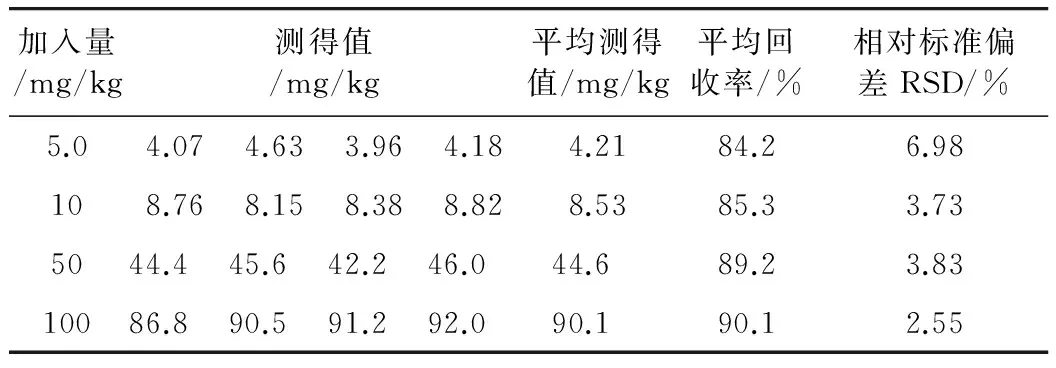
表2 加标样品的回收率及精密度(n=4)
查阅相关文献,将本检测方法的技术要求与相关文献进行对比,结果见表3。
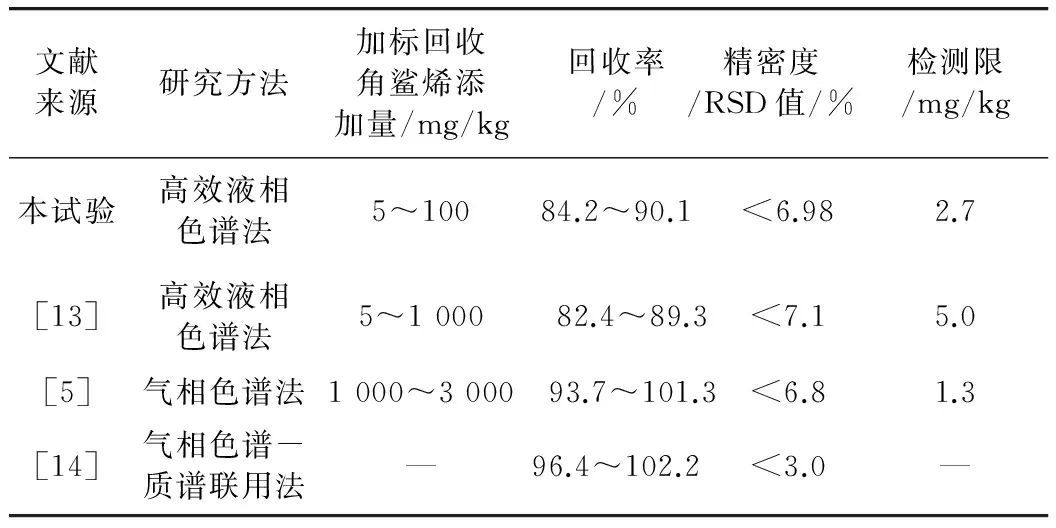
表3 检测方法的技术要求对比
查阅国标GB/T 27404—2008,本研究中的回收率、精密度及检测限均符合检测方法的技术要求标准,再将本研究中检测方法的技术要求与其他发表论文对比,综合可得本研究方法可行。
2.2.4 实际样品分析
准确吸取样品溶液20 μL进样,以外标法计算样品中角鲨烯含量,结果表明茶叶籽油中角鲨烯含量为4.1 mg/kg。
3 结论
采用GC-MS分析茶叶籽油不皂化物成分,鉴定出主要成分,完成了茶叶籽油中角鲨烯的定性分析;采用HPLC法测定出茶叶籽油中角鲨烯含量为4.1 mg/kg,平均添加回收率为84.2%~90.1%,相对标准偏差(RSD)<6.98%(n=4) ,测定低限(LOQ)为2.7 mg/kg。
本测定方法灵敏度好,可靠,重复性好,可应用于茶叶籽油中角鲨烯的检测分析。
[1]吴立军. 天然药物化学[M]. 北京:人民卫生出版社,2003:222
[2]官波,郑文诚. 角鲨烯提取、纯化及其应用[J]. 粮食与油脂,2010(2):44-46
[3]Nergizc,Celan. The effect of consecutive steps of refining on squalene content of vegetable oils[J]. Food Sci Technol,2011,48(3): 382-385
[4]谢勇,苏素娇,梁一池. 气相色谱法测定茶籽油中角鲨烯含量的研究[J]. 河南工业大学学报:自然科学版,2012,33(1):42-44
[5]钟冬莲,汤富彬,沈丹玉,等. 油茶籽油中角鲨烯含量的气相色谱法测定[J]. 分析试验室, 2011, 30(11) :104-106
[6]Murkovic Michael,Lechner Sonja ,Pietzka Ariane,et al. Analysis of minor components in olive oil[J]. Journal of biochemical and biophysical methods,2004,61(1-2):155-160
[7]付松,向仕学. 气相色谱-质谱法检测保健食品中角鲨烯[J]. 中国卫生检验杂志,2003,13(6) :717-717
[8]陈全斌,程忠泉,杨建香,等. 罗汉果种仁油中角鲨烯的高效液相色谱分析[J]. 广西科学,2006,13(2):118-120
[9]李和,陶海荣,刘璐琪,等. 十种植物种子油不皂化物的分离与分析[R]. 北京:第二十一届IUPAC国际天然产物化学会议,1998
[10]汤富彬,沈丹玉,刘毅华,等. 油茶籽油和橄榄油中主要化学成分分析[J]. 中国粮油学报,2013,28(7):108-113
[11]朱晋萱,朱跃进,张士康,等. 茶叶籽油的脂肪伴随物成分分析初报[J]. 茶食品技术,2011(4):47-50
[12]Alfonso Ranalli,Panlo Cabras,Enfilia Iannucci Lipochromes,et al. aromas and other components of virgin olive oil are affected by processing technology[J]. Food Chemistry 2001,73: 445-451
[13]张欣,于瑞祥,杨瑞钰,等. 植物油中角鲨烯的提取与高效液相色谱法分析[J]. 中国粮油学报,2013,28(5):96-99
[14]毛多斌,贾春晓,孙晓丽,等. 几种功能性植物油中角鲨烯和维生素E分析[J]. 中国粮油学报,2007,22(2):79-82.
Qualitative and Quantitative Analysis of Squalene in Tea Seed Oil
Xiao Yipo1Deng Danwen1Luo Jiaxing3Shan Yan2Bai Xue1Zhang Bin1
(Sino-German Food Engineering Center of Nanchang University1, Nanchang 330047)(Sino-German Joint Research Institute of Nanchang University2, Nanchang 330047)(Zhang shu Oil factory of Jiangxi Jinjia Grains Co.Ltd3, Zhangshu 331200)
The unsaponifiable matters of tea seed oil has been analyzed by GC-MS; squalene in tea seed oil has been determined by high performance liquid chromatography. The results showed that the main components of tea seed oil unsaponifiables were squalene and alpha tocopherol, In addition, there were small quantities of huisache alcohol, geranyl linalool, Lanosterin, cis-Jasmone, D12 oleanene, 2,4-Di-tert-butylphenol and 2,5-Di-tert-butyl-p-benzoquinone.The squalene in sample were separated from the other impurities by C18 column. On condition of that: the mobile phase of methanol/acetonitrile (60+40,V/V), the detection wavelength of 210 nm, the flow rate of 2 mL/min, the column temperature at 30 ℃, these should be chosed as determination conditions, the components in tea seed oil could be effectively separated.The squalene content in tea seed oil was 4.1 mg/kg measured by HPLC. The linear correlation between peak area and concentration of squalene was fine in concentration range of 20~500 mg/L with the linear correlation coefficient (R2) of 0.999 0. The average recoveries were 84.2%~90.1%, the relative standard deviation was less than 6.98% (n=4), and the Limit of Quantity (LOQ) was 2.7 mg/kg.
tea seed oil, unsaponifiables, GC-MS, squalene, high performance liquid chromatography
TS222+.1
A
1003-0174(2016)04-0108-05
2014-08-12
肖义坡,男,1990年出生,硕士,食品加工与保藏
张彬,男,1956年出生,教授,油脂加工
