山茶油脱臭馏出物中角鲨烯的分离纯化及对猪油抗氧化作用的研究
2019-08-19叶虔臻董柳青周琛媛沈建福
叶虔臻 王 微 董柳青 周琛媛 沈建福
(浙江大学生物系统工程与食品科学学院1,杭州 310058)(桐庐县检验检测中心2,杭州 311500)(浙江经贸职业技术学院3,杭州 310018)
角鲨烯(Squalene)是由6 个异戊二烯连接而成的不饱和三萜类化合物,常温下呈油状,有轻微令人愉悦的气味,具有抗氧化、抗辐射、调控胆固醇代谢、抑制微生物生长等功效,被广泛用于化妆品、医药和食品工业等领域的开发中[1]。角鲨烯来源广泛,存在于鲨鱼肝脏、植物种籽,以及某些微生物、微藻和人体皮脂中。而目前天然角鲨烯提取主要以植物,如油橄榄、鸡矢藤、红枣等,或植物油及其加工副产物,如皂脚、脱臭馏出物及冬化物等中分离得到[2]。也有研究表明采用工程菌株可大幅提高角鲨烯的制备[3]。
脱臭馏出物是油脂在脱臭环节得到的副产物,含有多种生物活性成分,如天然VE、植物甾醇、角鲨烯等[4]。据李志晓等[5]对油茶籽油微量营养成分在加工过程中的分析和刘存存[6]对茶油加工过程中不同阶段生物活性成分含量的分析看,脱臭工序是山茶油中角鲨烯损失最多的环节,从而使角鲨烯富集于脱臭馏出物中。
皂化分离法能将脱臭馏出物中的大量油脂形成脂肪酸盐,再通过水洗除去,利用有机溶剂萃取不皂化物,第一次浓缩富集角鲨烯。通过硅胶进一步分离不皂化物,收集洗脱液进行检测,合并含有角鲨烯的相同成分,纯化角鲨烯。相比于超临界CO2萃取、分子蒸馏法以及酶法提取法,皂化分离法和柱层析法相结合,操作简便易行,设备投入低,维护少,有较大的分离容量及固定相价廉且能反复多次使用等优点,能够实现产业化生产。主要的缺点是分离时间太长,可以采用顶部加压法缩短分离时间并提高分离效率[7]。
研究对山茶油脱臭馏出物中角鲨烯的提取工艺进行探究,为从山茶油脱臭馏出物中提取天然角鲨烯提供借鉴。
1 材料与方法
1.1 材料与仪器
山茶油脱臭馏出物;角鲨烯标准品(纯度≧98%);100~200目硅胶、200~300目硅胶;氢氧化钾、90%乙醇、无水乙醇、正己烷、乙酸乙酯、无水硫酸钠。
7890B 气相色谱仪;HP-5色谱柱(30.0 m×0.32 mm×0.25 μm);SHB-ⅢA循环水式多用真空泵;RE-52旋转蒸发仪。
1.2 实验方法
1.2.1 不皂化物的制备
参考GB/T 5535.2—2008并稍作修改[8]。准确称取山茶油脱臭馏出物10.00 g于500 mL具塞圆底烧瓶中。加入不同体积、不同浓度的氢氧化钾-乙醇溶液后,于一定温度下,反应不同时间。待反应完全,从冷凝管顶部加入50 mL蒸馏水后冷却至室温,或在流水中加速冷却。将反应液转移至250 mL分液漏斗中,加入50 mL正己烷,萃取3次,合并萃取液。分多次用25 mL 10%乙醇水溶液清洗萃取液,直至流出液不使酚酞变红为止。若清洗过程出现乳浊现象,可添加少量无水乙醇进行破乳。将萃取液过无水硫酸钠脱水后,进行旋蒸,得不皂化物,充入氮气于4 ℃冰箱放置,备用。
1.2.2 气相色谱条件
HP-5毛细管色谱柱(30.0 m×0.32 mm×0.25 μm);程序升温:初始温度160 ℃,保持2 min;以15 ℃/min上升至280 ℃,保持5 min;再以5 ℃/min上升至300 ℃,保持2 min。检测器温度330 ℃,进样口温度300 ℃,不分流。
1.2.3 角鲨烯标准曲线的绘制
准确称取20 mg角鲨烯标品,用正己烷定容到10 mL,得2 mg/mL角鲨烯标准储备液。分别取0.05、0.25、0.50、1.00、7.50 mL储备液,用正己烷定容至10 mL,得到各浓度。以峰面积为纵坐标(y),各质量浓度为横坐标(x),绘制标准曲线。
1.2.4 角鲨烯含量和提取率的测定
称取不皂化物0.03 g,正己烷定容至3 mL。吸取1 mL溶液过0.45 μmol/L有机滤膜,进气相待测。
1.2.5 单因素实验及纯化实验
采用皂化法提取山茶油脱臭馏出物中的角鲨烯,对碱浓度、料液比、反应时间、反应温度进行单因素实验。准确称取0.075 g不皂化物,采用200~300目硅胶对不皂化物中的角鲨烯做进一步分离纯化。采用干法上样,洗脱剂为正己烷∶乙酸乙酯=100∶1进行洗脱,每10 mL为一管进行收集,气相进行检测,根据标曲计算各管角鲨烯含量。
1.2.6 日内精密度与日间精密度
在精炼山茶油中添加角鲨烯标准溶液,按照1.2.1的处理方式,选取10、100、500、1 000 μg/mL 4个浓度进行精密度和回收率的实验。日内精密度每个浓度平行测定6次,日间精密度每个浓度平行测定3次,连续测定5 d,取平均值,计算结果。
1.2.7 抗氧化性实验
分别添加不同浓度的角鲨烯纯化物和0.02%TBHQ、0.02%BHT和0.01%没食子酸丙酯于自制猪油中,并采用Rancimat氧化分析仪对其抗氧化性进行评估。
2 结果与分析
2.1 角鲨烯标准曲线的绘制
角鲨烯标准品气相检测如图1所示,在13.907 min左右出峰。角鲨烯标准曲线见图2,y轴为峰面积,x轴为角鲨烯浓度(μg/mL),线性回归方程为:y=2.419 4x-23.43,R2=0.999 6。
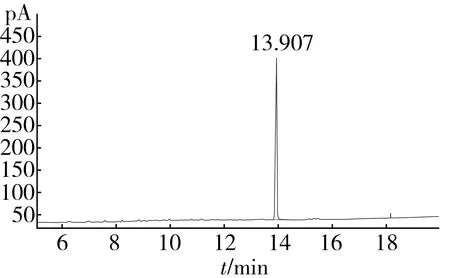
图1 角鲨烯标准品
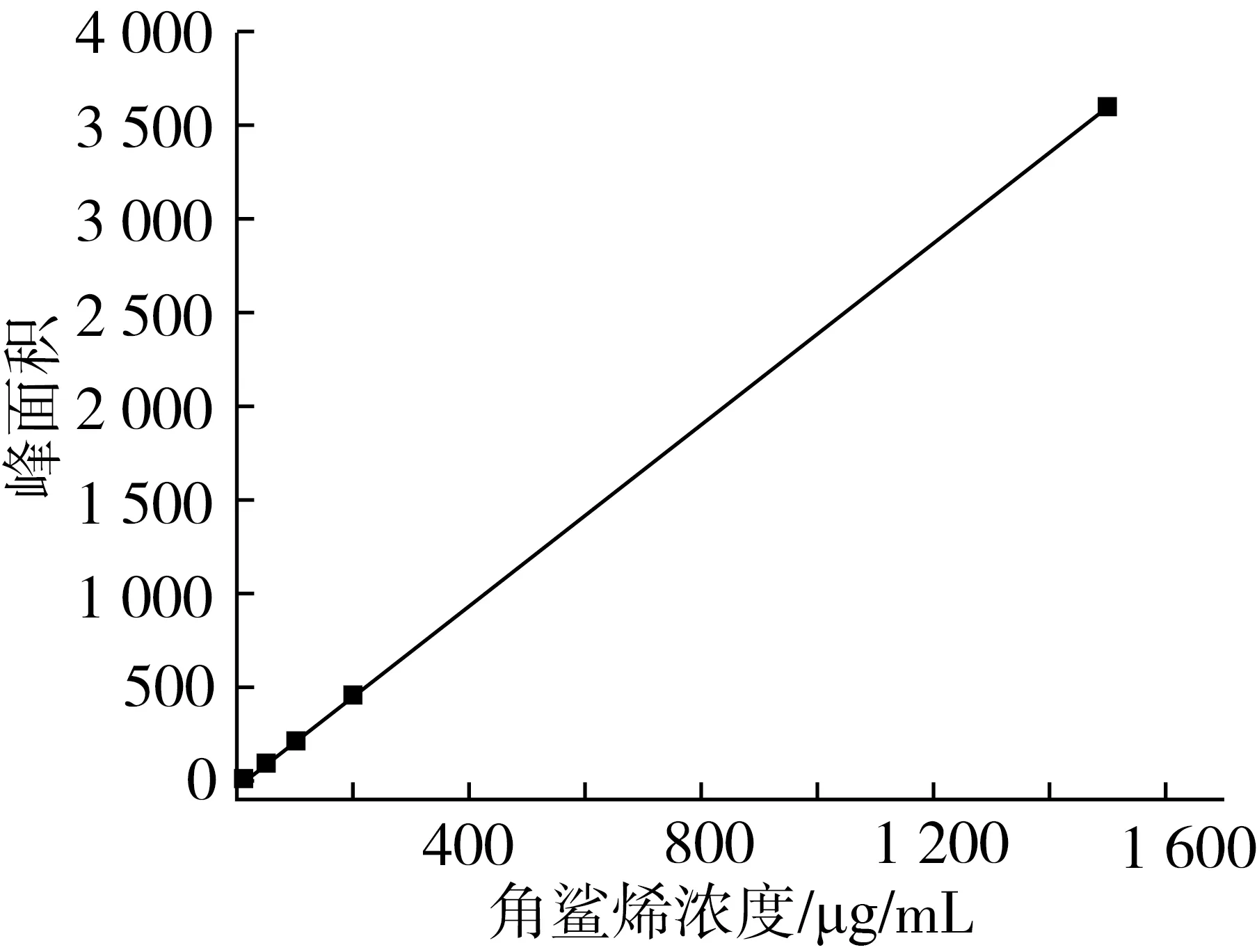
图2 角鲨烯标准曲线
2.2 单因素实验
2.2.1 反应温度对角鲨烯含量和提取率的影响
在碱浓度1.0 mol/L,料液比1∶5下,反应时间60 min下,探究反应温度分别为60、70、80、90、100 ℃时对角鲨烯含量和提取率的影响。
由图3a和图4a可知,随着反应温度的升高,角鲨烯含量先上升后下降,在70 ℃时达到最高,为30.6%。皂化反应是一个吸热反应,当温度较低时,反应速率慢,皂化不充分,剩余过多的脂肪酸,使得角鲨烯含量减少,提取率较高;随着温度上升,反应加快。但温度过高时,角鲨烯在高温碱性条件下反应时间过长,会加剧损失,使得含量和提取率均下降。
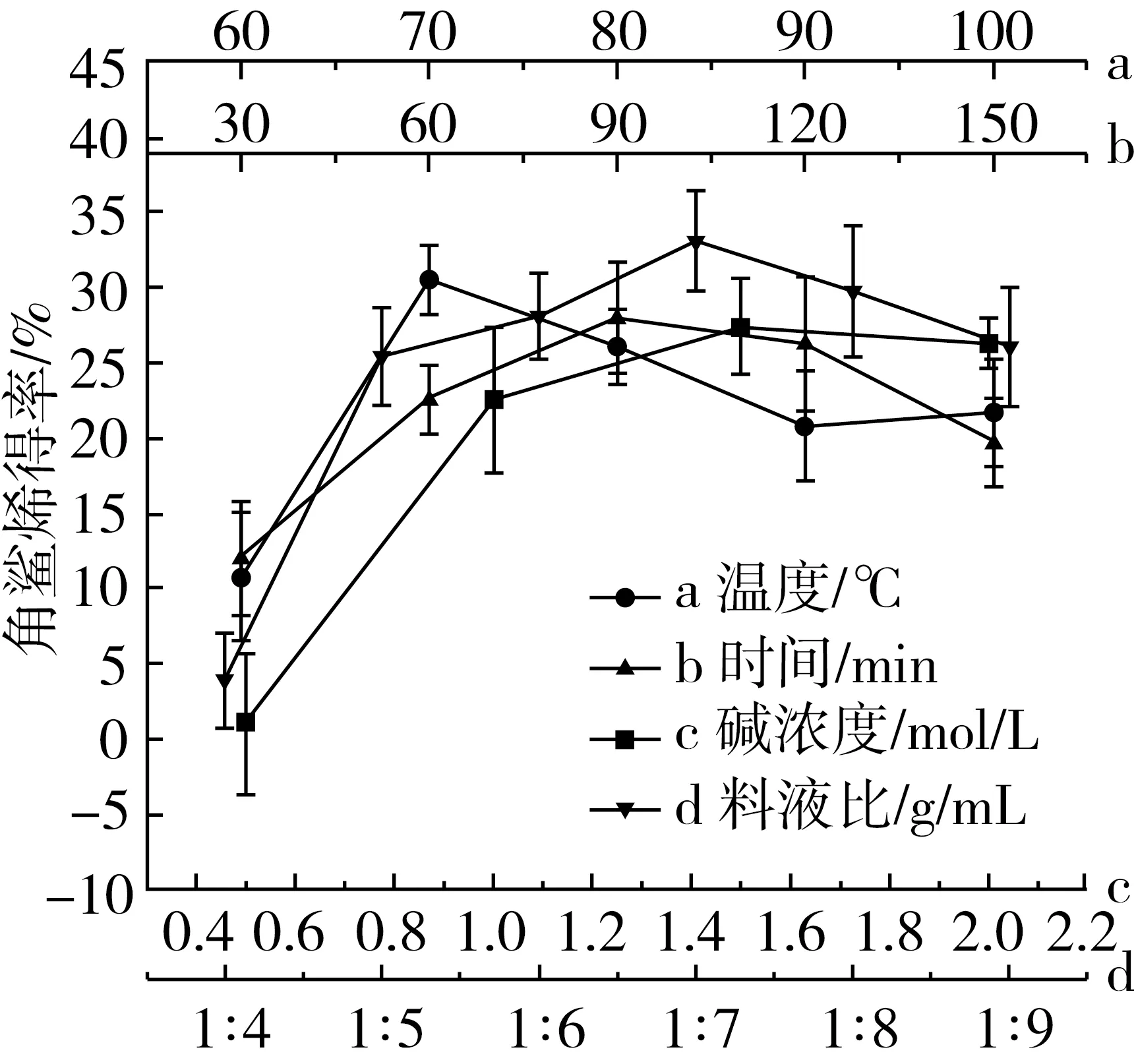
图3 不同因素对角鲨烯含量的影响
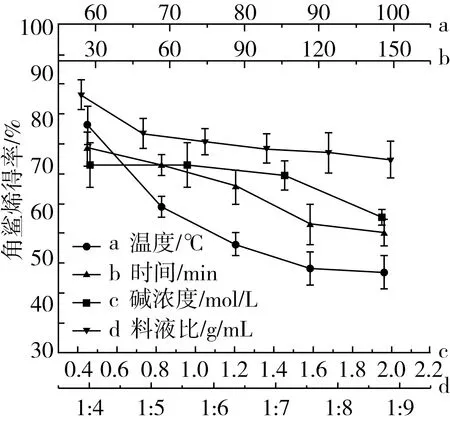
图4 不同因素对角鲨烯提取率的影响
2.2.2 反应时间对角鲨烯含量和提取率的影响
在90 ℃,碱浓度1.0 mol/L,料液比1∶5下,探究反应时间分别为30、60、90、120、150 min时对角鲨烯含量和提取率的影响。
由图3b和图4b可知,随着反应时间的增加,在90 min时含量达到最高,反应时间加长,角鲨烯的含量和提取率均有较大幅度的下降。这是由于在高温碱性条件下,时间越长,角鲨烯被破坏的越多,损失量均增大。而时间过短,反应不充分,提取率虽然较高,但含量较低,增加了后续纯化的难度[9]。
2.2.3 碱浓度对角鲨烯含量和提取率的影响
在90 ℃,料液比1∶5,反应时间60 min下,探究碱浓度分别为0.5、1.0、1.5、2.0 mol/L时对角鲨烯含量和提取率的影响。
由图3c和图4c可知,随着碱浓度的升高,角鲨烯含量呈上升趋势,在1.5 mol/L时达到最高;提取率则呈现缓慢下降的趋势。这是由于在低浓度时,皂化不完全,残留过多的脂肪酸,水洗不能去除,导致角鲨烯在不皂化物中的含量过低;随着浓度的升高,皂化更加彻底,反应更完全,角鲨烯得到富集,但过量的碱也可能导致角鲨烯被破坏,因此提取率下降[10]。
2.2.4 料液比对角鲨烯含量和提取率的影响
在90 ℃,碱浓度1.0 mol/L,反应时间60 min下,探究料液比分别为1∶4、1∶5、1∶6、1∶7、1∶8、1∶9时对角鲨烯含量和提取率的影响。
由图3d和图4d可知,随着料液比增加,角鲨烯含量先上升后下降,提取率呈下降趋势。在料液比1∶7左右时,脱臭馏出物与碱溶液反应较完全,因此角鲨烯含量高。但随着碱液量的增加,角鲨烯在高温下被破坏的量也随之增加,从而提取率有所下降。
2.3 正交实验
以角鲨烯含量和提取率为指标,选取碱浓度、料液比、反应时间、反应温度4个因素,每个因素3水平作为变量,设计L9(34)因素水平表,见表1,实验结果见表2。
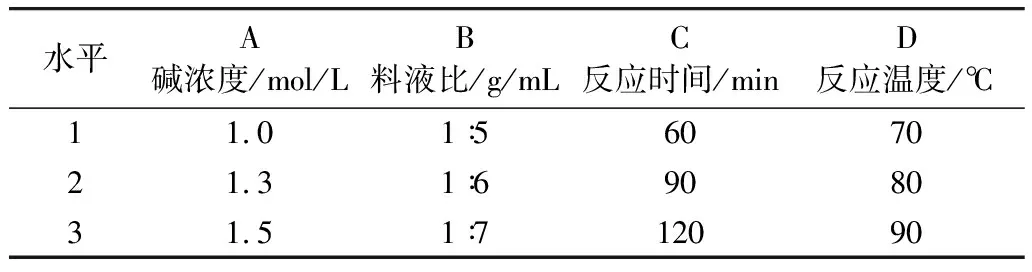
表1 正交实验因素水平表
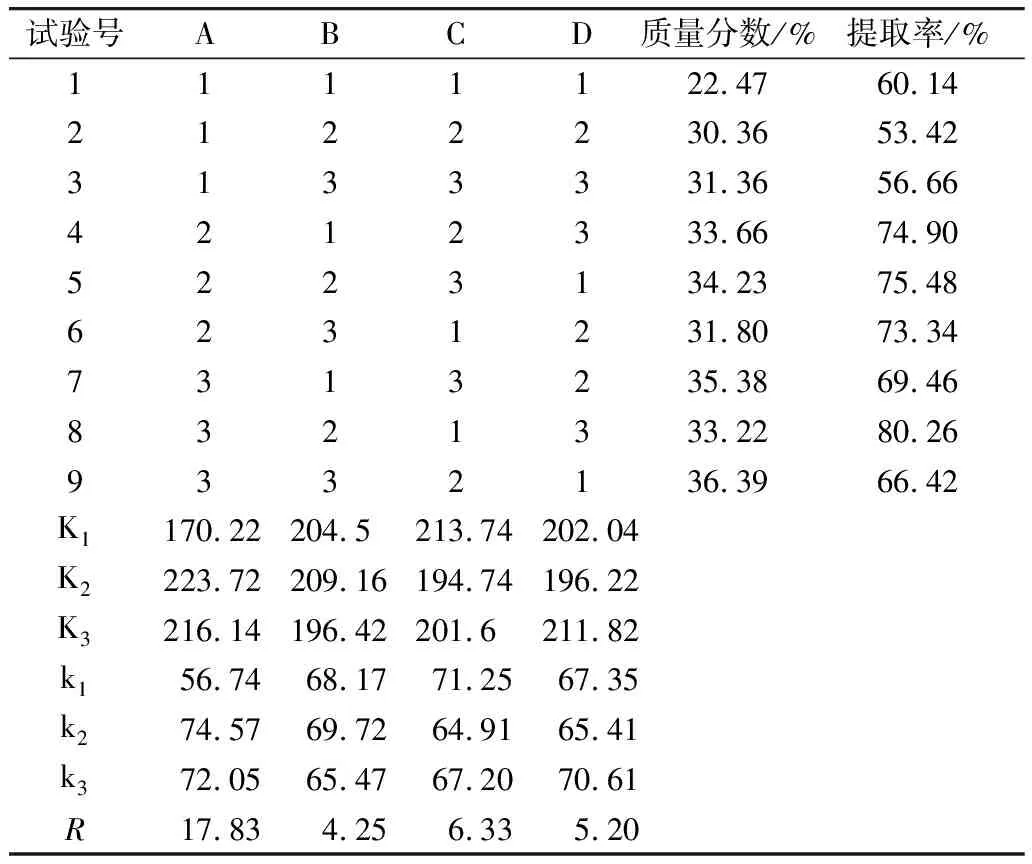
表2 角鲨烯含量和提取率正交实验结果表
从表2可知,经正交优化后,角鲨烯的含量和提取率均大幅提升,含量除第一组外均达到30%及以上,提取率除第二、三组外,也都达到了60%以上。由于角鲨烯含量相差不大,选取提取率进行数据极差分析。通过极差分析结果来看,影响角鲨烯提取率的因素主次顺序分别为A>C>D>B,即碱浓度>反应温度>反应时间>料液比。综合分析可知,实验最优方案为A2B2C1D3,即碱浓度1.3 mol/L,料液比1∶6,反应时间60 min,反应温度90 ℃,并在此条件下重复实验,含量和提取率分别为35.22%和81.97%。
2.4 日内精密度及日间精密度
角鲨烯的加标回收率及日内精密度与日间精密度结果见表3和表4。
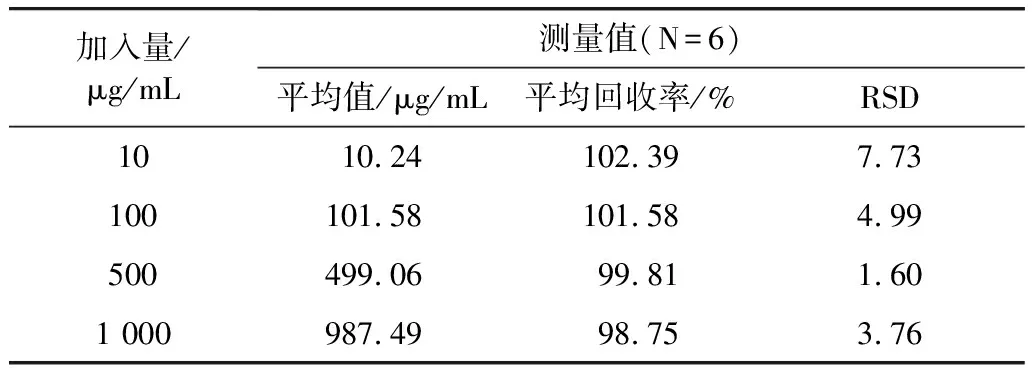
表3 山茶油样品中角鲨烯的加标回收率及日内精密度
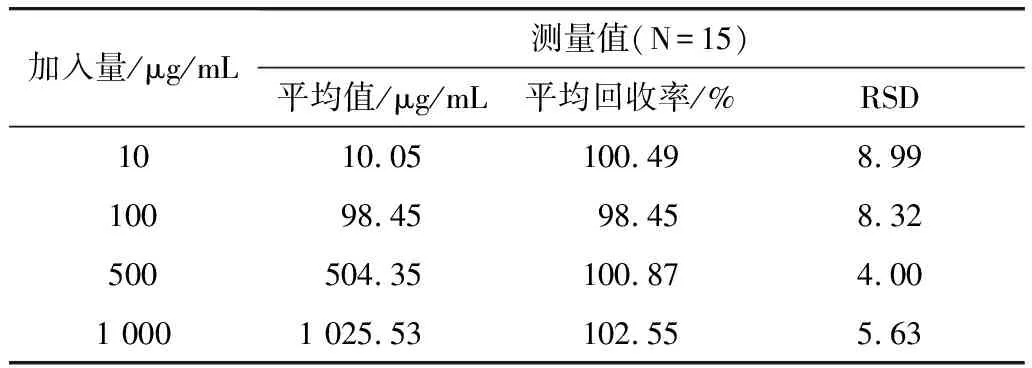
表4 山茶油样品中角鲨烯的加标回收率及日间精密度
从表3可得,日内精密度检测中加标回收率在98.75%~102.39%之间,RSD值在1.60~7.73之间;从表4可得,日间精密度检测中加标回收率在98.45%~102.55%,RSD值介于4.00~8.99,两者都符合RSD<10%的规定。
2.5 角鲨烯分离纯化
硅胶柱层析进一步纯化不皂化物,获得角鲨烯纯品。纯化结果如图5所示,气相色谱检测(第23管)如图6所示。
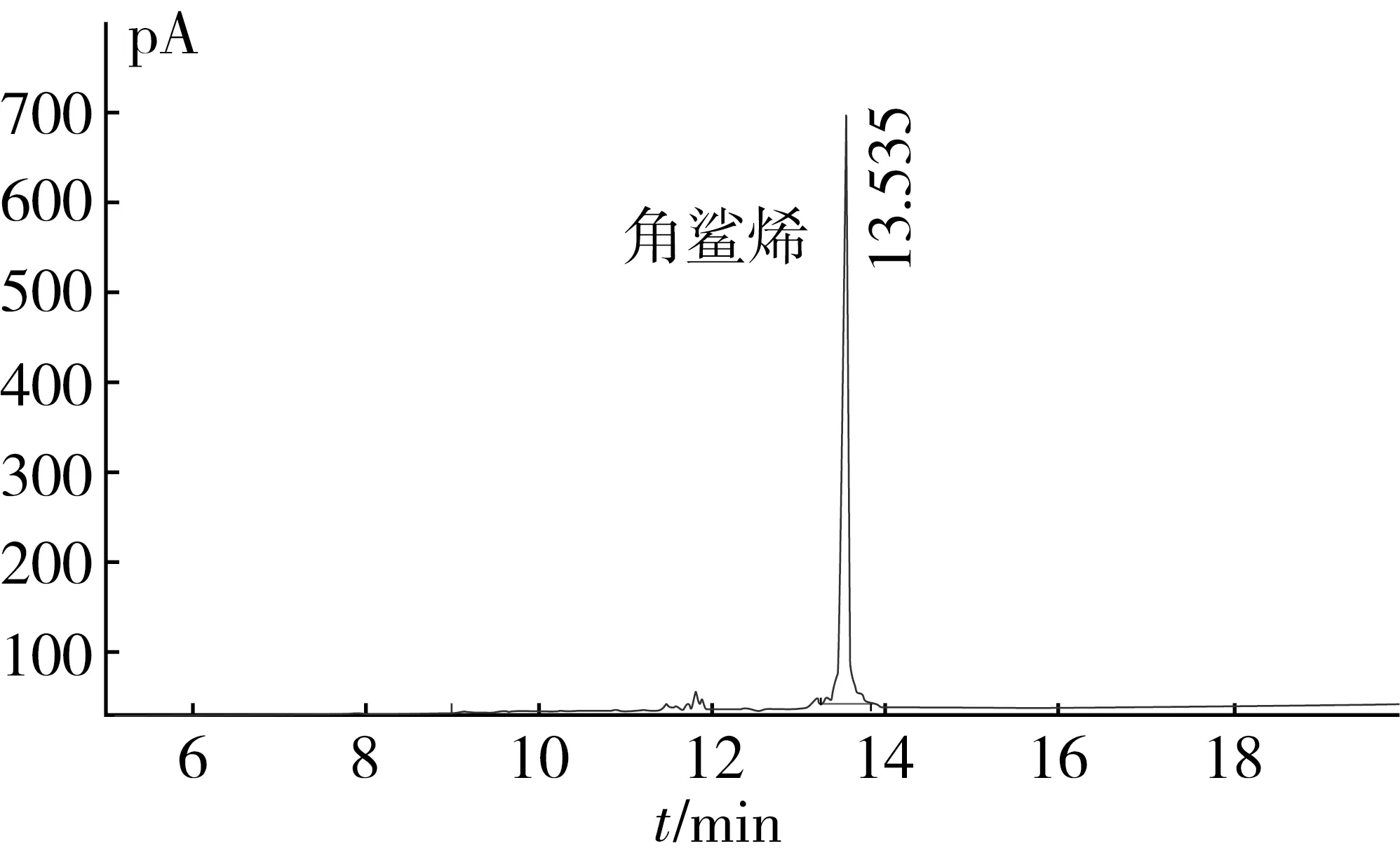
图5 硅胶柱分离不皂化物中角鲨烯
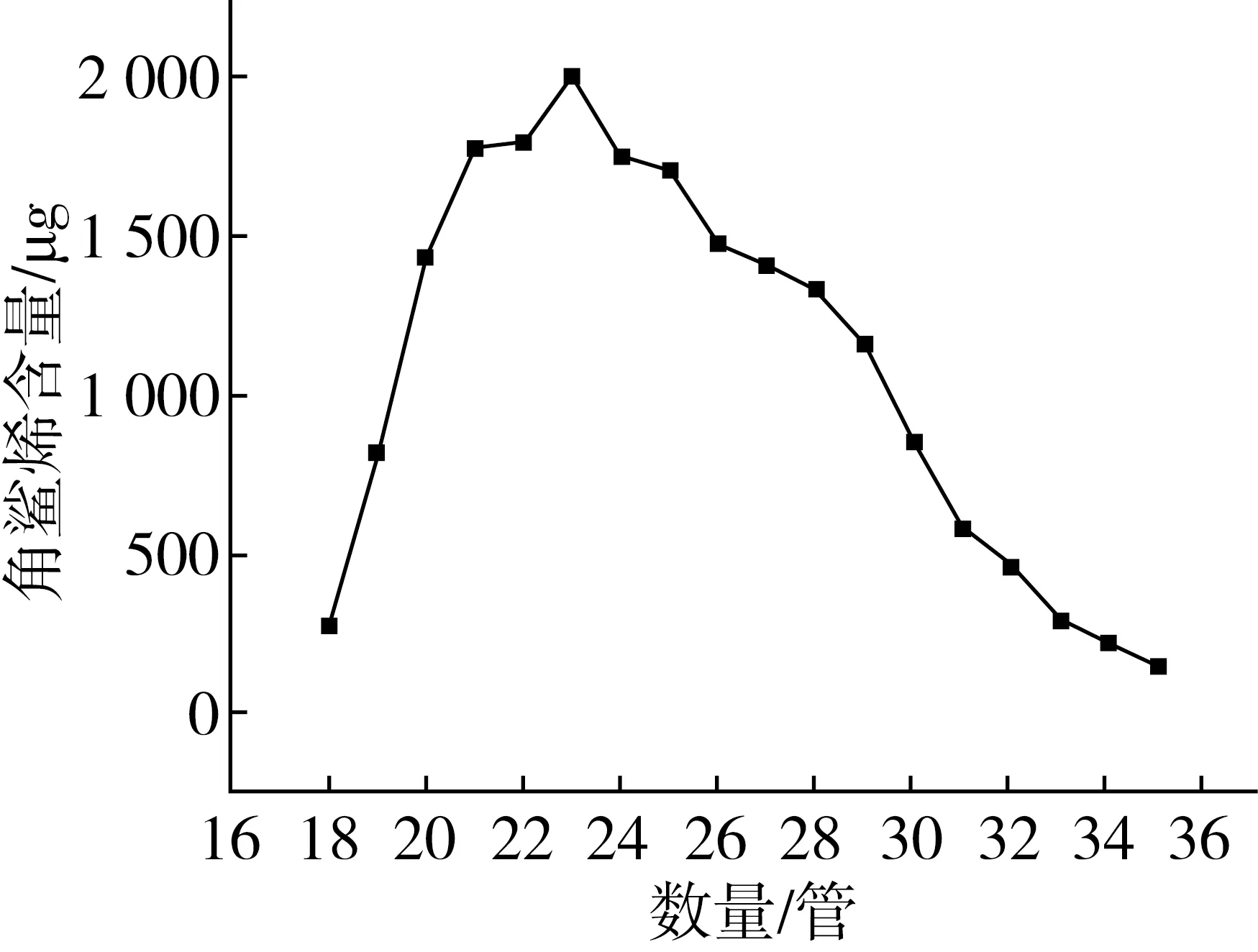
图6 纯化后角鲨烯气相色谱检测(第23管)
从图6可知,在第18管时,角鲨烯开始富集,并在第23管的时候达到最高值,之后逐渐减少,到第35管左右含量明显减少。图5可以看到经硅胶分离后,角鲨烯的纯度得到极大的提升,从第20管到第34管,角鲨烯的出峰图像均与第23管相似。因此,通过200~300目硅胶纯化不皂化物中的角鲨烯,可得到有效富集,收率达到94.5%,纯度为90%。
2.6 Rancimat 氧化分析实验
在130 ℃下,比较了不同浓度角鲨烯提取物和不同抗氧化剂及复配后的抗氧化性效果,结果见图7、图8。

注:与猪油组比较,不同字母表示有显著性差异(P<0.05)。图7 不同浓度角鲨烯对猪油的抗氧化作用

注:A:猪油 0.02%角鲨烯纯化物;B: 0.02%BHT 0.02%角鲨烯纯化物+0.02%BHT;C: 0.01%PG 0.02%角鲨烯纯化物+0.01%PG;D:0.02%TBHQ 0.02%角鲨烯纯化物+0.02%TBHQ。*表示该组相比较于组内有显著性差异(P<0.05)。图8 抗氧化剂复配对猪油的抗氧化作用
从图7可知,添加了0.02%角鲨烯纯化物的猪油诱导时间显著提升,表明该浓度下的角鲨烯可有效增强油脂的抗氧化性(P<0.05),但在高浓度时诱导时间反而降低,可能是角鲨烯自身被氧化后的产物加剧了油脂的氧化;在图8中,抗氧化剂均能显著提高猪油的抗氧化性(P<0.05),而TBHQ的作用效果最佳,BHA和PG次之且作用效果相当。不过当角鲨烯提取物与各抗氧化剂复配使用时,PG与角鲨烯的复配有显著的增益效果(P<0.05),而其余的复配效果不显著(P>0.05)。
3 结论
山茶油含有丰富的、有利于人体健康的代谢产物,如植物甾醇、维生素E、角鲨烯等,但脱臭环节真空、高温的条件,使得这些代谢产物损失严重。本研究结合皂化法和柱层析法,从山茶油的脱臭馏出物中富集和纯化角鲨烯。此方法不仅降低了生产成本,同时也提高了天然产物的利用率,避免了企业在设备上的昂贵投入和维护。最优提取条件为碱浓度1.3 mol/L,料液比1∶6,反应时间60 min,反应温度90 ℃。在此条件下角鲨烯质量分数为35.22%,提取率为81.97%,实测值与预测值接近。通过硅胶柱层析进一步分离纯化角鲨烯,收率为94.5%,纯度为90%。此外,对其抗氧化性进行探究,发现0.02%的提取物有较好的抗氧化性,但在高浓度时有促氧化的作用。通过协同作用可促进其他抗氧化剂的效果,因此可以作为油脂中其他天然或合成抗氧化剂的增效剂复合使用。
