吡非尼酮抑制TGF-β1诱导的人肺成纤维细胞表型转化*
2016-12-26吴超琛林浩博
吴超琛, 林浩博, 张 晓△
(1南方医科大学,广东 广州 510515; 2广东省人民医院,广东省医学科学院风湿病科,广东 广州 510080)
吡非尼酮抑制TGF-β1诱导的人肺成纤维细胞表型转化*
吴超琛1, 2, 林浩博2, 张 晓1, 2△
(1南方医科大学,广东 广州 510515;2广东省人民医院,广东省医学科学院风湿病科,广东 广州 510080)
目的: 研究吡非尼酮(PFD)是否抑制转化生长因子β1(TGF-β1)诱导的人肺成纤维细胞(HLFs)表型转化。方法:MTT法检测细胞存活率;EdU法检测细胞的增殖能力;Transwell实验检测细胞的迁移和侵袭能力,Western blot法和细胞免疫荧光检测α-平滑肌肌动蛋白(α-SMA)的蛋白水平,实时荧光定量PCR检测α-SMA和Ⅰ、Ⅲ型胶原蛋白的mRNA表达水平。结果:不同浓度的吡非尼酮(0.1、0.2、0.3、0.5和0.8 mg/L)无明显的细胞毒性作用,后续实验应用0.2 mg/L为干预浓度。吡非尼酮(0.2 mg/L)预处理HLFs能明显地抑制TGF-β1诱导的细胞增殖、迁移和侵袭能力,下调Ⅰ、Ⅲ型胶原蛋白的mRNA表达水平(P<0.05),并且干扰TGF-β1诱导的细胞骨架重组和表型转化,使α-SMA的mRNA和蛋白水平均下降(P<0.05)。结论:吡非尼酮能有效地抑制TGF-β1所诱导的HLFs细胞功能和表型转化。
吡非尼酮; 转化生长因子β1; 人肺成纤维细胞
间质性肺病(interstitial lung disease,ILD)是一类具有相似的影像学、病理学和临床表现特点的肺脏薄壁组织炎症性疾病,大多数原因不明,但部分病因可能与特定的环境、肿瘤、结缔组织病相关。目前对于结缔组织病相关的间质性肺病(connective tissue disease-associated interstitial lung disease,CTD-ILD)的治疗多采用激素和免疫抑制剂治疗及非药物治疗(如戒烟、氧疗、机械通气、肺康复甚至肺移植),但无针对ILD病理改变进行特异性治疗的药物,因此总体疗效不佳[1]。
吡非尼酮(pirfenidone,PFD)是一种新的具有广谱抗纤维化作用的小分子吡啶酮类化合物,在治疗特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)取得了一定的效果,在美国已获得FDA批准[2]。有研究报道,吡非尼酮能抑制大鼠心肌成纤维细胞和大鼠肝脏星状细胞株的细胞功能和下调α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和胶原的表达,有望改善心肌重构和治疗肝脏纤维化[3-4]。Inomata等[5]采用博来霉素诱导的小鼠肺纤维化模型,吡非尼酮能显著降低肺脏CC趋化因子配体2(CC chemokine ligand 2,CCL2)和CCL12的表达,从而降低成纤维细胞的迁移能力,影响成纤维细胞储备池的规模。但是,吡非尼酮是否能够影响人肺成纤维细胞的增殖、迁移、侵袭功能,是否干扰成纤维细胞的细胞骨架重组和表型转化等更深层次地揭示其作用机制的研究国内尚未见报道。
材 料 和 方 法
1 材料
吡非尼酮(Sigma);抗α-SMA抗体(Abcam);MTT试剂(华蓝化学);牛血清白蛋白(Seikagaku);鬼笔环肽-488和Alexa Fluor 488羊抗兔荧光II抗(Invitrogen);转化生长因子β1(transforming growth factor-β1,TFG-β1;R&D);DMEM Basic和胎牛血清(Gibco);EdU 增殖试剂盒(广州锐博);多聚甲醛和抗β-actin抗体(Sigma);Triton X-100(Amresco);Transwell小室(Corning);Invasion小室(BD);羊抗兔IgG II抗(CST);PCR聚合酶(TaKaRa);PCR引物(上海生工生物)。
2 方法
2.1 组织块法培养原代人肺成纤维细胞 在无菌条件下,选取年龄小于55岁、无感染、不吸烟患者肺部远离肿瘤的正常肺组织(经病理切片证实),PBS反复漂洗后用眼科剪将组织剪成1 mm×1 mm×1 mm大小,将其种植于25 cm2培养瓶中,6 h后加入体积分数20%胎牛血清、含青霉素1×105U/L和链霉素100 mg/L的DMEM培养液4 mL。在5% CO2、37 ℃培养箱中原代培养成纤维细胞,每隔2~3天全量换液,待细胞游离、扩增至满瓶后用体积分数0.25%胰酶+0.02% EDTA溶液消化传代,采用自然纯化法得到纯化的人肺成纤维细胞。实验采用第4~7代细胞进行检测。所有肺脏组织取材前均取得患者知情同意及研究所在单位医学伦理审查批准。
2.2 实验分组 实验分为3组:(1) 正常对照(control, CTR)组;(2) TGF-β1刺激组:应用5 μg/L的TGF-β1处理HLFs 24 h;(3) TGF-β1+PFD治疗组:0.2 mg/L PFD作用于HLFs 72 h,撤去,用PBS洗2次,接着用5 μg/L的TGF-β1作用24 h。
2.3 MTT实验测定细胞存活率 将HLFs以107~108/L的密度接种于96孔板,置于CO2培养箱培养,无血清培养12 h后,更换全培养基,加入不同浓度的PFD(0、0.1、0.2和0.3 mg/L),每个浓度重复5次,设置空白孔及1%浓度DMSO孔,继续培养72 h,每孔加入无血清培养基稀释的MTT工作液5 g/L继续培养4 h,弃去培养基,每孔加入150 μL DMSO终止培养,使用酶标仪检测各孔吸光度(A)值,波长设定为570 nm。按公式:细胞存活率(%)=处理组A/对照组A×100%,求出处理组细胞存活率,重复3次。
2.4 EdU细胞增殖实验 将HLFs接种于96孔培养板中孵育48 h,每孔加入100 μL EdU溶液后继续培养4 h,按照说明书进行固定染色,染色后立即荧光显微镜下观察计数,随机挑选5个视野计算EdU阳性细胞比例。
2.5 细胞迁移和侵袭实验 用DMEM无血清培养基定细胞密度至5.0×107/L,Transwell 小室下室中加入600 μL 含10% 胎牛血清的培养基,上室中加入细胞悬液200 μL,放置于37 ℃、5% CO2培养箱中24 h 左右。上室移入空白孔中,PBS 洗3 次,加入适量甲醇固定15 min,然后换到其它孔中,结晶紫染色15 min。染色完毕后,PBS 洗2遍,棉签擦拭膜内面,去除未迁移的细胞。用手术刀片切下Transwell小室上的膜,置于载玻片上用中性树胶封片,显微镜观察计数,每孔至少计数5个随机视野跨膜/基质胶的细胞数,取均值,与对照组进行标准化。如果侵袭实验,则采用包被有Matrigel的Transwell 小室,小室下用15% 胎牛血清 的培养基,细胞培养24~36 h。
2.6 细胞免疫荧光 将HLFs细胞消化传代后接种至6孔板细胞爬片按前述实验分组药物处理后,细胞长至60%~70%,4%多聚甲醛 20 ℃固定20 min,0.2% Triton打孔10 min,5% BSA封闭30 min,加I抗(α-SMA,1∶50)4 ℃湿盒过夜,然后用PBS洗10 min 3次,加入鬼笔环肽(红光,1∶400)和II抗(绿光,1∶10 000),室温孵育60 min,然后再用PBS洗10 min 3次,DAPI(蓝光,1∶200)染核5 min,抗荧光衰减剂封片,荧光显微镜下观察,获取图像。
2.7 Western blot法检测蛋白的表达 将HLFs接种于60 mm培养皿中,贴壁生长至80%时给予不同处理因素,弃培养液,用预冷的PBS洗2次,各皿加入80 μL裂解液后置4 ℃裂解30 min,12 000 r/min离心15 min,取上清,蛋白浓度采用BCA法进行测定。总蛋白经SDS-PAGE分离后,转移到PVDF膜上。用5%脱脂奶粉(TBST配置)封闭90 min,加入I抗(α-SMA,1∶50),4 ℃过夜,然后用TBST洗10 min 3次,加入II抗(1∶1 000),室温孵育60 min,然后再用TBST洗10 min 3次。ECL发光液将PVDF膜显色,凝胶成像系统扫描分析结果。
2.8 Real-time PCR 采用TRIzol一步法提取各组细胞总RNA,采用TaKaRa公司的逆转录试剂盒,按照说明书推荐的标准配制逆转录体系;在PCR仪中37 ℃反应 15 min,然后85 ℃反应30 s,以灭活逆转录酶;逆转录后,使用灭菌ddH2O将cDNA 稀释合适的倍数;采用TaKaRa的SYBR荧光定量PCR试剂盒,参照说明书配制反应体系,相应基因的引物序列见表1;采用三步法进行PCR反应,将靶基因Ct值与内参照基因(18S rRNA)进行比较,计算各目的基因的相对表达水平。
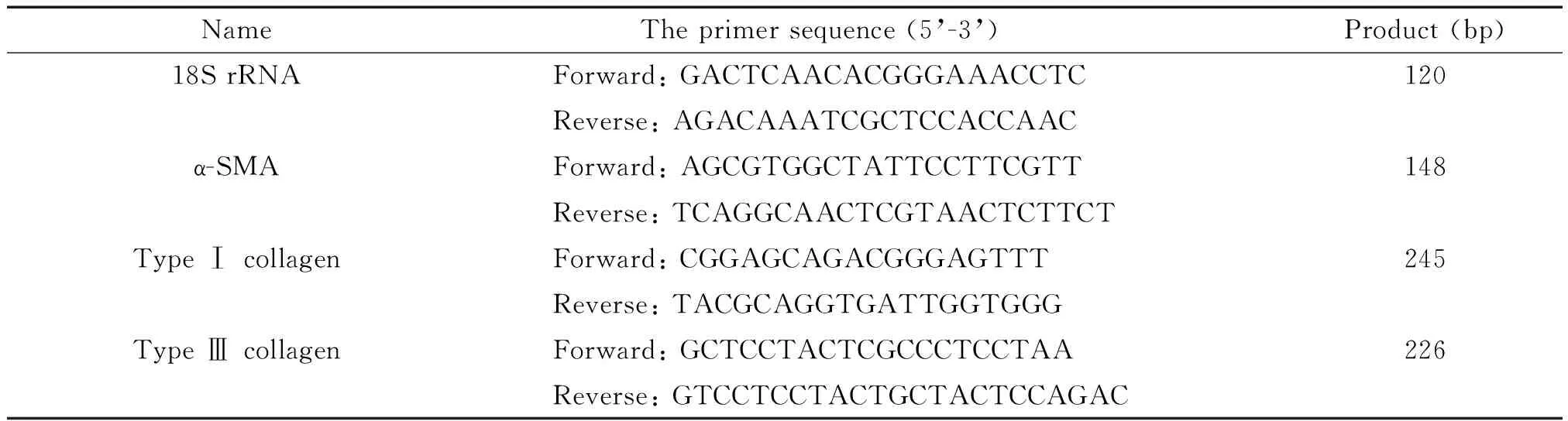
表1 引物序列
3 统计学处理
用SPSS 21.0统计学软件进行统计分析。实验数据定量资料用均数±标准误(mean±SEM)表示,多组间比较采用单因素方差分析,两组间比较采用Bonferoni检验, 以P<0.05 为差异有统计学意义。
结 果
1 吡非尼酮对HLFs活性的影响
为了解不同浓度吡非尼酮对HLFs细胞存活率的影响和寻找合适的药物浓度,我们观察了不同浓度(0.1、0.2、0.3、0.5和0.8 mg/L)下吡非尼酮的细胞毒性作用,结果如图1所示:不同浓度的吡非尼酮处理后HLFs的存活率分别为(85.11±9.71)%、(80.53±15.61)%、(76.27±8.90)%、(66.91±7.64)%和(55.83 ±19.63)%,空白对照组和溶剂DMSO对照组细胞存活率为(100.00±31.52)%和(64.91±36.04)%。经统计学分析,浓度为0.1 mg/L、0.2 mg/L、0.3 mg/L、0.5 mg/L和0.8 mg/L吡非尼酮及1% DMSO溶剂浓度与空白对照组比较差异均无统计学显著性,不引起细胞毒性,见图1A。根据此结果,后续实验应用0.2 mg/L的PFD为干预浓度。
2 吡非尼酮抑制TGF-β1对HLFs功能的影响
应用 TGF-β1刺激HLFs可明显地增强细胞增殖能力,表现为增殖细胞(EdU阳性细胞)占视野下细胞总数的比例增加,与对照组比较,差异有统计学显著性(P<0.01);吡非尼酮预处理组增殖细胞比例明显下降,与TGF-β1刺激组相比较,具有统计学差异(P<0.01),提示吡非尼酮能明显地抑制TGF-β1诱导的增殖,见图1B。
对照组、TGF-β1刺激组、吡非尼酮预处理组穿过生物膜进入下室的细胞数分别为215.00±16.02、281.00±25.95和197.80±16.79,经统计学分析,TGF-β1刺激组较对照组明显升高(P<0.01),吡非尼酮预处理组较TGF-β1刺激组明显下降(P<0.01),提示吡非尼酮能明显地抑制TGF-β1诱导的迁移;对照组、TGF-β1刺激组和吡非尼酮预处理组该3组穿过基质胶进入下室的细胞数分别为24.00±4.39、62.60±9.47和33.20±3.77,经统计学分析,TGF-β1刺激组较对照组明显升高(P<0.01),吡非尼酮预处理组较TGF-β1刺激组明显下降(P<0.01),提示吡非尼酮能明显地抑制TGF-β1诱导的侵袭,见图2。
实时定量PCR检测结果可见TGF-β1刺激组Ⅰ、Ⅲ型胶原蛋白的mRNA表达增加,与对照组相比差异有统计学显著性(P<0.01);吡非尼酮预处理组Ⅰ、Ⅲ型胶原蛋白的mRNA表达下降(P<0.05),与TGF-β1刺激组相比,差异具有统计学显著性(P<0.05),说明吡非尼酮能抑制TGF-β1诱导的细胞分泌,见图3。
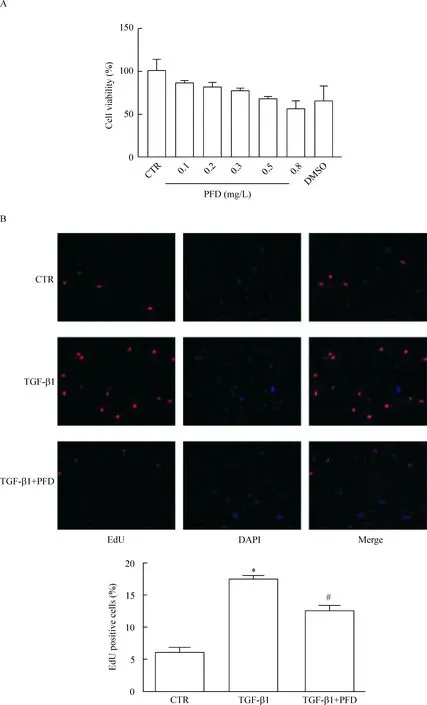
Figure 1.The effect of pirfenidone (PFD) on the viability (A) and proliferation (B) of HLFs (×200). Mean±SEM.n=5.*P<0.05vsCTR group;#P<0.05vsTGF-β1 group.
图1 吡非尼酮对人肺成纤维细胞细胞活力及增殖的影响
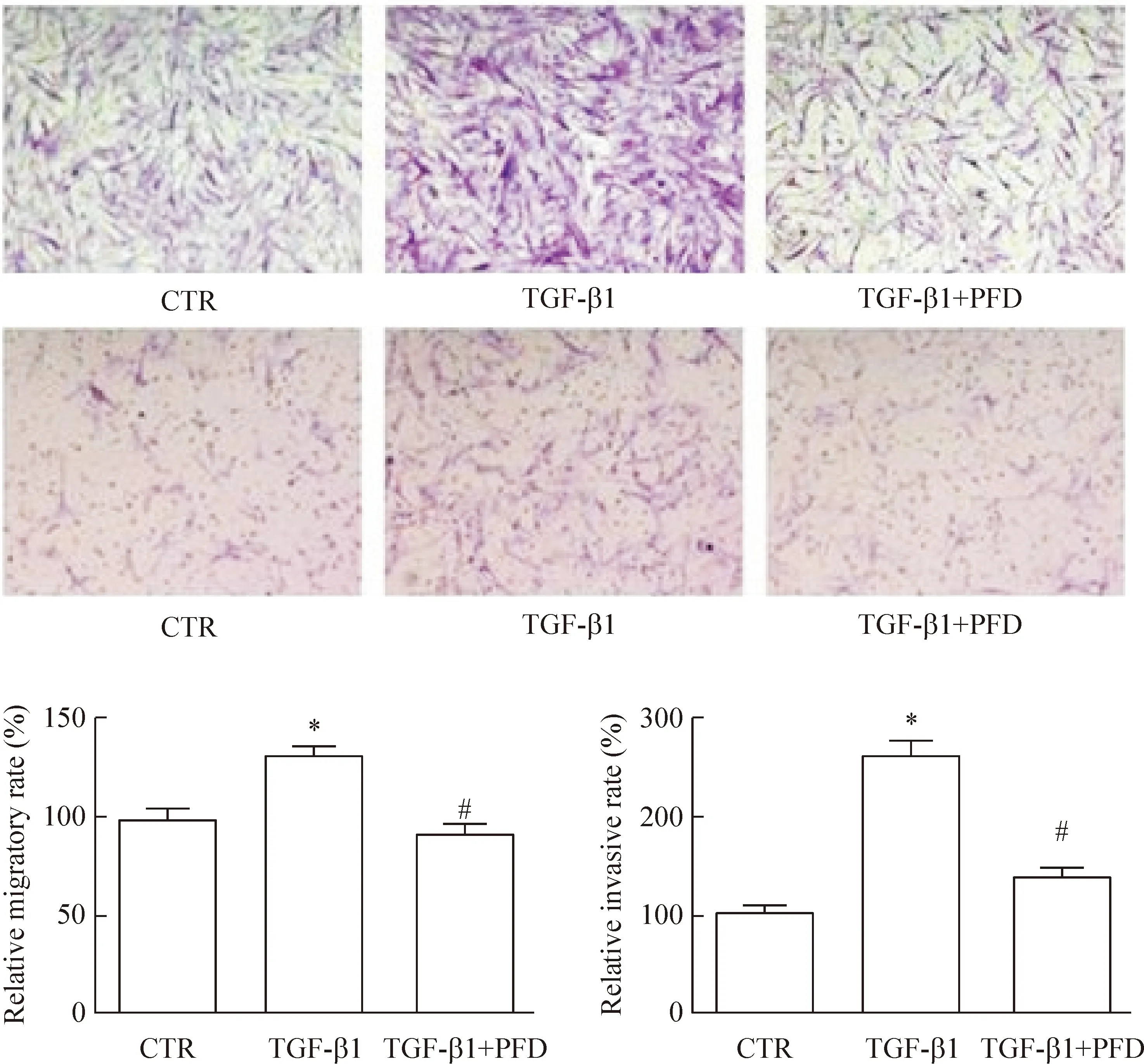
Figure 2.The effect of pirfenidone (PFD) on the migratory and invasive abilities of HLFs (×200). Mean±SEM.n=5.*P<0.05vsCTR group;#P<0.05vsTGF-β1 group.
图2 吡非尼酮对人肺成纤维细胞迁移和侵袭的影响
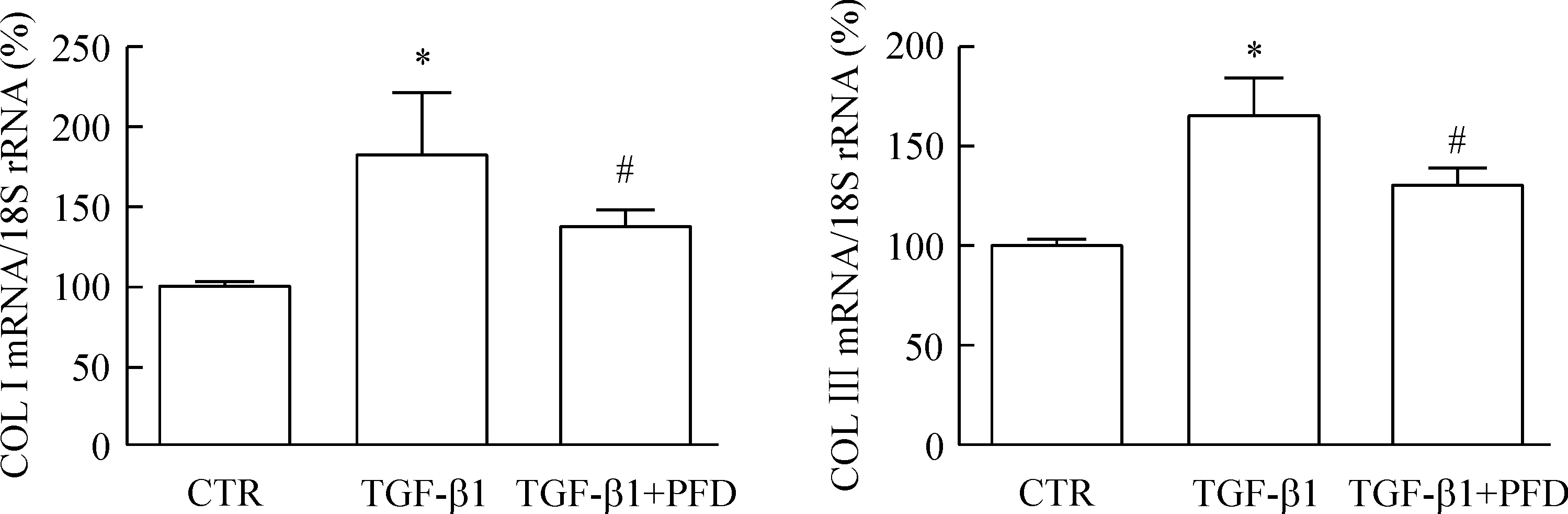
Figure 3.The effect of pirfenidone (PFD) on the mRNA expression of type I and III collagens in TGF-β1-induced HLFs. Mean±SEM.n=3.*P<0.05vsCTR group;#P<0.05vsTGF-β1 group.
图3 吡非尼酮对TGF-β1诱导的HLFs的Ⅰ、Ⅲ型胶原蛋白mRNA表达的影响
3 吡非尼酮对TGF-β1诱导的HLFs细胞骨架和表型转化的影响
对照组的HLFs表达少量α-SMA,细胞内纤维形肌动蛋白(F-actin)分布规则清晰、彼此连接,保持细胞的正常外形; TGF-β1刺激组的α-SMA荧光信号明显增强,F-actin成粗大束状排列;吡非尼酮预处理组的α-SMA荧光信号较TGF-β1刺激组有明显减弱,F-actin荧光强度稍有减弱,部分区域收缩变短,细胞表层(纤维与质膜平行排列,通过某些位点连接质膜)出现大量斑点样染色亮点,细胞膜发生褶皱,细胞体积缩小,提示吡非尼酮能抑制TGF-β1诱导的细胞骨架重组从而影响细胞运动功能。
实时定量PCR和Western blot实验结果如图4所示,TGF-β1处理组的α-SMA在mRNA水平和蛋白水平的表达均上调,与对照组相比较差异有统计学显著性(P<0.01);吡非尼酮预处理组的α-SMA表达明显减少(P<0.01),提示吡非尼酮能抑制TGF-β1诱导的HLFs表型转化。
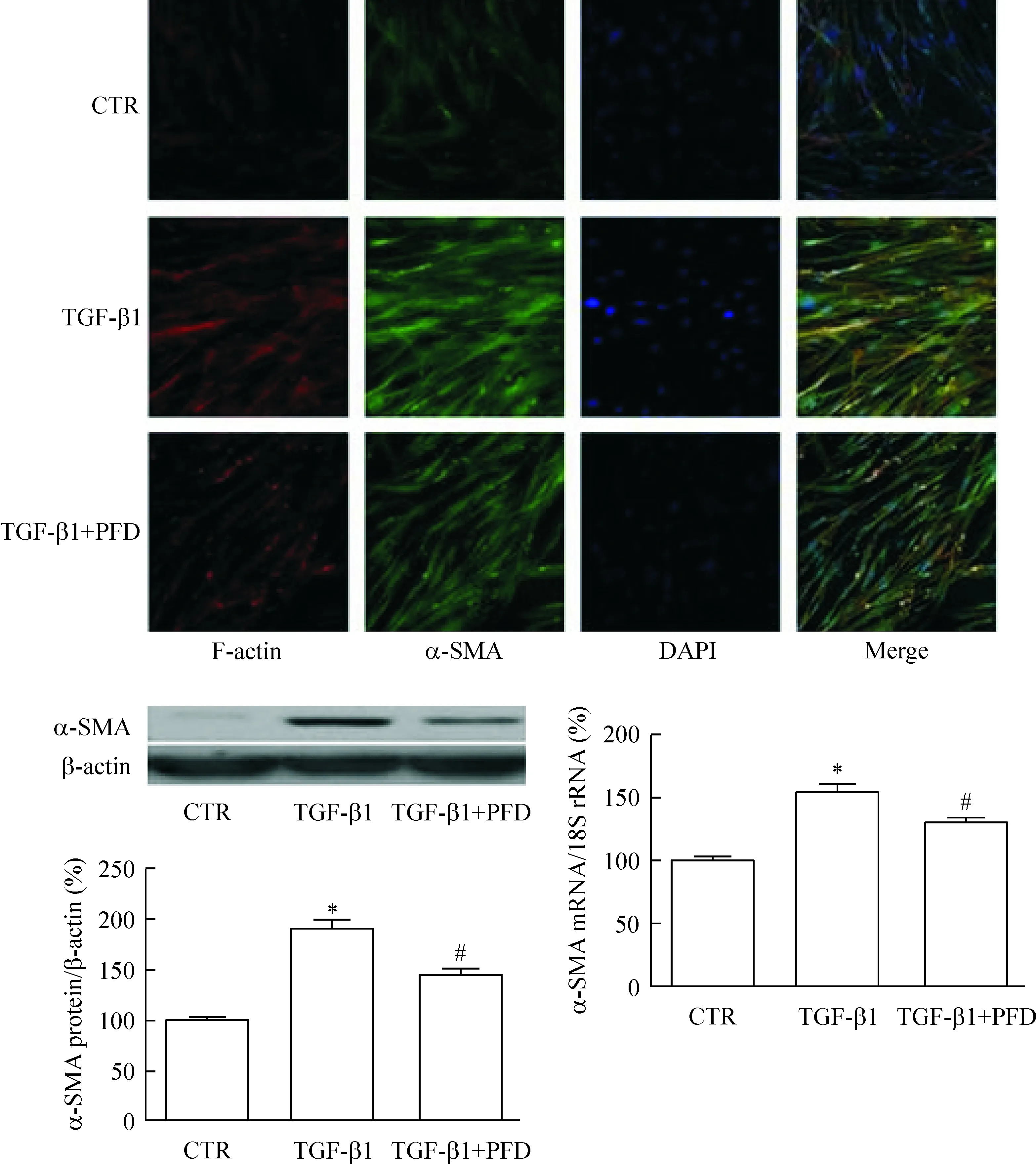
Figure 4.The effect of pirfenidone (PFD) on alterations of α-SMA expression in TGF-β1-induced HLFs (×200). Mean±SEM.n=3.*P<0.05vsCTR group;#P<0.05vsTGF-β1 group.
图4 吡非尼酮对TGF-β1诱导的HLFs表型转化标志物α-SMA表达的影响
讨 论
吡非尼酮是一种小分子的抗纤维化药物,已经被证实在博来霉素诱导的小鼠纤维化模型中能从病理上降低肺脏纤维化程度[5],但其抗纤维化作用的具体机制仍不全面,尤其在细胞功能方面的研究甚少。目前认为肌成纤维细胞的细胞功能对不同脏器纤维化的发生发展起着重要作用,其细胞功能的抑制能更为直接有效地反映抗纤维化的作用[6]。由于临床上获取肺脏标本难度较大,国内外多采用动物来源的肺成纤维细胞或者成纤维细胞株进行研究[7-8]。既往研究报道显示,吡非尼酮不仅能抑制人心肌成纤维细胞的增殖和迁移能力,还能降低大鼠肝脏星形细胞的增殖能力,但尚未全面性地评估吡非尼酮对成纤维细胞所有细胞功能的影响[3-4]。本实验中采用人肺成纤维细胞进行原代培养的研究能消除种属差别的影响,更真实地反应吡非尼酮在机体内抗纤维化的作用及机制。本文证实吡非尼酮能明显抑制TGF-β1对HLFs的细胞功能的影响,使其增殖、迁移、侵袭能力和细胞分泌能力均明显下降,补充了吡非尼酮在细胞水平上抗纤维化作用的研究空缺。
肌成纤维细胞是纤维化的先驱细胞,其中原位成纤维细胞是肌成纤维细胞的主要来源,在肺脏损伤等始动因素作用下,成纤维细胞向肌成纤维细胞转化,合成胶原增多并沉积在肺泡间隔,使肺顺应性下降和肺脏功能受损[6]。TGF-β1是多种器官纤维化过程的中枢因子,能诱导成纤维细胞表型转化,可以促进其增殖和生长,增加胶原合成,阻止细胞外基质的降解。近年,我们[9]和其他学者[10-12]已经证实,CTD-ILD患者和博来霉素诱导的肺纤维化小鼠模型中,肺脏组织TGF-β1表达增加,细胞外基质沉积,病理显示肺泡炎症及间质增厚。肌成纤维细胞高表达α-SMA,不仅能合成细胞外基质,还能体现出类似平滑肌细胞的细胞骨架收缩特性[13]。本次实验结果显示,吡非尼酮能抑制TGF-β1诱导的人肺成纤维细胞向肌成纤维细胞转化,下调α-SMA的表达,影响细胞骨架蛋白重组,降低细胞运动能力。上述研究提示,吡非尼酮可能通过抑制HLFs表型转化和细胞骨架蛋白重组,以实现上述对细胞功能的影响,并进一步证实吡非尼酮通过干扰TGF-β1通路达到抑制胶原沉积的作用。
目前将吡非尼酮应用于CTD-ILD的治疗仅有很少的病例报道,其治疗效果及安全性仍需更多的研究证实[14]。本实验初次将吡非尼酮应用于人的肺成纤维细胞,更进一步探索了其在细胞水平抗纤维化的作用。今后研究将通过动物模型的建立,深入探讨肺纤维化的细胞因子及信号转导通路,并探索吡非尼酮应用于其他病因引起的间质性肺病的治疗效果及安全性。
[1] Aparicio IJ, Lee JS. Connective tissue disease-associated interstitial lung diseases: unresolved issues[J]. Semin Respir Crit Care Med, 2016, 37(3):468-476.
[2] Behr J, Bendstrup E, Crestani B, et al. Safety and tolerability of acetylcysteine and pirfenidone combination therapy in idiopathic pulmonary fibrosis: a randomised, double-blind, placebo-controlled, phase 2 trial[J]. Lancet Respir Med, 2016, 4(6):445-453.
[3] Shi Q, Liu X, Bai Y, et al.Invitroeffects of pirfenidone on cardiac fibroblasts: proliferation, myofibroblast diffe-rentiation, migration and cytokine secretion[J]. PLoS One, 2011, 6(11):e28134.
[4] Xiang XH, Jiang TP, Zhang S, et al. Pirfenidone inhibits proliferation, arrests the cell cycle, and downregulates heat shock protein-47 and collagen type I in rat hepatic stellate cellsinvitro[J]. Mol Med Rep, 2015, 12(1):309-314.
[5] Inomata M, Kamio K, Azuma A, et al. Pirfenidone inhi-bits fibrocyte accumulation in the lungs in bleomycin-induced murine pulmonary fibrosis[J]. Respir Res, 2014, 15(1):1-14.
[6] Bagnato G, Harari S. Cellular interactions in the pathogenesis of interstitial lung diseases[J]. Eur Respir Rev, 2015, 24(135):102-114.
[7] Hisatomi K, Mukae H, Sakamoto N, et al. Pirfenidone inhibits TGF-beta1-induced over-expression of collagen type I and heat shock protein 47 in A549 cells[J]. BMC Pulm Med, 2012, 12(1):1-9.
[8] 陈培芬, 邱智辉, 张香梅, 等. 巨噬细胞移动抑制因子经Rho激酶途径促进人胚肺成纤维细胞表型转化[J]. 中国病理生理杂志,2012,28(11):1938-1942.
[9] 逯明蕾, 张 晓, 张光峰, 等. 小窝蛋白-1在CTD-ILD肺组织中的表达及TGF-β1对其表达调控的体外研究[J]. 陕西医学杂志, 2012, 41(6):660-663.
[10]Lucattelli M, Fineschi S, Selvi E, et al. Ajulemic acid exerts potent anti-fibrotic effect during the fibrogenic phase of bleomycin lung[J]. Respir Res, 2016, 17(1):1-16
[11]Oku H, Shimizu T, Kawabata T, et al. Antifibrotic action of pirfenidone and prednisolone: different effects on pulmonary cytokines and growth factors in bleomycin-induced murine pulmonary fibrosis[J]. Eur J Pharmacol, 2008, 590(1-3):400-408.
[12]胡玉洁, 李 理, 李伟峰, 等. 依那西普抑制博来霉素诱导的小鼠肺纤维化[J]. 中国病理生理杂志,2013,29(6):1034-1038.
[13]Hinz B, Celetta G, Tomasek JJ, et al. Alpha-smooth muscle actin expression upregulates fibroblast contractile acti-vity[J]. Mol Biol Cell, 2001, 12(9):2730-2741.
[14]Miura Y, Saito T, Fujita K, et al. Clinical experience with pirfenidone in five patients with scleroderma-related interstitial lung disease[J]. Sarcoidosis Vasc Diffuse Lung Dis, 2014, 31(3):235-238.
(责任编辑: 林白霜, 罗 森)
Pirfenidone inhibits TGF-β1-induced differentiation of myofibroblast in human lung fibroblast populations
WU Chao-chen1, 2, LIN Hao-bo2, ZHANG Xiao1, 2
(1SouthernMedicalUniversity,Guangzhou510515,China;2DepartmentofRheumatology,GuangdongAcademyofMedicalSciences,GuangdongGeneralHospital,Guangzhou510080,China.E-mail: 13922255387@163.com)
AIM: To investigate the effect of pirfenidone on transforming growth factor-β1 (TGF-β1)-induced fibroblast-to-myofibroblast transitioninvitro. METHODS: The cell viability was measured by MTT assay. The proliferation of human lung fibroblasts (HLFs) was detected by EdU incorporation. Migratory and invasive abilities were measured by Boyden chamber assay. The α-smooth muscle actin (α-SMA) protein expression was determined by Western blot and immunofluorescence. The mRNA expression of α-SMA and type Ⅰ and Ⅲ collagens was evaluated by RT-qPCR. RESULTS: Pirfenidone at different concentrations (0.1, 0.2, 0.3, 0.5 and 0.8 mg/L) had no cytotoxic effect on the HLFs, and pirfenidone at 0.2 mg/L was used for the intervention. Pretreatment of the HLFs with 0.2 mg/L pirfenidone prior to TGF-β1 not only markedly suppressed the changes of proliferation, migration, invasion and reorganization of actin cytoskeleton in the HLFs (P<0.01), but also down-regulated the expression of α-SMA and type Ⅰ and Ⅲ collagens triggered by TGF-β1 (P<0.05). CONCLUSION: Pirfenidone has an inhibitory effect on TGF-β1-induced activated cell functions and fibroblast-to-myofibroblast transition in HLFs.
Pirfenidone; Transforming growth factor-β1; Human lung fibroblasts
1000- 4718(2016)11- 2049- 07
2016- 07- 14
2016- 08- 23
广东省自然科学基金资助项目(No.S2012010008702)
R363
A
10.3969/j.issn.1000- 4718.2016.11.022
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-83824249; E-mail: 13922255387@163.com
